Właściwości wód podziemnych
|
|
|
- Kazimiera Wiśniewska
- 8 lat temu
- Przeglądów:
Transkrypt
1 Gospodarka Wodna Gospodarka Wodna Wykład nr 4 Na podstawie podręcznika HYDROGEOLOGIA z podstawami geologii, Jerzy KOWALSKI, WUP, Wrocław 2007 OPRACOWAŁ dr hab.inż.wojciech Chmielowski prof.pk Instytut Inżynierii i Gospodarki Wodnej Zakład Gospodarki Wodnej, PK Właściwości wód podziemnych
2 Fizyczne, organoleptyczne, chemiczne, i bakteriologiczne własności wód podziemnych 1 Właściwości fizyczne i organoleptyczne Do cech fizycznych wód podziemnych, istotnych dla ich praktycznego wykorzystania, należą : 1. Temperatura, 2. Przezroczystość i mętność, 3. Barwa, 4. Przewodnictwo elektryczne, 5. Radoczynność Do cech organoleptycznych wód podziemnych, istotnych dla ich praktycznego wykorzystania, należą : zapach i smak
3 1.1 TEMPERATURA Temperatura wód podziemnych waha się w granicach stopni C. Temperatura wód podziemnych zależy od szeregu czynników, jak: 1. Szerokość geograficzna, 2. Wysokość nad poziom morza, 3. Głębokość pod powierzchnią ziemi, 4. Prędkość przepływu wody, 5. Geologiczno fizyczne właściwości środowiska geologicznego. Temperatura wody wykazuje pewne wahania w zależności od głębokości występowania. Wahania dobowe sięgają do głębokości 0,8-1,0 m, sezonowe 5-8m, a roczne m.
4 Głębokości te zależą od przewodnictwa cieplnego gleby i skał, struktury, wilgotności, pokrycia powierzchni terenu, ekspozycji i nachylenia terenu Na głębokości, w której zanikają wahania temperatur, rozciąga się strefa stałych temperatur, zwana strefą neutralną Temperatura w tej strefie równa jest średniej temperaturze położenia tej miejscowości nad poziomem morza. Poniżej strefy stałych temperatur, temperatura skał, a w ślad za tym także i wody rośnie według wartości stopnia geotermicznego i na określonej głębokości jest zawsze stała. Na tej podstawie możliwe jest obliczenie teoretycznej temperatury wody na zadanej głębokości lub głębokości, z której pochodzi woda o określonej temperaturze.
5 Obliczenie TEMPERATURY wody na zadanej głębokości T H = T t H H śr = t śr g + A + H h g o [ C] [ T ( t + A) ] + h[ m] H śr temperatura wody na glebokosci H, srednia roczna temperatura powietrza w danej miejscowosci, A wspolczynnik poprawkowy zalezny od wysokosci nad poziom morza, wysokosc n. p. m o wartosc A[ C] 0,8 1,0 1,3 h glebokosc strefy stalych temperatur, g stopien geotermiczny,, okolo m
6 H = g T t T H śr [ T ( t + A) ] + h[ m] temperatura wody na glebokosci H = 300 srednia roczna temperatura powietrza wysokosc n. p. m o wartosc A[ C] 0,8 1,0 1,3 h glebokosc strefy stalych temperatur = g stopien geotermiczny, H = 20 o H + 1,1 o śr, okolo m o [ C] [ m] w danej miejscowosci, = A wspolczynnik poprawkowy zalezny od wysokosci = = 29, [ m],, [ m] nad 20 o [ C] poziom morza,
7 Z uwagi na temperaturę dzielimy wodę na podstawie kryterium hydrogeologicznego na wody : Chłodne Zwykłe Ciepłe T<t śr T=t śr T>t śr Według kryterium balneologicznego dzielimy wody na Zwykłe T<= 20 0 C Termalne T> 20 0 C Wody termalne dzielą się z kolei w stosunku do temperatury ciała ludzkiego na: Hipotermalne ( pocieplne) T= C Homeotermalne( równocieplne) T=34 0 C 38 0 C Hipertermalne (nadcieplne) T>38 0 C
8 1.2 PRZEZROCZYSTOŚĆ i MĘTNOŚĆ Przezroczystość wody jest to zdolność przepuszczania prze nią promieni słonecznych. Mętność wody to zdolność absorbowania promieni słonecznych Mętność wywołana jest obecnością zawiesin pyłowych lub koloidalnych pochodzenia mineralnego lub organicznego. W większości przypadków wody podziemne są doskonale przezroczyste. Dużą mętność wykazują wody bagienne oraz wody mioceńskie formacji brunatno-węglowej, w których zawarte są zawiesiny pyłu węgla brunatnego. Oznaczenie przezroczystości polega na określeniu wysokości słupa wody, przez który wzorcowy druk o wysokości liter 1,25 mm daje się przeczytać. Miarą przezroczystości jest wysokość słupa wody w centymetrach, przy którym druk jest wyraźnie i ostro czytelny
9 Mętność oznacza się przez porównanie badanej wody umieszczonej w szklanym cylindrze z odpowiednimi wzorcami mętności. Wzorcami są szklane cylindry z wodą, w której znajdują się drobne zawiesiny ziemi okrzemkowej lub kaolinu o różnej zawartości wyrażonej w miligramach na decymetr sześcienny wody. Wzorzec określa następujące zawartości ziemi okrzemkowej [ ] 3 mg 0, 0,25; 0,5; dm W praktyce często pomija się badania mętności i oznacza się ją przeliczając wyniki badania przezroczystości na odpowiednie wartości mętności wg przybliżonego wzoru: 950 M= P 3 M metosc wody mg dm P przezroczystosc [ ] [ cm]
10 1.3 BARWA Barwa rzeczywista spowodowana jest wyłącznie rozpuszczonymi w wodzie związkami, Barwa pozorna spowodowana jest mechanicznymi zawiesinami, które mogą być usunięte Barwę oznacza się w skali platynowo-kobaltowej przez porównanie próbki ze wzorcami. Wyniki podaje się w mgpt/dm AKTYWNOŚĆ Źródłem naturalnej radoczynności wód podziemnych są pierwiastki promieniotwórcze należące do szeregów: uranowo-radowego, torowego, antynowego. Jednostką bezwzględną natężenia radoczynności jest 1 bekerel (Bq), który równa się rozpadowi 1 atomu na sekundę.
11 Aktywność właściwą określa się liczbą bekereli na metr sześcienny wody (Bq/m 3 ) W zależności od natężenia promieniowania wyróżnia się radoczynność: Słabą <80 (Bq/dm3) Średnią (Bq/dm3) Silną (Bq/dm3) Radoczynność niektórych źródeł w Polsce
12 1.5 SMAK Odczucia smakowe zależą od: 1. Wrażliwości narządów zmysłu smaku, tzn. kubków smakowych, znajdujących się na języku i oplecionych zakończeniami nerwowymi, 2. Temperatury wody, 3. Jakości i ilości rozpuszczonych lub zawieszonych substancji Przy dobrej wrażliwości najmniejsze stężenia potrzebne do wyczucia smaku wynoszą: NaCL ( chlorek sodu, sól kuchenna) 165 mg/dm 3 W zależności od substancji wywołujących smak rozróżnia się następujące rodzaje smaków MgSO 4 (siarczan magnezu) 250 mg/dm 3 KCl ( chlorek potasu) 420 mg/dm 3
13 1.6 ZAPACH Wody podziemne są przeważnie bez zapachu. Jedynie wody płytkie pozostające w ścisłym związku 1. z bagnami, 2. moczarami i torfowiskami, 3. wody zakażone ściekami miejskimi lub przemysłowymi 4. i niektóre wody mineralne mają mniej lub bardziej intensywny zapach. Rozróżnia się 5 stopni natężenia zapachu podobnie jak smaku. Woda przy natężeniu 3 stopnia jest niezdatna do picia, przy wyższych stopniach nie można jej również stosować do celów gospodarczych.
14 ZAPACH R Zapachy roślinne wywołane związkami Organicznymi, które Nie znajdują się w stanie rozkładu Zapachy pochodzenia naturalnego Zapachy specyficzne pochodzenia nienaturalnego Zapach chlorowy Zapach ziemisty Zapach fenolowy Zapach torfowy S Zapach mszysty Zapach kory drzewnej Zapachy gnilne wywołane substancjami organicznymi w stanie rozkładu Zapach stęchły Zapach zbutwiały G Zapach zgnitych jaj
15 2. Właściwości chemiczne wód podziemnych 2.1 Skład chemiczny wód podziemnych zależy przede wszystkim od rodzaju i właściwości skał, przez które woda się przesącza. Najbardziej rozpowszechnione w wodach podziemnych są : aniony chloru, siarczanowy, wodorowęglanowy, kationy sodu, wapnia, amonu, magnezu Poza wymienionymi pierwiastkami w wodach podziemnych znajdować się mogą jako mikroelementy : lit, bor, fluor, glin, krzem, miedź, bar, ołów, chrom, arsen, Śladowo mogą występować : rubin, złoto, rtęć, oraz pierwiastki promieniotwórcze: radon, toron, aktynon, rad, tor.
16 2.2 Ogólna mineralizacja. Stopień zmineralizowania wody określa się prze ogólną mineralizację, której wskaźnikiem orientacyjnym jest masa suchej pozostałości określająca zawartość nielotnych składników wody Ogólna mineralizacja jest nieco zaniżona gdyż w procesie odparowywania i suszenia osadu następuje częściowy rozkład węglanów z wydzieleniem lotnego dwutlenku węgla. Suchą pozostałość wyznacza się przez odparowanie wody i wysuszenie powstałego osadu w temperaturze C Suchą pozostałość oblicza się jako stosunek masy suchego osadu do objętości próbki wody: S = m s [ ] mg dm 3 V
17 Według ogólnej mineralizacji dzieli się wody na trzy podstawowe grupy: 1. Normalne lub słodkie S<500 mg/dm 3 2. O podwyższonej mineralizacji S=500 do 1000 mg/dm 3 3. Mineralne S>1000 mg/dm Odczyn wody Hydroliza - reakcja chemiczna polegająca na rozpadzie cząsteczek związku chemicznego na dwa lub więcej mniejszych fragmentów w reakcji z wodą lub parą wodną. W wodach podziemnych które są złożonymi roztworami, wartość stężenia jonów wodorowych ph zależy przede wszystkim od dysocjacji rozpuszczonych składników Dysocjacja elektrolityczna to proces rozpadu cząsteczek związków chemicznych na jony pod wpływem rozpuszczalnika,
18 Symbol ph oznacza logarytm stężenia jonów wodorowych [H + ] ze znakiem ujemnych. 1. Podczas hydrolizy soli słabej zasady i słabego kwasu odczyn roztworu pozostaje praktycznie obojętny. 2. Hydroliza soli słabego kwasu i mocnej zasady wytwarza roztwór alkaliczny, 3. a hydroliza soli pochodzącej z mocnego kwasu i słabej zasady wytwarza roztwór kwaśny. Jeżeli ph = -log [H+] = 7 oznacza to, że jej odczyn takiej wody jest obojętny. Zmiana ph na mniejsze od 7 oznacza zmianę odczynu na kwaśny, zaś ph >7 wskazuje na odczyn zasadowy. Odczyn wód naturalnych waha się w granicach ph 4-9 i zależy od wielu czynników: zawartości węglanów, wodorowęglanów i dwutlenku węgla (wody węglanowe są zasadowe, ubogie w węglany kwaśne); charakteru podłoża glebowego, które może zawierać związki o charakterze kwaśnym lub zasadowym; zanieczyszczeń ściekami; opadów atmosferycznych, które mogą powodować wzrost ilości słabych i mocnych kwasów w wodach
19 2.4 Dwutlenek węgla CO 2 Źródłem dwutlenku węgla są procesy magmowe i chemiczne, fizjologiczne oraz działalność człowieka. W procesach magmowych i wulkanicznych powstają ogromne ilości dwutlenku węgla, który szczelinami dostaje się do wody podziemnej i łatwo się rozpuszcza. Dwutlenek węgla odgrywa dużą rolę przy rozpuszczaniu niektórych węglanów zwłaszcza wapnia i magnezu. 2.5 Tlen Zawartość tlenu w wodach podziemnych jest bardzo mała. Na pewnej głębokości, zwanej granica tlenową, tlen zupełnie zanika. 2.6 Wapń Jest jednym z najbardziej rozpowszechnionych w wodzie pierwiastkiem. Zawartość wapnia w wodach bliższych powierzchni terenu nie przekracza 1g/dm 3
20 2.7 Magnez Występuje on rzadziej niż wapń i w mniejszych ilościach. Powstaje przez ługowanie dolomitu CaMg(CO 3 ) 2. Przy zawartości ponad 1000 mg/dm 3 jest źródłem agresywności magnezowej 2.8 Twardość wody Obecność soli wapniowych i magnezowych w wodzie warunkuje bardzo ważną właściwość chemiczną, zwaną twardością wody. Im większe stężenie jonów Ca 2+, Mg 2+, tym większa jest twardość wody. Twardość węglanowa nazywana tez przemijającą wywołana jest przez wodorowęglany wapnia i magnezu. Twardość węglanowa w nieznacznym stopniu spowodowana jest obecnością węglanów i wodorotlenków wapnia i magnezu
21 Twardość niewęglanowa ( twardość stała) spowodowana jest obecnością mniej pospolitych soli wapniowych takich jak siarczany i chlorki, rzadziej azotany, fosforany, krzemiany. Sole te nie wytrącają się podczas gotowania Suma twardości węglanowej i niewęglanowej jest twardością ogólną Obowiązująca w Polsce jednostka twardości wody jest jeden mg CaCO 3 /dm 3
22 Węglan wapnia (CaCO 3 ) to białe ciało stałe, trudno rozpuszczalne w wodzie, jednak jest rozpuszczalny w wodzie nasyconej dwutlenkiem węgla lub w roztworze chlorki amonu (NH 4 Cl - salmiak). Ma budowę krystaliczną. Temperatura topnienia wynosi 1289 o C. W wysokiej temperaturze (ok. 900oC) oraz pod wpływem kwasów rozkłada się na tlenek wapnia (CaO - wapno palone) i dwutlenek węgla (CO2). W wodzie nasyconej dwutlenkiem węgla przechodzi w wodorowęglan wapnia: CaCO 3 + H 2 O + CO 2 Ca(HCO 3 ) 2 Wody podziemne zawierające CO 2 rozpuszczają skały wapienne. Wydostając się na powierzchnię tracą CO 2 i wydzielają węglan. Dzięki temu procesowi na ścianach jaskiń powstają stalaktyty i stalagmity. W przyrodzie występuje w postaci: kalcytu - jest to najtwardsza, krystaliczna postać węglanu wapnia. Może być bezbarwny lub w zależności od domieszek - żółty, różowy, szary. Jest składnikiem wielu skał osadowych (wapieni, margli) oraz metamorficznych (marmurów). Wykorzystywany jest głównie w przemyśle ceramicznym i szklarskim.
23 aragonitu - pospolity składnik skorupy i szkieletów współczesnych organizmów, główny składnik pereł. Niekiedy tworzy się w skutek procesów hydrotermalnych, krystalizuje z wód gorących źródeł lub tworzy nacieki na jaskiniach. W jubilerstwie jest rzadko stosowany ze względu na miękkość. kamienia wapiennego kredy - skała osadowa powstałą w wyniku nagromadzenia dużych ilości wapiennych szkieletów glonów planktonicznych, skorupek otwornic i drobnych nieorganicznych ziaren kalcytu. W Polsce występuje na Wyżynie Lubelskiej. Kamień wapienny wykorzystywany jest do produkcji wapna palonego (reakcja podana jest wyżej) i cementu. Z kredy naturalnej wyrabia się kredę do pisania oraz jest to dodatek w produkcji farb. Tzw. kreda strącona jest używana do wyrobu papieru, kitu, farb, gumy oraz past do zębów.
24 2.9 Żelazo i mangan Żelazo i mangan występują w wodach podziemnych w niewielkiej ilości. Nieduże ilości, rzędu dziesiętnych mg/dm 3, powodują zmianę smaku wody ( smak atramentu). W przewodach wodociągowych tworzy się szlamisty osad, który z czasem twardnieje, zmniejsza czynna powierzchnie przepływu aż do całkowitego zatkania rur. Woda z większą zawartością żelaza i manganu nie może być stosowana w pralniach, farbiarniach i przemyśle spożywczym. Wody do picia i celów gospodarczych nie mogą zawierać ogólnego Fe ponad 0,5 mg/dm 3 oraz manganu Mn 2+ ponad 0,1 mg/dm Jon chlorkowy Należy do najczęściej rozpowszechnionych, towarzyszy jonom sodu i potasu, wywołując zasolenie wód. Wpływa ujemnie na smak i zapach. W wodach pitnych zawartość jonu chlorkowego nie może przekraczać 250 mg CL - /dm 3. Obecność wolnego chloru dopuszczalna jest tylko w razie chlorowania wody w ilości 0,3-0,5 mg CL 2 /dm 3.
25 2.11 Jon siarczanowy SO 4 2- Głównym jego źródłem jest ługowanie skał siarczanowych - gipsu, anhydrytu, soli magnezowo-potasowych. Często jon siarczanowy dostaje się do płytkich wód podziemnych wskutek rozkładu i utleniania substancji organicznych. Zawartość jego w wodach do picia nie może przekraczać 200 mg SO 4 2- /dm 3 W większych ilościach działa agresywnie w stosunku do betonu powodując spęcznienie i spękanie betonu Związki azotowe azotanowy Występują one w postaci jonów amonowych, jonów azotynowych i azotanowych. Większe ich ilości, rzędu kilku lub kilkunastu mg/dm 3, występują w niektórych wodach płytkich, do których mogą dostać się ze źródeł powierzchniowego zanieczyszczenia. W skutek rozkładu substancji białkowych powstaje, przy współudziale bakterii gnilnych, amoniak. Obecność amoniaku w wodzie płytkiej wskazuje na świeże źródło zanieczyszczenia, równoczesna zaś obecność amoniaku, azotynów i azotanów wskazuje, że woda jest od długiego czasu zanieczyszczana. NH NO NO jon jon jon amonowy azotynowy
26 3. Zakres badań fizycznych i chemicznych własności wód podziemnych Określenie podstawowych cech fizycznych i chemicznych jest niezbędne do charakterystyki technicznej i hydrogeologicznej wód podziemnych. Zakres analizy zależy od celu jakiemu ma służyć i winien być każdorazowo ustalany przez hydrogeologa i technologa. Orzeczenie o badaniach powinno zawierać następujące informacje : 1. Dane dot. Laboratorium wykonującego badania, 2. Osoby, która pobrała próbkę, 3. Lokalizacja ujęcia, 4. Czasu i sposobu pobrania próbki, 5. Ilości i głębokości pobrania wody, 6. Warstwy wodonośnej Dz.U zawiera Rozporządzenie Ministra Zdrowia dotyczące wymagania odnośnie jakości wody do spożycia przez ludzi, częstotliwość i zakres badań wody, program monitoringu jakości wody, sposób nadzoru nad laboratoriami wykonującymi badania jakości wody, oraz sposób informowania konsumentów o jakości wody.
27 Gospodarka Wodna Gospodarka Wodna Wykład nr 4 Na podstawie podręcznika HYDROGEOLOGIA z podstawami geologii, Jerzy KOWALSKI, WUP, Wrocław 2007 OPRACOWAŁ dr hab.inż.wojciech Chmielowski prof.pk Instytut Inżynierii i Gospodarki Wodnej Zakład Gospodarki Wodnej, PK Właściwości wód podziemnych
Właściwości wód podziemnych
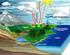 Właściwości wód podziemnych Właściwości fizyczne i organoleptyczne wód podziemnych: Temperatura Przeźroczystość. Mętność, Barwa, Radoczynność, Smak, Zapach. Skład chemiczny wód podziemnych zależy od rodzaju
Właściwości wód podziemnych Właściwości fizyczne i organoleptyczne wód podziemnych: Temperatura Przeźroczystość. Mętność, Barwa, Radoczynność, Smak, Zapach. Skład chemiczny wód podziemnych zależy od rodzaju
Raport Jakość wody i ścieków w 2011 roku
 Raport Jakość wody i ścieków w 2011 roku Opracowanie: Magdalena Kubiak Technolog wody i ścieków Zatwierdził: Piotr Trojanowski Prezes zarządu Warta, 2012 1. Wstęp Zakład Wodociągów Gminy i Miasta Warta
Raport Jakość wody i ścieków w 2011 roku Opracowanie: Magdalena Kubiak Technolog wody i ścieków Zatwierdził: Piotr Trojanowski Prezes zarządu Warta, 2012 1. Wstęp Zakład Wodociągów Gminy i Miasta Warta
1. Regulamin bezpieczeństwa i higieny pracy... 10 2. Pierwsza pomoc w nagłych wypadkach... 12 Literatura... 12
 Spis treści III. Wstęp... 9 III. Zasady porządkowe w pracowni technologicznej... 10 1. Regulamin bezpieczeństwa i higieny pracy... 10 2. Pierwsza pomoc w nagłych wypadkach... 12 Literatura... 12 III. Wskaźniki
Spis treści III. Wstęp... 9 III. Zasady porządkowe w pracowni technologicznej... 10 1. Regulamin bezpieczeństwa i higieny pracy... 10 2. Pierwsza pomoc w nagłych wypadkach... 12 Literatura... 12 III. Wskaźniki
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY
 WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
WYKRYWANIE ZANIECZYSZCZEŃ WODY POWIERZA I GLEBY Instrukcja przygotowana w Pracowni Dydaktyki Chemii Zakładu Fizykochemii Roztworów. 1. Zanieczyszczenie wody. Polska nie należy do krajów posiadających znaczne
Spis treści. Wstęp. Twardość wody
 Spis treści 1 Wstęp 1.1 Twardość wody 1.2 Oznaczanie twardości wody 1.3 Oznaczanie utlenialności 1.4 Oznaczanie jonów metali 2 Część doświadczalna 2.1 Cel ćwiczenia 2.2 Zagadnienia do przygotowania 2.3
Spis treści 1 Wstęp 1.1 Twardość wody 1.2 Oznaczanie twardości wody 1.3 Oznaczanie utlenialności 1.4 Oznaczanie jonów metali 2 Część doświadczalna 2.1 Cel ćwiczenia 2.2 Zagadnienia do przygotowania 2.3
22 marca - Światowy Dzień Wody
 22 marca - Światowy Dzień Wody Bez wody nie ma życia... Woda jako czysty związek wodoru i tlenu (H 2 O) w przyrodzie nie występuje. Jest bardzo rozcieńczonym roztworem soli, kwasów, zasad i gazów. Skład
22 marca - Światowy Dzień Wody Bez wody nie ma życia... Woda jako czysty związek wodoru i tlenu (H 2 O) w przyrodzie nie występuje. Jest bardzo rozcieńczonym roztworem soli, kwasów, zasad i gazów. Skład
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
INSPEKCJA OCHRONY ŚRODOWISKA KATALOG WYBRANYCH FIZYCZNYCH I CHEMICZNYCH WSKAŹNIKÓW ZANIECZYSZCZEŃ WÓD PODZIEMNYCH I METOD ICH OZNACZANIA
 INSPEKCJA OCHRONY ŚRODOWISKA KATALOG WYBRANYCH FIZYCZNYCH I CHEMICZNYCH WSKAŹNIKÓW ZANIECZYSZCZEŃ WÓD PODZIEMNYCH I METOD ICH OZNACZANIA Biblioteka Monitoringu Środowiska Warszawa 2013 Niniejsze opracowanie
INSPEKCJA OCHRONY ŚRODOWISKA KATALOG WYBRANYCH FIZYCZNYCH I CHEMICZNYCH WSKAŹNIKÓW ZANIECZYSZCZEŃ WÓD PODZIEMNYCH I METOD ICH OZNACZANIA Biblioteka Monitoringu Środowiska Warszawa 2013 Niniejsze opracowanie
Wodorotlenki O O O O. I n. I. Wiadomości ogólne o wodorotlenkach.
 Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Rafał Tytus Bray. Politechnika Gdańska Wydział Inżynierii Lądowej i Środowiska września 2017 Ustka
 Rafał Tytus Bray Politechnika Gdańska Wydział Inżynierii Lądowej i Środowiska 14 15 września 2017 Ustka Twardość wody jest jednym z najstarszych wskaźników jakości wody, pochodzącym jeszcze z czasów ery
Rafał Tytus Bray Politechnika Gdańska Wydział Inżynierii Lądowej i Środowiska 14 15 września 2017 Ustka Twardość wody jest jednym z najstarszych wskaźników jakości wody, pochodzącym jeszcze z czasów ery
OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD
 OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD POWIERZCHNIOWYCH WPROWADZENIE Właściwości chemiczne wód występujących w przyrodzie odznaczają się dużym zróżnicowaniem. Zależą one między innymi od budowy geologicznej
OZNACZANIE WŁAŚCIWOŚCI BUFOROWYCH WÓD POWIERZCHNIOWYCH WPROWADZENIE Właściwości chemiczne wód występujących w przyrodzie odznaczają się dużym zróżnicowaniem. Zależą one między innymi od budowy geologicznej
OZNACZANIE TWARDOŚCI WODY SPOSOBEM WARTHA - PFEIFERA
 OZNACZANIE TWARDOŚCI WODY SPOSOBEM WARTHA - PFEIFERA WSTĘP RODZAJE TWARDOŚCI WODY Twardość wody jest jej właściwością wynikającą z obecności rozpuszczonych w niej związków, głównie wapnia i magnezu. Pierwotnie
OZNACZANIE TWARDOŚCI WODY SPOSOBEM WARTHA - PFEIFERA WSTĘP RODZAJE TWARDOŚCI WODY Twardość wody jest jej właściwością wynikającą z obecności rozpuszczonych w niej związków, głównie wapnia i magnezu. Pierwotnie
I. Pobieranie próbek. Lp. Wykaz czynności Wielkość współczynnika
 Koszty i wykaz badań wykonywanych w Wojewódzkim Inspektoracie Ochrony Środowiska w Poznaniu 1. Stawka podstawowa wynosi 40,41 zł. 2. Wyliczenie kosztów usługi następuje w sposób następujący: koszt usługi
Koszty i wykaz badań wykonywanych w Wojewódzkim Inspektoracie Ochrony Środowiska w Poznaniu 1. Stawka podstawowa wynosi 40,41 zł. 2. Wyliczenie kosztów usługi następuje w sposób następujący: koszt usługi
BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH WODY
 ĆWICZENIE NR 1 BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH WODY Cel ćwiczenia Poznanie wybranych metod oznaczania własności wody. Zakres wymaganych wiadomości 1. Własności fizykochemiczne wody. 2. Równanie Nernsta,
ĆWICZENIE NR 1 BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH WODY Cel ćwiczenia Poznanie wybranych metod oznaczania własności wody. Zakres wymaganych wiadomości 1. Własności fizykochemiczne wody. 2. Równanie Nernsta,
Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Konkurs Chemiczny dla uczniów szkół ponadgimnazjalnych rok szkolny 2013/2014 Imię i nazwisko uczestnika Szkoła Klasa Nauczyciel Imię
Powiatowa Stacja Sanitarno-Epidemiologiczna w Olecku
 Powiatowa Stacja Sanitarno-Epidemiologiczna w Olecku Zaopatrzenie ludności w wodę W 2010 roku Powiatowa Stacja Sanitarno - Epidemiologiczna w Olecku objęła nadzorem 17 urządzeń służących do zaopatrzenia
Powiatowa Stacja Sanitarno-Epidemiologiczna w Olecku Zaopatrzenie ludności w wodę W 2010 roku Powiatowa Stacja Sanitarno - Epidemiologiczna w Olecku objęła nadzorem 17 urządzeń służących do zaopatrzenia
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
Wanda Wołyńska Instytut Biotechnologii Przemysłu Rolno-Spożywczego Oddział Cukrownictwa. IBPRS Oddział Cukrownictwa Łódź, czerwiec 2013r.
 Wanda Wołyńska Instytut Biotechnologii Przemysłu Rolno-Spożywczego Oddział Cukrownictwa Łódź, 25-26 czerwiec 2013r. 1 Badania fizyko-chemiczne wód i ścieków wykonywane są w różnych celach i w zależności
Wanda Wołyńska Instytut Biotechnologii Przemysłu Rolno-Spożywczego Oddział Cukrownictwa Łódź, 25-26 czerwiec 2013r. 1 Badania fizyko-chemiczne wód i ścieków wykonywane są w różnych celach i w zależności
KLASYFIKACJA JAKOŚCI WÓD PODZIEMNYCH W 2004 ROKU
 KLASYFIKACJA JAKOŚCI WÓD PODZIEMNYCH W 2004 ROKU Badania wód podziemnych w sieci krajowej prowadzi od 1991 roku Państwowy Instytut Geologiczny. Badania obejmują wody podziemne różnych użytkowych poziomów
KLASYFIKACJA JAKOŚCI WÓD PODZIEMNYCH W 2004 ROKU Badania wód podziemnych w sieci krajowej prowadzi od 1991 roku Państwowy Instytut Geologiczny. Badania obejmują wody podziemne różnych użytkowych poziomów
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Wapń i jego związki. -występowanie i otrzymywanie -właściwości fizyczne i chemiczne - ważniejsze związki wapnia
 Wapń i jego związki -występowanie i otrzymywanie -właściwości fizyczne i chemiczne - ważniejsze związki wapnia Wapń występowanie Występowanie: występuje wyłącznie w postaci związanej CaCO 3 w minerałachkalcyt,
Wapń i jego związki -występowanie i otrzymywanie -właściwości fizyczne i chemiczne - ważniejsze związki wapnia Wapń występowanie Występowanie: występuje wyłącznie w postaci związanej CaCO 3 w minerałachkalcyt,
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1651
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1651 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 2 Data wydania: 30 lipca 2018 r. Nazwa i adres LABSTAR MATEUSZ
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1651 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 2 Data wydania: 30 lipca 2018 r. Nazwa i adres LABSTAR MATEUSZ
Spis treści. Właściwości fizyczne. Wodorki berylowców. Berylowce
 Berylowce Spis treści 1 Właściwości fizyczne 2 Wodorki berylowców 3 Tlenki berylowców 4 Nadtlenki 5 Wodorotlenki 6 Iloczyn rozpuszczalności 7 Chlorki, fluorki, węglany 8 Siarczany 9 Twardość wody 10 Analiza
Berylowce Spis treści 1 Właściwości fizyczne 2 Wodorki berylowców 3 Tlenki berylowców 4 Nadtlenki 5 Wodorotlenki 6 Iloczyn rozpuszczalności 7 Chlorki, fluorki, węglany 8 Siarczany 9 Twardość wody 10 Analiza
profesjonalne, kompleksowe opomiarowanie i rozliczanie mediów dostarczanych do Twojego lokalu
 BIAŁYSTOK GDAŃSK WARSZAWA ul. Świętojańska 6 ul. Fieldorfa 10/3 tel. 533 025 696 tel. /85/ 654 67 53 tel. /58/ 710 05 98 profesjonalne, kompleksowe opomiarowanie i rozliczanie mediów dostarczanych do Twojego
BIAŁYSTOK GDAŃSK WARSZAWA ul. Świętojańska 6 ul. Fieldorfa 10/3 tel. 533 025 696 tel. /85/ 654 67 53 tel. /58/ 710 05 98 profesjonalne, kompleksowe opomiarowanie i rozliczanie mediów dostarczanych do Twojego
Szkolny konkurs chemiczny Grupa B. Czas pracy 80 minut
 Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
MONITORING PRZEGLĄDOWY
 Załącznik nr 2 Tabela 1. Zakres badań wody, ścieków, osadów i odpadów Lp Przedmiot badań Cena wykonania analizy wraz z poborem i opracowaniem wyników w formie sprawozdania dla wszystkich prób MONITORING
Załącznik nr 2 Tabela 1. Zakres badań wody, ścieków, osadów i odpadów Lp Przedmiot badań Cena wykonania analizy wraz z poborem i opracowaniem wyników w formie sprawozdania dla wszystkich prób MONITORING
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
Jerzy Masełko WODA WPROWADZENIE. 1. Właściwości fizyczne i chemiczne wody
 Jerzy Masełko WODA WPROWADZENIE 1. Właściwości fizyczne i chemiczne wody Woda jest jednym z najbardziej rozpowszechnionych związków chemicznych w przyrodzie. Woda ma interesujące anomalia o dużym znaczeniu
Jerzy Masełko WODA WPROWADZENIE 1. Właściwości fizyczne i chemiczne wody Woda jest jednym z najbardziej rozpowszechnionych związków chemicznych w przyrodzie. Woda ma interesujące anomalia o dużym znaczeniu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Oferta cenowa pobierania oraz wykonania badań próbek wody, ścieków, osadów ściekowych i biogazu
 Oferta cenowa pobierania oraz wykonania badań próbek wody, ścieków, osadów ściekowych i biogazu Zakres badań realizowanych przez: Zakres badań wody LBORTORIUM CENTRLNE BDNIE WODY ul. Wodociągowa 8, 43-356
Oferta cenowa pobierania oraz wykonania badań próbek wody, ścieków, osadów ściekowych i biogazu Zakres badań realizowanych przez: Zakres badań wody LBORTORIUM CENTRLNE BDNIE WODY ul. Wodociągowa 8, 43-356
KLASYFIKACJA JAKOŚCI WÓD PODZIEMNYCH W SIECI KRAJOWEJ W 2005 ROKU
 KLASYFIKACJA JAKOŚCI WÓD PODZIEMNYCH W SIECI KRAJOWEJ W 2005 ROKU Zgodnie z Ramową Dyrektywą Wodną Unii Europejskiej 2000/60/WE, Państwa Członkowskie zobowiązane są do ustanowienia i prowadzenia stałego
KLASYFIKACJA JAKOŚCI WÓD PODZIEMNYCH W SIECI KRAJOWEJ W 2005 ROKU Zgodnie z Ramową Dyrektywą Wodną Unii Europejskiej 2000/60/WE, Państwa Członkowskie zobowiązane są do ustanowienia i prowadzenia stałego
HYDROLIZA SOLI. 1. Hydroliza soli mocnej zasady i słabego kwasu. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
OCENA AGRESYWNOŚCI I KOROZJI WOBEC BETONU I STALI PRÓBKI WODY Z OTWORU NR M1 NA DRODZE DW 913
 Mysłowice, 08.03.2016 r. OCENA AGRESYWNOŚCI I KOROZJI WOBEC BETONU I STALI PRÓBKI WODY Z OTWORU NR M1 NA DRODZE DW 913 Zleceniodawca: GEOMORR Sp. j. ul. Chwałowicka 93, 44-206 Rybnik Opracował: Specjalista
Mysłowice, 08.03.2016 r. OCENA AGRESYWNOŚCI I KOROZJI WOBEC BETONU I STALI PRÓBKI WODY Z OTWORU NR M1 NA DRODZE DW 913 Zleceniodawca: GEOMORR Sp. j. ul. Chwałowicka 93, 44-206 Rybnik Opracował: Specjalista
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Wyznaczanie parametrów kolektywnych układu
 Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Wyznaczanie parametrów kolektywnych układu Oznaczanie twardości wody metodą kompleksometryczną Wstęp
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Wyznaczanie parametrów kolektywnych układu Oznaczanie twardości wody metodą kompleksometryczną Wstęp
Wykaz badań prowadzonych przez laboratorium - woda
 1 Temperatura 0 50 0 C (pomiar bezpośredni) 2 Chlor wolny 0,03 2,00 mg/l 0,02 2,00 mg/l 3 Mętność 0,10-1000 NTU (metoda nefelometryczna) 4 Barwa 5-70 mg/l Pt (metoda wizualna) 5 Zapach (metoda organoleptyczna)
1 Temperatura 0 50 0 C (pomiar bezpośredni) 2 Chlor wolny 0,03 2,00 mg/l 0,02 2,00 mg/l 3 Mętność 0,10-1000 NTU (metoda nefelometryczna) 4 Barwa 5-70 mg/l Pt (metoda wizualna) 5 Zapach (metoda organoleptyczna)
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny wk. Powietrzeimisja. Powietrzeemisja
 Załącznik 1 do zarządzenia nr 15/18 Podlaskiego Wojewódzkiego Inspektora Ochrony Środowiska z dnia 26 marca 2018r. L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja
Załącznik 1 do zarządzenia nr 15/18 Podlaskiego Wojewódzkiego Inspektora Ochrony Środowiska z dnia 26 marca 2018r. L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja
SKRÓCONY OPIS PROGRAMU NA ROK 2017
 F-01/ENV E N V I R O N SKRÓCONY OPIS PROGRAMU NA ROK 2017 Edycja nr 4 z dnia 4 stycznia Opracował: Zatwierdził: Imię i Nazwisko Krzysztof Jędrzejczyk Krzysztof Wołowiec Data 4 stycznia 4 stycznia Podpis
F-01/ENV E N V I R O N SKRÓCONY OPIS PROGRAMU NA ROK 2017 Edycja nr 4 z dnia 4 stycznia Opracował: Zatwierdził: Imię i Nazwisko Krzysztof Jędrzejczyk Krzysztof Wołowiec Data 4 stycznia 4 stycznia Podpis
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 432
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 432 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 14 Data wydania: 6 lipca 2016 r. Nazwa i adres: AB 432 PRZEDSIĘBIORSTWO
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 432 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 14 Data wydania: 6 lipca 2016 r. Nazwa i adres: AB 432 PRZEDSIĘBIORSTWO
Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny wk. Powietrzeimisja. Powietrzeemisja
 Załącznik 1 do zarządzenia nr 13/17 Podlaskiego Wojewódzkiego Inspektora Ochrony Środowiska z dnia 10 marca 2017r. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja
Załącznik 1 do zarządzenia nr 13/17 Podlaskiego Wojewódzkiego Inspektora Ochrony Środowiska z dnia 10 marca 2017r. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 432
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 432 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 15 maja 2015 r. Nazwa i adres: AB 432 PRZEDSIĘBIORSTWO
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 432 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 15 maja 2015 r. Nazwa i adres: AB 432 PRZEDSIĘBIORSTWO
ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW.
 ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW. Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza
ĆWICZENIA LABORATORYJNE WYKRYWANIE WYBRANYCH ANIONÓW I KATIONÓW. Chemia analityczna jest działem chemii zajmującym się ustalaniem składu jakościowego i ilościowego badanych substancji chemicznych. Analiza
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 933
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 933 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 14 Data wydania: 16 stycznia 2019 r. Nazwa i adres: ZAKŁADY
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 933 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 14 Data wydania: 16 stycznia 2019 r. Nazwa i adres: ZAKŁADY
Opracowanie składu pożywek nawozowych w oparciu o jakość wody
 INSTYTUT OGRODNICTWA SKIERNIEWICE Opracowanie składu pożywek nawozowych w oparciu o jakość wody Autorzy: dr Jacek Dyśko, dr Waldemar Kowalczyk Opracowanie przygotowane w ramach zadania 4.5: Monitorowanie
INSTYTUT OGRODNICTWA SKIERNIEWICE Opracowanie składu pożywek nawozowych w oparciu o jakość wody Autorzy: dr Jacek Dyśko, dr Waldemar Kowalczyk Opracowanie przygotowane w ramach zadania 4.5: Monitorowanie
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 787
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 787 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 13 listopada 2018 r. AB 787 Nazwa i adres
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 787 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 13 listopada 2018 r. AB 787 Nazwa i adres
Podstawowe właściwości fizyczne i chemiczne wody
 Gospodarka energetyczna, wodna i ściekowa Podstawowe właściwości fizyczne i chemiczne wody Wody różnego rodzaju pokrywają prawie ¾ powierzchni naszego globu, z czego 97% stanowią morza i oceany, około
Gospodarka energetyczna, wodna i ściekowa Podstawowe właściwości fizyczne i chemiczne wody Wody różnego rodzaju pokrywają prawie ¾ powierzchni naszego globu, z czego 97% stanowią morza i oceany, około
ANEKS 5 Ocena poprawności analiz próbek wody
 ANEKS 5 Ocena poprawności analiz próbek wody Bilans jonów Zasady ogólne Kontroli jakości danych dokonuje się wykonując bilans jonów. Bilans jonów jest podstawowym testem poprawności wyników analiz chemicznych
ANEKS 5 Ocena poprawności analiz próbek wody Bilans jonów Zasady ogólne Kontroli jakości danych dokonuje się wykonując bilans jonów. Bilans jonów jest podstawowym testem poprawności wyników analiz chemicznych
Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW.
 Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW. CHEMIA ANIONÓW W ROZTWORACH WODNYCH Celem ćwiczenia jest zapoznanie się z właściwościami chemicznymi wybranych anionów pierwiastków I oraz II okresu
Instrukcja do ćwiczenia WŁAŚCIWOŚCI WYBRANYCH ANIONÓW. CHEMIA ANIONÓW W ROZTWORACH WODNYCH Celem ćwiczenia jest zapoznanie się z właściwościami chemicznymi wybranych anionów pierwiastków I oraz II okresu
Inżynieria Środowiska S1. Chemia zajęcia laboratoryjne. Badanie fizykochemiczne wody
 Zasadowość wody Właściwością wody, którą określa się jako zasadowość, jest zdolność do zobojętniania kwasów mineralnych w określonych warunkach. Właściwość tę nadają wodzie obecne w niej wodorowęglany
Zasadowość wody Właściwością wody, którą określa się jako zasadowość, jest zdolność do zobojętniania kwasów mineralnych w określonych warunkach. Właściwość tę nadają wodzie obecne w niej wodorowęglany
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii
 Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Raport Jakość wody i ścieków w 2013 roku
 Raport Jakość wody i ścieków w 2013 roku Opracowanie: Magdalena Frajtak-Lepczyńska p.o.technolog wody i ścieków Zatwierdził: Piotr Trojanowski Prezes zarządu Warta, 2014 1. Wstęp Zakład Wodociągów Gminy
Raport Jakość wody i ścieków w 2013 roku Opracowanie: Magdalena Frajtak-Lepczyńska p.o.technolog wody i ścieków Zatwierdził: Piotr Trojanowski Prezes zarządu Warta, 2014 1. Wstęp Zakład Wodociągów Gminy
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 921
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 921 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 03 czerwca 2016 r. Nazwa i adres: AB 921 OKRĘGOWA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 921 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 03 czerwca 2016 r. Nazwa i adres: AB 921 OKRĘGOWA
RAPORT JAKOŚĆ WODY I ŚCIEKÓW
 2014 RAPORT JAKOŚĆ WODY I ŚCIEKÓW Opracowanie: Magdalena Frajtak-Lepczyńska Główny Technolog wody i ścieków Zatwierdził: Piotr Trojanowski Prezes zarządu WARTA, 2015 1. Wstęp Zakład Wodociągów Gminy i
2014 RAPORT JAKOŚĆ WODY I ŚCIEKÓW Opracowanie: Magdalena Frajtak-Lepczyńska Główny Technolog wody i ścieków Zatwierdził: Piotr Trojanowski Prezes zarządu WARTA, 2015 1. Wstęp Zakład Wodociągów Gminy i
10,10 do doradztwa nawozowego 0-60 cm /2 próbki/ 275. 20,20 Badanie azotu mineralnego 0-90 cm. 26,80 C /+ Egner/
 1 Cennik 2008 GLEBA MAKROELEMENTY Badania pełnopłatne Pozycja cennika Kwota w zł Preparatyka ( 2 mm) 2 2,20 Oznaczenie ph 5 4,50 Ekstrakcja przysw. form fosforu i potasu 18 4,50 Oznaczenie przyswajalnego
1 Cennik 2008 GLEBA MAKROELEMENTY Badania pełnopłatne Pozycja cennika Kwota w zł Preparatyka ( 2 mm) 2 2,20 Oznaczenie ph 5 4,50 Ekstrakcja przysw. form fosforu i potasu 18 4,50 Oznaczenie przyswajalnego
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 277
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 277 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 09 maja 2016 r. Nazwa i adres AB 277 OKRĘGOWA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 277 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 09 maja 2016 r. Nazwa i adres AB 277 OKRĘGOWA
Jednostki. AT 4 2,0-80 mg/kg s,m O 2 PBW-24 Metoda manometryczna (OxiTop) 0,013-3,86 0,010-3,00 PBM-01. mg/l NH 4 mg/l N-NH 4. mg/l NO 3 mg/l N-NO 3
 Status metody Cecha badana Formy oznaczenia A Aktywność oddechowa (AT4) A Azot amonowy Amoniak Azot amonowy Azot amonowy Amoniak Azot amonowy Zakres wykorzystyw any w badaniach Jednostki 1 Nr procedury,
Status metody Cecha badana Formy oznaczenia A Aktywność oddechowa (AT4) A Azot amonowy Amoniak Azot amonowy Azot amonowy Amoniak Azot amonowy Zakres wykorzystyw any w badaniach Jednostki 1 Nr procedury,
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1044
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1044 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 6 lipca 2018 r. Nazwa i adres EKO-KOMPLEKS
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1044 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 11 Data wydania: 6 lipca 2018 r. Nazwa i adres EKO-KOMPLEKS
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU
 DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU PRZEŁAMANIA WPROWADZENIE Ostatnim etapem uzdatniania wody w procesie technologicznym dla potrzeb ludności i przemysłu jest dezynfekcja. Proces ten jest niezbędny
DEZYNFEKCJA WODY CHLOROWANIE DO PUNKTU PRZEŁAMANIA WPROWADZENIE Ostatnim etapem uzdatniania wody w procesie technologicznym dla potrzeb ludności i przemysłu jest dezynfekcja. Proces ten jest niezbędny
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Klasa II : Dział 1. WODA I ROZTWORY WODNE
 Klasa II : Dział 1. WODA I ROZTWORY WODNE Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą Celujący wymienia rodzaje wód; wie, jaką funkcję pełni woda w budowie organizmów; podaje przykłady
Klasa II : Dział 1. WODA I ROZTWORY WODNE Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą Celujący wymienia rodzaje wód; wie, jaką funkcję pełni woda w budowie organizmów; podaje przykłady
WYSOKOŚĆ OPŁAT POBIERANYCH ZA ZADANIA WYKONYWANE PRZEZ OKRĘGOWE STACJE CHEMICZNO-ROLNICZE
 WYSOKOŚĆ OPŁAT POBIERANYCH ZA ZADANIA WYKONYWANE PRZEZ OKRĘGOWE STACJE CHEMICZNO-ROLNICZE Lp. Nazwa zadania Jednostka Kwota w zł I. Analizy fizyczne, fizykochemiczne i chemiczne gleb mineralnych oraz organicznych
WYSOKOŚĆ OPŁAT POBIERANYCH ZA ZADANIA WYKONYWANE PRZEZ OKRĘGOWE STACJE CHEMICZNO-ROLNICZE Lp. Nazwa zadania Jednostka Kwota w zł I. Analizy fizyczne, fizykochemiczne i chemiczne gleb mineralnych oraz organicznych
WYMAGANIA EDUKACYJNE
 GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
ILOŚCIOWE OZNACZANIE SIARCZANÓW W WODZIE WODOCIĄGOWEJ METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
 ILOŚCIOWE OZNACZANIE SIARCZANÓW W WODZIE WODOCIĄGOWEJ METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wprowadzenie 1.1.
ILOŚCIOWE OZNACZANIE SIARCZANÓW W WODZIE WODOCIĄGOWEJ METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wprowadzenie 1.1.
CHEMIA KLASA II I PÓŁROCZE
 CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
CHEMIA KLASA II I PÓŁROCZE wymienia zasady bhp dotyczące obchodzenia się z kwasami definiuje pojęcia: elektrolit i nieelektrolit wyjaśnia, co to jest wskaźnik i wymienia trzy przykłady odróżnia kwasy od
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
L.p. Powietrzeemisja. Powietrzeimisja. ścieki
 L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja Powietrzeemisja 1 Pobieranie próbek wody powierzchniowej i ścieków do badań fiz.-chem. i biologicznych 2 Pobieranie
L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny Powietrzeimisja Powietrzeemisja 1 Pobieranie próbek wody powierzchniowej i ścieków do badań fiz.-chem. i biologicznych 2 Pobieranie
Badania laboratoryjne składu chemicznego wód podziemnych
 Katowice 27.11.2015r. Odpowiedź na list Towarzystwa na rzecz Ziemi W związku ze zgłaszanymi przez Towarzystwo na rzecz Ziemi (pismo z dnia 05.11.2015r.) pytaniami dotyczącymi pierwiastków występujących
Katowice 27.11.2015r. Odpowiedź na list Towarzystwa na rzecz Ziemi W związku ze zgłaszanymi przez Towarzystwo na rzecz Ziemi (pismo z dnia 05.11.2015r.) pytaniami dotyczącymi pierwiastków występujących
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum
 WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE II gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 UZDATNIANIE WODY DO CELÓW PRZEMYSŁOWYCH WSTĘP Woda w czystej postaci (jako H 2 O) nie występuje w przyrodzie. Jest ona zawsze roztworem soli, kwasów i zasad oraz gazów. W pewnych przypadkach ilość substancji
UZDATNIANIE WODY DO CELÓW PRZEMYSŁOWYCH WSTĘP Woda w czystej postaci (jako H 2 O) nie występuje w przyrodzie. Jest ona zawsze roztworem soli, kwasów i zasad oraz gazów. W pewnych przypadkach ilość substancji
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
ZESTAW 06 MATERIAŁY DLA UCZNIÓW GIMNAZJUM JEZUITÓW W GDYNI
 ZESTAW 06 MATERIAŁY DLA UCZNIÓW GIMNAZJUM JEZUITÓW W GDYNI EGZAMIN KOMPETENCYJNY KWIECIEŃ 2006 rok Informacje do zadań 1. i 2. Wykres przedstawia zależność rozpuszczalności wybranych związków wapnia w
ZESTAW 06 MATERIAŁY DLA UCZNIÓW GIMNAZJUM JEZUITÓW W GDYNI EGZAMIN KOMPETENCYJNY KWIECIEŃ 2006 rok Informacje do zadań 1. i 2. Wykres przedstawia zależność rozpuszczalności wybranych związków wapnia w
Ćwiczenie 1: Elementy analizy jakościowej
 Ćwiczenie 1: Elementy analizy jakościowej Analiza chemiczna stanowi zbiór metod stosowanych w celu ustalenia składu jakościowego i ilościowego substancji. Wśród metod analitycznych możemy wyróżnić: 1)
Ćwiczenie 1: Elementy analizy jakościowej Analiza chemiczna stanowi zbiór metod stosowanych w celu ustalenia składu jakościowego i ilościowego substancji. Wśród metod analitycznych możemy wyróżnić: 1)
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1044
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1044 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 20 marca 2017 r. Nazwa i adres EKO-KOMPLEKS
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1044 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 20 marca 2017 r. Nazwa i adres EKO-KOMPLEKS
W dniach sierpnia 2011 r. obchodzony jest,,światowy Tydzień Wody. Akcja
 W dniach 21-27 sierpnia 2011 r. obchodzony jest,,światowy Tydzień Wody. Akcja organizowana jest od 1991 r. pod patronatem Stockholm International Water Institute (SIWI). Tegorocznym tematem przewodnim
W dniach 21-27 sierpnia 2011 r. obchodzony jest,,światowy Tydzień Wody. Akcja organizowana jest od 1991 r. pod patronatem Stockholm International Water Institute (SIWI). Tegorocznym tematem przewodnim
PAŃSTWOWY POWIATOWY INSPEKTOR SANITARNY W KATOWICACH. OKRESOWA OCENA JAKOŚCI WODY DLA MIASTA MYSŁOWICE za rok 2014
 PAŃSTWOWY POWIATOWY INSPEKTOR SANITARNY W KATOWICACH UL. BARBARY 17, 40-053 KATOWICE http://www.psse.katowice.pl/ NS/HKiŚ/4564/U/2015 e-mail: psse.katowice@pis.gov.pl Katowice, dnia 04.02.2015r. Sekretariat
PAŃSTWOWY POWIATOWY INSPEKTOR SANITARNY W KATOWICACH UL. BARBARY 17, 40-053 KATOWICE http://www.psse.katowice.pl/ NS/HKiŚ/4564/U/2015 e-mail: psse.katowice@pis.gov.pl Katowice, dnia 04.02.2015r. Sekretariat
E N V I R O N SKRÓCONY OPIS PROGRAMU NA ROK Wydanie 2 z dnia r. Imię i Nazwisko Krzysztof Jędrzejczyk Karolina Sójka
 E N V I R O N SKRÓCONY OPIS PROGRAMU NA ROK 2018 Wydanie 2 z dnia 02-01-2018 r. Opracował: Zatwierdził: Imię i Nazwisko Krzysztof Jędrzejczyk Karolina Sójka Data 02-01-2018 02-01-2018 Podpis Niniejszy
E N V I R O N SKRÓCONY OPIS PROGRAMU NA ROK 2018 Wydanie 2 z dnia 02-01-2018 r. Opracował: Zatwierdził: Imię i Nazwisko Krzysztof Jędrzejczyk Karolina Sójka Data 02-01-2018 02-01-2018 Podpis Niniejszy
Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań. 6,0 458,82 zł. 2,0 152,94 zł. 2,5 191,18 zł. 2,0 152,94 zł
 Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny cena jednostkowa Powietrze- imisja Powietrze- emisja cena jednostkowa
Współczynniki kalkulacyjne, ceny poboru próbek i wykonania badań L.p. Wykaz czynności Woda lub ścieki Gleby, odpady, osady, materiał roślinny cena jednostkowa Powietrze- imisja Powietrze- emisja cena jednostkowa
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
 RÓWNOWAGI W ROZTWORACH ELETROLITÓW Opracowanie: dr Jadwiga Zawada, dr inż. rystyna Moskwa, mgr Magdalena Bisztyga 1. Dysocjacja elektrolityczna Substancje, które podczas rozpuszczania w wodzie (lub innych
RÓWNOWAGI W ROZTWORACH ELETROLITÓW Opracowanie: dr Jadwiga Zawada, dr inż. rystyna Moskwa, mgr Magdalena Bisztyga 1. Dysocjacja elektrolityczna Substancje, które podczas rozpuszczania w wodzie (lub innych
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Materiały i tworzywa pochodzenia naturalnego
 Materiały i tworzywa pochodzenia naturalnego 1. Przyporządkuj opisom odpowiadające im pojęcia. Wpisz litery (A I) w odpowiednie kratki. 3 p. A. hydraty D. wapno palone G. próchnica B. zaprawa wapienna
Materiały i tworzywa pochodzenia naturalnego 1. Przyporządkuj opisom odpowiadające im pojęcia. Wpisz litery (A I) w odpowiednie kratki. 3 p. A. hydraty D. wapno palone G. próchnica B. zaprawa wapienna
Łukasz K. Tomasz M. Ochrona Wód
 Łukasz K. Tomasz M. Ochrona Wód Ogólne charakterystyka wód naturalnych Woda występująca w przyrodzie stanowi wodny roztwór substancji nieorganicznych i organicznych, jak również zawiera koloidy i zawiesiny.
Łukasz K. Tomasz M. Ochrona Wód Ogólne charakterystyka wód naturalnych Woda występująca w przyrodzie stanowi wodny roztwór substancji nieorganicznych i organicznych, jak również zawiera koloidy i zawiesiny.
Jak obliczyć skład pożywki w oparciu o analizę wody - zalecenia
 Samodzielna Pracownia Analiz Chemicznych Laboratorium Analiz Gleby i Roślin Jak obliczyć skład pożywki w oparciu o analizę wody zalecenia Autorzy: dr Waldemar Kowalczyk, mgr Anna Felczyńska Opracowanie
Samodzielna Pracownia Analiz Chemicznych Laboratorium Analiz Gleby i Roślin Jak obliczyć skład pożywki w oparciu o analizę wody zalecenia Autorzy: dr Waldemar Kowalczyk, mgr Anna Felczyńska Opracowanie
OPIS PRZEDMIOTU ZAMÓWIENIA. I. Badania wody surowej, uzdatnionej, wód popłucznych i wody z rzeki
 OPIS PRZEDMIOTU ZAMÓWIENIA I. Badania wody surowej, uzdatnionej, wód popłucznych i wody z rzeki Wykonanie badań wraz z pobraniem próbek i opracowaniem wyników zgodnie z harmonogramem stanowiącym załącznik
OPIS PRZEDMIOTU ZAMÓWIENIA I. Badania wody surowej, uzdatnionej, wód popłucznych i wody z rzeki Wykonanie badań wraz z pobraniem próbek i opracowaniem wyników zgodnie z harmonogramem stanowiącym załącznik
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH
 OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH Pomiary czynników szkodliwych i uciążliwych na stanowiskach pracy powietrze - czynniki chemiczne pyły hałas Analizy nawozów Analizy wody i ścieków Analizy produktów
OFERTA NA WYKONYWANIE BADAŃ LABORATORYJNYCH Pomiary czynników szkodliwych i uciążliwych na stanowiskach pracy powietrze - czynniki chemiczne pyły hałas Analizy nawozów Analizy wody i ścieków Analizy produktów
Wymagania edukacyjne z chemii w klasie 2E
 Wymagania edukacyjne z chemii w klasie 2E Woda i roztwory wodne Wymagania na ocenę wymienia rodzaje wód; wie, jaką funkcję pełni woda w budowie organizmów; podaje przykłady roztworów i zawiesin spotykanych
Wymagania edukacyjne z chemii w klasie 2E Woda i roztwory wodne Wymagania na ocenę wymienia rodzaje wód; wie, jaką funkcję pełni woda w budowie organizmów; podaje przykłady roztworów i zawiesin spotykanych
