CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Gabriel Milewski
- 7 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ortopedina, 7,5 mg, tabletki 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY Meloksykam 7,5 mg Substancja pomocnicza o znanym działaniu: Każda tabletka produktu Ortopedina, 7,5 mg, zawiera 23,5 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Tabletka Okrągłe, jasnożółte tabletki, o średnicy 8,0 mm oznaczone > na jednej stronie i ML 7.5 na drugiej stronie. 4. DANE KLINICZNE 4.1 Wskazania do stosowania Krótkotrwałe leczenie objawowe zaostrzeń choroby zwyrodnieniowej stawów. Długotrwałe leczenie objawowe reumatoidalnego zapalenia stawów lub zesztywniającego zapalenia stawów kręgosłupa. 4.2 Dawkowanie i sposób podawania Dawkowanie Zaostrzenie choroby zwyrodnieniowej stawów: 7,5 mg na dobę (jedna tabletka 7,5 mg). W przypadku braku poprawy, dawkę można zwiększyć do 15 mg na dobę (dwie tabletki 7,5 mg). Reumatoidalne zapalenie stawów, zesztywniające zapalenie stawów kręgosłupa: 15 mg raz na dobę (dwie tabletki 7,5 mg). (Patrz również Szczególne grupy pacjentów ). Zależnie od skuteczności terapeutycznej, dawka może być zmniejszona do 7,5 mg raz na dobę (jedna tabletka 7,5 mg). NIE NALEŻY PRZEKRACZAĆ DAWKI DOBOWEJ 15 mg. Działania niepożądane meloksykamu mogą być ograniczone do minimum poprzez zastosowanie najmniejszej skutecznej dawki przez najkrótszy okres konieczny do ustąpienia objawów. (patrz punkt 4.4). Należy okresowo kontrolować ustąpienie objawów oraz odpowiedź na leczenie, szczególnie u pacjentów z chorobą zwyrodnieniową stawów. Szczególne grupy pacjentów Pacjenci w podeszłym wieku oraz pacjenci ze zwiększonym ryzykiem wystąpienia działań niepożądanych (patrz punkt 5.2): 1
2 Do długotrwałego leczenia osób w podeszłym wieku z reumatoidalnym zapaleniem stawów i zesztywniającym zapaleniem stawów kręgosłupa zalecana jest dawka dobowa 7,5 mg. Pacjenci ze zwiększonym ryzykiem wystąpienia działań niepożądanych powinni rozpocząć leczenie od dawki 7,5 mg na dobę (patrz punkt 4.4). Niewydolność nerek (patrz punkt 5.2): U pacjentów dializowanych z ciężką niewydolnością nerek nie wolno przekraczać dawki 7,5 mg na dobę. Nie ma potrzeby zmniejszania dawki u pacjentów z łagodną i umiarkowaną niewydolnością nerek (tj. pacjenci z klirensem kreatyniny większym niż 25 ml/min). (Postępowanie u pacjentów z ciężką niewydolnością nerek nie poddawanych dializie - patrz punkt 4.3). Niewydolność wątroby: Nie ma potrzeby zmniejszenia dawki u pacjentów z łagodną i umiarkowaną niewydolnością wątroby. (Postępowanie u pacjentów z ciężką niewydolnością wątroby, patrz punkt 4.3). Dzieci i młodzież: Produkt leczniczy Ortopedina jest przeciwwskazany u dzieci i młodzieży w wieku poniżej 16 lat (patrz punkt 4.3). Sposób podawania Podanie doustne. Całkowitą dawkę dobową należy przyjmować jednorazowo, w dawce pojedynczej, popijając wodą lub innym płynem w trakcie posiłku. 4.3 Przeciwwskazania Meloxycam jest przeciwwskazany w następujących przypadkach: trzeci trymestr ciąży (patrz punkt 4.6 Wpływ na płodność, ciążę i laktację ). dzieci i młodzież w wieku poniżej 16 lat. uczulenie na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, lub uczulenie na substancje o podobnym działaniu np. niesteroidowe leki przeciwzapalne (NLPZ) i kwas acetylosalicylowy. Meloksykamu nie należy stosować u pacjentów z objawami astmy oskrzelowej, polipami nosa, obrzękiem naczynioruchowym lub pokrzywką, stwierdzanymi w następstwie podawania kwasu acetylosalicylowego lub innych niesteroidowych leków przeciwzapalnych. stwierdzenie w wywiadzie krwawienia z przewodu pokarmowego lub perforacji, związanych z wcześniejszym leczeniem lekami z grupy NLPZ. czynna lub nawracająca choroba wrzodowa przewodu pokarmowego i (lub) krwawienie (tj. co najmniej dwa wyraźne epizody potwierdzonego owrzodzenia lub krwawienia) w wywiadzie. ciężka niewydolność wątroby. ciężka niewydolność nerek u pacjentów niedializowanych. krwawienie z przewodu pokarmowego, stwierdzone w wywiadzie krwotoki z naczyń mózgowych lub inne zaburzenia prowadzące do krwawień. ciężka niewydolność serca. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Działania niepożądane mogą zostać zminimalizowane poprzez zastosowanie najmniejszej skutecznej dawki przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.2 oraz wpływ na przewód pokarmowy i układ krążenia poniżej). W przypadku niewystarczającej skuteczności terapeutycznej nie należy zwiększać zalecanej maksymalnej dawki dobowej, ani podawać jednocześnie inne leki z grupy NLPZ, ponieważ nie udowodniono, by zwiększało to skuteczność działania, a może doprowadzić do zwiększenia ryzyka toksyczności. Należy unikać jednoczesnego stosowania meloksykamu wraz z innymi lekami z grupy NLPZ, włącznie z selektywnymi inhibitorami cyklooksygenazy-2. 2
3 Meloksykam nie jest zalecany w leczeniu pacjentów z ostrymi atakami bólu. Jeśli po kilku dniach leczenia nie uzyskana zostanie poprawa, należy ponownie ocenić kliniczne korzyści z leczenia. Przed zastosowaniem leczenia meloksykamem należy się upewnić, że wszelkie podawane w wywiadzie przypadki zapalenia przełyku, żołądka i (lub) choroby wrzodowej żołądka zostały wyleczone. Należy rutynowo zwracać uwagę na możliwość nawrotu tych chorób i na występowanie nawrotów choroby w przeszłości w trakcie leczenia meloksykamem. Wpływ na przewód pokarmowy Krwawienia z przewodu pokarmowego, owrzodzenie i perforacja, które mogą być śmiertelne były obserwowane w każdym momencie leczenia NLPZ, z objawami ostrzegawczymi lub bez, lub z poważnymi zdarzeniami dotyczącymi układu pokarmowego w wywiadzie. Ryzyko krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji wzrasta wraz ze zwiększeniem dawki leków z grupy NLPZ, u pacjentów z chorobą wrzodową w wywiadzie, w szczególności w przypadku powikłanych krwawień lub perforacji (patrz punkt 4.3) oraz u pacjentów w podeszłym wieku. Ta grupa pacjentów powinna otrzymywać leczenie w najmniejszej dostępnej dawce. Skojarzone leczenie produktami leczniczymi działającymi ochronnie (np. mizoprostolem lub inhibitorami pompy protonowej) należy rozważyć u tych pacjentów, jak również w grupie pacjentów wymagających jednoczesnego leczenia małymi dawkami kwasu acetylosalicylowego oraz innymi lekami zwiększającymi ryzyko działań niepożądanych w obrębie przewodu pokarmowego (patrz poniżej i punkt 4.5). Pacjenci, u których zdiagnozowano działanie toksyczne na przewód pokarmowy, zwłaszcza w podeszłym wieku, powinni zgłaszać nietypowe objawy brzuszne (zwłaszcza krwawienia z przewodu pokarmowego), szczególnie w początkowych etapach leczenia. Zaleca się zachowanie ostrożności u pacjentów otrzymujących jednocześnie leki, które mogą zwiększać ryzyko powstawania owrzodzeń lub krwawienia, takie jak heparyna stosowana u pacjentów w podeszłym wieku lub w dawkach leczniczych, doustne kortykosteroidy, leki przeciwzakrzepowe takie jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub inne niesteroidowe leki przeciwzapalne włącznie z kwasem acetylosalicylowym podawanym w dawkach przeciwzapalnych ( 1 g jako dawka pojedyncza lub 3 g jako całkowita dawka dobowa) (patrz punkt 4.5). W przypadku wystąpienia krwawienia z przewodu pokarmowego lub owrzodzenia przewodu pokarmowego, podawanie meloksykamu należy przerwać. Leki z grupy NLPZ powinno się podawać z ostrożnością pacjentom z chorobami przewodu pokarmowego w wywiadzie (wrzodziejące zapalenie okrężnicy, choroba Crohna), ponieważ leki te mogą zaostrzyć przebieg tych chorób (patrz punkt 4.8 działania niepożądane). Wpływ na układ krążenia i naczynia mózgowe Pacjentów z nadciśnieniem tętniczym w wywiadzie i (lub) łagodną do umiarkowanej zastoinową niewydolnością serca należy odpowiednio kontrolować i wydawać właściwe zalecenia, ponieważ obserwowano zatrzymywanie płynów i powstawanie obrzęków w związku ze stosowaniem NLPZ. Zaleca się kliniczną kontrolę ciśnienia tętniczego u pacjentów z grupy ryzyka, szczególnie w trakcie rozpoczynania leczenia meloksykamem. Z badań klinicznych i danych epidemiologicznych wynika, że przyjmowanie niektórych niesteroidowych leków przeciwzapalnych z meloksykamem włącznie (szczególnie w leczeniu długotrwałym oraz w dużych dawkach) jest związane z niewielkim zwiększeniem ryzyka zdarzeń zakrzepowych tętnic (np. zawał mięśnia sercowego lub udar). Dane te są niewystarczające, aby wykluczyć takie ryzyko w przypadku przyjmowania meloksykamu. 3
4 Pacjenci z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca, chorobą niedokrwienną serca, chorobą tętnic obwodowych i (lub) chorobą naczyń mózgowych powinni być leczeni meloksykamem bardzo rozważnie. Podobną rozwagę należy zachować przed rozpoczęciem długotrwałego leczenia pacjentów z czynnikami ryzyka chorób układu krążenia (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu). Reakcje skórne Bardzo rzadko donoszono o występowaniu ciężkich reakcji skórnych, z których niektóre kończyły się zgonem, obejmujących złuszczające zapalenie skóry, zespół Stevensa-Johnsona oraz toksyczne martwicze oddzielanie się naskórka w związku z leczeniem NLPZ (patrz punkt 4.8). Największe ryzyko wystąpienia tych reakcji istnieje w początkowym okresie leczenia, przy czym pierwsze objawy w większości przypadków pojawiają się w ciągu pierwszego miesiąca leczenia. Należy przerwać leczenie meloksykamem po pierwszym wystąpieniu wysypki skórnej, uszkodzenia błon śluzowych lub jakichkolwiek objawów nadwrażliwości. Podczas stosowania meloksykamu obserwowano zagrażające życiu reakcje skórne, takie jak złuszczające zapalenie skóry, zespół Stevensa-Johnsona (ang. SJS, Stevens-Johnson Syndrome) i toksyczne martwicze oddzielanie się naskórka (ang. TEN, Toxic Epidermal Necrolysis). Należy poinformować pacjentów o możliwych objawach i obserwować reakcje skórne. Największe ryzyko dla wystąpienia złuszczającego zapalenia skóry, SJS lub TEN jest w ciągu pierwszych tygodni leczenia. Jeżeli wystąpią objawy SJS lub TEN (np. progresywna wysypka na skórze, często z pęcherzami lub zmianami na błonach śluzowych), należy przerwać leczenie meloksykamem. Wczesne rozpoznanie reakcji skórnych oraz natychmiastowe zaprzestanie podawania produktu leczniczego daje lepsze rokowania w leczeniu SJS i TEN. Wczesne odstawienie produktu leczniczego wiąże się z lepszym rokowaniem. Jeśli u pacjenta stosującego meloksykam rozwinie się SJS lub TEN, nie wolno w późniejszym leczeniu u tego pacjenta ponownie stosować meloksykamu. Parametry czynności wątroby i nerek Jak w przypadku większości leków z grupy NLPZ, sporadycznie obserwowano zwiększenie aktywności aminotransferaz w surowicy krwi, zwiększone stężenie bilirubiny lub zmiany innych parametrów czynności wątroby jak również zwiększone stężenie kreatyniny i azotu mocznikowego w surowicy krwi, a także zgłaszano nieprawidłowe wartości innych wyników badań. W większości przypadków były to zaburzenia niewielkie i przemijające. W przypadku, gdy zaburzenia są znaczące lub utrzymują się, należy przerwać podawanie meloksykamu i przeprowadzić odpowiednie badania kontrolne. Czynnościowa niewydolność nerek NLPZ hamując działanie prostaglandyn polegające na rozszerzaniu naczyń w nerkach, mogą prowadzić do czynnościowej niewydolności nerek przez zmniejszenie filtracji kłębuszkowej. Działanie to jest zależne od dawki. W przypadku pacjentów, których dotyczą wymienione poniżej czynniki ryzyka, na początku leczenia lub przy zwiększaniu dawki produktu leczniczego zalecana jest kontrola diurezy i innych parametrów czynności nerek: podeszły wiek jednoczesne stosowanie inhibitorów ACE, antagonistów angiotensyny II, sartanów, leków moczopędnych (patrz punkt 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji) hipowolemia (bez względu na przyczynę) zastoinowa niewydolność serca niewydolność nerek zespół nerczycowy nefropatia toczniowa ciężkie zaburzenie czynności wątroby (stężenie albumin w surowicy <25 g/l lub punktacja w skali Child-Pugh 10) 4
5 W rzadkich przypadkach stosowanie leków z grupy NLPZ może powodować śródmiąższowe zapalenie nerek, kłębuszkowe zapalenie nerek, martwicę rdzenia nerki lub zespół nerczycowy. U pacjentów ze schyłkową niewydolnością nerek poddawanych hemodializie dawka meloksykamu nie powinna być większa niż 7,5 mg. Nie jest konieczne zmniejszenie dawki u pacjentów z łagodną lub umiarkowaną niewydolnością nerek (np. u pacjentów z klirensem kreatyniny powyżej 25 ml/min). Zatrzymanie sodu, potasu i wody Podawanie leków z grupy NLPZ może spowodować zatrzymanie sodu, potasu i wody w organizmie, co może zaburzać działanie leków moczopędnych powodujących wydalanie sodu z moczem. Ponadto może wystąpić zmniejszenie skuteczności działania leków przeciwnadciśnieniowych (patrz punkt 4.5). W konsekwencji u pacjentów wrażliwych mogą wystąpić lub zaostrzyć się obrzęki, niewydolność serca lub nadciśnienie tętnicze. Dlatego konieczna jest obserwacja kliniczna pacjentów z grup ryzyka (patrz punkt 4.2 i 4.3). Hiperkaliemia Rozwojowi hiperkaliemii może sprzyjać cukrzyca lub jednoczesne stosowanie leków zwiększających stężenie potasu we krwi (patrz punkt 4.5.). W takich przypadkach należy regularnie kontrolować stężenie potasu. Inne ostrzeżenia i środki ostrożności Pacjenci w podeszłym wieku lub osłabieni często gorzej znoszą działania niepożądane produktu leczniczego, dlatego w ich przypadku konieczna jest szczególna kontrola. Jak w przypadku stosowania innych leków z grupy NLPZ, należy zachować szczególną ostrożność podczas leczenia pacjentów w podeszłym wieku, u których czynność nerek, wątroby czy serca często bywa zaburzona. U pacjentów w podeszłym wieku, którym podawane są leki z grupy NLPZ częstość występowania działań niepożądanych jest zwiększona, w szczególności dochodzi do krwawień lub perforacji przewodu pokarmowego, które mogą zakończyć się zgonem (patrz punkt 4.2). Meloksykam, podobnie jak inne leki z grupy NLPZ, może maskować objawy występującego zakażenia. Stosowanie meloksykamu, podobnie jak innych leków hamujących aktywność cyklooksygenazy/ syntezę prostaglandyn, może zaburzać płodność i nie zaleca się podawania tego leku kobietom planującym ciążę. Dlatego w przypadku kobiet, które mają problemy z zajściem w ciążę, lub które leczą się z powodu niepłodności, należy rozważyć odstawienie meloksykamu. Ortopedina zawiera laktozę. Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zaburzeniem wchłaniania glukozygalaktozy nie powinni stosować tego leku. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Badania interakcji prowadzone były wyłącznie z udziałem dorosłych. Inne niesteroidowe leki przeciwzapalne, w tym salicylany i kwas acetylosalicylowy 3 g na dobę Jednoczesne stosowanie meloksykamu (patrz punkt 4.4.) z innymi lekami z grupy NLPZ, w tym również z kwasem acetylosalicylowym, podawanymi w dawkach przeciwzapalnych ( 1 g jako dawka pojedyncza lub 3 g jako całkowita dawka dobowa) nie jest zalecane. Jednoczesne podawanie kilku leków z grupy NLPZ może zwiększyć ryzyko krwawienia i wrzodów przewodu pokarmowego w wyniku działania synergistycznego. Kortykosteroidy (np. glikokortykosteroidy) Jednoczesne stosowanie kortykosteroidów wymaga ostrożności i uważnej obserwacji pacjenta ze względu na zwiększone ryzyko krwawienia lub owrzodzeń w przewodzie pokarmowym. 5
6 Leki przeciwzakrzepowe lub heparyna stosowana u pacjentów w podeszłym wieku lub w dawkach leczniczych Istnieje zwiększone ryzyko krwawienia wskutek hamowania czynności płytek krwi i uszkodzenia błony śluzowej żołądka. NLPZ mogą nasilić działanie leków przeciwzakrzepowych takich jak warfaryna (patrz punkt 4.4). Nie zaleca się jednoczesnego stosowania leków z grupy NLPZ i leków przeciwzakrzepowych lub heparyny u pacjentów w podeszłym wieku lub w dawkach leczniczych (patrz punkt 4.4). W pozostałych przypadkach należy zachować ostrożność stosując heparynę, ze względu na zwiększone ryzyko krwawienia. W sytuacji, gdy nie można uniknąć takiego połączenia leków, konieczne jest uważne monitorowanie znormalizowanego wskaźnika INR (ang. International Normalized Ratio). Leki trombolityczne i hamujące działanie płytek Zwiększone ryzyko krwawienia wskutek hamowania czynności płytek krwi i uszkodzenia błony śluzowej żołądka. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) Zwiększone ryzyko krwawienia z przewodu pokarmowego. Leki moczopędne, inhibitory ACE i antagoniści receptora angiotensyny II Leki z grupy NLPZ mogą zmniejszać działanie leków moczopędnych i innych leków obniżających ciśnienie krwi. U niektórych pacjentów z zaburzoną czynnością nerek (np. pacjenci odwodnieni lub w podeszłym wieku z zaburzoną czynnością nerek) jednoczesne podawanie inhibitora ACE lub antagonistów receptora angiotensyny II i leków, które hamują czynność cyklooksygenazy, może powodować dalsze pogorszenie czynności nerek, włączając możliwość wystąpienia ostrej niewydolności nerek, która na ogół jest stanem odwracalnym. Tego typu leczenie skojarzone należy przeprowadzać z zachowaniem ostrożności, zwłaszcza u osób w podeszłym wieku. Pacjenci powinni być odpowiednio nawodnieni, a po wprowadzeniu terapii skojarzonej i okresowo w czasie jej trwania należy rozważyć monitorowanie czynności nerek (patrz również punkt 4.4). Leki z grupy NLPZ (w tym kwas acetylosalicylowy w dawce >3 g na dobę) i antagoniści receptora angiotensyny II mogą wywierać efekt synergistyczny na obniżenie filtracji kłębuszkowej, która może się pogorszyć gdy czynność nerek ulegnie zmianie. Inne leki przeciwnadciśnieniowe (np. leki blokujące receptory beta-adrenergiczne) Jak podano powyżej, może wystąpić osłabienie działania hipotensyjnego leków blokujących receptory beta-adrenergiczne (wskutek zahamowania syntezy prostaglandyn, które rozszerzają naczynia krwionośne). Inhibitory kalcyneuryny (np. cyklosporyna, takrolimus) Poprzez działanie mediacyjne prostaglandyn leki NLPZ mogą zwiększać działanie nefrotoksyczne inhibitorów kalcyneuryny. Podczas leczenia skojarzonego należy dokładnie monitorować czynność nerek. Kontrola czynności nerek jest zalecana zwłaszcza u pacjentów w podeszłym wieku. Systemy terapeutyczne domaciczne Istnieją dane o zmniejszeniu skuteczności systemów terapeutycznych domacicznych pod wpływem leków z grupy NLPZ. O zmniejszaniu skuteczności systemów terapeutycznych domacicznych i innych podobnych środków przez leki z grupy NLPZ donoszono wcześniej, lecz konieczne jest dalsze potwierdzenie tych informacji. Interakcje farmakokinetyczne (wpływ meloksykamu na farmakokinetykę innych leków) Lit Leki z grupy NLPZ zwiększają stężenie litu we krwi (poprzez zmniejszenie wydalania litu przez nerki), które może osiągać wartości toksyczne. Nie zaleca się jednoczesnego stosowania litu i leków z grupy NLPZ (patrz punkt 4.4). Jeżeli konieczne jest zastosowanie leczenia skojarzonego, należy uważnie monitorować stężenie litu w osoczu podczas rozpoczynania leczenia, dostosowywania dawkowania oraz odstawiania meloksykamu. 6
7 Metotreksat Leki z grupy NLPZ mogą zmniejszać wydzielanie kanalikowe metotreksatu, zwiększając w ten sposób jego stężenie w osoczu. Dlatego też, u pacjentów przyjmujących duże dawki metotreksatu (powyżej 15 mg/tydzień) nie zaleca się równoczesnego stosowania leków z grupy NLPZ (patrz punkt 4.4). Ryzyko wystąpienia interakcji między produktami zawierającymi związki z grupy NLPZ i metotreksatem należy również wziąć pod uwagę u pacjentów przyjmujących mniejsze dawki metotreksatu, zwłaszcza u pacjentów z zaburzeniami czynności nerek. Jeśli konieczne jest zastosowanie leczenia skojarzonego, należy kontrolować wskaźniki morfologii krwi i czynność nerek. Należy zachować ostrożność w przypadku, gdy leki z grupy NLPZ i metotreksat podawane są jednocześnie w ciągu 3 dni, gdyż stężenie metotreksatu w osoczu krwi może wzrosnąć i spowodować zwiększoną toksyczność. Pomimo, że farmakokinetyka metotreksatu (15 mg/tydzień) nie ulegała znaczącym zmianom podczas jednoczesnego stosowania meloksykamu, należy pamiętać o możliwości nasilenia toksycznego wpływu metotreksatu na parametry hematologiczne podczas stosowania z lekami z grupy NLPZ (patrz wyżej) (patrz punkt 4.8). Interakcje farmakokinetyczne: Wpływ innych leków na farmakokinetykę meloksykamu Cholestyramina Cholestyramina przyspiesza eliminację meloksykamu poprzez zaburzenie krążenia wątrobowojelitowego, w wyniku czego klirens meloksykamu ulega zwiększeniu o 50%, a okres półtrwania zmniejsza się do 13±3 h. Interakcja ta ma znaczenie kliniczne. Nie stwierdzono mających znaczenie kliniczne interakcji podczas jednoczesnego stosowania z lekami zobojętniającymi, cymetydyną i digoksyną. 4.6 Wpływ na płodność, ciążę i laktację Płodność Stosowanie meloksykamu, podobnie jak innych leków hamujących aktywność cyklooksygenazy/ syntezę prostaglandyn, może zaburzać płodność i nie zaleca się podawania tego leku kobietom planującym ciążę. Z tego względu w przypadku kobiet, które mają problemy z zajściem w ciążę, lub które leczą się z powodu niepłodności, należy rozważyć odstawienie meloksykamu. Ciąża Hamowanie syntezy prostaglandyn może wywierać szkodliwy wpływ na przebieg ciąży i (lub) rozwój zarodka i płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronień, jak również wad serca i wytrzewienia wrodzonego (gastroschisis) u dzieci w związku z zahamowaniem syntezy prostaglandyn we wczesnym okresie ciąży. Bezwzględne ryzyko wystąpienia wad rozwojowych serca zwiększa się z mniej niż 1% do około 1,5%. Ryzyko zwiększa się wraz ze zwiększeniem dawki i czasem leczenia. Wykazano, że podanie zwierzętom inhibitorów syntezy prostaglandyn prowadziło do zwiększenia przypadków strat przed i poimplantacyjnych, jak również śmiertelności zarodka lub płodu. Ponadto, u zwierząt którym podawano inhibitory syntezy prostaglandyn w okresie ciąży związanym z rozwojem narządów stwierdzono zwiększenie częstości występowania innych wad rozwojowych, łącznie z wadami serca. W okresie pierwszego i drugiego trymestru ciąży inhibitory syntezy prostaglandyn powinny być stosowane jedynie w przypadkach bezwzględnej konieczności. Jeśli inhibitory syntezy prostaglandyn przyjmowane są przez kobiety planujące ciążę lub w czasie pierwszego lub drugiego trymestru ciąży, należy stosować jak najmniejszą dawkę i jak najkrótszy okres leczenia. Podczas stosowania w trzecim trymestrze ciąży, wszystkie inhibitory syntezy prostaglandyn mogą powodować narażenie: - płodu na: działanie toksyczne na serce i płuca (przedwczesne zamknięcie przetrwałego przewodu tętniczego i nadciśnienie płucne) zaburzenia czynności nerek, które może przekształcić się w niewydolność nerek z małowodziem - u matki i noworodka, w końcowym okresie ciąży: 7
8 wydłużenie okresu krwawienia w wyniku zahamowania agregacji płytek mogącej wystąpić nawet po podaniu bardzo małych dawek zahamowanie czynności skurczowej macicy, co może prowadzić do opóźnienia lub wydłużenia akcji porodowej. Z uwagi na powyższe, inhibitory syntezy prostaglandyn są przeciwwskazane w trzecim trymestrze ciąży. Karmienie piersią Brak doświadczenia dotyczącego stosowania meloksykamu, jednak wiadomo, że leki NLPZ przenikają do mleka matki. Z tego względu nie zaleca się stosowania leku u kobiet karmiących piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów lub obsługiwania maszyn Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów mechanicznych lub obsługiwania maszyn. Opierając się na profilu farmakodynamicznym i obserwowanych działaniach niepożądanych, meloksykam ma niewielki albo nie ma żadnego wpływu na te zdolności. Niemniej jednak zaleca się unikanie prowadzenia pojazdów i obsługiwania maszyn, jeśli wystąpią zaburzenia widzenia lub senność, zawroty głowy albo inne objawy dotyczące ośrodkowego układu nerwowego. 4.8 Działania niepożądane a) Opis ogólny Z badań klinicznych i danych epidemiologicznych wynika, że stosowanie niektórych NLPZ (szczególnie w długotrwałym leczeniu dużymi dawkami) może być związane z niewielkim zwiększeniem zdarzeń zakrzepowych tętnic (np. zawał serca lub udar) (patrz punkt 4.4). W związku z leczeniem NLPZ zgłaszano występowanie obrzęków, nadciśnienia tętniczego i niewydolności serca. Najczęściej obserwowane działania niepożądane dotyczą przewodu pokarmowego. Mogą wystąpić owrzodzenie, perforacja lub krwawienie z przewodu pokarmowego, czasami zakończone zgonem, zwłaszcza u pacjentów w podeszłym wieku (patrz punkt 4.4). Podczas leczenia zaobserwowano występowanie: nudności, wymiotów, biegunki, zaparć, wzdęć, niestrawności, bólów brzucha, krwi w stolcu, krwawych wymiotów, wrzodziejącego zapalenia błony śluzowej jamy ustnej, zaostrzenia zapalenia jelita grubego i choroby Leśniowskiego-Crohna (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania). Rzadziej donoszono o występowaniu zapalenia błony śluzowej żołądka. Podana poniżej częstość występowania działań niepożądanych oparta jest o ich występowanie w 27 badaniach klinicznych, w których czas leczenia wynosił co najmniej 14 dni. Badania kliniczne obejmowały pacjentów, którym podawano meloksykam doustnie w dawce dobowej 7,5 lub 15 mg przez okres do 1 roku. Poniżej podano również te działania niepożądane, które zostały opisane w raportach dotyczących stosowania produktu po wprowadzeniu do obrotu. Działania niepożądane podzielono pod względem częstości występowania, na następujące grupy: bardzo często ( 1/10); często ( 1/100 i <1/10), niezbyt często ( 1/1 000 i <1/100), rzadko ( 1/ i <1/1 000), bardzo rzadko ( 1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). b) Tabela działań niepożądanych 8
9 Zaburzenia krwi i układu chłonnego Niezbyt często: niedokrwistość Rzadko: zaburzenia w morfologii krwi (w tym wzoru odsetkowego krwinek białych): leukopenia, trombocytopenia Donoszono o bardzo rzadkich przypadkach agranulocytozy (patrz podpunkt c). Zaburzenia układu immunologicznego Niezbyt często: reakcje alergiczne inne niż anafilaktyczne lub anafilaktoidalne Częstość nieznana: reakcje anafilaktyczne lub anafilaktoidalne Zaburzenia psychiczne Rzadko: zaburzenia nastroju, koszmary senne Częstość nieznana: stan splątania, dezorientacja Zaburzenia układu nerwowego Często: ból głowy Niezbyt często: zawroty głowy, senność Zaburzenia oka Rzadko: zaburzenia widzenia, w tym widzenie nieostre, zapalenie spojówek Zaburzenia ucha i błędnika Niezbyt często: zawroty głowy pochodzenia błędnikowego Rzadko: szumy uszne Zaburzenia serca Rzadko: kołatanie serca Niewydolność serca zgłaszano w związku z leczeniem NLPZ. Zaburzenia naczyniowe Niezbyt często: zwiększenie ciśnienia krwi (patrz punkt 4.4), nagłe zaczerwienienie twarzy Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: występowanie napadów astmy u pacjentów uczulonych na kwas acetylosalicylowy lub inne leki z grupy NLPZ Zaburzenia żołądka i jelit Najczęściej obserwowane działania niepożądane mają charakter zaburzeń żołądkowo-jelitowych. Bardzo często: niestrawność, nudności, wymioty, bóle brzucha, zaparcia, wzdęcia, biegunka Niezbyt często: utajone lub makroskopowe krwawienia z przewodu pokarmowego, choroba wrzodowa żołądka, zapalenie błony śluzowej jamy ustnej, zapalenie błony śluzowej żołądka, odbijanie Rzadko: zapalenie jelita grubego, owrzodzenie żołądka i (lub) dwunastnicy, zapalenie przełyku Bardzo rzadko: perforacja przewodu pokarmowego Mogące wystąpić choroba wrzodowa żołądka, perforacje lub krwawienia z przewodu pokarmowego mogą zakończyć się zgonem, zwłaszcza u osób w podeszłym wieku (parz punkt 4.4). Donoszono o występowaniu smolistych stolców, krwawych wymiotów, owrzodzenia błony śluzowej jamy ustnej, zaostrzenia zapalenia okrężnicy i choroby Crohna (patrz punkt 4.4). Zaburzenia wątroby i dróg żółciowych Niezbyt często: przejściowe zaburzenia czynności wątroby (np. zwiększenie aktywności aminotransferaz lub zwiększenie stężenia bilirubiny) Bardzo rzadko: zapalenie wątroby Zaburzenia skóry i tkanki podskórnej Niezbyt często: obrzęk naczynioruchowy, świąd, wysypka 9
10 Rzadko: ciężkie reakcje skórne (SCARs): zespół Stevensa-Johnsona (SJS) i toksyczne martwicze oddzielanie się naskórka (TEN) (patrz punkt 4.4), pokrzywka Bardzo rzadko: reakcje pęcherzowe, rumień wielopostaciowy Częstość nieznana: nadwrażliwość na światło Zaburzenia nerek i dróg moczowych Niezbyt często: zatrzymanie sodu i wody w organizmie, hiperkaliemia, (patrz punkt 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania oraz punkt 4.5), nieprawidłowe wyniki badań czynności nerek (zwiększenie stężenia kreatyniny w surowicy i (lub) stężenia mocznika w surowicy) Bardzo rzadko: ostra niewydolność nerek w szczególności u pacjentów z czynnikami ryzyka (patrz punkt 4.4) Zaburzenia ogólne i stany w miejscu podania Niezbyt często: obrzęk, w tym obrzęk kończyn dolnych c) Informacje dotyczące jednostkowych przypadków ciężkich i (lub) często występujących działań niepożądanych Obserwowano pojedyncze przypadki agranulocytozy u pacjentów leczonych jednocześnie meloksykamem i innymi lekami o potencjalnym działaniu mielotoksycznym (patrz punkt 4.5). d) Działania niepożądane, których nie obserwowano jeszcze w związku z omawianym produktem, lecz które uważa się zwykle za mające związek z innymi lekami z tej grupy Organiczne uszkodzenia nerek prowadzące prawdopodobnie do ostrej niewydolności nerek: bardzo rzadko donoszono o przypadkach śródmiąższowego zapalenia nerek, ostrej martwicy kanalikowej, zespołu nerczycowego oraz martwicy brodawek nerkowych (patrz punkt 4.4). Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, Warszawa, tel.: , faks: , ndl@urpl.gov.pl. 4.9 Przedawkowanie Objawy występujące po ostrym przedawkowaniu leków z grupy NLPZ są zwykle ograniczone do letargu, senności, nudności, wymiotów i bólów w nadbrzuszu, które zwykle ustępują po zastosowaniu leczenia wspomagającego. Wystąpić mogą krwotoki z przewodu pokarmowego. Ciężkie zatrucie może powodować nadciśnienie tętnicze, ostrą niewydolność nerek, zaburzenia czynności wątroby, depresję oddechową, śpiączkę, drgawki, zapaść sercowo-naczyniową i zatrzymanie czynności serca. Odnotowano występowanie reakcji anafilaktoidalnych po podaniu terapeutycznych dawek leków z grupy NLPZ, mogą one również wystąpić w wyniku przedawkowania. Pacjenci po przedawkowaniu lekami z grupy NLPZ powinni być leczeni objawowo i podtrzymująco. W badaniu klinicznym wykazano przyspieszoną eliminację meloksykamu poprzez doustne podanie 4 g cholestyraminy, 3 razy na dobę. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne 10
11 Grupa farmakoterapeutyczna: Niesteroidowe leki przeciwzapalne i przeciwreumatyczne, oksykamy. kod ATC: M 01 AC 06. Meloksykam jest niesteroidowym lekiem przeciwzapalnym z grupy oksykamów (NLPZ), wykazującym działanie przeciwzapalne, przeciwbólowe i przeciwgorączkowe. Przeciwzapalne właściwości meloksykamu zostały udowodnione w klasycznych modelach zapalenia. Podobnie jak w przypadku innych niesteroidowych leków przeciwzapalnych dokładny mechanizm działania pozostaje nieznany. Jednakże co najmniej jeden mechanizm działania jest wspólny dla wszystkich leków z grupy NLPZ (włączając meloksykam): hamowanie syntezy prostaglandyn, znanych mediatorów procesu zapalnego. 5.2 Właściwości farmakokinetyczne Wchłanianie Meloksykam jest dobrze wchłaniany z przewodu pokarmowego, co znajduje odzwierciedlenie w dużej całkowitej biodostępności wynoszącej 89% po podaniu doustnym (kapsułki). Wykazano, że tabletki, zawiesina doustna i kapsułki są biorównoważne. Po podaniu pojedynczej dawki, maksymalne stężenie w osoczu osiągane jest po 2 godzinach dla zawiesiny, dla postaci doustnych (kapsułki lub tabletki) w ciągu 5 do 6 godzin. Po podaniu wielokrotnym stan równowagi był osiągany po 3-5 dniach. Podawanie produktu leczniczego raz na dobę prowadzi do osiągnięcia stężeń, które wykazują stosunkowo niewielką fluktuację (stężenie maksymalne/stężenie minimalne), w zakresie 0,4-1,0 μg/ml (odpowiednio C min i C max w stanie równowagi) dla dawek wynoszących 7,5 mg oraz 0,8-2,0 μg/ml dla dawek wynoszących 15 mg. Maksymalne stężenie meloksykamu w stanie równowagi osiągane jest po 5-6 godzinach w przypadku tabletek, kapsułek i zawiesiny doustnej. Stosowanie produktu przez okres ponad roku prowadzi do osiągnięcia stężeń podobnych do osiąganych w stanie równowagi. Równocześnie spożywany pokarm nie wpływa na wchłanianie meloksykamu po podaniu doustnym. Dystrybucja Meloksykam bardzo silnie wiąże się z białkami osocza, głównie albuminami (99%). Meloksykam przenika do mazi stawowej, gdzie osiąga stężenie wartości połowy stężenia w osoczu. Objętość dystrybucji jest mała i wynosi średnio 11 litrów. Zmienność międzyosobnicza kształtuje się na poziomie 30% do 40%. Metabolizm Meloksykam jest metabolizowany głównie w wątrobie. W moczu zidentyfikowano cztery metabolity farmakodynamicznie nieczynne. Głównie metabolit, 5' karboksymeloksykam (60% dawki), powstaje w wyniku utleniania metabolitu pośredniego, 5' hydroksymethylmeloksykamu, który również jest wydalany w niewielkiej ilości (9% dawki). Badania in vitro wykazują, że CYP 2C9, z niewielkim udziałem izoenzymu CYP 3A4, odgrywają ważną rolę w tym szlaku metabolicznym. Aktywność peroksydazowa jest prawdopodobnie odpowiedzialna za powstawanie dwóch innych metabolitów, które stanowią odpowiednio 16% i 4% podanej dawki. Wydalanie Meloksykam jest wydalany głównie w postaci metabolitów, w równym stopniu w moczu i z kałem. Mniej niż 5% wydala się z kałem w postaci niezmienionej, podczas gdy jedynie ślady macierzystego związku są wykrywane w moczu. Średni okres półtrwania wynosi około 20 godzin. Całkowity klirens osoczowy wynosi średnio 8 ml/min. Liniowość lub nieliniowość Meloksykam wykazuje liniową farmakokinetykę w zakresie dawek 7,5-15 mg, zarówno po podaniu doustnym jak i domięśniowym. Szczególne grupy pacjentów 11
12 Niewydolność wątroby lub nerek Niewydolność wątroby oraz łagodna i umiarkowana niewydolność nerek nie mają istotnego wpływu na farmakokinetykę meloksykamu. W schyłkowej niewydolności nerek zwiększenie objętości dystrybucji może wpływać na stężenie meloksykamu, dlatego nie wolno przekraczać dawki 7,5 mg (patrz punkt 4.2). Pacjenci w podeszłym wieku Średni klirens osoczowy w stanie stacjonarnym jest nieznacznie mniejszy u pacjentów w podeszłym wieku niż u młodszych pacjentów. 5.3 Przedkliniczne dane o bezpieczeństwie Z badań przedklinicznych wynika, że profil toksykologiczny meloksykamu jest taki sam, jak innych związków z grupy NLPZ: owrzodzenia i nadżerki przewodu pokarmowego oraz martwicę brodawek nerkowych zaobserwowano po długotrwałym podawaniu dużych dawek dwóm gatunkom zwierząt. Badania dotyczące wpływu doustnie podawanego meloksykamu na reprodukcję u szczurów wykazały zmniejszenie liczby owulacji i zahamowanie implantacji oraz działania embriotoksyczne (zwiększenie przypadków resorpcji) dla dawek toksycznych dla samic, 1 mg/kg i powyżej. Zakres zastosowanych dawek był 10-5 razy większy od dawek klinicznych (7,5 15 mg) obliczonych w mg/kg dla osoby o masie 75 kg. Pod koniec ciąży stwierdzono, że meloksykam, podobnie jak wszystkie inhibitory syntezy prostaglandyn, wykazywał działanie toksyczne na płód. Meloksykam nie wykazywał działania mutagennego, ani w badaniach in vitro ani in vivo. Nie wykazano działania rakotwórczego u szczurów i myszy po podaniu meloksykamu w dawkach wielokrotnie większych niż stosowane klinicznie. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu cytrynian dwuwodny Laktoza jednowodna Celuloza mikrokrystaliczna Powidon K-25 Krzemionka koloidalna bezwodna Krospowidon typ A Magnezu stearynian 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata 6.4 Specjalne środki ostrożności przy przechowywaniu Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania Blistry PVC/PE/PVDC/Aluminium po 7, 10, 14, 20 lub 30 tabletek, w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 12
13 6.6 Szczególne środki ostrożności dotyczące usuwania Brak szczególnych wymagań dotyczących usuwania. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Actavis Group PTC ehf. Reykjavíkurvegi Hafnarfjörður Islandia 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 13
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ortopedina Forte, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Meloksykam 15 mg Substancja pomocnicza o znanym działaniu: Każda tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ortopedina Forte, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Meloksykam 15 mg Substancja pomocnicza o znanym działaniu: Każda tabletka
6,50 zł netto (7,02 zł brutto).
 Warszawa, dn. 2 kwietnia 2013 r. OFERTA SPECJALNA DLA SZPITALI NA ZAKUP LEKU: Aglan 15 mg x 60 tabl (Meloksykam) Szanowni Państwo, Z dniem 2.04.2013 r. Sanofi-Aventis Sp. z o.o. wprowadza ofertę specjalną
Warszawa, dn. 2 kwietnia 2013 r. OFERTA SPECJALNA DLA SZPITALI NA ZAKUP LEKU: Aglan 15 mg x 60 tabl (Meloksykam) Szanowni Państwo, Z dniem 2.04.2013 r. Sanofi-Aventis Sp. z o.o. wprowadza ofertę specjalną
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aspicam Bio, 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aspicam Bio, 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancja pomocnicza
Jasnożółte, okrągłe tabletki z logo podmiotu odpowiedzialnego po jednej stronie i napisem 59D/59D po drugiej stronie.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Movalis 7,5 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Movalis 7,5 mg tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meloxicamum 123ratio, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 15 mg meloksykamu (Meloxicamum). Każda tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meloxicamum 123ratio, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 15 mg meloksykamu (Meloxicamum). Każda tabletka
ASPICAM 15 mg, tabletki
 Ulotka dołączona do opakowania: informacja dla użytkownika ASPICAM 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika ASPICAM 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
Ulotka dołączona do opakowania: Informacja dla pacjenta. Reumelox, 7,5 mg, tabletki Meloxicamum
 Ulotka dołączona do opakowania: Informacja dla pacjenta Reumelox, 7,5 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla
Ulotka dołączona do opakowania: Informacja dla pacjenta Reumelox, 7,5 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Movalis, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Movalis, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Movalis, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Aspicam, 7,5 mg, tabletki Aspicam, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka zawiera 7,5 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Aspicam, 7,5 mg, tabletki Aspicam, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka zawiera 7,5 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Reumelox, 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Reumelox, 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lormed 7,5, tabletki 7,5 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancja pomocnicza:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lormed 7,5, tabletki 7,5 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancja pomocnicza:
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meloxicam Arrow 7,5 mg, tabletki Meloxicam Arrow 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Meloksykam 7,5 mg lub 15 mg (Meloxicamum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meloxicam Arrow 7,5 mg, tabletki Meloxicam Arrow 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Meloksykam 7,5 mg lub 15 mg (Meloxicamum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ASPICAM, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ASPICAM, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 15 mg meloksykamu (Meloxicamum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meloxistad tabletki 15 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera: 15 mg meloksykamu (Meloxicamum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meloxistad tabletki 15 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera: 15 mg meloksykamu (Meloxicamum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Melobax 7,5; 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7,5 mg meloksykamu. Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Melobax 7,5; 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7,5 mg meloksykamu. Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
Aneks III. Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta.
 Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rostil, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rostil, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Movalis 15 mg/1,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu zawiera 10 mg meloksykamu Jedna ampułka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Movalis 15 mg/1,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu zawiera 10 mg meloksykamu Jedna ampułka
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Opokan 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancje pomocnicze biologicznie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Opokan 7,5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 7,5 mg meloksykamu (Meloxicamum). Substancje pomocnicze biologicznie
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Trosicam, 7,5 mg, tabletki ulegające rozpadowi w jamie ustnej
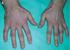 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Trosicam, 7,5 mg, tabletki ulegające rozpadowi w jamie ustnej 2 SKŁAD ILOŚCIOWY I JAKOŚCIOWY Każda tabletka ulegająca rozpadowi w jamie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Trosicam, 7,5 mg, tabletki ulegające rozpadowi w jamie ustnej 2 SKŁAD ILOŚCIOWY I JAKOŚCIOWY Każda tabletka ulegająca rozpadowi w jamie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussal Antitussicum, 15 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 15 mg dekstrometorfanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussal Antitussicum, 15 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 15 mg dekstrometorfanu
Ulotka dołączona do opakowania: informacja dla pacjenta. Ortopedina, 7,5 mg, tabletki. Meloxicamum
 Ulotka dołączona do opakowania: informacja dla pacjenta Ortopedina, 7,5 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Ortopedina, 7,5 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Opokan INJ, 15 mg/1,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg meloksykamu (Meloxicamum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Opokan INJ, 15 mg/1,5 ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg meloksykamu (Meloxicamum).
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Histigen, 8 mg, tabletki Histigen, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Histigen: jedna tabletka zawiera 8 mg dichlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Histigen, 8 mg, tabletki Histigen, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Histigen: jedna tabletka zawiera 8 mg dichlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKU LECZNICZEGO Aglan, 15 mg/1,5 ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 10 mg meloksykamu. 1 ampułka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKU LECZNICZEGO Aglan, 15 mg/1,5 ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 10 mg meloksykamu. 1 ampułka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vestibo, 8 mg, tabletki Vestibo, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 8 mg betahistyny dichlorowodorku.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vestibo, 8 mg, tabletki Vestibo, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 8 mg betahistyny dichlorowodorku.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vertix, 24 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 24 mg betahistyny dichlorowodorku. Jedna tabletka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vertix, 24 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 24 mg betahistyny dichlorowodorku. Jedna tabletka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vertix, 8 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 8 mg betahistyny dichlorowodorku. Jedna tabletka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vertix, 8 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 8 mg betahistyny dichlorowodorku. Jedna tabletka zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas monohydricus).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOBENOX, 250 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOBENOX, 250 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 250 mg wapnia dobezylanu jednowodnego (Calcii dobesilas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka powlekana zawiera 80 mg fenspirydu chlorowodorku (Fenspiridi hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EURESPAL 80 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 80 mg fenspirydu chlorowodorku (Fenspiridi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EURESPAL 80 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 80 mg fenspirydu chlorowodorku (Fenspiridi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
ULOTKA DLA PACJENTA: INFORMACJA DLA PACJENTA. AGLAN 15; 15 mg, tabletki Meloxicamum
 ULOTKA DLA PACJENTA: INFORMACJA DLA PACJENTA AGLAN 15; 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
ULOTKA DLA PACJENTA: INFORMACJA DLA PACJENTA AGLAN 15; 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Ibuprom RR 12 tabletek powlekanych
 Ibuprom RR 12 tabletek powlekanych cena: 8,90 PLN Opis słownikowy Czas dostawy Dawka Opakowanie Postać Producent Rejestracja Substancja czynna Zastosowanie 2-5 dni 400 mg 12 tabletek Tabletki USP lek ibuprofen
Ibuprom RR 12 tabletek powlekanych cena: 8,90 PLN Opis słownikowy Czas dostawy Dawka Opakowanie Postać Producent Rejestracja Substancja czynna Zastosowanie 2-5 dni 400 mg 12 tabletek Tabletki USP lek ibuprofen
Ulotka dla pacjenta: informacja dla użytkownika. Noflamen, 15 mg, tabletki. (Meloxicamum)
 Ulotka dla pacjenta: informacja dla użytkownika Noflamen, 15 mg, tabletki (Meloxicamum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla
Ulotka dla pacjenta: informacja dla użytkownika Noflamen, 15 mg, tabletki (Meloxicamum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Karbis, 4 mg, tabletki Karbis, 8 mg, tabletki Karbis, 16 mg, tabletki Karbis, 32 mg, tabletki Candesartanum cilexetilum Należy zapoznać się z treścią ulotki
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Karbis, 4 mg, tabletki Karbis, 8 mg, tabletki Karbis, 16 mg, tabletki Karbis, 32 mg, tabletki Candesartanum cilexetilum Należy zapoznać się z treścią ulotki
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas). Substancja
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA PYLOX 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA PYLOX 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA PYLOX 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Laboratoria PolfaŁódź Paracetamol, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg paracetamolu (Paracetamolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Laboratoria PolfaŁódź Paracetamol, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg paracetamolu (Paracetamolum).
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta. Aspicam Bio 7,5 mg, tabletki. Meloxicamum
 Ulotka dołączona do opakowania: informacja dla pacjenta Aspicam Bio 7,5 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Aspicam Bio 7,5 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux Forte, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 200 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux Forte, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 200 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO
 CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nabuton VP, 500 mg, tabletki. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 500 mg nabumetonu (Nabumetonum). Pełny wykaz substancji
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nabuton VP, 500 mg, tabletki. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 500 mg nabumetonu (Nabumetonum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924 mg butamiratu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
Ulotka dołączona do opakowania: informacja dla pacjenta. MeloxiMed Forte 15 mg, tabletki Meloxicamum
 Ulotka dołączona do opakowania: informacja dla pacjenta MeloxiMed Forte 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta MeloxiMed Forte 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: jedna tabletka zawiera 71,3 mg laktozy jednowodnej.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan Control, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan Control, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
Ulotka dołączona do opakowania: informacja dla pacjenta. MELOKSAM, 15 mg, tabletki
 Ulotka dołączona do opakowania: informacja dla pacjenta MELOKSAM, 15 mg, tabletki (Meloxicamum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta MELOKSAM, 15 mg, tabletki (Meloxicamum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika. TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL, 5 mg, tabletki. Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL, 5 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL, 5 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna tabletka zawiera 16 mg betahistyny dichlorowodorku.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polvertic, 8 mg, tabletki Polvertic, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Polvertic, 8 mg: Polvertic, 16 mg: Jedna tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polvertic, 8 mg, tabletki Polvertic, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Polvertic, 8 mg: Polvertic, 16 mg: Jedna tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
Ulotka dołączona do opakowania: informacja dla pacjenta. MOLSIDOMINA WZF, 2 mg, tabletki MOLSIDOMINA WZF, 4 mg, tabletki.
 Ulotka dołączona do opakowania: informacja dla pacjenta MOLSIDOMINA WZF, 2 mg, tabletki MOLSIDOMINA WZF, 4 mg, tabletki Molsidominum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta MOLSIDOMINA WZF, 2 mg, tabletki MOLSIDOMINA WZF, 4 mg, tabletki Molsidominum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka zawiera 625 mg glukozaminy (w postaci glukozaminy chlorowodorku).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flexove, tabletki 625 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 625 mg glukozaminy (w postaci glukozaminy chlorowodorku).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flexove, tabletki 625 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 625 mg glukozaminy (w postaci glukozaminy chlorowodorku).
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL FORTE; 10 mg, tabletki Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
MeloxiLEK 15, 15 mg, tabletki Meloxicamum
 Ulotka dołączona do opakowania: informacja dla pacjenta MeloxiLEK 15, 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta MeloxiLEK 15, 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
Ulotka dołączona do opakowania: informacja dla pacjenta. Opokan-forte, 15 mg, tabletki Meloxicamum
 Ulotka dołączona do opakowania: informacja dla pacjenta Opokan-forte, 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Opokan-forte, 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika. ZYX, 5 mg, tabletki powlekane. Levocetirizini dihydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polvertic, tabletki 24 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 24 mg betahistyny dichlorowodorku Jedna tabletka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polvertic, tabletki 24 mg 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 24 mg betahistyny dichlorowodorku Jedna tabletka zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta. Antrend 15 mg, tabletki Meloxicamum
 Ulotka dołączona do opakowania: informacja dla pacjenta Antrend 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Antrend 15 mg, tabletki Meloxicamum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO. Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1
 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rheumocam 1 mg tabletki do żucia dla psów Rheumocam 2, mg tabletki do żucia dla psów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Każda tabletka zawiera:
1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rheumocam 1 mg tabletki do żucia dla psów Rheumocam 2, mg tabletki do żucia dla psów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Każda tabletka zawiera:
