(86) Data i numer zgłoszenia międzynarodowego: , PCT/FR97/01316
|
|
|
- Kamil Laskowski
- 8 lat temu
- Przeglądów:
Transkrypt
1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) (21) Numer zgłoszenia (13) B1 (22) Data zgłoszenia (86) Data i numer zgłoszenia międzynarodowego: , PCT/FR97/01316 (87) Data i numer publikacji zgłoszenia międzynarodowego: , W O98/03199, PCT Gazette nr 04/98 (51) IntCl7 A61K 39/295 C12N 15/45 C12N 15/35 C12N 15/50 C12N 15/38 Kompozycja szczepionki przeciwko patogenom psów, zastosowanie jednego albo wielu (54) plazmidów, zestaw do szczepienia, szczepionki dla psów, zastosowanie plazmidu oraz sposób szczepienia (30) Pierwszeństwo: ,FR,96/09401 (73) Uprawniony z patentu: MERIAL, Lyon, FR (43) Zgłoszenie ogłoszono: BUP 14/99 (72) Twórcy wynalazku: Jean-Christophe Audonnet, Lyon, FR Annabelle Boucharaon, Lyon, FR Michel Riviere, Ecully, FR (45) O udzieleniu patentu ogłoszono: WUP 11/05 (74) Pełnomocnik: Kossowska Janina, PATPOL Sp z o o PL B1 (57) 1. Kompozycja szczepionki przeciwko patogenom psów, zn am ien n a tym, ze obejmuje przynajmniej dwie wartościowości szczepionek, z których każda obejmuje integrujący plazmid, obejmujący gen jednej z wartościowości patogenu psów, który wyraża go in vivo w komórkach psowatego gospodarza, a konkretnie wartościowości wirusa choroby Carre CDV i wartościowość wirusa psiej parwowirozy CPV, przy czym plazmidy obejmują dla każdej wartościowości jeden albo więcej genów wybranych z grupy obejmującej geny HA 1 F wirusa choroby Carre i gen VP2 wirusa psiej parwowirozy. 13. Zestaw do szczepienia, zn a m ie n n y tym, ze obejmujący kom pozycję szczepionki określonej w jednym z zastrz. 1-10, i pierwszą szczepionkę dla psów wybraną z grupy obejmującej żywą pełną szczepionkę, inaktywowaną pełną szczepionkę, szczepionkę podjednostkową, szczepionkę rekombinowaną, przy czym ta pierwsza szczepionka posiada antygen kodowany przez szczepionkę polinukleotydową albo antygen zapewniający odporność krzyżową, do podawania tej pierwszej szczepionki podczas pierwszego szczepienia 1 kompozycji szczepionki podczas szczepienia przypominającego. 18 Sposób szczepienia psów przeciwko wściekliźnie, zn am ien n y tym, ze psu podaje się szczepionkę obejmującą plazmid, który zawiera i wyraża in vivo gen G wścieklizny oraz odpowiedni nośnik.
2 Kompozycja szczepionki przeciwko patogenom psów, zastosowanie jednego albo wielu plazmidów, zestaw do szczepienia, szczepionki dla psów, zastosowanie plazmidu oraz sposób szczepienia Zastrzeżenia patentowe 1. Kompozycja szczepionki przeciwko patogenom psów, znam ienna tym, ze obejmuje przynajmniej dwie wartościowości szczepionek, z których każda obejmuje integrujący plazmid, obejmujący gen jednej z wartościowości patogenu psów, który wyraża go in vivo w komórkach psowatego gospodarza, a konkretnie wartościowości wirusa choroby Carre CDV i wartościowość wirusa psiej parwowirozy CPV, przy czym plazmidy obejmują dla każdej wartościowości jeden albo więcej genów wybranych z grupy obejmującej geny HA i F wirusa choroby Carre i gen VP2 wirusa psiej parwowirozy. 2. Kompozycja szczepionki według zastrz. 1, znam ienna tym, że dla wartościowości wirusa choroby Carre, plazmid(y) obejmuje (ą) geny HA i F, w tym samym plazmidzie albo w różnych plazmidach. 3. Kompozycja szczepionki według zastrz. 1, zn am ien n a tym, ze obejmuje wartościowość psiego koronawirusa CCV, z jednym albo kilkoma plazmidami zawierającymi jeden lub więcej genów wybranych z grupy genów S i M. 4. Kompozycja według zastrz. 3, znam ienna tym, ze obejmuje gen S albo geny S i M. 5 Kompozycja szczepionki według zastrz. 1, zn am ien n a tym, ze dodatkowo obejmuje wartościowość skuteczną w zapobieganiu zespołowi zaburzeń oddechowych, m ianowicie PI2 w jednym albo w w ielu plazmidach, które obejm ują przynajmniej jeden spośród genów HA i F. 6 Kompozycja szczepionki według zastrz. 5, znam ienna tym, ze obejmuje geny HA i F wartościowości dla zespołu zaburzeń oddechowych. 7. Kompozycja szczepionki według zastrz. 1, znam ienna tym, że obejmuje jedną albo wiele wartościowości wybranych z grupy obejmującej herpeswirozę CHV, chorobę z Lyme albo wściekliznę, przy czym plazmidy obejmują dla każdej wartościowości jeden albo wiele genów wybranych z grupy obejmującej geny gb i gd dla wirusa CHV, geny OspA, OspB i p 100 dla B. burgdorferi i gen G dla wścieklizny. 8 Kompozycja szczepionki według zastrz. 7, zn am ien n a tym, ze obejmuje herpeswirozę, przy czym dwa geny gb i gd są włączone do dwóch różnych plazmidów albo do jednego plazmidu. 9 Kompozycja szczepionki według zastrz. 8, znam ienna tym, ze dla choroby z Lyme obejmuje gen OspA. 10. Kompozycja szczepionki według zastrz. 1, znam ienna tym, ze obejmuje od 10 ng do 1 mg, korzystnie od 100 ng do 500 µg, jeszcze korzystniej od 1 µg do 250 µg każdego z plazmidów. 11. Kompozycja szczepionki według zastrz. 1 zn am ien n a tym, ze ma dołączoną instrukcję obsługi wskazującą, ze tę kompozycję można zastosować jako szczepionkę przypominającą dla pierwszej szczepionki dla psów wybranej z grupy obejmującej żywą pełną szczepionkę, inaktywowaną pełną szczepionkę, szczepionkę podjednostkow ą szczepionkę rekombinowaną, przy czym ta pierwsza szczepionka posiada antygen kodowany przez szcze pionkę polinukleotydow ą albo antygen zapewniający odporność krzyżową. 12. Zastosowanie jednego albo wielu plazmidów, jak określone w jednym z zastrz od 1 do 10, do wytwarzania szczepionki dla psów, uprzednio szczepionych pierw szą szczepionką wybraną z grupy obejmującej żywą pełną szczepionkę, inaktyw ow aną pełną szczepionkę, szczepionkę podjednostkową, szczepionkę rekom binowaną, przy czym ta pierwsza szczepionka posiada antygen(y) kodowane(y) przez plazm id albo antygen(y) zapewniajacy(e) odporność krzyżową
3 Zestaw do szczepienia, zn am ien n y tym, ze obejmujący kompozycję szczepionki określonej w jednym z zastrz 1-10, i pierwszą szczepionkę dla psów wybraną z grupy obejmującej żywą pełną szczepionkę, inaktywowaną pełną szczepionkę, szczepionkę podjednostkową szczepionkę rekombinowaną przy czym ta pierwsza szczepionka posiada antygen kodowany przez szczepionkę polinukleotydową albo antygen zapewniający odporność krzyżow ą do podawania tej pierwszej szczepionki podczas pierwszego szczepienia i kompozycji szczepionki podczas szczepienia przypominającego. 14. Szczepionka do szczepienia psów przeciwko wściekliźnie, zn am ien n a tym, ze obejmuje plazmid, który zawiera i wyraża in vivo gen G wścieklizny oraz odpowiedni nośnik 15. Szczepionka według zastrz. 14, znam ienna tym, ze gen jest pod kontrolą promotora wybranego z grupy składającej się z promotora CMY-IE, wczesnego promotora SV40, późnego promotora SV40, promotora LTR wirusa mięsaka Rousa, promotora genu cytoszkieletu 16. Szczepionka według zastrz. 14, znam ienna tym, że ekspresja genu jest pod kontrolą promotora CMY-IE. 17. Zastosowanie plazmidu, który zawiera i wyraża in vivo gen G wścieklizny oraz odpowiedniego nośnika do wytwarzania szczepionki do szczepienia psów przeciwko wściekliźnie. 18 Sposób szczepienia psów przeciwko wściekliźnie, znam ienny tym, ze psu podaje się szczepionkę obejmującą plazmid, który zawiera i wyraża in vivo gen G wścieklizny oraz odpowiedni nośnik. 19. Szczepionka dla psów, znam ienna tym, ze obejmuje plazmid, który zawiera i wyraża in vivo gen P12 HA lub gen P12 F oraz odpowiedni nośnik. 20 Szczepionka według zastrz. 19, znam ienna tym, ze plazmid zawiera i wyraża oba geny HA i F 21. Szczepionka według zastrz. 19, znam ienna tym, ze obejmuje pierwszy plazmid, który zawiera i wyraża gen HA oraz drugi plazmid, który zawiera i wyraża gen F. 22 Szczepionka dla psów, znam ienna tym, że obejmuje plazmid, który zawiera i wyraża in vivo gen CHV gb lub CHV gd oraz odpowiedni nośnik. 23 Szczepionka według zastrz. 22, znam ienna tym, że plazmid zawiera i wyraża oba geny gb i gd. 24. Szczepionka według zastrz. 22, znam ienna tym, ze obejmuje pierwszy plazmid, który zawiera i wyraża gen gb oraz drugi plazmid, który zawiera i wyraża gen gd. 25. Szczepionka dla psów, znam ienna tym, ze obejmuje plazmid, który zawiera i wyraża in vivo gen CCV S lub gen CCV M oraz odpowiedni nośnik. 26. Szczepionka według zastrz. 25, znam ienna tym, ze plazmid zawiera i wyraża oba geny S i M. 27. Szczepionka według zastrz. 25, znam ienna tym, ze obejmuje pierwszy plazmid, który zawiera i wyraża gen S oraz drugi plazmid, który zawiera i wyraża gen M. 28 Szczepionka dla psów, znam ienna tym, ze obejmuje plazmid, który zawiera i wyraża in vivo gen CPV VP2 oraz od powiedni nośnik. 29. Szczepionka dla psów, znam ienna tym, ze obejmuje plazmid, który zawiera i wyraża in vivo gen CDV HA lub gen CDV F oraz odpowiedni nośnik. 30. Szczepionka według zastrz. 27, znam ienna tym, ze plazmid zawiera i wyraża oba geny HA i F. 31. Szczepionka według zastrz 29, znam ienna tym, ze obejmuje pierwszy plazmid, który zawiera i wyraża gen HA i drugi plazmid, który zawiera i wyraża gen F. 32. Szczepionka do szczepienia psów przeciwko chorobie z Lyme, znam ienna tym, ze obejmuje plazmid, który zawiera i wyraża in vivo geny OspA, OspB lub p 100 oraz odpowiedni nośnik 33. Szczepionka według zastrz. 32, zn am ienna tym, że plazmid zawiera i wyraża gen OspA. 34. Szczepionka według dowolnego z zastrz. od 19 do 33, znam ienna tym, że gen jest pod kontrolą promotora wybranego z grupy składającej się z promotora CMY-IE, wczesnego promotora SV40, późnego promotora SV40, promotora LTR wirusa mięsaka Rousa, promotora genu cytoszkieletu.
4 Szczepionka według dowolnego z zastrz od 19 do 33, znam ienna tym, ze ekspresja genu jest pod kontrolą promotora CMY-IE. * * Przedmiotem wynalazku jest kompozycja szczepionki przeciwko patogenom psów, zastosowanie jednego albo wielu plazmidów, zestaw do szczepienia, szczepionki dla psów, zastosowanie plazmidu oraz sposób szczepienia psów. Choroby zakaźne psów są niezwykle różnorodne i często trudne do opanowania ze względu na warunki spotykane w środowisku naturalnym. Istnieje obecnie wiele szczepionek, zwłaszcza przeciwko chorobie Carre' (wirus CDV), parwowirozie (wirus CCV), koronawirozie, kaszlowi kennelowemu lub zespołowi zaburzeń oddechowych (wirus P 12) i wściekliźnie (rabdowirus). Szczepionki te generalnie są szczepionkami żywymi obejmującymi szczepy atenuowane. Dotyczy to zwłaszcza szczepionki przeciwko chorobie Carre', szczepionki przeciwko zakażeniom adenowirusami, szczepionki przeciwko parwowirozie i szczepionki przeciwko psiemu koronawirusowi. W niektórych przypadkach proponowano również szczepionki inaktywowane, podobnie jak dla wścieklizny i koronawirozy Te różnorodne szczepionki są sprzedawane zarówno osobno, to znaczy w postaci szczepionek monowalentnych, jak i w postaci złożonej, jako szczepionki poliwalentne. Wytwarzane do tej pory skojarzone poliwalentne szczepionki stwarzają problemy związane ze zgodnością i stabilnością. Istnieje rzeczywista potrzeba zapewnienia zgodności między różnymi wartościowościami szczepionki, z powodu zastosowania różnych antygenów, bądź z powodu samych kompozycji, szczególnie w przypadku gdzie połączone są szczepionki inaktywowane i szczepionki żywe. Istnieje również problem konserwacji takiej kombinacji szczepionek i ich bezpieczeństwa, szczególnie w obecności adiuwantu. Takie szczepionki są na ogół dosyć drogie. Dodatkowo stopień ochrony i czas jej trwania może być bardzo zmienny i wrażliwy na warunki środowiska naturalnego. Ma to szczególnie znaczenie w przypadku szczepienia szczeniąt, u których przeciwciała pochodzenia matczynego zapobiegają immunizacji przez szczepionki inaktywowane, a nawet żywe. Tak więc jest wskazane udoskonalenie szczepienia psowatych, a zwłaszcza psów, z uwzględnieniem ograniczeń ekonomicznych, które wykluczają stosowanie szczepionek drogich lub skomplikowanych w użyciu. Badania dotyczące szczepień przeciwko chorobie Carre wykorzystujące oczyszczone preparaty antygenów fuzyjnych F i równoważników hemaglutyniny H w kompletnym adiuwancie Freunda sugerują, ze antygen F mógłby być interesującym immunogenem ze względu na zapewnienie ochrony przeciwko wirusowi CDV (E. Norrby i in., J. Virol. Maj 1986' ) jako szczepionka podjednostkową. Inny artykuł (P. de Vries i in., J. Gen, Virol. 1988, 69: ) sugeruje z drugiej strony, ze białka F i HA CDV mogą być korzystne w szczepieniu według techniki kompleksów immunostymulujących (ISCOMS). Myszy immunizowane rekombinowaną szczepionką wyrażającą gen dla białka F CDV były zabezpieczone przez prowokacją tym wirusem. Wyniki te jednakże są jedynie doświadczalne, stąd są trudne do oceny zwłaszcza w środowisku naturalnym W odniesieniu do za k a ż e n ia p arw ow irozą b a d a n ia n a d p o d j ednostkow ą s z c z e p i o n k ą obejmującą główne białko kapsydowe VP2 wirusa CPV uzyskane przez rekombinację genetyczną w bakulowirusach wykazały możliwą ochronę szczepionych psów przed prowokacją wirusem CPV. W odniesieniu do psiego herpeswirusa, przeprowadzono badania nad wykorzystaniem glikoprotein jako składników szczepionek podjednostkowych. Badania te wykazały wzbudzenie
5 krzyżowej odporności z innymi wirusami herpes takimi jak FHV, ale nie przedstawiono żadnych wniosków, co do możliwości wytworzenia szczepionki ochronnej. Dla choroby z Lyme, kompozycja OspA i OspB wywołuje ochronę u myszy i psów, a sam OspA u myszy, chomików i psów. W zgłoszeniach patentowych WO-A , WO-A , WO-A i WO- -A doniesiono o stosowaniu ostatnio rozwijanych technik szczepionek polinukleotydowych Wiadomo, ze szczepionki te wykorzystują plazmid zdolny do wyrażania w komórkach gospodarza antygenu włączonego do plazmidu. Proponowano wszystkie drogi podawania (dootrzewnową, dożylną, domięśniową, przezskórną, śródskórną, śluzów kow ą i podobne) Do szczepień stosowane są różne środki, takie jak DNA osadzone na powierzchni cząstek złota, które są wystrzeliwane tak, ze penetrują przez skórę zwierzęcia (Tang i in., Nature 356, , 1992) i wtryskiwacze do wstrzyknięć strumienia płynu, które powodują, ze jest możliwa jednoczesna transfekcja skóry, tkanek mięśniowych, tkanek tłuszczowych i tkanek gruczołu sutkowego (Furth i in., Analytical Biochemistry, 205, , 1992). W szczepionkach polinukleotydowych mogą również być stosowane zarówno nagie DNA jak i kompozycje DNA, na przykład wewnątrz kationowych lipidów albo liposomów. Wcześniejszy stan techniki nie podaje żadnych wyników mówiących o ochronie psów z wykorzystaniem sposobu szczepień polinukleotydowych przeciwko tym chorobom. Znacznie mniej wiadomo do tej pory o psich koronawirusach CCV i o czynnikach odpowiedzialnych za zespół zaburzeń oddechowych. W odniesieniu do wścieklizny, ochronę myszy przeciwko prowokacji czynnikiem zjadliwym wykazano po leczeniu szczepionką polinukleotydową wyrażającą gen dla białka G pod kontrolą wczesnego wirusowego promotora SV40 (Xiang i in., Virology 199, 1994, ), podobne wyniki osiągnięto stosując promotor CMV IE. Celem wynalazku jest dostarczenie kompozycji multiwalentnej szczepionki, która zapewni skuteczne szczepienie psów przeciwko wielu czynnikom chorobotwórczym, która zawiera różne wartościowości, oraz spełnia wszystkie wymagane kryteria wzajemnej zgodności i stabilności wartościowości Taka kompozycja szczepionki, która umożliwi połączenie różnych wartościowości w tym samym nośniku, jest łatwa w użyciu i niedroga Dodatkowo celem wynalazku jest dostarczenie takiego sposobu szczepień psów, który umożliwi zwiększenie skuteczności szczepionki według wynalazku albo znaczące zmniejszenie ilości szczepień i uzyskanie zadowalającego bezpieczeństwa. Przedmiotem wynalazku jest kompozycja szczepionki przeciwko patogenom psów, obejmująca przynajmniej dwie wartościowości szczepionek, z których każda obejmuje integrujący plazmid, obejmujący gen jednej z wartościowości patogenu psów, który wyraża go in vivo w komórkach psowatego gospodarza, a konkretnie wartościowości wirusa choroby Carre CDV i wartościowość wirusa psiej parwowirozy CPV, przy czym plazmidy obejm ują dla każdej wartościowości jeden albo więcej genów wybranych z grupy obejmującej geny HA i F wirusa choroby Carre i gen VP2 wirusa psiej parwowirozy. Korzystnie dla wartościowości dla wirusa choroby Carre, plazmid(y) obejmuje geny HA i F zarówno włączone do jednego plazmidu jak i włączone do różnych plazmidów Kompozycja szczepionki według wynalazku może również obejmować wartościowość dla psiego koronawirusa CCV, z jednym lub więcej genami wybranymi z grupy genów S i M, korzystnie gen S albo geny S i M. Geny te mogą być włączone do różnych plazmidów lub połączone razem w tym samym plazmidzie w sposób pozwalający na ich wyrażanie W korzystnym wykonaniu powyżej wymienione kompozycje szczepionki b1- i triwalentne według wynalazku mogą również obejmować, dodatkowo, wartościowości skuteczne w zapobieganiu zespołowi zaburzeń oddychania, mianowicie wartościowość PI2, które obejmują przynajmniej jedne z genów HA i F, korzystniej oba geny HA i F. Kompozycja szczepionki według wynalazku korzystnie obejmuje również jedną albo wiele wartościowości wybranych z grupy obejmującej herpeswirozę CHV, chorobę z Lyme albo wściekliznę, plazmidy obejmujące dla każdej wartościowości, jeden albo wiele genów wybranych z grupy obejmującej geny gb i gd dla wirusa CHV, geny OspA, OspB i p 100 dla B burgdorferi (choroba z Lyme) i gen G dla wścieklizny.
6 Korzystnie dla zakażenia wirusem herpes dwa geny gb i gd są połączone zarówno w dwóch plazmidach, jak i w jednym Dla choroby z Lyme, korzystny jest gen OspA. W korzystnym wykonaniu wynalazku kompozycja szczepionki według wynalazku ma dołączoną instrukcję obsługi wskazującą, ze tę kompozycję można zastosować jako szczepionkę przypominającą dla pierwszej szczepionki dla psów wybranej z grupy obejmującej żywą pełną szczepionkę, inaktywowaną pełną szczepionkę, szczepionkę podjednostkową, szczepionkę rekombinowaną przy czym ta pierwsza szczepionka posiada antygen kodowany przez szczepionkę polinukleotydową albo antygen zapewniający odporność krzyżową. Wartościowość według mniejszego wynalazku należy rozumieć jako przynajmniej jeden antygen zapewniający ochronę przeciwko wirusowi jako rozważanemu patogenowi, i jest możliwe, ze wartościowość zawiera, jako podwartościowości, jeden lub więcej zmodyfikowanych lub naturalnych genów z jednego lub więcej szczepów rozważanego patogenu Gen czynnika patogennego należy rozumieć nie tylko jako gen kompletny, lecz również jako różnorodne sekwencje nukleotydowe, w tym fragmenty zachowujące zdolność do wywołania odpowiedzi odpornościowej. Wyrażenie, że geny obejmują sekwencje nukleotydowe równoważne z tymi opisanymi szczegółowo w przykładach, dotyczy sekwencji różniących się, lecz kodujących to samo białko. Oznacza to również sekwencje nukleotydowe innych szczepów rozważanego patogenu, które zapewniają ochronę krzyżow ą albo ochronę charakterystyczną dla danego szczepu albo grupy szczepu. Oznacza również sekwencje nukleotydowe, które zostały zmodyfikowane w celu ułatwienia ekspresji in vivo w zwierzęciu będącym gospodarzem, lecz ciągle kodują to samo białko. Kompozycja szczepionki według wynalazku zawiera różne wartościowości w terapeutycznie skutecznych ilościach. Korzystnie kompozycja szczepionki według wynalazku obejmuje od 10 ng do 1 mg, korzystnie od 100 ng do 500 µg, jeszcze korzystniej od 1 µg do 250 µg każdego z plazmidów Nośnik stosowany do podawania szczepionki, na przykład drogą domięśniową będzie w objętości dawki między 0,1 a 5 ml, korzystniej między 0, 5 a 2 ml. Przedmiotem wynalazku jest również zastosowanie jednego albo wielu plazmidów według wynalazku do wytwarzania szczepionki dla psów, uprzednio szczepionych pierwszą szczepionką wybraną z grupy obejmującej żywą pełną szczepionkę, inaktywowaną pełną szczepionkę, szczepionkę podjednostkową, szczepionkę rekombinowaną, przy czym ta pierwsza szczepionka posiada antygen(y) kodowane(y) przez plazmid albo antygen(y) zapewniający(e) odporność krzyżową. Wskazane jest stosowanie nagich plazmidów po prostu w nośniku do szczepionki, którym zazwyczaj będzie sól fizjologiczna (0,9% NaCl), woda destylowana, bufor TE i tym podobne M ogą w ten sposób oczywiście być wykorzystane wszystkie formy szczepionki polinukleotydowej wcześniej opisane w stanie techniki. Każdy plazmid zawiera promotor zdolny do zapewnienia ekspresji włączonego genu, pod jego kontrolą w komórkach gospodarza Zazwyczaj będzie to silny promotor eukariotyczny, a zwłaszcza wczesny promotor CMV-IE wirusa cytomegaln pochodzenia ludzkiego lub mysiego, albo ewentualnie o innym pochodzeniu np. od szczurów, świń albo od świnek morskich. Bardziej ogólnie, promotor może być zarówno pochodzenia wirusowego jak i komórkowego Jako promotor wirusowy inny niż CMY-IE można wymienić wczesny i późny promotor wirusa SV40 albo promotor LTR wirusa mięsaka Rous'a. Możliwy jest również promotor wirusa, z którego pochodzi gen, na przykład własny promotor genu. Jako promotor komórkowy może być wymieniony promotor genu cytoszkieletu, taki jak na przykład promotor desminy (Bolmont i in., Journal of Submicroscopic Cytology and pathology, ; i Zhenlin i in.. Gene, 1989, 78, ). albo alternatywnie promotor aktyny Gdy kilka genów jest prezentowanych w tym samym plazmidzie, m ogą one być prezentowane w tej samej jednostce transkrypcyjnej lub w dwóch różnych jednostkach. Kombinacja różnych wartościowości szczepionki według wynalazku może być korzystnie uzyskana przez zmieszanie plazmidów polinukleotydowych wyrażających antygen(y) każdej wartościowości, lecz antygeny kilku wartościowości mogą być również wyrażane w tym samym plazmidzie.
7 Przedmiotem wynalazku jest również zestaw do szczepienia obejmujący kompozycję szczepionki według wynalazku i pierwszą szczepionkę dla psów wybraną z grupy obejmującej żywą pełną szczepionkę, inaktywowaną pełną szczepionkę, szczepionkę podjednostkową, szczepionkę rekombinowaną, przy czym ta pierwsza szczepionka posiada antygen kodowany przez szczepionkę polinukleotydową albo antygen zapewniający odporność krzyżową, do podawania tej pierwszej szczepionki podczas pierwszego szczepienia i kompozycji szczepionki podczas szczepienia przypominającego. Kolejnym przedmiotem wynalazku jest szczepionka do szczepienia psów przeciwko wściekliźnie obejmująca plazmid, który zawiera i wyraża in vivo gen G wścieklizny oraz odpowiedni nośnik. W zakres wynalazku wchodzi również zastosowanie plazmidu, który zawiera i wyraża in vivo gen G wścieklizny oraz odpowiedniego nośnika do wytwarzania szczepionki do szczepienia psów przeciwko wściekliźnie Przedmiotem niniejszego wynalazku jest również sposób szczepienia psów przeciwko wściekliźnie, według którego psu podaje się szczepionkę obejmującą plazmid zawierający i wyrażający in vivo gen G wścieklizny oraz odpowiedni nośnik. Kompozycje szczepionki według wynalazku mogą być podawane różnymi sposobami podawania opisanymi we wcześniejszym stanie techniki dla szczepionek polinukleotydowych albo znanymi technikami podawania, przy czym korzystną drogą podawania jest droga domięśniowa. Wydajność prezentowania antygenów układowi odpornościowemu różni się zależnie od tkanki Błony śluzowe układu oddechowego służą jako bariera przeciwko wnikaniu patogenów i są związane z tkankami limfatycznymi wspomagającymi miejscową odporność. Podawanie szczepionki przez kontakt z błonami śluzowymi, zwłaszcza błoną śluzową policzka i błoną śluzową gardła i błoną śluzową okolicy oskrzeli jest szczególnie wskazane dla szczepień przeciwko chorobom układu oddechowego i pokarmowego. Możliwe jest podawanie szczepionki przez błony śluzowe, szczególnie z zastosowaniem nebulizacji albo rozpylacza albo wody pitnej. W związku z tym możliwe jest podawanie tą drogą kompozycji szczepionki według wynalazku. Przedmiotem wynalazku jest również szczepionka dla psów obejmująca plazmid, który zawiera i wyraża in vivo gen P12 HA lub gen P12 F oraz odpowiedni nośnik, korzystnie plazmid zawiera i wyraża oba geny HA i F, korzystniej szczepionka obejmuje pierwszy plazmid, który zawiera i wyraża gen HA oraz drugi plazmid, który zawiera i wyraża gen F. Kolejnym przedmiotem wynalazku jest szczepionka dla psów obejmująca plazmid, który zawiera i wyraża in vivo gen CHV gb lub CHV gd oraz odpowiedni nośnik, korzystnie plazmid zawiera i wyraża oba geny gb i gd, korzystniej szczepionka obejmuje pierwszy plazmid, który zawiera i wyraża gen gb oraz drugi plazmid, który zawiera i wyraża gen gd. W zakres wynalazku wchodzi również szczepionka dla psów obejmująca plazmid, który zawiera i wyraża in vivo gen CCV S lub gen CCV M oraz odpowiedni nośnik, korzystnie plazmid zawiera i wyraża oba geny S i M, korzystniej szczepionka obejmuje pierwszy plazmid, który zawiera i wyraża gen S oraz drugi plazmid, który zawiera i wyraża gen M Kolejnym przedmiotem wynalazku jest szczepionka dla psów obejmująca plazmid, który zawiera i wyraża in vivo gen CPV VP2 oraz odpowiedni nośnik. Przedmiotem wynalazku jest również szczepionka dla psów obejmująca plazmid, który zawiera i wyraża in vivo gen CDV HA lub gen CDV F oraz odpowiedni nośnik, korzystnie plazmid zawiera i wyraża oba geny HA i F, korzystniej szczepionka obejmuje pierwszy plazmid, który zawiera i wyraża gen HA i drugi plazmid, który zawiera i wyraża gen F W zakres wynalazku wchodzi również szczepionka do szczepienia psów przeciwko chorobie z Lyme obejmująca plazmid, który zawiera i wyraża in vivo geny OspA, OspB lub p 100 oraz odpowiednimnośnik, korzystniej plazmid zawiera i wyraża gen OspA. W korzystnym wykonaniu szczepionki według wynalazku gen jest pod kontrolą promotoia wybranego z grupy składającej się z promotora CMY-IE, wczesnego promotora SV40, późnego promotora SV40, promotora LTR wirusa mięsaka Rousa, promotora genu cytoszkieletu, korzystniej ekspresja genu jest pod kontrolą promotora CMY-IE.
8 Szczepionki monowalentne zawierające jeden lub więcej plazmidów kodujących jeden lub więcej wcześniej opisanych genów z jednego z powyższych wirusów, mogą różnić się odnośnie, co do wyboru genów, ich kombinacji, kompozycji plazmidów, objętości dawki, dawek i innych cech Kompozycje monowalentnej szczepionki mogą być również stosowanie (i) do przygotowania kompozycji opisanej powyżej szczepionki poliwalentnej, (ii) pojedynczo w przypadku aktualniej patologii, (iii) do połączenia ze szczepionką innego typu (żywą lub w całości inaktywowaną, rekombinowaną, podjednostkową) przeciwko innej patologii, albo (iv) jako dawka przypominająca dla szczepionki opisanej powyżej. Warte odnotowania jest, ze szczepionka polinukleotydowa posiada potencjalne działanie dawki przypominającej, co powoduje spotęgowanie odpowiedzi immunologicznej i nabycie długotrwałej odporności. Ogólnie, szczepionka służąca do pierwszego szczepienia może być wybrana ze szczepionek różnych producentów szczepionek weterynaryjnych dostępnych na rynku. Możliwe jest również szczepienie obejmujące pierwsze szczepienia, tak jak to opisano powyżej i dawkę przypominającą kompozycją szczepionki według wynalazku. Wskazane jest podawanie w pierwszej kolejności zwierzęciu skutecznej dawki szczepionki tradycyjnej, szczególnie inaktywowanej, żywej, atenuowanej albo rekombinowanej albo alternatywnie szczepionki podjednostkowej, zapewniającej pierwsze szczepienie i podawanie po czasie korzystnie od 2 do 6 tygodni poliwalentnej albo monowalentnej szczepionki według wynalazku Sposób przygotowania kompozycji szczepionek, to znaczy przygotowania wartościowości i ich mieszanin, wynika jasno z opisu wynalazku. Wynalazek teraz zostanie opisany bardziej szczegółowo przez wykonania wynalazku podane w odniesieniu do towarzyszących rysunków. Lista Figur Figura nr 1: Plazmid pvr1012 Figura nr 2: Plazmid pab044 Figura nr 3. Plazmid pab036 Figura nr 4: Plazmid pab024 Figura nr 5' Plazmid pab021 Figura nr 6 Plazmid pab022 Figura nr 7 Plazmid pab037 Figura nr 8' Plazmid pab038 Figura nr 9. Plazmid pab017 Figura nr 10 Plazmid pab041 Lista sekwencji Id. Sekw. nr : Id Sekw. nr 1. oligonukleotyd AB0 17 Id. Sekw. nr 2' oligonukleotyd AB0 18 Id Sekw. nr 3 oligonukleotyd AB085 Id. Sekw. nr 4 oligonukleotyd AB086 Id Sekw. nr 5 oligonukleotyd AB053 Id. Sekw. nr 6. oligonukleotyd AB054 Id. Sekw. nr 7: oligonukleotyd AB045 Id. Sekw. nr 8: oligonukleotyd AB048 Id. Sekw. nr 9. o ligonukleotyd AB049 Id Sekw nr 10: oligonukleotyd AB050 Id Sekw. nr 11: oligonukleotyd AB087 Id Sekw. nr 12 oligonukleotyd AB088 Id Sekw. nr 13 oligonukleotyd AB089 Id Sekw nr 14: oligonukleotyd AB090 Id Sekw. nr 15 oligonukleotyd AB038
9 Id Sekw nr 16 oligonukleotyd AB039 Id Sekw. nr 17: oligonukleotyd AB011 Id Sekw. nr 18. oligonukleotyd AB012 Przykłady Przykład 1: Hodowla wirusa Wirusy hoduje się w odpowiednim układzie komórkowym, do uzyskania efektu cytopatycznego. Układy komórkowe do zastosowania dla każdego z wirusów są znane specjalistom Pokrótce, komórki wrażliwe na wirusa, które hoduje się w minimalnej niezbędnej pożywce Eagle'a (MEM) albo w innej odpowiedniej pożywce, zakaża się badanym szczepem wirusa stosując wielokrotność zakażenia równą 1. Zakażone komórki inkubuje się w 37 C przez czas niezbędny do wystąpienia całkowitego efektu cytopatycznego (średnio 36 godzin). Przykład 2: Hodowla bakterii Szczepy Borrelia burgdorferi hodowano w odpowiedniej pożywce i w warunkach dobrze znanym specjalistom. Warunki te i pożywkę opisał szczegółowo A. Barbour (J. Biol. Med 1984, 57, 71-75). Ekstrakcję bakteryjnego DNA przeprowadzono w warunkach opisanych przez W. Simpson i in., (Infect. Immunol. 1990, 58, ). Również można było wykorzystać klasyczne techniki opisane przez J. Sambrook i in., (Molecular clomng. A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989) Przykład 3: Ekstrakcja wirusowych genomowych DNA Po hodowli, nadsącz i rozłożone komórki zbiera się i całą zawiesinę wirusa wiruje się przy 1000 g przez 10 minut w 4 C w celu usunięcia resztek komórkowych. Cząstki wirusa zbiera się przez ultrawirowanie przy g przez godzinę w 4 C. Osad pobiera się w minimalnej objętości buforu (10 mm Tris, 1 mm EDTA). Tę zatężoną zawiesinę wirusa traktuje się proteinazą K (100 µg/ml objętości końcowej) w obecności soli sodowej siarczanu dodecylu (SDS) (0,5%) przez 2 godziny w 37 C Wirusowy DNA ekstrahuje się mieszaniną fenol/chloroform i precypituje 2 objętościami absolutnego etanolu. Po pozostawieniu przez noc w -20 C, DNA wiruje się przy g przez 15 minut w 4 C. Osad DNA suszy się i pobiera w minimalnej objętości sterylnej, ultraczystej wody. Następnie można go trawić enzymami restrykcyjnymi. Przykład 4: Izolacja wirusowych genomowych RNA Wirusy RNA oczyszczono według technik znanych specjalistom. Następnie, genomowy wirusowy RNA każdego z wirusów izolowano stosując technikę ekstrakcji rodankiem guanidyny/fenol-chloroform opisaną przez Chomczynski i Sacchi (Anal. Biochem., 1987, ) Przykład 5 Techniki biologii molekularnej Wszystkie konstrukcje plazmidów przeprowadzono stosując standardowe techniki biologii molekularnej, opisane przez Sambrook i in., (Molecular Cloning: A Laboratory Manual, wyd. 2, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989). Wszystkie fragmenty restrykcyjne zastosowane w wynalazku wyizolowano stosując zestaw Geneclean (BIO 101 Inc., La Jolla, CA). Przykład 6: Technika RT-PCR Swoiste oligonukleotydy (obejmujące miejsca restrykcyjne na końcach 5' w celu ułatwienia klonowania amplifikowanych fragmentów) syntetyzowano w taki sposób, ze pokrywały w całości regiony kodujące genów, które miały być amplifikowane (patrz, konkretne przykłady) Reakcję odwrotnej transkrypcji (RT) i reakcję łańcuchową polimerazy (PCR) przeprowadzono technikami standardowymi (Sambrook i in., 1989). Każdą z reakcji RT-PCR przeprowadzono z parą swoistych starterów amplifikacji z ekstrahowanym genomowym wirusowym RNA jako matrycą. Amplifikowany komplementarny DNA ekstrahowano mieszaniną fenol/chloroform/alkohol izoamylowy (25:24:1), po czym trawiono enzymami restrykcyjnymi. Przykład 7: plazmid pvr1012 Plazmid pvr1012 (figura 1) otrzymano z Vical In c, San Diego, CA, USA. Jego konstrukcję opisano w Hartikka i in. (Human Gene Therapy, 1996, 7: ). Przykład 8: Konstruowanie plazmidu pab044 (gen HA CDV)
10 Reakcję RT-PCR techniką według przykładu 6 przeprowadzono z genomowym RNA wirusa choroby Carre (CDV) (szczep Onderstepoort) (M. Sidhu i in., Virology, 1993, 193, 66-72) wytworzonym techniką według przykładu 4 z następującymi oligonukleotydami: AB0 17 (35-mer) (Id Sekw. nr 1) 5'AAAACTGCAGAATGCTCCCCTACCAAGACAAGGTG3' AB018 (37-mer) (Id. Sekw nr 2) 5' CGCGGATCCTTAACGGTTACATGAGAATCTTATACGG3' w taki sposób, ze izolowano gen kodujący glikoproteinę HA CDV w postaci fragmentu PstI-BamHI o wielkości 1835 bp. Po oczyszczeniu, fragment PCR o wielkości 1835 bp trawiono PstI i BamHI w celu uwolnienia fragmentu Pstl-BamHI o wielkości 1817 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawionym uprzednio PstI i BamHI, otrzymując plazmid pab044 (6676 bp) (figura 2). Przykład 9: Konstruowanie plazmidu AB036 (gen F CDV) Reakcję RT-PCR techniką według przykładu 6 przeprowadzono z genomowym RNA wirusa choroby Carre (CDV) (szczep Onderstepoort) (R. Driellen, Genbank nr dostępu X65509) wytworzonym techniką według przykładu 4 z następującymi oligonukleotydarni: AB085 (40-mer) (Id Sekw. nr 3) 5 ATAAGAAGCGGCCGCACATGCACAAGGGAATCCCCAAAAG3 AB086 (32-mer) (Id. Sekw. nr 4) 5'CGCGGATCCACTTCAGTGTGATCTCACATAGG3 w taki sposób, ze izolowano gen kodujący glikoproteinę f CDV w postaci fragmentu NotI-BamHI Po oczyszczeniu, produkt PCR-RT o wielkości 2018 bp trawiono NotI i BamHI w celu uwolnienia fragmentu NotI-BamHI o wielkości 2000 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawiony uprzednio PstI i BamHI, otrzymując plazmid pab036 (6893 bp) (figura 3). Przykład 10' Konstrukcja plazmidu pab024 (gen VP2 psiego parwowirusa) Reakcję PCR przeprowadzono z genomowym DNA psiego parwowirusa (CPV) (szczep CPV-B) (C. Pam sh i in., GenBank nr dostępu M 19296) wytworzonym techniką według przykładu 3 z następującymi oligonukleotydam i: AB053 (33-mer) (Id. Sekw. nr 5) 5' ACGCGTCGACATGAGTGATGGAGCAGTTCAACC3' AB054 (33-mer) (Id. Sekw. nr 6) 5 'CGCGGATCCTTAATATAATTTTCTAGGTGCTAG3' (5634 bp) (figura 6). w taki sposób, ze izolowano gen kodujący białko kapsydowe VP2 (CPV VP2) w postaci fragmentu SalI-BamHI. Po oczyszczeniu, produkt PCR trawiono SalI i BamHI w celu uwolnienia fragmentu SalI-BamHI o wielkości 1760 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawionym uprzednio SalI i BamHI, otrzymując plazmid pab024 (6629 bp) (figura 4). Przykład 11: Konstrukcja plazmidu pab021 (gen S CCV) Reakcję RT-PCR techniką według przykładu 6 przeprowadzono z genomowym RNA psiego koronawirusa (CCV) (B. Horsburgh i in.. J. Gen. Virol., 1992, ) z następującymi oligonukleotydami: AB045 (32-mer) (Id. Sekw. nr 7) 5 ACGCGTCGACATGATTGTGCTTACATTGTGCC 3' AB048 (35-mer) (Id Sekw nr 8) 5' CGCGGATCCTCAGTGAACATGAACTTTTTCAATAG3'
11 w taki sposób, ze amplifikowano fragment obejmujący gen kodujący glikoproteinę S CCV w postaci fragmentu SalI-BamHI. Po oczyszczeniu, produkt RT-PCR trawiono SalI i BamHI w celu uwolnienia fragmentu SalI-BamHI o wielkości 4361 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawionym uprzednio SalI i BamHI, otrzymując plazmid pab021 (9030 bp) (figura 5). Przykład 12: Konstrukcja plazmidu pab022 (gen M CCV) Reakcję RT-PCR techniką według przykładu 6 przeprowadzono z genomowym RNA psiego koronawirusa (CCV) (B. Horsburgh i m., J. Gen. Virol., 1992, 73, ) przeprowadzono według techniki z przykładu 4, z następującymi oligonukleotydam i: AB049 (34-mer) (Id. Sekw. nr 9) 5' AAAACTGCAGAAATGAAGAAAATTTTGTTTTTAC3' AB050 (33-mer) (Id. Sekw. nr 10) 5'CGCGGATCCTTATACCATATGTAATAATTTTTC3' w taki sposób, ze izolowano sekwencję kodującą gliko-proteinę M w postaci fragmentu PstI-BamHI. Po oczyszczemu, produkt PCR-RT trawiono PstI i BamHI w celu uwolnienia fragmentu Pstl-BamHI o wielkości 792 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawionym uprzednio PstI i BamHI, otrzymując plazmid pab022 (5651 bp) (figura 6) Przykład 13 - Konstrukcja plazmidu pab037 (gen gb CHV) Reakcję PCR przeprowadzono z genomowym DNA psiego wirusa herpes (CHV) (szczep Carmichael) (K Limbach in., J. Gen. Virol., 1994, 75, ), według techniki z przykładu 3, z następującymi oligonukleotydami: AB087 (34-mer) (Id. Sekw. nr 11) 5' AAAACTGCAGAAGTATGTTTTCATTGTATCTATA3' AB088 (34-mer) (Id Sekw. nr 12) 5 CTAGTCTAGATTATTAAACTTTACTTTCATTTTC3' w taki sposób, ze izolowano gen kodujący glikoproteinę gb wirusa CHV w postaci fragmentu. Po oczyszczeniu, produkt PCR o wielkości 2667 bp trawiono PstI i XbaI w celu uwolnienia fragmentu PstI-XbaI o wielkości 2648 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawiony uprzednio PstI-XbaI, otrzymując plazmid pab- 037(6107 bp) (figura 7) Przykład 14: Konstrukcja plazmidu pab038 (gen gd CHV) Reakcję PCR przeprowadzono z genomowym DNA psiego wirusa herpes (CHV) (szczep Carmichael) (K. Limbach i in., J. Gen. Virol., 1994, 75, ), według techniki z przykładu 3, z następującymi oligonukleotydami: AB089 (34-mer) (Id Sekw nr 13) 5 'AAAACTGCAGAAAATGATTAAACTTCTATTTATC3' AB090 (35-mer) (Id Sekw nr 14) 5'ATAAGAATGCGGCCGCAAAGGCTAAACATTTGTTG3' w taki sposób, ze izolowano gen kodujący glikoproteinę gd wirusa CHV w postaci fragmentu PstI-NotI Po oczyszczeniu, produkt PCR o wielkości 1072 bp trawiono PstI i NotI w celu uwolnienia fragmentu PstI-NotI o wielkości 1049 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawiony uprzednio PstI i NotI, otrzymując plazmid pab038 (5930 bp) (figura 8) Przykład 15. Konstrukcja plazmidu pab017 (gen osp A Borrelia burgdorferi) Reakcję PCR przeprowadzono z genomowym DNA Borrelia burgdorferi (szczep B31) (S Bergstrom i in., Mol Microbiol 1989, 3, ), według techniki z przykładu 2, z następującymi oligonukleotydami:
12 AB038 (37-mer) (Id. Sekw. nr 15) 5'ACGCGTCGACTATGAAAAAATATTTATTGGGAATAGG3' AB039 (34-mer) (Id. Sekw. nr 16) 5'CGCGGATCCCTTATTTTAAAGCGTTTTTAATTTC3' w taki sposób, ze izolowano gen białko błonowe OspA w postaci fragmentu SalI- BamHI. Po oczyszczeniu, produkt PCR o wielkości 842 bp trawiono SalI i BamHI w celu uwolnienia fragmentu SalI-BamHI o wielkości 829 bp. Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawiony uprzednio SalI i BamHI, otrzymując plazmid pab017 (5698 bp) (figura 9). Przykład 16 Konstrukcja plazmidu pab041 (gen G) Reakcję RT-PCR techniką według przykładu 6 przeprowadzono z genomowym RNA bydlęcego wirusa wścieklizny (szczep ERA) (A. Anilionis i in., Naturę, 1981, 294, ), przygotowano techniką według przykładu 4, z następującymi oligonukleotydam i- AB011 (33-mer) (Id. Sekw. nr 17) 5' AAAACTGCAGAGATGGTTCCTCAGGCTCTCCTG3' AB012 (34-mer) (Id. Sekw. nr 18) 5 CGCGGATCCTCACAGTCTGGTCTCACCCCCACTC3' w taki sposób, ze amplifikowano fragment 1589 bp zawierający gen kodujący glikoproteinę G wirusa wścieklizny. Po oczyszczeniu, produkt RT-PCR trawiono PstI i BamHI w celu uwolnienia fragmentu PstI-BamHI o wielkości 1578 bp Fragment ten następnie poddano ligacji z wektorem pvr1012 (przykład 7), trawiony uprzednio PstI i BamHI, otrzymując plazmid pab041 (6437 bp) (figura 10) Przykład 17: Wytwarzanie i oczyszczanie plazmidów Do wytwarzania plazmidów przeznaczonych do szczepienia zwierząt, można zastosować dowolną technikę, która umożliwia otrzymanie zawiesiny oczyszczonych plazmidów, głównie w postaci super-skręconej. Techniki te znane są specjalistom. W szczególności można wymienić technikę lizy alkalicznej, a następnie dwa kolejne ultrawirowania na gradiencie chlorku cezu, w obecności bromku etydyny, jak to opisano w Sambrook i in., (Molecular Clomng A Laboratory Manual, wyd. 2, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989). Można również powołać zgłoszenie patentowe PCT WO 95/21250 i PCT WO 96/02658 opisujące metodę wytwarzania, na skalę przemysłową, plazmidów, które można zastosować do szczepienia. W celu wytwarzania szczepionek (patrz, przykład 17), oczyszczone plazmidy zawiesza się w celu otrzymania zawiesin o wysokim stężeniu (> 2 mg/ml), które są możliwe do przechowywania. W tym celu, plazmidy zawiesza się w ultraczystej wodzie albo w buforze TE (10 mm Tris; 1 mm EDTA, ph 8,0). Przykład 18 Wytwarzanie szczepionek skojarzonych Różne plazmidy konieczne do wytwarzania szczepionek skojarzonych miesza się wychodząc z ich stężonych roztworów (przykład 16). Mieszaniny wytwarza się w taki sposób, ze stężenie końcowe każdego z plazmidów odpowiada skutecznej dawce każdego z nich. Roztwory, które można zastosować do ustalenia stężenia końcowego szczepionki m ogą być roztworami 0,9% NaCl albo buforem PBS. Szczególnie formulacje takie jak liposomy lub kationowe lipidy można również wykorzystać w przygotowaniu szczepionek Przykład 19: Szczepienie psów. Psy szczepi się dawkami 10 µg, 50 µg albo 250 µg na plazmid Wstrzykiwanie można przeprowadzić igłą, drogą domięśniową. W tym przypadku objętość podawanej dawki szczepionki wynosi 1 albo 2 mi. Wstrzykiwanie można przeprowadzić igłą, drogą śródskórną. W tym przypadku dawki podawane są w całkowitej objętości 1 ml w dziesięciu punktach po 0,1 ml albo w 20 punktach po 0,05 ml. Wstrzyknięcia śródskórne przeprowadza się po ogoleniu skóry (bok klatki piersiowej) albo w okolicach nieowłosionych, na przykład na wewnętrznej stronie ud. Wtryskiwacz do wstrzyknięć płynu może być również wykorzystany do wstrzyknięć śródskórnych
13
14
15
16 Figura N 6 FiguraN 7
17 FiguraN 8 FiguraN 9
18 F ig u r a N 1 0 Figura N 1 Departament Wydawnictw UP RP Nakład 50 egz Cena 4,00 zł
Klonowanie molekularne Kurs doskonalący. Zakład Geriatrii i Gerontologii CMKP
 Klonowanie molekularne Kurs doskonalący Zakład Geriatrii i Gerontologii CMKP Etapy klonowania molekularnego 1. Wybór wektora i organizmu gospodarza Po co klonuję (do namnożenia DNA [czy ma być metylowane
Klonowanie molekularne Kurs doskonalący Zakład Geriatrii i Gerontologii CMKP Etapy klonowania molekularnego 1. Wybór wektora i organizmu gospodarza Po co klonuję (do namnożenia DNA [czy ma być metylowane
PL 204536 B1. Szczepanik Marian,Kraków,PL Selmaj Krzysztof,Łódź,PL 29.12.2003 BUP 26/03 29.01.2010 WUP 01/10
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
(86) Data i numer zgłoszenia międzynarodowego: , PCT/FR00/ (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 205608 (21) Numer zgłoszenia: 352484 (22) Data zgłoszenia: 08.06.2000 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 205608 (21) Numer zgłoszenia: 352484 (22) Data zgłoszenia: 08.06.2000 (86) Data i numer zgłoszenia międzynarodowego:
Dobierając optymalny program szczepień, jesteśmy w stanie zapobiec chorobom, które mogą być zagrożeniem dla zdrowia Państwa pupila.
 SZCZEPIENIA KOTÓW Działamy według zasady: Lepiej zapobiegać niż leczyć Wychodząc naprzeciw Państwa oczekiwaniom oraz dbając o dobro Waszych pupili opisaliśmy program profilaktyczny chorób zakaźnych psów,
SZCZEPIENIA KOTÓW Działamy według zasady: Lepiej zapobiegać niż leczyć Wychodząc naprzeciw Państwa oczekiwaniom oraz dbając o dobro Waszych pupili opisaliśmy program profilaktyczny chorób zakaźnych psów,
(12) OPIS PATENTOWY (19)PL (11)188460
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19)PL (11)188460 (21) Numer zgłoszenia: 333127 (13) B1 (22) Data zgłoszenia: 04.11.1997 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19)PL (11)188460 (21) Numer zgłoszenia: 333127 (13) B1 (22) Data zgłoszenia: 04.11.1997 (86) Data i numer zgłoszenia
(12) OPIS PATENTOWY (19) PL (11)
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 190729 (21) Numer zgłoszenia: 344137 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej ( S ) Data zgłoszenia: 27.04.1999 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 190729 (21) Numer zgłoszenia: 344137 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej ( S ) Data zgłoszenia: 27.04.1999 (86) Data i numer zgłoszenia
SZCZEPIONKI DLA PSÓW. Biocan Puppy Biocan DP Biocan C Biocan DHPPi Biocan DHPPi + L Biocan DHPPi + LR Biocan R Biocan M Biocan B Borrelym 3
 SZCZEPIONKI DLA PSÓW Biocan Puppy Biocan DP Biocan C Biocan DHPPi Biocan DHPPi + L Biocan DHPPi + LR Biocan R Biocan M Biocan B Borrelym 3 VETERINARY MEDICAMENTS PRODUCER Biocan Puppy specjalna szczepionka
SZCZEPIONKI DLA PSÓW Biocan Puppy Biocan DP Biocan C Biocan DHPPi Biocan DHPPi + L Biocan DHPPi + LR Biocan R Biocan M Biocan B Borrelym 3 VETERINARY MEDICAMENTS PRODUCER Biocan Puppy specjalna szczepionka
PL B1 (12) O P I S P A T E N T O W Y (19) P L (11) (13) B 1 A61K 9/20. (22) Data zgłoszenia:
 R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
WYNALAZKI BIOTECHNOLOGICZNE W POLSCE. Ewa Waszkowska ekspert UPRP
 WYNALAZKI BIOTECHNOLOGICZNE W POLSCE Ewa Waszkowska ekspert UPRP Źródła informacji w biotechnologii projekt SLING Warszawa, 9-10.12.2010 PLAN WYSTĄPIENIA Umocowania prawne Wynalazki biotechnologiczne Statystyka
WYNALAZKI BIOTECHNOLOGICZNE W POLSCE Ewa Waszkowska ekspert UPRP Źródła informacji w biotechnologii projekt SLING Warszawa, 9-10.12.2010 PLAN WYSTĄPIENIA Umocowania prawne Wynalazki biotechnologiczne Statystyka
Historia i przyszłość szczepień
 IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
Zestawy do izolacji DNA i RNA
 Syngen kolumienki.pl Gotowe zestawy do izolacji i oczyszczania kwasów nukleinowych Zestawy do izolacji DNA i RNA Katalog produktów 2012-13 kolumienki.pl Syngen Biotech Sp. z o.o., 54-116 Wrocław, ul. Ostródzka
Syngen kolumienki.pl Gotowe zestawy do izolacji i oczyszczania kwasów nukleinowych Zestawy do izolacji DNA i RNA Katalog produktów 2012-13 kolumienki.pl Syngen Biotech Sp. z o.o., 54-116 Wrocław, ul. Ostródzka
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Rok akademicki: 2014/2015 Kod: EIB-2-206-BN-s Punkty ECTS: 3. Kierunek: Inżynieria Biomedyczna Specjalność: Bionanotechnologie
 Nazwa modułu: Genetyka molekularna Rok akademicki: 2014/2015 Kod: EIB-2-206-BN-s Punkty ECTS: 3 Wydział: Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej Kierunek: Inżynieria Biomedyczna
Nazwa modułu: Genetyka molekularna Rok akademicki: 2014/2015 Kod: EIB-2-206-BN-s Punkty ECTS: 3 Wydział: Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej Kierunek: Inżynieria Biomedyczna
PL B1. UNIWERSYTET PRZYRODNICZY W LUBLINIE, Lublin, PL BUP 26/11
 PL 214501 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 214501 (13) B1 (21) Numer zgłoszenia: 391458 (51) Int.Cl. C12Q 1/68 (2006.01) C12N 15/29 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
PL 214501 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 214501 (13) B1 (21) Numer zgłoszenia: 391458 (51) Int.Cl. C12Q 1/68 (2006.01) C12N 15/29 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Inżynieria Genetyczna ćw. 3
 Materiały do ćwiczeń z przedmiotu Genetyka z inżynierią genetyczną D - blok Inżynieria Genetyczna ćw. 3 Instytut Genetyki i Biotechnologii, Wydział Biologii, Uniwersytet Warszawski, rok akad. 2018/2019
Materiały do ćwiczeń z przedmiotu Genetyka z inżynierią genetyczną D - blok Inżynieria Genetyczna ćw. 3 Instytut Genetyki i Biotechnologii, Wydział Biologii, Uniwersytet Warszawski, rok akad. 2018/2019
(86) Data i numer zgłoszenia międzynarodowego: , PCT/FR00/ (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 210451 (21) Numer zgłoszenia: 352212 (22) Data zgłoszenia: 08.06.2000 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 210451 (21) Numer zgłoszenia: 352212 (22) Data zgłoszenia: 08.06.2000 (86) Data i numer zgłoszenia międzynarodowego:
Biologia Molekularna z Biotechnologią ===============================================================================================
 Uniwersytet Gdański, Wydział Biologii Biologia i Biologia Medyczna II rok Katedra Genetyki Molekularnej Bakterii Katedra Biologii i Genetyki Medycznej Przedmiot: Katedra Biologii Molekularnej Biologia
Uniwersytet Gdański, Wydział Biologii Biologia i Biologia Medyczna II rok Katedra Genetyki Molekularnej Bakterii Katedra Biologii i Genetyki Medycznej Przedmiot: Katedra Biologii Molekularnej Biologia
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Definicje. Białka rekombinowane (ang. recombinant proteins, r-proteins) Ukierunkowana mutageneza (ang. site-directed/site-specific mutagenesis)
 Definicje Białka rekombinowane (ang. recombinant proteins, r-proteins) Białka, które powstały w żywych organizmach (lub liniach komórkowych) w wyniku ekspresji rekombinowanego DNA. Rekombinowany DNA jest
Definicje Białka rekombinowane (ang. recombinant proteins, r-proteins) Białka, które powstały w żywych organizmach (lub liniach komórkowych) w wyniku ekspresji rekombinowanego DNA. Rekombinowany DNA jest
Biologia medyczna, materiały dla studentów
 Zasada reakcji PCR Reakcja PCR (replikacja in vitro) obejmuje denaturację DNA, przyłączanie starterów (annealing) i syntezę nowych nici DNA (elongacja). 1. Denaturacja: rozplecenie nici DNA, temp. 94 o
Zasada reakcji PCR Reakcja PCR (replikacja in vitro) obejmuje denaturację DNA, przyłączanie starterów (annealing) i syntezę nowych nici DNA (elongacja). 1. Denaturacja: rozplecenie nici DNA, temp. 94 o
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
TaqNova-RED. Polimeraza DNA RP20R, RP100R
 TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
(12) OPIS PATENTOWY. (86) Data i numer zgłoszenia międzynarodowego , PCT/KR96/00238
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (21) Numer zgłoszenia: 327971 (22) Data zgłoszenia: 11.12.1996 (86) Data i numer zgłoszenia międzynarodowego 11.12.1996,
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (21) Numer zgłoszenia: 327971 (22) Data zgłoszenia: 11.12.1996 (86) Data i numer zgłoszenia międzynarodowego 11.12.1996,
Diagnostyka wirusologiczna w praktyce klinicznej
 Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
TaqNovaHS. Polimeraza DNA RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925
 TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 5, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 5, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP96/05837
 RZECZPOSPOLITA POLSKA (12)OPIS PATENTOWY (19)PL (11)186469 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 327637 (22) Data zgłoszenia: 24.12.1996 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA (12)OPIS PATENTOWY (19)PL (11)186469 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 327637 (22) Data zgłoszenia: 24.12.1996 (86) Data i numer zgłoszenia międzynarodowego:
(86) Data i numer zgłoszenia międzynarodowego: 13.12.1999,PCT/EP99/09864 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202483 (21) Numer zgłoszenia: 349335 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.12.1999 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202483 (21) Numer zgłoszenia: 349335 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.12.1999 (86) Data i numer zgłoszenia
RT31-020, RT , MgCl 2. , random heksamerów X 6
 RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
Zawartość. Wstęp 1. Historia wirusologii. 2. Klasyfikacja wirusów
 Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Mikroorganizmy Zmodyfikowane Genetycznie
 Mikroorganizmy Zmodyfikowane Genetycznie DEFINICJA Mikroorganizm (drobnoustrój) to organizm niewidoczny gołym okiem. Pojęcie to nie jest zbyt precyzyjne lecz z pewnością mikroorganizmami są: bakterie,
Mikroorganizmy Zmodyfikowane Genetycznie DEFINICJA Mikroorganizm (drobnoustrój) to organizm niewidoczny gołym okiem. Pojęcie to nie jest zbyt precyzyjne lecz z pewnością mikroorganizmami są: bakterie,
Przeciwciała poliklonalne przeciwko białkom Helicobacter pylori oraz sposób ich wytwarzania. (74) Pełnomocnik:
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 201982 (21) Numer zgłoszenia: 361069 (22) Data zgłoszenia: 03.07.2003 (13) B1 (51) Int.Cl. A61K 39/40 (2006.01)
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 201982 (21) Numer zgłoszenia: 361069 (22) Data zgłoszenia: 03.07.2003 (13) B1 (51) Int.Cl. A61K 39/40 (2006.01)
PL B1. UNIWERSYTET PRZYRODNICZY W LUBLINIE, Lublin, PL BUP 04/14. SYLWIA OKOŃ, Dąbrowica, PL KRZYSZTOF KOWALCZYK, Motycz, PL
 PL 220315 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 220315 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 400252 (22) Data zgłoszenia: 06.08.2012 (51) Int.Cl.
PL 220315 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 220315 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 400252 (22) Data zgłoszenia: 06.08.2012 (51) Int.Cl.
KLONOWANIE DNA REKOMBINACJA DNA WEKTORY
 KLONOWANIE DNA Klonowanie DNA jest techniką powielania fragmentów DNA DNA można powielać w komórkach (replikacja in vivo) W probówce (PCR) Do przeniesienia fragmentu DNA do komórek gospodarza potrzebny
KLONOWANIE DNA Klonowanie DNA jest techniką powielania fragmentów DNA DNA można powielać w komórkach (replikacja in vivo) W probówce (PCR) Do przeniesienia fragmentu DNA do komórek gospodarza potrzebny
Scenariusz lekcji z biologii w szkole ponadgimnazjalnej
 Scenariusz lekcji z biologii w szkole ponadgimnazjalnej Temat lekcji: Planowanie doświadczeń biologicznych jak prawidłowo zaplanować próbę kontrolną? Cele kształcenia IV etap edukacyjny: 1. Wymagania ogólne:
Scenariusz lekcji z biologii w szkole ponadgimnazjalnej Temat lekcji: Planowanie doświadczeń biologicznych jak prawidłowo zaplanować próbę kontrolną? Cele kształcenia IV etap edukacyjny: 1. Wymagania ogólne:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
tama Vet Szybkie testy weterynaryjne Argenta dostępne w ofercie firmy str. 1
 tama Vet Szybkie testy weterynaryjne dostępne w ofercie firmy Argenta str. 1 str. 2 .. Zasada działania szybkiego testu tamavet opiera się na połączeniu przeciwciał z antygenami. Próbka pobrana od pacjenta
tama Vet Szybkie testy weterynaryjne dostępne w ofercie firmy Argenta str. 1 str. 2 .. Zasada działania szybkiego testu tamavet opiera się na połączeniu przeciwciał z antygenami. Próbka pobrana od pacjenta
PL B1 (13) B1 A47G 21/06. DE STER NV, Hoogstraten, BE. Jef De Schütter, Brecht, BE. Borowska-Kryśka Urszula, PATPOL Spółka z 0.0.
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 174701 (21) Numer zgłoszenia: 314130 (22) Data zgłoszenia: 02.09.1994 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 174701 (21) Numer zgłoszenia: 314130 (22) Data zgłoszenia: 02.09.1994 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (86) Data i numer zgłoszenia
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
Ćwiczenia 1 Wirtualne Klonowanie Prowadzący: mgr inż. Joanna Tymeck-Mulik i mgr Lidia Gaffke. Część teoretyczna:
 Uniwersytet Gdański, Wydział Biologii Katedra Biologii Molekularnej Przedmiot: Biologia Molekularna z Biotechnologią Biologia II rok ===============================================================================================
Uniwersytet Gdański, Wydział Biologii Katedra Biologii Molekularnej Przedmiot: Biologia Molekularna z Biotechnologią Biologia II rok ===============================================================================================
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
Techniki biologii molekularnej Kod przedmiotu
 Techniki biologii molekularnej - opis przedmiotu Informacje ogólne Nazwa przedmiotu Techniki biologii molekularnej Kod przedmiotu 13.9-WB-BMD-TBM-W-S14_pNadGenI2Q8V Wydział Kierunek Wydział Nauk Biologicznych
Techniki biologii molekularnej - opis przedmiotu Informacje ogólne Nazwa przedmiotu Techniki biologii molekularnej Kod przedmiotu 13.9-WB-BMD-TBM-W-S14_pNadGenI2Q8V Wydział Kierunek Wydział Nauk Biologicznych
Inżynieria genetyczna- 6 ECTS. Inżynieria genetyczna. Podstawowe pojęcia Część II Klonowanie ekspresyjne Od genu do białka
 Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii
 Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
Krętki: Borrelia spp
 Krętki: Borrelia spp Borrelia burgdorferi Borrelia burgdorferi - mikroaerofilne bakterie Gram-ujemne o średnicy 0,3-0,5 µm i długości 20-30 µm powodująca najczęściej spośród krętków Borrelia chorobę zakaźną
Krętki: Borrelia spp Borrelia burgdorferi Borrelia burgdorferi - mikroaerofilne bakterie Gram-ujemne o średnicy 0,3-0,5 µm i długości 20-30 µm powodująca najczęściej spośród krętków Borrelia chorobę zakaźną
(12) OPIS PATENTOWY (19) PL (11) (13) B1
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 162995 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 283854 (22) Data zgłoszenia: 16.02.1990 (51) IntCl5: C05D 9/02 C05G
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 162995 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 283854 (22) Data zgłoszenia: 16.02.1990 (51) IntCl5: C05D 9/02 C05G
Techniki molekularne w mikrobiologii SYLABUS A. Informacje ogólne
 Techniki molekularne w mikrobiologii A. Informacje ogólne Elementy sylabusu Nazwa jednostki prowadzącej kierunek Nazwa kierunku studiów Poziom kształcenia Profil studiów Forma studiów Rodzaj Rok studiów
Techniki molekularne w mikrobiologii A. Informacje ogólne Elementy sylabusu Nazwa jednostki prowadzącej kierunek Nazwa kierunku studiów Poziom kształcenia Profil studiów Forma studiów Rodzaj Rok studiów
(86) Data i numer zgłoszenia międzynarodowego: , PCT/SI94/00010
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) O P IS P A T E N T O W Y (19) P L (11) 178163 ( 2 1 ) N u m e r z g ł o s z e n ia : 311880 (22) Data zgłoszenia: 08.06.1994 (86) Data
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) O P IS P A T E N T O W Y (19) P L (11) 178163 ( 2 1 ) N u m e r z g ł o s z e n ia : 311880 (22) Data zgłoszenia: 08.06.1994 (86) Data
Polimeraza Taq (1U/ l) 1-2 U 1 polimeraza Taq jako ostatni składniki mieszaniny końcowa objętość
 Ćwiczenie 6 Technika PCR Celem ćwiczenia jest zastosowanie techniki PCR do amplifikacji fragmentu DNA z bakterii R. leguminosarum bv. trifolii TA1 (RtTA1). Studenci przygotowują reakcję PCR wykorzystując
Ćwiczenie 6 Technika PCR Celem ćwiczenia jest zastosowanie techniki PCR do amplifikacji fragmentu DNA z bakterii R. leguminosarum bv. trifolii TA1 (RtTA1). Studenci przygotowują reakcję PCR wykorzystując
Inżynieria genetyczna
 Inżynieria genetyczna i technologia rekombinowanego DNA Dr n. biol. Urszula Wasik Zakład Biologii Medycznej Inżynieria genetyczna świadoma, celowa, kontrolowana ingerencja w materiał genetyczny organizmów
Inżynieria genetyczna i technologia rekombinowanego DNA Dr n. biol. Urszula Wasik Zakład Biologii Medycznej Inżynieria genetyczna świadoma, celowa, kontrolowana ingerencja w materiał genetyczny organizmów
(12) OPIS PATENTOWY. (86) Data i numer zgłoszenia międzynarodowego: 01.06.1995, PCT/US95/06915
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (21 ) Numer zgłoszenia: 317874 (19) PL (11) 180639 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 01.06.1995 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (21 ) Numer zgłoszenia: 317874 (19) PL (11) 180639 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 01.06.1995 (86) Data i numer zgłoszenia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1711158 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 16.11.2004 04806793.8
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1711158 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 16.11.2004 04806793.8
Sposób otrzymywania białek o właściwościach immunoregulatorowych. Przedmiotem wynalazku jest sposób otrzymywania fragmentów witellogeniny.
 1 Sposób otrzymywania białek o właściwościach immunoregulatorowych Przedmiotem wynalazku jest sposób otrzymywania fragmentów witellogeniny. Wynalazek może znaleźć zastosowanie w przemyśle spożywczym i
1 Sposób otrzymywania białek o właściwościach immunoregulatorowych Przedmiotem wynalazku jest sposób otrzymywania fragmentów witellogeniny. Wynalazek może znaleźć zastosowanie w przemyśle spożywczym i
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 231)
 Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Powodzenie reakcji PCR wymaga właściwego doboru szeregu parametrów:
 Powodzenie reakcji PCR wymaga właściwego doboru szeregu parametrów: dobór warunków samej reakcji PCR (temperatury, czas trwania cykli, ilości cykli itp.) dobór odpowiednich starterów do reakcji amplifikacji
Powodzenie reakcji PCR wymaga właściwego doboru szeregu parametrów: dobór warunków samej reakcji PCR (temperatury, czas trwania cykli, ilości cykli itp.) dobór odpowiednich starterów do reakcji amplifikacji
PL B1. PRZEDSIĘBIORSTWO PRODUKCJI FARMACEUTYCZNEJ HASCO-LEK SPÓŁKA AKCYJNA, Wrocław, PL BUP 09/13
 PL 222738 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 222738 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 396706 (22) Data zgłoszenia: 19.10.2011 (51) Int.Cl.
PL 222738 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 222738 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 396706 (22) Data zgłoszenia: 19.10.2011 (51) Int.Cl.
Zakład Chorób Ryb. PIWet. Zastosowanie molekularnych metod do diagnostyki wirusowych chorób ryb, wirusa krwotocznej posocznicy
 PIWet Zakład Chorób Ryb Zastosowanie molekularnych metod do diagnostyki wirusowych chorób ryb, wirusa krwotocznej posocznicy łososiowatych o (VHS), wirusa zakaźnej a martwicy układu krwiotwórczego (IHN)
PIWet Zakład Chorób Ryb Zastosowanie molekularnych metod do diagnostyki wirusowych chorób ryb, wirusa krwotocznej posocznicy łososiowatych o (VHS), wirusa zakaźnej a martwicy układu krwiotwórczego (IHN)
IZOLACJA KWASÓW NUKLEINOWYCH WARUNKI ZALICZENIA PRZEDMIOTU- 7 ECTS PRZEDMIOT PROGOWY!!!
 WARUNKI ZALICZENIA PRZEDMIOTU- 7 ECTS PRZEDMIOT PROGOWY!!! W1-4p W2-4p W3-4p W4-4p W5-4p W6-4p W7-4p W8-4p W9-4p W10-4p min 21p wyjściówka I 40p wyjściówka II 40p egzamin I egzamin II min 21p 60p 60p min
WARUNKI ZALICZENIA PRZEDMIOTU- 7 ECTS PRZEDMIOT PROGOWY!!! W1-4p W2-4p W3-4p W4-4p W5-4p W6-4p W7-4p W8-4p W9-4p W10-4p min 21p wyjściówka I 40p wyjściówka II 40p egzamin I egzamin II min 21p 60p 60p min
Inwestycja w przyszłość czyli znaczenie ochrony własności przemysłowej dla współczesnej biotechnologii
 Inwestycja w przyszłość czyli znaczenie ochrony własności przemysłowej dla współczesnej biotechnologii Zdolność patentowa wynalazków biotechnologicznych dr Małgorzata Kozłowska Ekspert w UPRP dr Ewa Waszkowska
Inwestycja w przyszłość czyli znaczenie ochrony własności przemysłowej dla współczesnej biotechnologii Zdolność patentowa wynalazków biotechnologicznych dr Małgorzata Kozłowska Ekspert w UPRP dr Ewa Waszkowska
(12) OPIS PATENTOWY (19) PL (11)
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 181834 (21) Numer zgłoszenia: 326385 (22) Data zgłoszenia: 30.10.1996 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 181834 (21) Numer zgłoszenia: 326385 (22) Data zgłoszenia: 30.10.1996 (86) Data i numer zgłoszenia międzynarodowego:
Anna Skop. Zachęcam do zapoznania się z prezentacja na temat szczepień.
 W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
CZYM JEST SZCZEPIONKA?
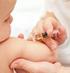 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
(12) O PIS PATENTOWY (19) PL (11) (13) B1
 RZECZPOSPOLITA POLSKA (12) O PIS PATENTOWY (19) PL (11) 159844 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 273721 ( 2) Data zgłoszenia: 14.07.1988 (51) IntCl.5: C12N 15/51
RZECZPOSPOLITA POLSKA (12) O PIS PATENTOWY (19) PL (11) 159844 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 273721 ( 2) Data zgłoszenia: 14.07.1988 (51) IntCl.5: C12N 15/51
(13) B1 PL B1. (57) 1. Sposób wytwarzania wieloważnej szczepionki przeciwko Pseudomonas aeruginosa
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 168182 (13) B1 (21)Numer zgłoszenia: 2 9 5 2 1 7 (51) IntCl6: A 61K 3 9 /1 0 4 UrządPatentowyRzeczypospolitej Polskiej (2) Datazgłoszenia : 0 7.0
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 168182 (13) B1 (21)Numer zgłoszenia: 2 9 5 2 1 7 (51) IntCl6: A 61K 3 9 /1 0 4 UrządPatentowyRzeczypospolitej Polskiej (2) Datazgłoszenia : 0 7.0
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
PROJEKT WSPÓŁFINANSOWANY PRZEZ UNIĘ EUROPEJSKĄ Z EUROPEJSKIEGO FUNDUSZU ROZWOJU REGIONALNEGO 1 z 7
 Poznań, dnia 28.04.2014 r. BioVentures Institute Spółka z ograniczoną odpowiedzialnością ul. Promienista 83 60 141 Poznań Zapytanie ofertowe nr 01/2014 Projekt Nowa technologia wytwarzania szczepionek
Poznań, dnia 28.04.2014 r. BioVentures Institute Spółka z ograniczoną odpowiedzialnością ul. Promienista 83 60 141 Poznań Zapytanie ofertowe nr 01/2014 Projekt Nowa technologia wytwarzania szczepionek
Agenda: Wynalazek jako własnośd intelektualna. Co może byd wynalazkiem. Wynalazek biotechnologiczny. Ochrona patentowa
 dr Bartosz Walter Agenda: Wynalazek jako własnośd intelektualna Co może byd wynalazkiem Wynalazek biotechnologiczny Ochrona patentowa Procedura zgłoszenia patentowego Gdzie, kiedy i jak warto patentowad
dr Bartosz Walter Agenda: Wynalazek jako własnośd intelektualna Co może byd wynalazkiem Wynalazek biotechnologiczny Ochrona patentowa Procedura zgłoszenia patentowego Gdzie, kiedy i jak warto patentowad
Biologia molekularna wirusów. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego.
 Biologia molekularna wirusów Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Co to jest wirus? Cząsteczka złożona z kwasu nukleinowego (DNA
Biologia molekularna wirusów Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Co to jest wirus? Cząsteczka złożona z kwasu nukleinowego (DNA
Ćwiczenia 1 Wirtualne Klonowanie. Prowadzący: mgr Anna Pawlik i mgr Maciej Dylewski. Część teoretyczna:
 Uniwersytet Gdański, Wydział Biologii Biologia i Biologia Medyczna II rok Katedra Biologii Molekularnej Przedmiot: Biologia Molekularna z Biotechnologią ===============================================================================================
Uniwersytet Gdański, Wydział Biologii Biologia i Biologia Medyczna II rok Katedra Biologii Molekularnej Przedmiot: Biologia Molekularna z Biotechnologią ===============================================================================================
Genomic Maxi AX Direct
 Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/19
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/19 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Eurican Herpes 205 - proszek i rozpuszczalnik do sporządzania emulsji do wstrzykiwań. 2.
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/19 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Eurican Herpes 205 - proszek i rozpuszczalnik do sporządzania emulsji do wstrzykiwań. 2.
(86) Data i numer zgłoszenia międzynarodowego: , PCT/GB98/00907
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 188971 (21) Numer zgłoszenia: 335877 (22) Data zgłoszenia: 25.03.1998 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 188971 (21) Numer zgłoszenia: 335877 (22) Data zgłoszenia: 25.03.1998 (86) Data i numer zgłoszenia międzynarodowego:
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Purevax RCP FeLV liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Purevax RCP FeLV liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Dawka 1-ml zawiera:
1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Purevax RCP FeLV liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Dawka 1-ml zawiera:
Wprowadzenie. Obliczanie miana wirusa i redukcja wirusa
 Ocena skuteczności systemów dekontaminacji Ecoquest w redukcji mian Norowirusa u myszy Wykonane przez Dr Lela Riley, RADIL LLC, Columbia MO 18 listopada 28 r. Wprowadzenie Członkami grupy Norowirusa są
Ocena skuteczności systemów dekontaminacji Ecoquest w redukcji mian Norowirusa u myszy Wykonane przez Dr Lela Riley, RADIL LLC, Columbia MO 18 listopada 28 r. Wprowadzenie Członkami grupy Norowirusa są
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
PL B1. UVEX ARBEITSSCHUTZ GMBH, Fürth, DE , DE, STEFAN BRÜCK, Nürnberg, DE BUP 19/
 PL 212472 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 212472 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 359123 (22) Data zgłoszenia: 12.03.2003 (51) Int.Cl.
PL 212472 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 212472 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 359123 (22) Data zgłoszenia: 12.03.2003 (51) Int.Cl.
Pytania Egzamin magisterski
 Pytania Egzamin magisterski Międzyuczelniany Wydział Biotechnologii UG i GUMed 1. Krótko omów jakie informacje powinny być zawarte w typowych rozdziałach publikacji naukowej: Wstęp, Materiały i Metody,
Pytania Egzamin magisterski Międzyuczelniany Wydział Biotechnologii UG i GUMed 1. Krótko omów jakie informacje powinny być zawarte w typowych rozdziałach publikacji naukowej: Wstęp, Materiały i Metody,
(86) Data i numer zgłoszenia międzynarodowego: ,PCT/EP02/06600 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202324 (21) Numer zgłoszenia: 366428 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 14.06.2002 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202324 (21) Numer zgłoszenia: 366428 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 14.06.2002 (86) Data i numer zgłoszenia
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY)
 Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH
 Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
(86) Data i numer zgłoszenia międzynarodowego: 09.08.2001, PCT/DE01/02954 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 199888 (21) Numer zgłoszenia: 360082 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 09.08.2001 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 199888 (21) Numer zgłoszenia: 360082 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 09.08.2001 (86) Data i numer zgłoszenia
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk
 Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Warszawa, dnia 12 lutego 2014 r. Poz. 198
 Warszawa, dnia 12 lutego 2014 r. Poz. 198 ROZPORZĄDZENIE MINISTRA OBRONY NARODOWEJ z dnia 3 lutego 2014 r. w sprawie programu szczepień ochronnych dla żołnierzy zawodowych oraz sposobu rejestracji przeprowadzanych
Warszawa, dnia 12 lutego 2014 r. Poz. 198 ROZPORZĄDZENIE MINISTRA OBRONY NARODOWEJ z dnia 3 lutego 2014 r. w sprawie programu szczepień ochronnych dla żołnierzy zawodowych oraz sposobu rejestracji przeprowadzanych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 7, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Vanguard Plus 7, liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów 2. SKŁAD
(13) B1 (12) OPIS PATENTOWY (19) PL (11) PL B1 G06F 12/16 G06F 1/30 H04M 1/64. (57)1. Układ podtrzymywania danych przy
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 175315 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 307287 (22) Data zgłoszenia: 15.02.1995 (51) IntCl6: H04M 1/64 G06F
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 175315 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 307287 (22) Data zgłoszenia: 15.02.1995 (51) IntCl6: H04M 1/64 G06F
Ćwiczenie 3. Amplifikacja genu ccr5 Homo sapiens wykrywanie delecji Δ32pz warunkującej oporność na wirusa HIV
 Ćwiczenie 3. Amplifikacja genu ccr5 Homo sapiens wykrywanie delecji Δ32pz warunkującej oporność na wirusa HIV Cel ćwiczenia Określenie podatności na zakażenie wirusem HIV poprzez detekcję homo lub heterozygotyczności
Ćwiczenie 3. Amplifikacja genu ccr5 Homo sapiens wykrywanie delecji Δ32pz warunkującej oporność na wirusa HIV Cel ćwiczenia Określenie podatności na zakażenie wirusem HIV poprzez detekcję homo lub heterozygotyczności
Przyjrzyj się bliżej jak PUREVAX zmienia przyszłość szczepień kotów
 Przyjrzyj się bliżej jak PUREVAX zmienia przyszłość szczepień kotów www.merial.com Zrozumieć wizję Firma Merial przyjrzała się bliżej Twoim potrzebom Innowacja Spokojne sumienie opracowywanie szczepionek
Przyjrzyj się bliżej jak PUREVAX zmienia przyszłość szczepień kotów www.merial.com Zrozumieć wizję Firma Merial przyjrzała się bliżej Twoim potrzebom Innowacja Spokojne sumienie opracowywanie szczepionek
(12) OPIS PATENTOWY (19) PL. (86) Data i numer zgłoszenia międzynarodowego: , PCT/DK95/00453
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (21) Numer zgłoszenia: 320220 (22) Data zgłoszenia: 14.11.1995 (86) Data i numer zgłoszenia międzynarodowego:
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (21) Numer zgłoszenia: 320220 (22) Data zgłoszenia: 14.11.1995 (86) Data i numer zgłoszenia międzynarodowego:
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
ĆWICZENIA Z BIOCHEMII
 ĆWICZENIA Z BIOCHEMII D U STUDENTfiW WYDZIAŁU LEKARSKIEGO Pod redakcją Piotra Laidlera, Barbary Piekarskiej, Marii Wróbel WYDAWNICTWO UNIWERSYTETU JAGIELLOŃSKIEGO ĆWICZENIA Z BIOCHEMII DLA STUDENTÓW WYDZIAŁU
ĆWICZENIA Z BIOCHEMII D U STUDENTfiW WYDZIAŁU LEKARSKIEGO Pod redakcją Piotra Laidlera, Barbary Piekarskiej, Marii Wróbel WYDAWNICTWO UNIWERSYTETU JAGIELLOŃSKIEGO ĆWICZENIA Z BIOCHEMII DLA STUDENTÓW WYDZIAŁU
Instrukcja ćwiczeń Biologia molekularna dla II roku Analityki Medycznej. Reakcja odwrotnej transkrypcji. Projektowanie starterów do reakcji PCR.
 INSTRUKCJA Ćwiczenie nr 5 Odczynniki: Sprzęt: 1. 5xNG cdna Buffer 2. 50 µm oligo(dt)20 3. NG dart RT mix l 4. Probówki typu Eppendorf 0,2 ml 5. Woda wolna od RNaz 6. Lód 1. Miniwirówka 2. Termocykler 3.
INSTRUKCJA Ćwiczenie nr 5 Odczynniki: Sprzęt: 1. 5xNG cdna Buffer 2. 50 µm oligo(dt)20 3. NG dart RT mix l 4. Probówki typu Eppendorf 0,2 ml 5. Woda wolna od RNaz 6. Lód 1. Miniwirówka 2. Termocykler 3.
mikrosatelitarne, minisatelitarne i polimorfizm liczby kopii
 Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoduk zawiesina i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla kaczek piżmowych
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoduk zawiesina i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla kaczek piżmowych
