CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. STERI-NEB IPRATROPIUM, 250 mikrogramów/ml, roztwór do nebulizacji
|
|
|
- Irena Górecka
- 9 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO STERI-NEB IPRATROPIUM, 250 mikrogramów/ml, roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do nebulizacji zawiera 250 mikrogramów bromku ipratropiowego (Ipratropii bromidum). Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Roztwór do nebulizacji. Bezbarwny roztwór. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Steri-Neb Ipratropium jest wskazany jako lek rozszerzający oskrzela w leczeniu podtrzymującym stanów skurczowych oskrzeli w przewlekłej obturacyjnej chorobie płuc. 4.2 Dawkowanie i sposób podawania Dawkowanie należy ustalać indywidualnie dla każdego pacjenta. Zalecane dawkowanie: Dorośli (w tym osoby w podeszłym wieku) i młodzież w wieku powyżej 14 lat: od 0,4 do 2,0 ml roztworu (od 100 do 500 mikrogramów) trzy do czterech razy na dobę. Dzieci w wieku od 3 do 14 lat: od 0,4 do 1,0 ml roztworu (od 100 do 250 mikrogramów) trzy do czterech razy na dobę. Ze względu na ograniczoną ilość danych dotyczących stosowania produktu leczniczego u dzieci w wieku poniżej 14 lat, w tej grupie wiekowej zalecane dawki należy stosować pod kontrolą lekarza. Należy poinformować pacjentów, aby zgłosili się do lekarza, jeżeli stosowanie produktu leczniczego nie powoduje istotnej poprawy lub stan pacjenta pogarsza się. W przypadku nagłej lub szybko nasilającej się duszności pacjent powinien natychmiast skonsultować się lekarzem. Sposób podawania: Steri-Neb Ipratropium jest przeznaczony wyłącznie do stosowania wziewnego (inhalacji) i nie może być podawany doustnie ani dożylnie. Produkt leczniczy może być podawany za pomocą dostępnych na rynku nebulizatorów. Instrukcja stosowania produktu, patrz punkt 6.6. Może być konieczne rozcieńczenie dawki roztworu do nebulizacji w celu uzyskania objętości odpowiedniej dla danego rodzaju nebulizatora (zazwyczaj 2 4 ml). Jeśli konieczne jest rozcieńczenie produktu leczniczego, należy użyć do tego celu 0,9% jałowy roztwór sodu chlorku. Należy przestrzegać zaleceń producenta nebulizatora. 1
2 4.3 Przeciwwskazania Nadwrażliwość na bromek ipratropiowy lub na którąkolwiek substancję pomocniczą Nadwrażliwość na atropinę lub jej pochodne. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Roztwór do nebulizacji należy stosować pod kontrolą lekarza, szczególnie na początku leczenia. Z powodu ryzyka wystąpienia paradoksalnego skurczu oskrzeli na początku leczenia, leczenie powinno być rozpoczynane w szpitalu. Stan pacjenta należy szczególnie uważnie kontrolować w ciągu pierwszego tygodnia leczenia. Pacjent powinien skontaktować się z lekarzem, jeżeli stosowane leczenie nie przynosi poprawy. U pacjentów wymagających długotrwałego leczenia lekami rozszerzającymi oskrzela, należy wykonywać regularnie badania umożliwiające kontrolę ich stanu zdrowia. Leki przeciwcholinergiczne należy ostrożnie stosować u pacjentów z jaskrą lub z ryzykiem jej wystąpienia, rozrostem gruczołu krokowego oraz w przypadku niedrożności szyi pęcherza moczowego. Leki przeciwcholinergiczne mogą spowodować zatrzymanie moczu u pacjentów z rozrostem gruczołu krokowego. U pacjentów z mukowiscydozą istnieje zwiększona skłonność do wystąpienia zaburzeń motoryki przewodu pokarmowego, dlatego podczas stosowania bromku ipratropiowego, podobnie jak innych leków przeciwcholinergicznych, u tych pacjentów należy zachować ostrożność. Po zastosowaniu produktu leczniczego Steri-Neb Ipratropium rzadko mogą wystąpić natychmiastowe reakcje nadwrażliwości z objawami pokrzywki, obrzęku naczynioruchowego, wysypki, skurczu oskrzeli, obrzęku jamy ustnej i gardła oraz anafilaksji. Istnieją nieliczne doniesienia o wystąpieniu działań niepożądanych dotyczących oczu (np. rozszerzenie źrenic, zwiększenie ciśnienia śródgałkowego, jaskra z wąskim kątem przesączania, ból oczu) po dostaniu się bromku ipratropium do oczu podczas nebulizacji. Ból oka lub dyskomfort, niewyraźne widzenie, widzenie kolorowej obwódki wokół źródeł światła lub zmienione widzenie kolorów z zaczerwienieniem oczu w następstwie przekrwienia spojówki i rogówki mogą być objawami ostrej jaskry z wąskim kątem przesączania. W przypadku wystąpienia któregokolwiek z wymienionych objawów należy rozpocząć leczenie zwężającymi źrenicę kroplami do oczu i natychmiast zasięgnąć porady specjalisty. Nie wolno dopuścić, aby roztwór leku dostał się do oczu. Należy poinstruować pacjenta, jak prawidłowo stosować produkt leczniczy Steri-Neb Ipratropium z nebulizatora oraz poinformować o konieczności ochrony oczu przed kontaktem z roztworem lub rozpylonym aerozolem. Zaleca się stosowanie roztworu do nebulizacji przez ustnik. Jeżeli nie można podać leku przez ustnik, a nebulizator wyposażony jest w maskę, musi ona dokładnie przylegać do twarzy. Ochrona oczu jest szczególnie ważna u pacjentów z predyspozycją do wystąpienia jaskry. 4.5 Interakcje z innymi lekami i inne rodzaje interakcji Jednoczesne stosowanie preparatu z lekami pobudzającymi receptory β-adrenergiczne oraz preparatami zawierającymi pochodne ksantyny może spowodować nasilenie działania rozszerzającego oskrzela. Jednoczesne podawanie w nebulizacji bromku ipratropiowego i β 2 -agonistów może zwiększać ryzyko wystąpienia ostrej jaskry u pacjentów z jaskrą z wąskim kątem przesączania w wywiadzie (patrz punkt 4.4). 4.6 Ciąża i laktacja 2
3 Nie ustalono bezpieczeństwa stosowania produktu leczniczego Steri-Neb Ipratropium w czasie ciąży. Bromek ipratropium nie powinien być stosowany w czasie ciąży, szczególnie w czasie pierwszego trymestru. Należy rozważyć, czy spodziewane korzyści terapeutyczne dla matki, wynikające ze stosowania produktu leczniczego Steri-Neb Ipratropium przewyższają potencjalne ryzyko dla płodu. Przedkliniczne badania na zwierzętach nie wykazały działania embriotoksycznego oraz teratogennego bromku ipratropiowego po podaniu wziewnym lub donosowo w dawkach znacznie większych niż zalecane do stosowania u ludzi. Nie wiadomo czy bromek ipratropiowy przenika do mleka matki. Istnieje małe prawdopodobieństwo, że bromek ipratropiowy może przedostać się w znaczącej ilości do organizmu noworodka. Nie należy podawać leku kobietom karmiącym piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Nie przeprowadzono badań nad wpływem produktu leczniczego na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu. W przypadku wystąpienia zaburzeń widzenia nie należy prowadzić pojazdów ani obsługiwać urządzeń mechanicznych. 4.8 Działania niepożądane Częstości występowania wymienionych poniżej działań niepożądanych określono na podstawie badań klinicznych z udziałem 3250 pacjentów stosujących bromek ipratropiowy. Zaobserwowane działania niepożądane pogrupowano według układów i narządów oraz częstości występowania: Bardzo często ( 1/10) Często ( 1/100 do <1/10) Niezbyt często ( 1/1000 do <1/100) Rzadko ( 1/ do <1/1000) Bardzo rzadko (<1/10 000) Zaburzenia układu immunologicznego Niezbyt często: pokrzywka. Rzadko: reakcja anafilaktyczna, obrzęk naczynioruchowy języka, warg oraz twarzy. Zaburzenia układu nerwowego Często: ból głowy, zawroty głowy. Zaburzenia oka Niezbyt często: zaburzenia akomodacji oka, jaskra z wąskim kątem przesączania. Rzadko: wzrost ciśnienia śródgałkowego, ból oka, rozszerzenie źrenic. Zaburzenia serca Niezbyt często: tachykardia. Rzadko: kołatanie serca, częstoskurcz nadkomorowy, migotanie przedsionków. Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Często: kaszel, miejscowe podrażnienie, skurcz oskrzeli wywołany inhalacją. Rzadko: skurcz krtani. Zaburzenia żołądka i jelit Często: suchość błony śluzowej jamy ustnej, wymioty, zaburzenia motoryki przewodu pokarmowego (zaparcia, biegunka). Rzadko: nudności. 3
4 Zaburzenia skóry i tkanki podskórnej Niezbyt często: wysypka, świąd. Zaburzenia nerek i dróg moczowych Rzadko: zatrzymanie moczu (ryzyko zatrzymania moczu jest zwiększone u pacjentów ze zwężeniem szyi pęcherza moczowego). 4.9 Przedawkowanie Nie odnotowano żadnych specyficznych objawów związanych z przedawkowaniem. Biorąc pod uwagę szeroki indeks terapeutyczny i miejscowe podawanie produktu leczniczego, nie powinny wystąpić żadne ciężkie objawy działania przeciwcholinergicznego. Jak w przypadku inny leków działających przeciwcholinergiczne, mogą wystąpić: suchość błony śluzowej jamy ustnej, zaburzenia akomodacji oka oraz tachykardia. Objawy te mogą świadczyć o przedawkowaniu. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Inne leki stosowane w obturacyjnych chorobach dróg oddechowych podawane drogą wziewną. Leki przeciwcholinergiczne. Kod ATC: R 03 BB 01 Bromek ipratropiowy jest czwartorzędowym związkiem amoniowym o właściwościach przeciwcholinergicznych. W badaniach przedklinicznych wykazano, iż bromek ipratropiowy hamuje odruchy przewodzone drogą nerwu błędnego, przez działanie antagonistyczne w stosunku do acetylocholiny przekaźnika uwalnianego z nerwu błędnego. Leki o działaniu przeciwcholinergicznym zapobiegają zwiększeniu stężenia wewnątrzkomórkowego cyklicznego guanozynomonofosforanu (cgmp) w następstwie oddziaływania acetylocholiny na receptory muskarynowe w mięśniach gładkich oskrzeli. Rozszerzenie oskrzeli w następstwie inhalacji produktu leczniczego Steri-Neb Ipratropium jest wywołane miejscowym stężeniem leku, wystarczającym do wywołania działania przeciwcholinergicznego na mięśnie gładkie oskrzeli; nie jest wynikiem działania ogólnoustrojowego leku. Dane z badań przedklinicznych i klinicznych nie wskazują na niekorzystny wpływ leku na wydzielanie śluzu w drogach oddechowych, oczyszczanie rzęskowe oraz wymianę gazową. 5.2 Właściwości farmakokinetyczne Działanie terapeutyczne produktu leczniczego jest wynikiem miejscowego działania substancji czynnej w drogach oddechowych. Po wziewnym zastosowaniu leku, 10 30% dawki, w zależności od stężenia roztworu, urządzenia oraz techniki inhalacji, dostaje się do płuc. Większa część dawki jest połykana i przechodzi przez przewód pokarmowy. W wyniku bardzo małego stopnia wchłaniania bromku ipratropium z przewodu pokarmowego, biodostępność połkniętej dawki wynosi około 2%. Taka część dawki nie ma istotnego wpływu na stężenie substancji czynnej we krwi. Część dawki, która dostała się do płuc, szybko przenika do krwiobiegu (w ciągu kilku minut). Na podstawie danych dotyczących wydalania produktu przez nerki (0 24 godzin) oceniono, że całkowita biodostępność ogólnoustrojowa bromku ipratropiowego (część dawki, która wchłonęła się z płuc i z przewodu pokarmowego) po inhalacji roztworu do nebulizacji wynosi 7 28%. Parametry farmakokinetyczne opisujące dystrybucję bromku ipratropiowego wyliczono na podstawie stężenia w osoczu krwi po podaniu dożylnym. 4
5 Zanotowano szybkie dwufazowe zmniejszanie się stężenia substancji czynnej we krwi. Objętość dystrybucji (V β ) wynosi 338 l (4,6 l/kg). Produkt leczniczy w minimalnym stopniu (mniej niż 20%) wiąże się z białkami osocza. Jon ipratropiowy nie przenika przez barierę krew mózg, co jest związane z amoniową budową jego cząsteczki. Okres półtrwania w końcowej fazie eliminacji wynosi około 1,6 godziny. Całkowity klirens leku wynosi średnio 2,3 l/min. Około 60% ogólnodostępnej dawki jest wydalane na drodze przemian metabolicznych, prawdopodobnie w wątrobie. Główne metabolity stwierdzane w moczu wykazują słabe powinowactwo do receptorów muskarynowych i uważane są za niewykazujące działania biologicznego. Około 40% ogólnodostępnej dawki jest wydalane z moczem zgodnie z określonym klirensem nerkowym wynoszącym 0,9 l/min. Badanie z zastosowaniem substancji znakowanej radioaktywnie wykazało, że 10% dawki bromku ipratropium podanego doustnie jest wchłaniane z przewodu pokarmowego, a następnie metabolizowane. Mniej niż 1% dawki podanej doustnie jest wydalane w postaci niezmienionej przez nerki. 5.3 Przedkliniczne dane o bezpieczeństwie Brak dowodów na działanie rakotwórcze bromku ipratropium. Nie zaobserwowano również działania teratogennego, mutagennego i toksycznego wpływu na płodność myszy, królików i szczurów. Brak innych istotnych danych przedklinicznych mających znaczenie dla lekarza, które nie byłyby podane w innych punktach Charakterystyki Produktu Leczniczego. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Kwas solny, rozcieńczony (1 mol/l) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Brak danych. 6.3 Okres ważności 2 lata. 6.4 Specjalne środki ostrożności przy przechowywaniu Przechowywać w temperaturze poniżej 25ºC, w oryginalnym opakowaniu w celu ochrony przed światłem. 6.5 Rodzaj i zawartość opakowania 20 pojemników z polietylenu (4 blistry miękkie po 5 szt.) zawierających po 1 ml (250 µg) lub 2 ml (500 µg) roztworu umieszczonych w tekturowym pudełku. 6.6 Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania Roztwór do nebulizacji jest jałowy do momentu otwarcia. Produkt leczniczy może być podawany za pomocą dostępnych na rynku nebulizatorów. 5
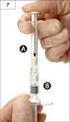
6 Przed użyciem należy dokładnie przeczytać instrukcję użycia nebulizatora. Instrukcja stosowania produktu: 1. Przygotować nebulizator do użycia zgodnie z zaleceniami producenta. 2. Ostrożnie oderwać plastikowy pojemnik od blistra (rys. A). Nigdy nie używać pojemnika, jeśli był uprzednio otwarty. 3. Trzymając pojemnik ostrożnie w pozycji pionowej, otworzyć go przez przekręcenie górnej części pojemnika (rys. B). 4. Jeżeli lekarz nie zaleci inaczej, wycisnąć całą zawartość plastikowego pojemnika do komory nebulizatora (rys. C). 5. Połączyć komorę z nebulizatorem i stosować zgodnie z zaleceniami lekarza. 6. Po użyciu umyć nebulizator zgodnie z zaleceniami producenta. Istotne jest, by utrzymywać nebulizator w czystości. Ponieważ pojemniki z lekiem nie zawierają środków konserwujących, istotne jest, aby zużyć zawartość natychmiast po otwarciu oraz użyć nowego opakowania przy każdym podaniu leku w celu uniknięcia zanieczyszczeń drobnoustrojami. Częściowo zużyte, otwarte lub uszkodzone opakowania zawierające pojedyncze dawki leku należy wyrzucić. Roztwór pozostały w komorze nebulizatora należy wylać. Instrukcja użytkowania znajduje się również w ulotce dla pacjenta dołączonej do każdego opakowania produktu leczniczego. Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Teva Pharmaceuticals Polska Sp. z o.o. ul. Emilii Plater Warszawa Polska 8. NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA r.; r.; r. 6
7 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
ATROVENT, 0,25 mg/ml, płyn do inhalacji z nebulizatora Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, płyn do inhalacji z nebulizatora Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, płyn do inhalacji z nebulizatora Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
ATROVENT, 0,25 mg/ml, roztwór do nebulizacji Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, roztwór do nebulizacji Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, roztwór do nebulizacji Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
Ulotka dołączona do opakowania: informacja dla pacjenta. ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol wziewny, roztwór Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol wziewny, roztwór Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol wziewny, roztwór Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ambrotaxer, 15 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 15 mg ambroksolu chlorowodorku. Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ambrotaxer, 15 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 15 mg ambroksolu chlorowodorku. Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
1. CO TO JEST BERODUAL I W JAKIM CELU SIĘ GO STOSUJE
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Berodual (0,5 mg + 0,25 mg)/ml roztwór do nebulizacji Fenoteroli hydrobromidum + Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Berodual (0,5 mg + 0,25 mg)/ml roztwór do nebulizacji Fenoteroli hydrobromidum + Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrovent, 0,25 mg/ml, płyn do inhalacji z nebulizatora 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml (20 kropli) płynu do inhalacji z nebulizatora
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrovent, 0,25 mg/ml, płyn do inhalacji z nebulizatora 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml (20 kropli) płynu do inhalacji z nebulizatora
Skrócona informacja o leku Spiriva Nazwa produktu leczniczego, dawka i postać farmaceutyczna:
 Skrócona informacja o leku Spiriva Nazwa produktu leczniczego, dawka i postać farmaceutyczna: SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych. Każda kapsułka zawiera 18 mikrogramów
Skrócona informacja o leku Spiriva Nazwa produktu leczniczego, dawka i postać farmaceutyczna: SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych. Każda kapsułka zawiera 18 mikrogramów
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATROPINUM SULFURICUM WZF 1%, 10 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg Atropini sulfas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATROPINUM SULFURICUM WZF 1%, 10 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg Atropini sulfas
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrovent, 0,25 mg/ml, roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml (20 kropli) roztworu do nebulizacji zawiera 261 mikrogramów
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrovent, 0,25 mg/ml, roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml (20 kropli) roztworu do nebulizacji zawiera 261 mikrogramów
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miodowo-pomarańczowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera 3 mg benzydaminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miodowo-pomarańczowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera 3 mg benzydaminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
Ulotka dołączona do opakowania: informacja dla pacjenta. Atrodil, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta Atrodil, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Atrodil, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Iprixon Neb, (0,5 mg + 2,5 mg)/2,5 ml, roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułka 2,5 ml zawiera 0,5 mg ipratropiowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Iprixon Neb, (0,5 mg + 2,5 mg)/2,5 ml, roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułka 2,5 ml zawiera 0,5 mg ipratropiowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: czerwień koszenilowa (E 124), metylu parahydroksybenzoesan, sód.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO XYLOMETAZOLIN WZF, 0,05%, 0,5 mg/ml, krople do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,5 mg ksylometazoliny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO XYLOMETAZOLIN WZF, 0,05%, 0,5 mg/ml, krople do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,5 mg ksylometazoliny
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum Plus (525 mg + 60 mg + 20 mg)/g, roztwór do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g roztworu do kąpieli zawiera 525 mg parafiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum Plus (525 mg + 60 mg + 20 mg)/g, roztwór do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g roztworu do kąpieli zawiera 525 mg parafiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924 mg butamiratu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Supremin MAX, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 1,5 mg butamiratu cytrynianu (Butamirati citras).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Supremin MAX, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 1,5 mg butamiratu cytrynianu (Butamirati citras).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrovent N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 odmierzona dawka (rozpylenie)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrovent N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 odmierzona dawka (rozpylenie)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrodil, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka inhalacyjna zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Atrodil, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka inhalacyjna zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Lunapret 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Lunapret 1 1. NAZWA PRODUKTU LECZNICZEGO Lunapret Valerianae radicis extractum siccum + Lupuli strobili extractum siccum tabletki powlekane, 250 mg + 60 mg 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Lunapret 1 1. NAZWA PRODUKTU LECZNICZEGO Lunapret Valerianae radicis extractum siccum + Lupuli strobili extractum siccum tabletki powlekane, 250 mg + 60 mg 2. SKŁAD
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miętowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 pastylka zawiera 3 mg benzydaminy chlorowodorku (Benzydamini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miętowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 pastylka zawiera 3 mg benzydaminy chlorowodorku (Benzydamini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamina o smaku miętowym, 4 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 4 mg bromoheksyny chlorowodorku (Bromhexini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamina o smaku miętowym, 4 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 4 mg bromoheksyny chlorowodorku (Bromhexini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu (Clotrimazolum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fungotac 10 mg/ml, krople do uszu, roztwór. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fungotac 10 mg/ml, krople do uszu, roztwór. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux Forte, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 200 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux Forte, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 200 mg trimebutyny maleinianu (Trimebutini maleas).
LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
3. POSTAĆ FARMACEUTYCZNA
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Envil kaszel, 30 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 30 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Envil kaszel, 30 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 30 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rivel, 5 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 5 mg mleczanu etakrydyny (Ethacridini lactas). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rivel, 5 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 5 mg mleczanu etakrydyny (Ethacridini lactas). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ventolin, 1 mg/ml (0,1%), roztwór do nebulizacji Ventolin, 2 mg/ml (0,2%), roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ventolin, 1 mg/ml (0,1%), roztwór do nebulizacji Ventolin, 2 mg/ml (0,2%), roztwór do nebulizacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TROPICAMIDUM WZF 1%, 10 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg tropikamidu (Tropicamidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TROPICAMIDUM WZF 1%, 10 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg tropikamidu (Tropicamidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: alkohol cetostearylowy, glikol propylenowy, kwas benzoesowy.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO DAKTARIN 20 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g kremu zawiera 20 mg azotanu mikonazolu (Miconazoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO DAKTARIN 20 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g kremu zawiera 20 mg azotanu mikonazolu (Miconazoli
Skrócona informacja o leku Spiolto Respimat
 Produkt leczniczy Spiolto Respimat jest dodatkowo monitorowany. W celu uzyskania dodatkowych informacji proszę zapoznać się z Charakterystyką Produktu Leczniczego. Skrócona informacja o leku Spiolto Respimat
Produkt leczniczy Spiolto Respimat jest dodatkowo monitorowany. W celu uzyskania dodatkowych informacji proszę zapoznać się z Charakterystyką Produktu Leczniczego. Skrócona informacja o leku Spiolto Respimat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani hydrobromidum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TUSSIDEX, 30 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TUSSIDEX, 30 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 0,15 mg polisulfonianu sodowego azapentacenu (Azapentaceni natrii polysulfonas).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO QUINAX, 0,15 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,15 mg polisulfonianu sodowego azapentacenu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO QUINAX, 0,15 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,15 mg polisulfonianu sodowego azapentacenu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 550 mikrogramów ksylometazoliny chlorowodorku (Xylometazolini hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Xylorin, 550 μg/ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 550 mikrogramów ksylometazoliny chlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Xylorin, 550 μg/ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 550 mikrogramów ksylometazoliny chlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Berodual (0,5 mg + 0,25 mg)/ml roztwór do nebulizacji Fenoteroli hydrobromidum + Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika Berodual (0,5 mg + 0,25 mg)/ml roztwór do nebulizacji Fenoteroli hydrobromidum + Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Envil katar, (1,5 mg + 2,5 mg)/ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml aerozolu do nosa zawiera 1,5 mg mepiraminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Envil katar, (1,5 mg + 2,5 mg)/ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml aerozolu do nosa zawiera 1,5 mg mepiraminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Histigen, 8 mg, tabletki Histigen, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Histigen: jedna tabletka zawiera 8 mg dichlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Histigen, 8 mg, tabletki Histigen, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Histigen: jedna tabletka zawiera 8 mg dichlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ambroxoli hydrochloridum Fontane, 15 mg/5 ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu doustnego zawiera 3 mg ambroksolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ambroxoli hydrochloridum Fontane, 15 mg/5 ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu doustnego zawiera 3 mg ambroksolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Steri-neb Salamol, 1 mg/ml (2,5 mg/2,5 ml), roztwór do nebulizacji Steri-neb Salamol, 2 mg/ml (5 mg/2,5 ml), roztwór do nebulizacji 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Steri-neb Salamol, 1 mg/ml (2,5 mg/2,5 ml), roztwór do nebulizacji Steri-neb Salamol, 2 mg/ml (5 mg/2,5 ml), roztwór do nebulizacji 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucoangin, 20 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucoangin, 20 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Steri-Neb Salamol 1 mg/ml (2,5 mg/2,5 ml), roztwór do nebulizacji 2 mg/ml (5 mg/2,5 ml), roztwór do nebulizacji Salbutamoli sulfas Należy zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Steri-Neb Salamol 1 mg/ml (2,5 mg/2,5 ml), roztwór do nebulizacji 2 mg/ml (5 mg/2,5 ml), roztwór do nebulizacji Salbutamoli sulfas Należy zapoznać
Objawowe leczenie suchego, drażniącego kaszlu różnego pochodzenia.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussicalin, 7,5 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu. Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussicalin, 7,5 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu. Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tribux, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 5 1. NAZWA PRODUKTU LECZNICZEGO CHLORCHINALDIN, 30 mg/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 30 mg chlorchinaldolu (Chlorquinaldolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 5 1. NAZWA PRODUKTU LECZNICZEGO CHLORCHINALDIN, 30 mg/g, maść 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g maści zawiera 30 mg chlorchinaldolu (Chlorquinaldolum).
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Septolux Max, 3 mg/ml, aerozol do stosowania w jamie ustnej, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septolux Max, 3 mg/ml, aerozol do stosowania w jamie ustnej, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden mililitr aerozolu zawiera 3
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septolux Max, 3 mg/ml, aerozol do stosowania w jamie ustnej, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden mililitr aerozolu zawiera 3
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Linomag 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Linomag płyn (Lini oleum virginale 3:1) - 200 mg/g 3. POSTAĆ FARMACEUTYCZNA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Linomag 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Linomag płyn (Lini oleum virginale 3:1) - 200 mg/g 3. POSTAĆ FARMACEUTYCZNA
CLEMASTINUM HASCO (Clemastinum) 1 mg, tabletki
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nizoral, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nizoral, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vertix, 8 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 8 mg betahistyny dichlorowodorku. Jedna tabletka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vertix, 8 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 8 mg betahistyny dichlorowodorku. Jedna tabletka zawiera
