CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Dominika Chmiel
- 9 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Srivasso, 18 µg, proszek do inhalacji w kapsułce twardej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 22,5 mikrograma bromku tiotropiowego jednowodnego, co odpowiada 18 mikrogramom tiotropium. Dawka dostarczona (uwalniana z ustnika aparatu do inhalacji HandiHaler) zawiera 10 mikrogramów tiotropium. Substancja pomocnicza o znanym działaniu: Jedna kapsułka zawiera około 5,5 miligrama laktozy (jednowodnej). Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek do inhalacji w kapsułkach twardych. Jasnozielone kapsułki twarde zawierające proszek do inhalacji. Na każdej kapsułce nadrukowany jest kod produktu TI 01 i nadrukowane jest logo firmy. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Tiotropium jest wskazany jako lek rozszerzający oskrzela w leczeniu podtrzymującym w celu złagodzenia objawów u pacjentów z przewlekłą obturacyjną chorobą płuc (POChP). 4.2 Dawkowanie i sposób podawania Dawkowanie Ten produkt leczniczy jest przeznaczony wyłącznie do stosowania wziewnego. Zaleca się inhalację zawartości jednej kapsułki (bromek tiotropiowy) raz na dobę, o tej samej porze każdego dnia, za pomocą aparatu do inhalacji HandiHaler. Nie należy stosować dawki większej niż zalecana. Kapsułki zawierające bromek tiotropiowy mogą być stosowane tylko wziewnie. Nie stosować doustnie. Kapsułek zawierających bromek tiotropiowy nie należy połykać. Bromek tiotropiowy może być inhalowany wyłącznie za pomocą aparatu do inhalacji HandiHaler. Szczególne grupy pacjentów Pacjenci w podeszłym wieku mogą stosować bromek tiotropiowy w zalecanej dawce. Pacjenci z zaburzeniami czynności nerek mogą stosować bromek tiotropiowy w zalecanej dawce. Pacjenci z umiarkowanymi do ciężkich zaburzeniami czynności nerek (klirens kreatyniny 50 ml/min), patrz punkt 4.4 i punkt 5.2. Pacjenci z zaburzeniami czynności wątroby mogą stosować bromek tiotropiowy w zalecanej dawce (patrz punkt 5.2). 1
2 Dzieci i młodzież POChP Produkt leczniczy nie ma zastosowania u dzieci i młodzieży (poniżej 18 lat) we wskazaniu podanym w punkcie 4.1. Mukowiscydoza Nie określono bezpieczeństwa stosowania i skuteczności produktu leczniczego Srivasso u dzieci i młodzieży. Brak dostępnych danych. Sposób podawania Aby zapewnić właściwy sposób podawania produktu leczniczego, lekarz lub inny pracownik służby zdrowia powinien przeszkolić pacjenta w zakresie prawidłowego stosowania inhalatora. Instrukcja użycia i obsługi aparatu do inhalacji Należy dokładnie przestrzegać zaleceń lekarza dotyczących stosowania leku Srivasso. Aparat do inhalacji HandiHaler jest dostosowany tylko do kapsułek leku Srivasso. Nie należy go używać do podawania innych leków. Aparat do inhalacji HandiHaler można używać przez okres jednego roku. Aparat do inhalacji HandiHaler: 1 Osłona górna 2 Ustnik 3 Obudowa z okienkiem 4 Przycisk przekłuwający 5 Komora centralna 1. Aby otworzyć osłonę górną, należy wcisnąć całkowicie przycisk przekłuwający, a następnie go puścić. 2. Należy otworzyć osłonę górną aparatu do inhalacji, odciągając ją do góry. Następnie należy podnieść do góry ustnik. 2
3 3. Bezpośrednio przed użyciem należy wyjąć kapsułkę leku Srivasso z blistra (patrz punkt Wyjmowanie kapsułki z blistra ) i umieścić ją w komorze centralnej (5) w sposób pokazany na rysunku. Nie ma znaczenia, którym końcem kapsułka zostanie wprowadzona do komory. 4. Zamknąć dokładnie ustnik, zatrzaskując go. Osłonę górną pozostawić otwartą. 5. Trzymając aparat do inhalacji HandiHaler z ustnikiem skierowanym ku górze, należy nacisnąć jeden raz do końca przycisk przekłuwający, a następnie go zwolnić. Kapsułka zostanie przekłuta, a lek przygotowany do inhalacji. 6. Wykonać głęboki wydech. Ważne: Nigdy nie należy wydychać powietrza przez ustnik. 7. Przyłożyć aparat do inhalacji HandiHaler do ust, szczelnie zacisnąć wargi wokół ustnika. Trzymając głowę w pozycji pionowej, wykonać powolny i głęboki wdech tak, aby słyszeć lub poczuć wibrację kapsułki. Nabrać jak najwięcej powietrza do płuc. Następnie wstrzymać oddech tak długo, jak długo nie stwarza to dyskomfortu, jednocześnie wyjąć aparat do inhalacji HandiHaler z ust. Powrócić do normalnego oddychania. Powtórzyć jeszcze jeden raz czynności opisane w punktach 6 i 7; pozwoli to na całkowite opróżnienie kapsułki. 8. Otworzyć ponownie ustnik. Usunąć pustą kapsułkę z inhalatora i wyrzucić ją. W czasie kiedy aparat do inhalacji HandiHaler nie jest używany, ustnik i osłona górna powinny być zamknięte. 3
4 Czyszczenie aparatu do inhalacji HandiHaler Aparat do inhalacji HandiHaler należy myć raz w miesiącu. Otworzyć osłonę górną i ustnik. Następnie unosząc przycisk przekłuwający, otworzyć obudowę z okienkiem. Usunąć resztki proszku, przemywając cały aparat do inhalacji ciepłą wodą. Strząsnąć nadmiar wody, po czym pozostawić otwarty aparat do inhalacji na powietrzu, na papierowym ręczniku do wysuszenia. Do całkowitego wysuszenia potrzeba około 24 godzin. Najlepiej więc umyć aparat do inhalacji natychmiast po użyciu tak, aby był gotowy do podania następnej dawki. Jeżeli to konieczne, zewnętrzną część ustnika można przetrzeć wilgotną, lecz nie mokrą ściereczką. Wyjmowanie kapsułki z blistra A. Oddzielić paski blistra, przerywając wzdłuż perforacji. B. Odciągnąć folię (tuż przed użyciem), aż odsłoni się jedna kapsułka. Jeżeli przez przypadek odsłoni się druga kapsułka w blistrze, należy ją wyrzucić. C. Wyjąć kapsułkę. Kapsułka leku Srivasso zawiera tylko niewielką ilość proszku do inhalacji, w związku z tym jest ona wypełniona tylko częściowo. 4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 lub atropinę lub jej pochodne, takie jak ipratropium czy oksytropium. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Bromku tiotropiowego, jako leku rozszerzającego oskrzela przeznaczonego do stosowania raz na dobę w terapii podtrzymującej, nie należy stosować w doraźnym leczeniu ostrych napadów skurczu oskrzeli. Po zastosowaniu bromku tiotropiowego w postaci proszku do inhalacji mogą wystąpić natychmiastowe reakcje nadwrażliwości. 4
5 Podobnie jak w przypadku innych leków przeciwcholinergicznych, należy zachować ostrożność podczas stosowania bromku tiotropiowego u pacjentów z jaskrą z wąskim kątem przesączania, rozrostem gruczołu krokowego lub niedrożnością szyi pęcherza moczowego (patrz punkt 4.8). Leki stosowane wziewnie mogą powodować skurcz oskrzeli wywołany inhalacją. Ponieważ stężenie leku w osoczu krwi zwiększa się wraz ze zmniejszaniem się czynności nerek, u pacjentów z umiarkowanymi do ciężkich zaburzeniami czynności nerek (klirens kreatyniny 50 ml/min) bromek tiotropiowy należy stosować jedynie w przypadku, gdy spodziewana korzyść dla pacjenta przewyższa potencjalne ryzyko. Brak długoterminowego doświadczenia dotyczącego stosowania bromku tiotropiowego u pacjentów z ciężkimi zaburzeniami czynności nerek (patrz punkt 5.2). Nie wolno dopuścić, aby podczas inhalacji bromek tiotropiowy dostał się do oczu. Pacjenta należy uprzedzić, że może to spowodować wystąpienie lub zaostrzenie objawów jaskry z wąskim kątem przesączania, ból oka lub dyskomfort, przemijające niewyraźne widzenie, widzenie tęczowej obwódki wokół źródła światła lub zmienione widzenie kolorów, jednocześnie z zaczerwienieniem oczu wywołanym przekrwieniem spojówek i obrzękiem rogówki. W przypadku wystąpienia któregokolwiek z tych objawów pacjent powinien przerwać stosowanie bromku tiotropiowego i niezwłocznie skonsultować się z lekarzem specjalistą. Suchość błony śluzowej jamy ustnej obserwowana w trakcie leczenia przeciwcholinergicznego może po dłuższym czasie powodować próchnicę zębów. Bromku tiotropiowego nie należy stosować częściej niż raz na dobę (patrz punkt 4.9). Kapsułka produktu Srivasso zawiera 5,5 mg laktozy jednowodnej. Taka ilość nie powoduje zazwyczaj problemów u pacjentów z nietolerancją laktozy. Pacjenci z rzadko występujacą, dziedziczną nietolerancją galaktozy, niedoborem laktozy typu Lapp lub zespołem złego wchłaniania glukozy-galaktozy nie powinni stosować tego produktu. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Chociaż nie przeprowadzono badań dotyczących interakcji leku, podawanie bromku tiotropiowego w postaci proszku do inhalacji równocześnie z innymi lekami często stosowanymi w leczeniu POChP, takimi jak: sympatykomimetyki rozszerzające oskrzela, metyloksantyny, steroidy doustne i wziewne, nie powodowało wystąpienia klinicznie istotnych interakcji lekowych. Jednoczesne podawanie bromku tiotropiowego i innych leków zawierających substancje o działaniu przeciwcholinergicznym nie było badane i w związku z tym nie jest zalecane. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Brak udokumentowanych danych klinicznych dotyczących stosowania bromku tiotropiowego u kobiet w ciąży. Badania na zwierzętach wykazały toksyczny wpływ na reprodukcję w połączeniu z toksycznością dla matki (patrz punkt 5.3). Zagrożenie dla ludzi nie jest znane. Produktu Srivasso nie należy stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne. Karmienie piersią Nie wiadomo, czy bromek tiotropiowy przenika do mleka kobiecego. Pomimo że wyniki badań przeprowadzonych w okresie laktacji u gryzoni wskazują, że tylko niewielkie ilości bromku tiotropiowego przenikają do mleka, stosowanie produktu leczniczego Srivasso w okresie karmienia piersią nie jest zalecane. Bromek tiotropiowy jest substancją o długim działaniu. Decyzję o kontynuowaniu lub przerwaniu 5
6 karmienia piersią, bądź też o kontynuowaniu lub przerwaniu stosowania produktu leczniczego Srivasso, należy podjąć, biorąc pod uwagę korzyści dla dziecka wynikające z karmienia piersią oraz korzyści dla matki wynikające ze stosowania produktu leczniczego. Płodność Brak danych klinicznych dla tiotropium dotyczących płodności. Badanie przedkliniczne z zastosowaniem tiotropium nie wykazało negatywnego wpływu na płodność (patrz punkt 5.3). 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jeżeli wystąpią zawroty głowy, niewyraźne widzenie lub ból głowy, nie należy prowadzić pojazdów ani obsługiwać maszyn. 4.8 Działania niepożądane Podsumowanie profilu bezpieczeństwa Wiele z wymienionych działań niepożądanych związanych jest z przeciwcholinergicznym działaniem produktu Srivasso. Tabelaryczne zestawienie działań niepożądanych Częstość działań niepożądanych wymienionych poniżej została oszacowana na podstawie częstości działań niepożądanych (tj. działań przypisanych tiotropium) zaobserwowanych w grupie 9647 pacjentów przyjmujących tiotropium w trakcie 28 łącznie analizowanych badań klinicznych, kontrolowanych placebo, z okresem leczenia od czterech tygodni do czterech lat. Częstość występowania została określona na podstawie następującej konwencji: Bardzo często ( 1/10); często ( 1/100 do < 1/10); niezbyt często ( 1/1000 do < 1/100); rzadko ( 1/ do < 1/1000); bardzo rzadko (< 1/10 000); częstość nieznana* (częstość nie może być określona na podstawie dostępnych danych). Klasyfikacja układów i narządów (wg terminologii MedDRA) Zaburzenia metabolizmu i odżywiania Odwodnienie Zaburzenia układu nerwowego Zawroty głowy Ból głowy Zaburzenia smaku Bezsenność Zaburzenia oka Niewyraźne widzenie Jaskra Zwiększone ciśnienie wewnątrzgałkowe Zaburzenia serca Migotanie przedsionków Częstoskurcz nadkomorowy Tachykardia Kołatanie serca Częstość występowania Częstość nieznana 6
7 Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Zapalenie gardła Dysfonia Kaszel Skurcz oskrzeli Krwawienie z nosa Zapalenie krtani Zapalenie zatok Zaburzenia żołądka i jelit Suchość błony śluzowej jamy ustnej Choroba refluksowa przełyku Zaparcia Kandydoza jamy ustnej i gardła Niedrożność jelit, w tym porażenna niedrożność jelit Zapalenie dziąseł Zapalenie języka Dysfagia Zapalenie jamy ustnej Nudności Próchnica zębów Zaburzenia skóry i tkanki podskórnej, zaburzenia układu immunologicznego Wysypka Pokrzywka Świąd Nadwrażliwość, w tym reakcje natychmiastowe Obrzęk naczynioruchowy Reakcje anafilaktyczne Zakażenia lub owrzodzenia skórne Suchość skóry Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Obrzęk stawów Zaburzenia nerek i dróg moczowych Bolesne lub utrudnione oddawanie moczu Zatrzymanie moczu Zakażenie układu moczowego Często Częstość nieznana Częstość nieznana Częstość nieznana Częstość nieznana Częstość nieznana Opis wybranych działań niepożądanych Najczęściej obserwowanymi działaniami niepożądanymi w kontrolowanych badaniach klinicznych były działania związane z przeciwcholinergicznym działaniem produktu, takie jak suchość błony śluzowej jamy ustnej, która pojawiła się u około 4% pacjentów. W 28 badaniach klinicznych suchość błony śluzowej jamy ustnej była przyczyną przerwania leczenia u 18 z 9647 pacjentów przyjmujących tiotropium (0,2%). Do ciężkich działań niepożądanych związanych z przeciwcholinergicznym działaniem produktu należą: jaskra, zaparcia, niedrożność jelit, w tym porażenna niedrożność jelit oraz zatrzymanie moczu. 7
8 Inne szczególne grupy pacjentów Częstość występowania objawów związanych z przeciwcholinergicznym działaniem produktu może zwiększać się z wiekiem. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181 C, Warszawa, tel: , faks: ; ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Podawanie dużych dawek bromku tiotropiowego może prowadzić do wystąpienia przedmiotowych i podmiotowych objawów związanych z przeciwcholinergicznym działaniem leku. Po podaniu zdrowym ochotnikom do 340 mikrogramów bromku tiotropiowego w pojedynczej dawce wziewnej nie zaobserwowano jednak działań niepożądanych związanych z ogólnoustrojowym działaniem przeciwcholinergicznym. Poza tym, po zastosowaniu u zdrowych ochotników bromku tiotropiowego w dawce do 170 mikrogramów na dobę przez 7 dni, nie zanotowano żadnych istotnych działań niepożądanych, z wyjątkiem suchości błony śluzowej jamy ustnej. W badaniu z zastosowaniem wielokrotnych dawek u pacjentów z POChP, przy maksymalnej dawce dobowej wynoszącej 43 mikrogramy bromku tiotropiowego, stosowanej przez cztery tygodnie, nie zanotowano znaczących działań niepożądanych. Ostre zatrucie po nieumyślnym spożyciu doustnym bromku tiotropiowego w kapsułkach jest mało prawdopodobne ze względu na małą biodostępność po podaniu doustnym. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Inne leki stosowane w chorobach obturacyjnych dróg oddechowych podawane drogą wziewną, leki przeciwcholinergiczne, kod ATC: R03B B04 Mechanizm działania Bromek tiotropiowy jest długo działającym, wybiórczym antagonistą receptorów muskarynowych, w medycynie klinicznej określanym jako lek przeciwcholinergiczny. Poprzez wiązanie się z receptorami muskarynowymi w mięśniówce gładkiej oskrzeli bromek tiotropiowy hamuje cholinergiczne (zwężające oskrzela) działanie acetylocholiny wydzielanej na zakończeniach nerwów przywspółczulnych. Wykazuje on podobne powinowactwo do poszczególnych podtypów receptora muskarynowego (od M1 do M5). Bromek tiotropiowy, działając jako kompetycyjny i odwracalny antagonista receptorów M3 w drogach oddechowych, powoduje rozszerzenie oskrzeli. Działanie to jest zależne od dawki i utrzymuje się ponad 24 godziny. Długotrwałe działanie jest prawdopodobnie spowodowane bardzo powolną dysocjacją cząsteczki produktu od receptora M3, przy czym okres połowicznej dysocjacji jest znacznie dłuższy w porównaniu z ipratropium. Jako lek przeciwcholinergiczny o strukturze N-czwartorzędowej bromek tiotropiowy stosowany wziewnie odznacza się wybiórczym, miejscowym działaniem na oskrzela. Stężenia terapeutyczne, przy których nie występują ogólnoustrojowe objawy działania przeciwcholinergicznego, mieszczą się w dopuszczalnym zakresie. Działanie farmakodynamiczne 8
9 Rozszerzenie oskrzeli jest wynikiem działania miejscowego (w drogach oddechowych), a nie ogólnoustrojowego. Dysocjacja tiotropium od receptora M2 jest szybsza niż w przypadku receptora M3, czego przejawem w czynnościowych badaniach in vitro była (kinetycznie zależna) selektywność podtypu receptora M3 względem M2. Duża siła działania i wolna dysocjacja od receptora znalazły swoje kliniczne odzwierciedlenie w postaci znaczącego i długotrwałego działania rozszerzającego oskrzela u pacjentów z POChP. Elektrofizjologia serca Elektrofizjologia: W badaniu dotyczącym wpływu na odstęp QT z udziałem 53 zdrowych ochotników produkt Srivasso podawany w dawkach 18 μg oraz 54 μg (tj. dawka trzykrotnie większa od dawki terapeutycznej) przez 12 dni nie powodował znaczącego wydłużenia odstępu QT w zapisie EKG. Skuteczność kliniczna i bezpieczeństwo stosowania Zasadniczy program fazy klinicznej obejmował cztery roczne i dwa półroczne badania z randomizacją i podwójnie ślepą próbą, z udziałem 2663 pacjentów (1308 otrzymywało bromek tiotropiowy). Program roczny obejmował dwa badania z kontrolą placebo i dwa z kontrolą aktywną (ipratropium). Dwa badania trwające 6 miesięcy przeprowadzono z kontrolą placebo i salmeterolu. W badaniach tych oceniano czynność płuc i istotne dla zdrowia wskaźniki, takie jak: duszność, występowanie zaostrzeń choroby i jakość życia związaną ze stanem zdrowia. W wyżej wymienionych badaniach zastosowanie bromku tiotropiowego raz na dobę pozwalało uzyskać znaczącą poprawę czynności płuc (natężona objętość wydechowa pierwszosekundowa FEV1 i natężona pojemność życiowa FVC) w ciągu 30 minut po podaniu pierwszej dawki. Działanie to utrzymywało się przez 24 godziny. Farmakodynamiczny stan stacjonarny uzyskiwano w ciągu jednego tygodnia, przy czym najsilniejsze działanie rozszerzające oskrzela obserwowano trzeciego dnia. Podanie bromku tiotropiowego powodowało znaczącą poprawę porannych i wieczornych wyników pomiaru PEFR (szczytowy przepływ wydechowy), ustaloną na podstawie codziennych zapisów pacjenta. Działanie rozszerzające oskrzela bromku tiotropiowego utrzymywało się przez okres jednego roku podawania leku, bez objawów tachyfilaksji. Badanie kliniczne z randomizacją, kontrolowane placebo przeprowadzone u 105 pacjentów z POChP wykazało, że, w porównaniu do placebo, działanie rozszerzające oskrzela utrzymywało się przez 24 godziny (okres pomiędzy kolejnymi dawkami), niezależnie od tego, czy lek był podany rano, czy wieczorem. W badaniach długoterminowych (trwających 6 miesięcy i rok) wykazano istotne dla zdrowia skutki działania bromku tiotropiowego. Bromek tiotropiowy powodował znaczącą poprawę u pacjentów z dusznością (jak oceniono z zastosowaniem Transition Dyspnea Index). Poprawa ta utrzymywała się przez cały okres leczenia. W dwóch badaniach klinicznych z randomizacją i podwójnie ślepą próbą, kontrolowanych placebo z udziałem 433 pacjentów z umiarkowaną do ciężkiej postacią POChP badano wpływ zmniejszenia uczucia duszności na tolerancję wysiłku. W badaniach tych wykazano, że przyjmowanie produktu Srivasso przez 6 tygodni znacząco poprawiło ograniczony z powodu choroby czas tolerancji wysiłku. W czasie ergometrii rowerowej przy 75% maksymalnym obciążeniu osiągnięto wynik 19,7% (badanie A: 640 sekund w grupie przyjmującej produkt Srivasso w porównaniu do 535 sekund w grupie przyjmującej placebo, przy wyjściowym wyniku 492 sekund) i 28,3% (badanie B: 741 sekund w grupie przyjmującej produkt Srivasso w porównaniu do 577 sekund w grupie przyjmującej placebo, przy wyjściowym wyniku 537 sekund). W badaniu klinicznym z randomizacją i podwójnie ślepą próbą, kontrolowanym placebo, z udziałem 1829 pacjentów z umiarkowaną do bardzo ciężkiej postacią POChP wykazano, że bromek tiotropiowy statystycznie znamiennie zmniejsza odsetek pacjentów, u których wystąpiły zaostrzenia POChP (32,2% do 27,8%) oraz statystycznie znamiennie zmniejsza liczbę zaostrzeń o 19% (1,05 do 0,85 zdarzeń w przeliczeniu na pacjenta na rok stosowania produktu leczniczego). Ponadto 7% pacjentów przyjmujących bromek tiotropiowy i 9,5% pacjentów z grupy placebo było hospitalizowanych z powodu zaostrzeń POChP 9
10 (p = 0,056). Liczba hospitalizacji z powodu POChP zmniejszyła się o 30% (0,25 do 0,18 zdarzeń w przeliczeniu na pacjenta na rok stosowania produktu leczniczego). W trwającym dziewięć miesięcy podwójnie ślepym badaniu klinicznym z randomizacją oraz kontrolą placebo z udziałem 492 pacjentów produkt leczniczy Srivasso poprawił jakość życia związaną ze stanem zdrowia, jak wykazano za pomocą kwestionariusza St. George s Respiratory Questionnaire (SGRQ) na podstawie punktacji ogólnej. Odsetek pacjentów przyjmujących produkt leczniczy Srivasso, którzy uzyskali znaczącą poprawę w zakresie ogólnej punktacji SGRQ (to znaczy więcej niż 4 jednostki), był o 10,9% wyższy w porównaniu z placebo (59,1% w grupie stosującej produkt Srivasso w porównaniu z 48,2% w grupie placebo (p=0,029). Średnia różnica między grupami wyniosła 4,19 jednostki (p = 0,001; przedział ufności: 1,69 6,68).Poprawa poddomen w punktacji SGRQ wyniosła 8,19 jednostki dla poddomeny objawy, 3,91 jednostki dla poddomeny aktywność oraz 3,61 jednostki dla poddomeny wpływ na życie codzienne. Poprawa w każdej z wymienionych poddomen była znamienna statystycznie. W trwającym cztery lata podwójnie ślepym badaniu klinicznym z randomizacją oraz kontrolą placebo z udziałem 5993 pacjentów (3006 pacjentów otrzymywało placebo, a 2987 otrzymywało produkt Srivasso) poprawa FEV1 w wyniku stosowania produktu leczniczego Srivasso, w porównaniu do placebo, utrzymywała się przez czteroletni okres obserwacji. W grupie pacjentów leczonych produktem Srivasso, w porównaniu do grupy placebo, odnotowano wyższy odsetek pacjentów, którzy ukończyli co najmniej 45- miesięczny okres leczenia (63,8% w porównaniu do 55,4%, p < 0,001). Roczne tempo spadku FEV1 było porównywalne dla produktu Srivasso oraz placebo. Podczas leczenia ryzyko zgonu zostało zmniejszone o 16%. Częstość występowania przypadków zgonu wynosiła 4,79 na 100 pacjentów na rok w grupie placebo w porównaniu z 4,10 na 100 pacjentów na rok w grupie tiotropium (współczynnik ryzyka HR tiotropium/placebo wyniósł 0,84; 95% CI = 0,73; 0,97). Leczenie tiotropium zmniejszyło ryzyko niewydolności oddechowej (jak odnotowano na podstawie zgłaszanych działań niepożądanych) o 19% (2,09 w porównaniu do 1,68 przypadku na 100 pacjentów na rok, ryzyko względne tiotropium/placebo wyniosło 0,81; 95% CI = 0,65; 0,999). Roczne randomizowane podwójnie zaślepione i podwójnie maskowane badanie prowadzone w równoległych grupach porównało wpływ leczenia produktem Srivasso raz na dobę do wpływu leczenia salmeterolem 50 mikrogramów HFA pmdi dwa razy na dobę na częstość występowania umiarkowanych i ciężkich zaostrzeń u 7376 pacjentów z POChP i zaostrzeniami przebytymi w okresie ostatniego roku. Tabela 1: Zestawienie punktów końcowych zaostrzeń Punkt końcowy Czas [dni] do pierwszego zaostrzenia Srivasso 18 mikrogramów N = 3707 Salmeterol 50 mikrogramów (HFA pmdi) N = 3669 Współczynnik (95% CI) ,83 (0,77-0,90) Czas do pierwszego ciężkiego zaostrzenia (hospitalizacja) - - 0,72 (0,61-0,85) Pacjenci, u których wystąpiło 1 zaostrzenie, n (%)* Pacjenci, u których wystąpiło 1 ciężkie zaostrzenie (hospitalizacja), n (%)* (34,4) (38,5) 0,90 (0,85-0,95) 262 (7,1) 336 (9,2) 0,77 (0,66-0,89) Wartość p < 0,001 < 0,001 < 0,001 < 0,001 Czas [dni] odnosi się do 1. kwartyla pacjentów. Analizę czasu do zdarzenia przeprowadzono za pomocą modelu proporcjonalnego hazardu Coxa z uwzględnieniem danych z połączonych ośrodków i leczenia jako współzmiennych; współczynnik odnosi się do współczynnika ryzyka. 10
11 Analizę czasu do zdarzenia przeprowadzono za pomocą modelu proporcjonalnego hazardu Coxa z uwzględnieniem danych z połączonych ośrodków i leczenia jako współzmiennych; współczynnik odnosi się do współczynnika ryzyka. Obliczenie czasu [dni] dla 1. kwartyla pacjentów jest niemożliwe, ponieważ odsetek pacjentów z ciężkimi zaostrzeniami jest za mały. * Liczba pacjentów, u których wystąpiło zdarzenie, została przeanalizowana za pomocą testu Cochrana-Mantela- Haenszela ze stratyfikacją wg danych z połączonych ośrodków; współczynnik odnosi się do współczynnika ryzyka. W porównaniu do salmeterolu produkt Srivasso spowodował wydłużenie czasu do pierwszego zaostrzenia (187 dni w porównaniu do 145 dni) i zmniejszenie ryzyka o 17% (współczynnik ryzyka 0,83; 95% przedział ufności [CI], 0,77 do 0,90; P < 0,001). Produkt Srivasso spowodował również wydłużenie czasu do pierwszego ciężkiego zaostrzenia (hospitalizacja) (współczynnik ryzyka 0,72; 95% CI, 0,61 do 0,85; P < 0,001). Dzieci i młodzież Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań produktu leczniczego Srivasso we wszystkich podgrupach populacji dzieci i młodzieży w POChP oraz mukowiscydozie (stosowanie u dzieci i młodzieży, patrz punkt 4.2). 5.2 Właściwości farmakokinetyczne a) Wprowadzenie ogólne Bromek tiotropiowy jest czwartorzędowym związkiem amoniowym, niewykazującym izomerii optycznej, bardzo słabo rozpuszczalnym w wodzie. Bromek tiotropiowy stosowany jest w postaci proszku do inhalacji. Na ogół po podaniu wziewnym większość dostarczonej dawki osadza się w przewodzie pokarmowym, w mniejszym zaś stopniu w narządzie docelowym, czyli w płucach. Wiele z opisanych poniżej danych farmakokinetycznych uzyskano po podaniu dawek większych niż zalecane. b) Ogólna charakterystyka substancji czynnej po podaniu produktu leczniczego Wchłanianie: Po podaniu produktu w postaci proszku do inhalacji u młodych, zdrowych ochotników całkowita biodostępność wynosi 19,5%, co sugeruje dużą biodostępność frakcji trafiającej do płuc. Ze względu na budowę chemiczną cząsteczki (IV-rzędowa struktura amoniowa), jak i na podstawie wyników badań in vitro, należy się spodziewać, że bromek tiotropiowy słabo wchłania się z przewodu pokarmowego (10 15%). Całkowita biodostępność doustnych roztworów bromku tiotropiowego wynosi 2 3%. Maksymalne stężenie bromku tiotropiowego w osoczu występuje po upływie 5 minut od inhalacji. Nie należy się spodziewać, aby pokarm miał wpływ na wchłanianie bromku tiotropiowego. Dystrybucja: Produkt wiąże się w 72% z białkami osocza i wykazuje objętość dystrybucji 32 l/kg. W stanie stacjonarnym stężenia bromku tiotropiowego w osoczu u pacjentów z POChP osiągały maksymalną wartość pg/ml po upływie 5 minut od inhalacji dawki 18 mikrogramów i szybko zmniejszały się, co jest charakterystyczne dla dystrybucji wielokompartmentowej. Stężenia w osoczu w stanie stacjonarnym wynosiły 3 4 pg/ml. Miejscowe stężenie leku w płucach nie jest znane, ale sposób podawania sugeruje, że jest ono znacznie większe niż w osoczu. Badania na szczurach wykazały, że stopień przenikania bromku tiotropiowego przez barierę krew-mózg nie jest znaczący. Metabolizm: Stopień biotransformacji jest mały. Wykazano, że u młodych, zdrowych ochotników 74% dawki podanej dożylnie wydala się w postaci niezmienionej z moczem. Ester bromku tiotropiowego ulega nieenzymatycznemu rozkładowi do alkoholu (N-metyloskopina) i kwasu ditienyloglikolowego, które nie mają powinowactwa do receptorów muskarynowych. Badania in vitro z użyciem mikrosomów wątroby ludzkiej i hepatocytów ludzkich wskazują, że pozostała część produktu (< 20% dawki podanej dożylnie) jest metabolizowana na drodze oksydacji zależnej od cytochromu P-450, a następnie sprzęgana z glutationem, co prowadzi do powstania różnych metabolitów II fazy. Badania in vitro z użyciem mikrosomów wątroby wskazują na możliwość zablokowania tego szlaku enzymatycznego przez inhibitory CYP 2D6 (i 3A4), chinidynę, ketokonazol i gestoden. Tak więc CYP 2D6 i 11
12 3A4 są włączone w szlak metaboliczny odpowiedzialny za przemianę mniejszej części podanej dawki. Bromek tiotropiowy, nawet w stężeniach większych niż lecznicze, nie hamuje aktywności CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 lub 3A w mikrosomach wątroby ludzkiej. Eliminacja: Okres półtrwania w końcowej fazie eliminacji bromku tiotropiowego wynosi od 5 do 6 dni po inhalacji. Całkowity klirens po podaniu dożylnym u młodych, zdrowych ochotników wynosił 880 ml/min przy różnicach indywidualnych rzędu 22%. Po podaniu dożylnym bromek tiotropiowy jest wydalany głównie w postaci niezmienionej z moczem (74%). Po podaniu leku w postaci proszku do inhalacji 14% zastosowanej dawki wydala się z moczem, a pozostała część dawki, głównie niewchłonięta w jelitach, wydala się z kałem. Klirens nerkowy bromku tiotropiowego jest większy od klirensu kreatyniny, co wskazuje na wydzielanie leku do moczu. Podczas długotrwałego, wziewnego stosowania produktu raz na dobę u pacjentów z POChP farmakokinetyczny stan stacjonarny uzyskiwano po 2 3 tygodniach, bez późniejszej kumulacji. Liniowość lub nieliniowość: Bromek tiotropiowy wykazuje liniową farmakokinetykę w zakresie dawek terapeutycznych zarówno po podaniu dożylnym, jak i po podaniu suchego proszku do inhalacji. c) Charakterystyka poszczególnych grup pacjentów Pacjenci w podeszłym wieku: Zgodnie z oczekiwaniem, podobnie jak w przypadku innych leków wydalanych głównie przez nerki, zaawansowany wiek pacjenta wiązał się ze zmniejszeniem klirensu nerkowego bromku tiotropiowego (326 ml/min u pacjentów w wieku < 58 lat z POChP do 163 ml/min u pacjentów w wieku > 70 lat z POChP), co można wytłumaczyć zmniejszeniem czynności nerek. Po podaniu wziewnym wydalanie bromku tiotropiowego z moczem zmniejszało się z 14% (u młodych, zdrowych ochotników) do około 7% (u pacjentów z POChP); u pacjentów z POChP stężenie leku w osoczu nie zmieniało się jednak w znaczący sposób wraz z wiekiem, jeśli odniesie się je do różnic występujących między poszczególnymi pacjentami i różnic u danego pacjenta (43% zwiększenie AUC 0-4godz. po podaniu produktu w postaci proszku do inhalacji). Pacjenci z zaburzeniami czynności nerek: Podobnie jak w przypadku innych leków wydalanych głównie przez nerki, zaburzenie czynności nerek prowadziło do zwiększenia stężenia leku w osoczu i zmniejszenia klirensu nerkowego leku zarówno po wlewie dożylnym, jak i po podaniu w postaci suchego proszku do inhalacji. Łagodne zaburzenia czynności nerek (Cl kr ml/min), które często występują u pacjentów w podeszłym wieku, powodowały nieznaczne zwiększenie stężenia bromku tiotropiowego w osoczu (39% zwiększenie AUC 0-4godz. po wlewie dożylnym) U pacjentów z POChP z umiarkowanymi do ciężkich zaburzeniami czynności nerek (Cl kr < 50 ml/min) dożylne podanie bromku tiotropiowego spowodowało dwukrotne zwiększenie stężenia leku w osoczu (82% zwiększenie AUC 0-4godz. ), co zostało potwierdzone po podaniu suchego proszku do inhalacji. Pacjenci z zaburzeniami czynności wątroby: Niewydolność wątroby nie powinna mieć znaczącego wpływu na właściwości farmakokinetyczne bromku tiotropiowego. Bromek tiotropiowy jest wydalany przede wszystkim przez nerki (74% dawki u młodych, zdrowych ochotników) i ulega prostej, nieenzymatycznej reakcji hydrolizy estru z wytworzeniem farmakologicznie nieaktywnych produktów. Dzieci i młodzież: Patrz punkt 4.2 d) Zależności farmakokinetyczno-farmakodynamiczne Parametry farmakokinetyczne produktu nie wpływają bezpośrednio na jego właściwości farmakodynamiczne. 5.3 Przedkliniczne dane o bezpieczeństwie Wiele działań leku obserwowanych w konwencjonalnych badaniach farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym i toksycznego wpływu na reprodukcję można wyjaśnić przeciwcholinergicznymi właściwościami bromku tiotropiowego. Typowe zaobserwowane 12
13 u zwierząt objawy to: zmniejszenie łaknienia, zmniejszenie przyrostu masy ciała, suchość w jamie ustnej i nosie, zmniejszenie wydzielania płynu łzowego i śliny, rozszerzenie źrenic i zwiększona częstość akcji serca. Inne istotne objawy zanotowane w badaniach toksyczności po podaniu wielokrotnym to: łagodne podrażnienie dróg oddechowych u szczurów i myszy przejawiające się zapaleniem błony śluzowej nosa i zmianami w nabłonku jamy nosowej i krtani, zapaleniem gruczołu krokowego, złogami białkowymi i kamicą pęcherza moczowego u szczurów. Szkodliwy wpływ na przebieg ciąży, rozwój zarodka i płodu, poród lub rozwój pourodzeniowy mógł być wykazany tylko po zastosowaniu dawek toksycznych dla matki. Bromek tiotropiowy nie wykazywał działania teratogennego ani u szczurów, ani u królików. W badaniu wpływu na rozrodczość i płodność szczurów nie wykazano żadnego działania niepożądanego na płodność lub cykle płciowe zarówno badanych rodziców, jak i ich potomstwa po żadnej z zastosowanych dawek produktu. Po miejscowym lub ogólnoustrojowym narażeniu pięciokrotnie przekraczającym narażenie po zastosowaniu dawek terapeutycznych obserwowano zmiany w układzie oddechowym (podrażnienie) i moczowo-płciowym (zapalenie gruczołu krokowego) oraz toksyczny wpływ na reprodukcję. Badania genotoksyczności i potencjalnego działania rakotwórczego nie ujawniły występowania szczególnego zagrożenia dla ludzi. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Laktoza jednowodna (zawierająca białko mleka) 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata Po pierwszym otwarciu blistra: 9 dni. Aparat do inhalacji HandiHaler należy wyrzucić po upływie 12 miesięcy od pierwszego użycia. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w temperaturze powyżej 25 C. Nie zamrażać. 6.5 Rodzaj i zawartość opakowania Blistry Al/PVC/Al zawierające po 10 kapsułek. HandiHaler jest aparatem do inhalacji pojedynczych dawek produktu, wykonanym z materiałów plastikowych (ABS) i stali nierdzewnej. Dostępne opakowania i dołączone urządzenia: Tekturowe pudełko zawierające 30 kapsułek (3 blistry) Tekturowe pudełko zawierające 60 kapsułek (6 blistrów) Tekturowe pudełko zawierające 90 kapsułek (9 blistrów) Tekturowe pudełko zawierające aparat do inhalacji HandiHaler i 10 kapsułek (1 blister) Tekturowe pudełko zawierające aparat do inhalacji HandiHaler i 30 kapsułek (3 blistry) Opakowanie szpitalne: Opakowanie zbiorcze zawierające 5 tekturowych pudełek po 30 kapsułek wraz z aparatem do inhalacji HandiHaler Opakowanie szpitalne: Opakowanie zbiorcze zawierające 5 tekturowych pudełek po 60 kapsułek Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 13
14 6.6 Specjalne środki ostrożności dotyczące usuwania Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Boehringer Ingelheim International GmbH Binger Strasse 173 D Ingelheim am Rhein Niemcy 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 14
Skrócona informacja o leku Spiriva Nazwa produktu leczniczego, dawka i postać farmaceutyczna:
 Skrócona informacja o leku Spiriva Nazwa produktu leczniczego, dawka i postać farmaceutyczna: SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych. Każda kapsułka zawiera 18 mikrogramów
Skrócona informacja o leku Spiriva Nazwa produktu leczniczego, dawka i postać farmaceutyczna: SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych. Każda kapsułka zawiera 18 mikrogramów
SPIRIVA 18 μg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych Tiotropium
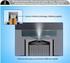 Ulotka dołączona do opakowania: informacja dla użytkownika SPIRIVA 18 μg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych Tiotropium Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika SPIRIVA 18 μg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych Tiotropium Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Srivasso, 18 µg, proszek do inhalacji w kapsułce twardej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 22,5 mikrograma bromku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Srivasso, 18 µg, proszek do inhalacji w kapsułce twardej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 22,5 mikrograma bromku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 18
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SPIRIVA, 18 µg/dawkę inhalacyjną, proszek do inhalacji w kapsułkach twardych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 18
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Braltus, 10 mikrogramów/ dawkę dostarczoną, proszek do inhalacji w kapsułce twardej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Braltus, 10 mikrogramów/ dawkę dostarczoną, proszek do inhalacji w kapsułce twardej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
Skrócona informacja o leku Spiolto Respimat
 Produkt leczniczy Spiolto Respimat jest dodatkowo monitorowany. W celu uzyskania dodatkowych informacji proszę zapoznać się z Charakterystyką Produktu Leczniczego. Skrócona informacja o leku Spiolto Respimat
Produkt leczniczy Spiolto Respimat jest dodatkowo monitorowany. W celu uzyskania dodatkowych informacji proszę zapoznać się z Charakterystyką Produktu Leczniczego. Skrócona informacja o leku Spiolto Respimat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO, OZNAKOWANIE OPAKOWAŃ I ULOTKA DLA PACJENTA
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO, OZNAKOWANIE OPAKOWAŃ I ULOTKA DLA PACJENTA Wersja: 04 października 2017 1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Wersja: 04 października 2017 2 1. NAZWA PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO, OZNAKOWANIE OPAKOWAŃ I ULOTKA DLA PACJENTA Wersja: 04 października 2017 1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Wersja: 04 października 2017 2 1. NAZWA PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO CLARITINE ALLERGY 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg Loratadinum (loratadyny). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Spiriva Respimat, 2,5 mikrograma/dawkę odmierzoną, roztwór do inhalacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka odmierzona zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Spiriva Respimat, 2,5 mikrograma/dawkę odmierzoną, roztwór do inhalacji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka odmierzona zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucoangin, 20 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucoangin, 20 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 20 mg ambroksolu chlorowodorku (Ambroxoli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: alkohol cetostearylowy, glikol propylenowy, kwas benzoesowy.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
Ulotka dołączona do opakowania: informacja dla pacjenta. ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol wziewny, roztwór Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol wziewny, roztwór Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol wziewny, roztwór Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancja pomocnicza
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PROSPAN, 26 mg, pastylki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna pastylka miękka zawiera 26 mg wyciągu (w postaci suchego wyciągu)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PROSPAN, 26 mg, pastylki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna pastylka miękka zawiera 26 mg wyciągu (w postaci suchego wyciągu)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lactulosum Aflofarm, 7,5 g/15 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 15 ml syropu zawiera 7,5 g laktulozy ciekłej (Lactulosum liquidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lactulosum Aflofarm, 7,5 g/15 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 15 ml syropu zawiera 7,5 g laktulozy ciekłej (Lactulosum liquidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: jedna tabletka zawiera 71,3 mg laktozy jednowodnej.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flonidan, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miętowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 pastylka zawiera 3 mg benzydaminy chlorowodorku (Benzydamini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miętowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 pastylka zawiera 3 mg benzydaminy chlorowodorku (Benzydamini
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO ALERIC, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 10 mg Loratadinum (loratadyny).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO ALERIC, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jedna tabletka zawiera 10 mg Loratadinum (loratadyny).
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924 mg butamiratu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT N, 20 mikrogramów/dawkę inhalacyjną, aerozol inhalacyjny, roztwór Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussal Antitussicum, 15 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 15 mg dekstrometorfanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tussal Antitussicum, 15 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka powlekana zawiera 15 mg dekstrometorfanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Stopex, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 15 mg dekstrometorfanu bromowodorku (Dextromethorphani
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Stopex, 15 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 15 mg dekstrometorfanu bromowodorku (Dextromethorphani
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NIZAX ACTIV, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NIZAX ACTIV, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miodowo-pomarańczowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera 3 mg benzydaminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak miodowo-pomarańczowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera 3 mg benzydaminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucohelix, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu (co odpowiada 1,18 g) zawiera 8,25 mg wyciągu suchego z liści bluszczu Hedera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Mucohelix, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu (co odpowiada 1,18 g) zawiera 8,25 mg wyciągu suchego z liści bluszczu Hedera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
Produktu nie należy stosować pod opatrunkiem okluzyjnym lub w postaci okładów.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani hydrobromidum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TUSSIDEX, 30 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TUSSIDEX, 30 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Lunapret 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Lunapret 1 1. NAZWA PRODUKTU LECZNICZEGO Lunapret Valerianae radicis extractum siccum + Lupuli strobili extractum siccum tabletki powlekane, 250 mg + 60 mg 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Lunapret 1 1. NAZWA PRODUKTU LECZNICZEGO Lunapret Valerianae radicis extractum siccum + Lupuli strobili extractum siccum tabletki powlekane, 250 mg + 60 mg 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
ATROVENT, 0,25 mg/ml, płyn do inhalacji z nebulizatora Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, płyn do inhalacji z nebulizatora Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, płyn do inhalacji z nebulizatora Ipratropii bromidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
Produkt stosowany pomocniczo w dolegliwościach związanych ze stanami zapalnymi stawów oraz w stanach bólowych po stłuczeniach.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak eukaliptusowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera 3 mg benzydaminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tantum Verde smak eukaliptusowy, 3 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera 3 mg benzydaminy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: zawartość laktozy jednowodnej w jednej tabletce to 62,5 mg.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Loratadine Galpharm, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Loratadine Galpharm, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Produkt leczniczy zawiera barwniki: tytanu dwutlenek (E 171), erytrozynę (E 127) i żółcień chinolinową (E 104).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg etamsylatu (Etamsylatum). Produkt
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg etamsylatu (Etamsylatum). Produkt
ATROVENT, 0,25 mg/ml, roztwór do nebulizacji Ipratropii bromidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, roztwór do nebulizacji Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ATROVENT, 0,25 mg/ml, roztwór do nebulizacji Ipratropii bromidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej wiadomości.
 VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Loratadyna EGIS, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny. Substancje pomocnicze: Każda
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Loratadyna EGIS, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 10 mg loratadyny. Substancje pomocnicze: Każda
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. sodu glutaminian (E 621)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Original Tymianek I Podbiał (100 mg + 100 mg)/pastylkę; pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne: Thymi herbae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Original Tymianek I Podbiał (100 mg + 100 mg)/pastylkę; pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne: Thymi herbae
100 g pasty zawiera: 36g wody chlorkowo- sodowej (solanki) siarczkowej, jodkowej 1g bocheńskiej leczniczej soli jodowo- bromowej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego SULPHODENT 370 mg/g pasta do zębów 2. Skład jakościowy i ilościowy 100 g pasty zawiera: 36g wody chlorkowo- sodowej (solanki) siarczkowej,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego SULPHODENT 370 mg/g pasta do zębów 2. Skład jakościowy i ilościowy 100 g pasty zawiera: 36g wody chlorkowo- sodowej (solanki) siarczkowej,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LACTEOL FORT 340 mg, 340 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: Substancja czynna: 340 mg w tym:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LACTEOL FORT 340 mg, 340 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: Substancja czynna: 340 mg w tym:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
SKRÓCONA INFORMACJA O LEKU
 Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
