Agencja Oceny Technologii Medycznych
|
|
|
- Jadwiga Szewczyk
- 8 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rekomendacja nr 122/2014 z dnia 19 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Prolia, denosumabum, roztwór do wstrzykiwań, 60 mg/1 ml, 1 amp.-strz.a 1 ml, we wskazaniu osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancja) do ich stosowania z T score -2,5 mierzone metodą DXA Prezes Agencji rekomenduje objęcie refundacją produktu leczniczego Prolia, denosumabum, roztwór do wstrzykiwań, 60 mg/1 ml, 1 amp.-strz.a 1 ml, EAN , we wskazaniu osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancja) do ich stosowania z T score -2,5 mierzone metodą DXA. Uzasadnienie rekomendacji Prezes Agencji, przychylając się do stanowiska Rady Przejrzystości, uważa za zasadne objęcie refundacją produktu leczniczego Prolia (denosumabum), roztwór do wstrzykiwań, 60 mg/1 ml; kod EAN: , we wskazaniu: osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancja) do ich stosowania z T score -2,5 mierzone metodą DXA, w ramach istniejącej grupy limitowej, z odpłatnością 30%. Dowody kliniczne wysokiej i umiarkowanej jakości wskazują na skuteczność stosowania denosumabu we wnioskowanej populacji, tj. u kobiet w wieku powyżej 60 r.ż., ze złamaniem osteoporotycznym,. Wykazano, że leczenie denosumabem powoduje redukcję ryzyka złamań, w tym między innymi złamań osteoporotycznych, klinicznych złamań kręgowych, złamań pozakręgowych. W wymienionych badaniach oceniana populacja była ograniczona do kobiet z T score -2,5, mierzone metodą DXA. Dlatego też, wskazanie powinno być ograniczone do populacji spełniającej to kryterium. Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa tel fax NIP REGON sekretariat@aotm.gov.pl
2 W długoterminowym okresie obserwacji wykazano wysokie bezpieczeństwo stosowanej technologii. U chorych kontynuujących terapię denosumabem utrzymywało się niskie ryzyko łamliwości kości (w tym odcinka lędźwiowego kręgosłupa, biodra, szyjki kości udowej oraz kości promieniowej). Zastosowanie denosumabu jest rekomendowane przez międzynarodowe i krajowe towarzystwa naukowe oraz przez ekspertów klinicznych. Prezes Agencji sugeruje wprowadzenie instrumentu dzielenia ryzyka, który w chwili obecnej nie został zaproponowany. Przedmiot wniosku Wnioskodawca, we wniosku o objęcie refundacją i ustalenie urzędowej ceny zbytu produktu leczniczego Prolia, denosumabum, roztwór do wstrzykiwań, 60 mg/1 ml, 1 amp.-strz.a 1 ml, EAN We wskazaniu osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancja) do ich stosowania, wnosi o dostępność refundacyjną we wskazaniu określonym stanem klinicznym z deklarowanym poziomem odpłatności dla pacjenta. Proponowana cena zbytu netto wynosi. Problem zdrowotny Osteoporoza jest chorobą tkanki kostnej, charakteryzującą się obniżeniem jej masy i jakości, co w konsekwencji prowadzi do zmniejszenia wytrzymałości mechanicznej szkieletu i większej podatności na złamania. Najczęściej dochodzi do złamań kręgów, które są przyczyną obniżenia wzrostu i deformacji sylwetki związanych z pogłębieniem kifozy piersiowej, a także zmniejszenia pojemności płuc, utrudnienia odpływu żylnego z dolnej połowy ciała i wzrostu śmiertelności. Spośród złamań pozakręgowych, do których zalicza się te dotyczące piszczeli, kości promieniowej, ramieniowej, udowej, żeber i miednicy, najgroźniejsze są złamania bliższego odcinka kości udowej. Osteoporoza może mieć charakter pierwotny lub wtórny. Rozpoznanie osteoporozy wtórnej dotyczy wszystkich osób z osteoporozą, u których ustalono inną przyczynę choroby niż wiek i zaburzenia w gospodarce hormonów płciowych. Populacja wnioskowana dotyczy kobiet cierpiących na osteoporozę pomenopauzalną, która jest jednym z rodzajów osteoporozy pierwotnej (inwolucyjnej). Osteoporoza pomenopauzalna związana jest z zaburzeniami gospodarki hormonów płciowych z następczym nadmiernym indukowaniem aktywności osteoklastów. W jej przebiegu dochodzi najczęściej do złamań kręgów i dalszego odcinka kości przedramienia. Postępowanie terapeutyczne w przypadku osteoporozy obejmuje leczenie niefarmakologiczne, do którego zalicza się zwiększanie wytrzymałości kości poprzez odpowiednią dietę, ekspozycję na promieniowanie słoneczne lub suplementację witaminy D i wapnia, rehabilitację i zapobieganie upadkom oraz leczenie farmakologiczne. Farmakoterapia w osteoporozie uwzględnia stosowanie leków, których mechanizm działania ukierunkowany jest na hamowanie resorpcji, intensyfikację kościotworzenia lub stanowi kombinację obu tych działań Opis wnioskowanego świadczenia Denosumab jest ludzkim przeciwciałem monoklonalnym (IgG2), skierowanym przeciwko oraz wiążącym się z dużym powinowactwem i swoistością z RANKL, zapobiegając aktywacji jego receptora, RANK, na powierzchni prekursorów osteoklastów i osteoklastów. Zapobieganie interakcji 2
3 RANKL/RANK hamuje powstawanie, funkcjonowanie i przeżycie osteoklastów, zmniejszając w ten sposób resorpcję warstwy korowej kości i kości beleczkowej. Wnioskowane wskazanie obejmuje osteoporozę pomenopauzalną u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancja) do ich stosowania. Zarejestrowane wskazania obejmują leczenie osteoporozy u kobiet po menopauzie, u których występuje zwiększone ryzyko złamań. Prolia znacząco zmniejsza ryzyko złamań kręgów, złamań pozakręgowych oraz złamań biodra. Leczenie utraty masy kostnej w przebiegu ablacji hormonalnej u mężczyzn z rakiem gruczołu krokowego, u których występuje zwiększone ryzyko złamań. U mężczyzn z rakiem gruczołu krokowego leczonych ablacją hormonalną Prolia znacząco zmniejsza ryzyko złamań kręgów. Denosumab (Prolia) jest lekiem obecnie refundowanym w ramach wykazu leków refundowanych u kobiet w wieku powyżej 65 lat ze stwierdzoną pierwotną osteoporozą pomenopauzalną (T-score mniejsze lub równe - 2,5 mierzone metodą DXA), ze złamaniem kręgowym lub złamaniem szyjki kości udowej, po niepowodzeniu leczenia bisfosfonianami lub przeciwwskazaniami (nietolerancją) do stosowania doustnych bisfosfonianów. Proponowane zmiany w populacji docelowej obejmują wiek pacjentek (wiek graniczny wynoszący 60 lat) oraz typ przebytego w historii złamania (dowolne złamanie osteoporotyczne). Alternatywna technologia medyczna Do technologii lekowych najczęściej rekomendowanych i stosowanych we wskazaniu: leczenie farmakologiczne osteoporozy pomenopauzalnej zalicza się bisfosfoniany (alendronian, ryzedronian, kwasy ibandronowy i zoledronowy), raloksyfen, parathormon i analogi parathormonu (teryparatyd) oraz ranelinian strontu oraz denosumab. Wykazano, że wszystkie ww. interwencje, stosowane łącznie z suplementacją wapnia i witaminy D zmniejszają ryzyko złamań kręgowych. Dodatkowo niektóre zmniejszają ryzyko złamań pozakręgowych. Jako komparator dla Prolii wnioskodawca wskazał leczenie objawowe wit. D oraz wapniem. Wybór ten uznano za zasadny. W opinii Agencji, komparatorem dla Prolii może być także produkt leczniczy Protelos (ranelinian strontu). Skuteczność kliniczna Celem analizy klinicznej była ocena skuteczności i bezpieczeństwa stosowania denosumabu dodanego do standardowego leczenia (wit. D oraz wapniem) w populacji kobiet z osteoporozą pomenopauzalną, w wieku >60 lat, ze złamaniem osteoporotycznym oraz po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancją) do ich stosowania. Analiza kliniczna wnioskodawcy została przeprowadzona w oparciu o wyniki badań odnalezionych w ramach przeglądu systematycznego. Kryteria włączenia do analizy spełniło 13 publikacji, w tym 4 badania RCT (9 publikacji) porównujące denosumab (DENO) z placebo (PLC) w terapii dodanej do standardowego leczenia (suplementacja wapnia i witaminy D). Ponadto w ramach analizy skuteczności i bezpieczeństwa DENO przedstawiono wyniki pochodzące z przedłużenia badania FREEDOM i McClung 2006 (4 publikacje). Główne ograniczenia dotyczą nie odnalezienia badań dla populacji, której charakterystyka dokładnie odpowiada populacji docelowej (kobiety z osteoporozą pomenopauzalną, w wieku >60 lat, ze złamaniem osteoporotycznym oraz po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami/nietolerancją do ich stosowania). Na podstawie wyników 4 RCT (FREEDOM, DEFEND, Seeman 2010, McClung 2006) wykazano, że dodanie denosumabu do terapii standardowej przyczynia się do istotnej statystycznie (IS) redukcji ryzyka: 3
4 złamań pozakręgowych: [RR = 0,80 (95%CI: 0,68; 0,94)]; [NNT = 69 (95%CI: 40; 259)], złamań biodra: [RR = 0,61 (95%CI: 0,37; 0,98)]; [NNT = 231 (95%CI: 118; 5121)], Ponadto zaobserwowano wzrost gęstości mineralnej kości mierzony wartością wskaźnika BMD w obrębie: kości promieniowej: [WMD = 3,46 (95%CI: 2,83;4,09)]; [SMD = 1,09 (95%CI: 0,91;1,26)]. Na podstawie długoterminowych obserwacji pacjentek zakwalifikowanych do 2 RCT (FREEDOM, McClung 2006) wykazano, że u chorych kontynuujących terapię denosumabem utrzymywało się niskie ryzyko łamliwości kości (w tym odcinka lędźwiowego kręgosłupa, biodra, szyjki kości udowej oraz kości promieniowej), ponadto obserwowano dalszy wzrost BMD o: 15,2% (72 mies. terapii denosumabem) i 16,5% (96 mies. terapii denosumabem) w odcinku lędźwiowym kręgosłupa, 7,5% (72 mies. terapii denosumabem) i 6,8% (96 mies. terapii denosumabem) w obrębie biodra, 6,7% (72 mies. terapii denosumabem) w szyjce kości udowej, 2,7% (72 mies. terapii denosumabem) i 1,3% (96 mies. terapii denosumabem) w kości promieniowej. W przypadku kobiet zakwalifikowanych pierwotnie do grupy PLC, rozpoczęcie terapii denosumabem prowadziło do redukcji ryzyka załamań oraz wzrostu wartości BMD o: 9,4% (36 mies. terapii denosumabem) i 11,9% (48 mies. terapii denosumabem) w odcinku lędźwiowym kręgosłupa, 4,8% (36 mies. terapii denosumabem) i 5,6% (48 mies. terapii denosumabem) w obrębie biodra, 4,0% (36 mies. terapii denosumabem) w szyjce kości udowej, 1,2% (36 mies. terapii denosumabem) w kości promieniowej. W ramach dodatkowej analizy przedstawiono wyniki porównania DENO z RS w populacji pacjentek z osteoporozą pomenopauzalną w oparciu o przegląd systematyczny Freemantle Porównanie pośrednie metodą Buchera wykazało, że DENO w porównaniu z RS istotnie statystycznie zmniejsza ryzyko wystąpienia nowych złamań kręgowych oraz klinicznych złamań kręgowych, natomiast nie wykazano istotnych statystycznie różnic odnośnie pozostałych rodzajów złamań. W ramach porównania pośredniego metodą MTC wykazano, że DENO w porównaniu z RS istotnie statystycznie zmniejsza ryzyko nowych złamań kręgowych. Nie stwierdzono istotnych statystycznie różnic odnośnie wpływu na ryzyko wystąpienia klinicznych złamań kręgowych, złamań pozakręgowych, złamań biodra oraz złamań nadgarstka. Skuteczność praktyczna Wnioskodawca, w analizach dołączonych do wniosku, nie przedstawił informacji odnośnie skuteczności praktycznej wnioskowanej technologii. 4
5 Bezpieczeństwo stosowania Nie wykazano IS różnic pomiędzy denosumabem a PLC odnośnie ryzyka wystąpienia odczynu miejscowego po iniekcji, infekcji, wycofania z badania lub przerwania terapii z powodu działań niepożądanych, ryzyka wystąpienia działań niepożądanych zarówno ogółem oraz działań niepożądanych związanych z leczeniem i ciężkich działań niepożądanych. Analiza profilu bezpieczeństwa przedłużenia terapii denosumabem o 3 lata w porównaniu z analogicznym okresem fazy randomizowanej (łącznie 6-letnia terapia denosumabem, badanie FREEDOM) wykazała podobne lub niższe ryzyko działań niepożądanych ogółem (93% vs 88%), ciężkich działań niepożądanych (26% vs 5%) oraz ciężkich działań niepożądanych prowadzących do zgonu (2% vs 2%). Terapia denosumabem u pacjentek otrzymujących placebo w ramach badania RCT również nie powodowała wzrostu ryzyka działań niepożądanych ogółem (93% vs 88%), ciężkich działań niepożądanych (25% vs 26%) oraz ciężkich działań powodujących zgon (2% vs 2%). Na stronie URPL odnaleziono komunikat z 31 stycznia 2013 roku dotyczący rzadkich przypadków występowania atypowego złamania kości udowej podczas leczenia produktem Prolia (DENO). Komunikat ten został opublikowany również przez MHRA w lutym 2013 roku. W komunikacie wskazano na konieczność zgłaszania przez pacjentów wystąpienia nowego lub nietypowego bólu uda, biodra lub pachwiny. Pacjenci, u których występują tego typu bóle, powinni być zdiagnozowani pod kątem wystąpienia niecałkowitego złamania kości. Na stronie EMA odnaleziono także decyzję wydaną w 2013 roku o konieczności zbadania przypadków pojawiania się zapalenia naczyń u pacjentów stosujących produkt Prolia. Propozycje instrumentów dzielenia ryzyka Podmiot odpowiedzialny, w analizach dołączonych do wniosku, nie przedstawił propozycji odnośnie instrumentów dzielenia ryzyka. Stosunek kosztów do uzyskiwanych efektów zdrowotnych Celem analizy ekonomicznej jest ocena opłacalności denosumabu (Prolia) w porównaniu z brakiem leczenia (placebo) w prewencji złamań po rozszerzeniu populacji refundacyjnej preparatu Prolia. Analizę ekonomiczną przeprowadzono z perspektywy płatnika publicznego (NFZ) oraz perspektywy wspólnej (NFZ + pacjent) w dożywotnim horyzoncie czasowym. Przeprowadzono analizę kosztów użyteczności dla porównania denosumab (Prolia) vs brak leczenia oraz w analizie dodatkowej przeprowadzono analizę minimalizacji kosztów dla porównania denosumab (Prolia) vs ranelinian strontu. W analizie ekonomicznej analizowano bezpośrednie koszty medyczne: wizyty ambulatoryjne, hospitalizacje, zaopatrzenie pacjenta w sprzęt ortopedyczny, rehabilitacja, leczenie ambulatoryjne, leki. Koszty związane z leczeniem/ diagnostyką/ rehabilitacją złamań (biodrowych w pierwszym roku po złamaniu, kręgowych w pierwszym roku po złamaniu, nadgarstka w pierwszym roku po złamaniu, innych w pierwszym roku po złamaniu, biodrowych w drugim i kolejnych latach po złamaniu, kręgowych w drugim i kolejnych latach po złamaniu). W analizie nie uwzględniono kosztów występowania działań niepożądanych związanych ze stosowaniem leków osteoporotycznych. W analizie ekonomicznej wykorzystano sporządzony, opierano się na modelu Markowa z długością cyklu wynoszącą 6 miesięcy (uwzględniono korektę połowy cyklu). 5
6 Analiza podstawowa Analiza kosztów-użyteczności została wykonana w dożywotnim horyzoncie czasowym z perspektywy płatnika (NFZ), perspektywy wspólnej (NFZ i pacjent) dla porównania preparatu Prolia (denosumab) z brakiem leczenia w populacji kobiet w wieku pomenopauzalnym z osteoporozą pierwotną. W analizie kosztów-użyteczności efektywności w zakresie złamań, zostały wyznaczone na podstawie badań FREEDOM oraz DEFEND. Badanie DEFEND obejmowało pacjentki bez wcześniejszych złamań. W badaniu FREEDOM uwzględniono pacjentki z i bez wcześniejszych złamań. W badaniach FREEDOM i DEFEND nie zawężano populacji do pacjentek po niepowodzeniu leczenia bisfosfonianami lub przeciwwskazaniami (nietolerancją) do stosowania doustnych bisfosfonianów. W analizie kosztów-użyteczności wykazano, że uzyskanie dodatkowego roku życia skorygowanego o jakość, w wyniku zastosowania preparatu Prolia (denosumab) w porównaniu z brakiem leczenia: Analiza dodatkowa W analizie minimalizacji kosztów wykazano, że różnica miedzy kosztem stosowania denosumabu (Prolia) a ranelinian strontu Wskazanie czy zachodzą okoliczności, o których mowa w art. 13 ust. 3 ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. nr 122, poz.696 z późn. zm.) Analiza kliniczna wnioskodawcy zawiera randomizowane badania kliniczne dowodzące wyższej skuteczności przedmiotowego leku nad wybranym przez wnioskodawcę komparatorem. Analiza minimalizacji kosztów została wykonana na podstawie porównania z komparatorem, który nie jest w Polsce refundowany. Wpływ na budżet płatnika publicznego Celem analizy była ocena wpływu na system ochrony zdrowia podjęcia decyzji o rozszerzeniu wskazań refundacyjnych produktu leczniczego Prolia (denosumab) we wskazaniu: pacjentki w wieku 6
7 powyżej 60 roku życia, ze stwierdzoną pierwotną osteoporozą pomenopauzalną, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancją) do ich stosowania. Analizę przeprowadzono z perspektywy płatnika publicznego (NFZ) oraz z perspektywy wspólnej (NFZ + pacjent w przypadku współpłacenia za leki), w 3-letnim horyzoncie czasowym ( ). Populację pacjentów, u których wnioskowana technologia będzie stosowana w przypadku pozytywnego rozpatrzenia wniosku (sc. nowy) oszacowano na osób w kolejnych latach analizy. W analizie rozważono dwa scenariusze. Aktualny wskazania refundacyjne dla preparatu Prolia pozostaną niezmienione. Prognozowany w przypadku podjęcia pozytywnej decyzji o poszerzeniu wskazań refundacyjnych dla preparatu Prolia (zmiana wymaganego wieku pacjentek z 65 roku życia na 60 rok życia, oraz typu przebytych złamań osteoporotycznych ze złamania szyjki kości udowej lub złamania kręgowego na dowolne złamanie osteoporotyczne). W analizie wyróżniono następujące składowe kosztów bezpośrednich: koszty preparatu Prolia; koszty podania preparatu Prolia; koszty leczenia złamań osteoporotycznych (nadgarstka, kręgu, biodra): wizyty ambulatoryjne, hospitalizacja, sprzęt ortopedyczny, rehabilitacja, leczenie ambulatoryjne. Główne ograniczenia wynikają między innymi z oszacowań populacji docelowej z wykorzystaniem danych z danych sprzedażowych, jak i badań epidemiologicznych, w tym polskich i zagranicznych. Kompilacja tak uzyskanych parametrów jest obarczona znaczną niepewnością. Uwagi do zapisów programu lekowego Nie dotyczy. 7
8 Omówienie rozwiązań proponowanych w analizie racjonalizacyjnej Omówienie rekomendacji wydawanych w innych krajach w odniesieniu do ocenianej technologii Przeprowadzono wyszukiwanie aktualnych rekomendacji, dotyczących zastosowania leku Prolia (denosumab) w leczeniu osteoporozy pomenopauzalnej w bazach bibliograficznych i serwisach internetowych instytucji i towarzystw naukowych. Odnaleziono 7 rekomendacji klinicznych i 5 rekomendacji refundacyjnych. Denosumab jest rekomendowany wraz z innymi lekami, jako opcja terapeutyczna w leczeniu osteoporozy pomenopauzalnej. W 2012 roku Pharmaceutical Benefits Advisory Committee (PBAC), w 2011 roku Haute Autorité De Santé (HAS) i Canadian Agency for Drugs and Technologies in Health (CADTH) oraz w 2010 roku The National Institute for Clinical Excellence (NICE) i Scottish Medicines Consortium (SMC), wydały pozytywne decyzje z odniesieniu do objęcia refundacją leku Prolia u w leczeniu kobiet z osteoporozą pomenopauzalną, jednak zauważyć należy, że uściślone populacje docelowe różniły się w pewnych zakresach od populacji zgodnej z wnioskiem refundacyjnym. 8
9 Podstawa przygotowania rekomendacji Rekomendacja została przygotowana na podstawie zlecenia z dnia r. Ministra Zdrowia (znak pisma: MZ-PLR /MKR/14), odnośnie przygotowania rekomendacji Prezesa w sprawie objęcia refundacją i ustalenia urzędowej ceny zbytu produktu leczniczego Prolia, denosumabum, roztwór do wstrzykiwań, 60 mg/1 ml, 1 amp.-strz.a 1 ml, EAN , we wskazaniu leczenie osteoporozy u kobiet w wieku pomenopauzalnym, na podstawie art. 35 ust 1. ustawy z dnia 12 maja 2011 roku o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. Nr 122, poz. 696, z późn. zm.), po uzyskaniu stanowiska Rady Przejrzystości nr 138/2014 z dnia 19 maja 2014 r. w sprawie oceny leku Prolia (denosumab) (kod EAN: ) we wskazaniu: osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub z przeciwwskazaniami (nietolerancja) do ich stosowania. Piśmiennictwo 1. Stanowisko Rady Przejrzystości nr 138/2014 z dnia 19 maja 2014 r. w sprawie oceny leku Prolia (denosumab) (kod EAN: ) we wskazaniu: osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub z przeciwwskazaniami (nietolerancja) do ich stosowania. 2. Wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu produktu leczniczego Prolia (denosumab) we wskazaniu: osteoporoza pomenopauzalna u kobiet w wieku powyżej 60 lat, ze złamaniem osteoporotycznym, po niepowodzeniu leczenia doustnymi bisfosfonianami lub przeciwwskazaniami (nietolerancja) do ich stosowania. Analiza weryfikacyjna AOTM-OT /
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej. Szanowny Panie Marszałku,
 Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 246/2014 z dnia 24 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 246/2014 z dnia 24 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 158/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Signifor (pasyreotyd), kod EAN 5909990958238 we wskazaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 158/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Signifor (pasyreotyd), kod EAN 5909990958238 we wskazaniu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 153/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją lek Selincro, nalmefen,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 153/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją lek Selincro, nalmefen,
30. DWULETNIA OBSERWACJI WYNIKÓW PROFILAKTYKI I LECZENIA OSTEOPOROZY. PROGRAM POMOST
 30. DWULETNIA OBSERWACJI WYNIKÓW PROFILAKTYKI I LECZENIA OSTEOPOROZY. PROGRAM POMOST Przedlacki J, Księżopolska-Orłowska K, Grodzki A, Sikorska-Siudek K, Bartuszek T, Bartuszek D, Świrski A, Musiał J,
30. DWULETNIA OBSERWACJI WYNIKÓW PROFILAKTYKI I LECZENIA OSTEOPOROZY. PROGRAM POMOST Przedlacki J, Księżopolska-Orłowska K, Grodzki A, Sikorska-Siudek K, Bartuszek T, Bartuszek D, Świrski A, Musiał J,
Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r.
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy
Pułapki osteoporozy. Beata Kwaśny-Krochin Zakład Reumatologii UJ CM. INTERNA DLA REZYDENTÓW Listopad 2017, Kraków
 Pułapki osteoporozy Beata Kwaśny-Krochin Zakład Reumatologii UJ CM INTERNA DLA REZYDENTÓW 24-25 Listopad 2017, Kraków U kogo diagnozować osteoporozę? kobieta> 65 r.ż. mężczyzny >70 r.ż. przebyte złamanie
Pułapki osteoporozy Beata Kwaśny-Krochin Zakład Reumatologii UJ CM INTERNA DLA REZYDENTÓW 24-25 Listopad 2017, Kraków U kogo diagnozować osteoporozę? kobieta> 65 r.ż. mężczyzny >70 r.ż. przebyte złamanie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Spodziewany efekt kliniczny wpływu wit. K na kość
 Rola witaminy K2 w prewencji utraty masy kostnej i ryzyka złamań i w zaburzeniach mikroarchitektury Ewa Sewerynek, Michał Stuss Zakład Zaburzeń Endokrynnych i Metabolizmu Kostnego Uniwersytetu Medycznego
Rola witaminy K2 w prewencji utraty masy kostnej i ryzyka złamań i w zaburzeniach mikroarchitektury Ewa Sewerynek, Michał Stuss Zakład Zaburzeń Endokrynnych i Metabolizmu Kostnego Uniwersytetu Medycznego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 115/2012 z dnia 12 listopada w sprawie zasadności finansowania leku Procoralan (EAN 5909990340439) we wskazaniu:
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 115/2012 z dnia 12 listopada w sprawie zasadności finansowania leku Procoralan (EAN 5909990340439) we wskazaniu:
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Zasady postępowania w osteoporozie. skrócona wersja
 Zasady postępowania w osteoporozie skrócona wersja Zasady postępowania w osteoporozie skrócona wersja 1 U kogo wykonywać badania w kierunku osteoporozy? Badania w kierunku osteoporozy należy wykonać u
Zasady postępowania w osteoporozie skrócona wersja Zasady postępowania w osteoporozie skrócona wersja 1 U kogo wykonywać badania w kierunku osteoporozy? Badania w kierunku osteoporozy należy wykonać u
POZA KLASYCZNYM DOSSIER I SPEŁNIANIEM WYMOGÓW FORMALNYCH WYKORZYSTANIE REAL WORLD DATA, PRZEGLĄDY BURDEN OF ILLNESS I UNMET NEED.
 POZA KLASYCZNYM DOSSIER I SPEŁNIANIEM WYMOGÓW FORMALNYCH WYKORZYSTANIE REAL WORLD DATA, PRZEGLĄDY BURDEN OF ILLNESS I UNMET NEED Izabela Pieniążek Klasyczne dossier? Rozporządzenie MZ w sprawie MINIMALNYCH
POZA KLASYCZNYM DOSSIER I SPEŁNIANIEM WYMOGÓW FORMALNYCH WYKORZYSTANIE REAL WORLD DATA, PRZEGLĄDY BURDEN OF ILLNESS I UNMET NEED Izabela Pieniążek Klasyczne dossier? Rozporządzenie MZ w sprawie MINIMALNYCH
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
OSTEOPOROZA choroba milionów złamań FAKTY
 OSTEOPOROZA choroba milionów złamań FAKTY Czerwiński E. 1,2, Osieleniec J 2, Borowy P 2 1 Zakład Chorób Kości i Stawów, WOZ, Coll. Med. Uniwersytetu Jagiellońskiego 2 Krakowskie Centrum Medyczne, ul. Kopernika
OSTEOPOROZA choroba milionów złamań FAKTY Czerwiński E. 1,2, Osieleniec J 2, Borowy P 2 1 Zakład Chorób Kości i Stawów, WOZ, Coll. Med. Uniwersytetu Jagiellońskiego 2 Krakowskie Centrum Medyczne, ul. Kopernika
Protelos (ranelinian strontu)
 Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu produktu leczniczego Protelos (ranelinian strontu) we wskazaniu:
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu produktu leczniczego Protelos (ranelinian strontu) we wskazaniu:
Tomasz Szafrański UNIWERSYTET MEDYCZNY IM. KAROLA MARCINKOWSKIEGO W POZNANIU ODDZIAŁ REUMATOLOGII I OSTEOPOROZY SZPITAL IM. J. STRUSIA W POZNANIU
 5 Tomasz Szafrański UNIWERSYTET MEDYCZNY IM. KAROLA MARCINKOWSKIEGO W POZNANIU ODDZIAŁ REUMATOLOGII I OSTEOPOROZY SZPITAL IM. J. STRUSIA W POZNANIU Historia choroby pacjenta Pacjentka lat 67 Wzrost 156
5 Tomasz Szafrański UNIWERSYTET MEDYCZNY IM. KAROLA MARCINKOWSKIEGO W POZNANIU ODDZIAŁ REUMATOLOGII I OSTEOPOROZY SZPITAL IM. J. STRUSIA W POZNANIU Historia choroby pacjenta Pacjentka lat 67 Wzrost 156
Rekomendacja nr 19/2016 Prezesa AOTM z dnia 6 kwietnia 2016r.
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2016 z dnia 6 kwietnia 2016r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie zakwalifikowania
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2016 z dnia 6 kwietnia 2016r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie zakwalifikowania
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 16/2015 z dnia 17 marca 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 16/2015 z dnia 17 marca 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Zasadność finansowania mechanicznej trombektomii w leczeniu udaru mózgu. Dr n. med. Przemysław Ryś
 Zasadność finansowania mechanicznej trombektomii w leczeniu udaru mózgu Dr n. med. Przemysław Ryś Czy trombektomia powinna być refundowana? Jakie kryteria brane są pod uwagę? Kto podejmuje decyzję refundacyjną?
Zasadność finansowania mechanicznej trombektomii w leczeniu udaru mózgu Dr n. med. Przemysław Ryś Czy trombektomia powinna być refundowana? Jakie kryteria brane są pod uwagę? Kto podejmuje decyzję refundacyjną?
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 115/2014 z dnia 5 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Botox,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 115/2014 z dnia 5 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Botox,
z przerzutami guzów litych do kości.
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 38/2012 z dnia 25 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 38/2012 z dnia 25 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych realizowanych w ramach
"Postępowanie lecznicze w osteoporozie" Cz. II. Maria Rell-Bakalarska Interdyscyplinarna Akademia Medycyny Praktycznej
 "Postępowanie lecznicze w osteoporozie" Cz. II Maria Rell-Bakalarska Interdyscyplinarna Akademia Medycyny Praktycznej 15 Nasze najlepsze bo Mówi się często, że największym przekleństwem Polaków jest nadmiar
"Postępowanie lecznicze w osteoporozie" Cz. II Maria Rell-Bakalarska Interdyscyplinarna Akademia Medycyny Praktycznej 15 Nasze najlepsze bo Mówi się często, że największym przekleństwem Polaków jest nadmiar
Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Opinia Rady Przejrzystości nr 272/2018 z dnia 8 października 2018 roku w sprawie zalecanych technologii medycznych,
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Opinia Rady Przejrzystości nr 272/2018 z dnia 8 października 2018 roku w sprawie zalecanych technologii medycznych,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 45/2014 z dnia 28 stycznia 2014 r. w sprawie oceny leku Botox (toksyna botulinowa typu A 100 jednostek) we wskazaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 45/2014 z dnia 28 stycznia 2014 r. w sprawie oceny leku Botox (toksyna botulinowa typu A 100 jednostek) we wskazaniu
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska
 Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
ECHA ASBMR Krytyczne spojrzenie na aktualizację zaleceń American College of Physician dotyczących leczenia osteoporozy
 ECHA ASBMR 2017 Krytyczne spojrzenie na aktualizację zaleceń American College of Physician dotyczących leczenia osteoporozy EWA MARCINOWSKA - SUCHOWIERSKA KLINIKA GERIATRII CENTRUM MEDYCZNEGO KSZTAŁCENIA
ECHA ASBMR 2017 Krytyczne spojrzenie na aktualizację zaleceń American College of Physician dotyczących leczenia osteoporozy EWA MARCINOWSKA - SUCHOWIERSKA KLINIKA GERIATRII CENTRUM MEDYCZNEGO KSZTAŁCENIA
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Art. 24 ust. 7 pkt 2 ustawy o refundacji
 Minimalne wymagania dotyczące analiz uwzględnianych we wnioskach o objęcie refundacją i ustalenie oraz podwyższenie urzędowej ceny zbytu dla produktów, które nie mają odpowiednika refundowanego w danym
Minimalne wymagania dotyczące analiz uwzględnianych we wnioskach o objęcie refundacją i ustalenie oraz podwyższenie urzędowej ceny zbytu dla produktów, które nie mają odpowiednika refundowanego w danym
Xeplion (palmitynian paliperydonu) w leczeniu schizofrenii
 1 Wykonawca: Raport został wykonany na zlecenie i sfinansowany przez firmę Janssen-Cilag Polska Sp. z o.o. Autorzy nie zgłosili konfliktu interesów. Wersja 2.0 ostatnia aktualizacja dnia 4 sierpnia 2015
1 Wykonawca: Raport został wykonany na zlecenie i sfinansowany przez firmę Janssen-Cilag Polska Sp. z o.o. Autorzy nie zgłosili konfliktu interesów. Wersja 2.0 ostatnia aktualizacja dnia 4 sierpnia 2015
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację?
 Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 76/2015 z dnia 1 czerwca 2015 roku w sprawie oceny leku Lemtrada (alemtuzumab),
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 76/2015 z dnia 1 czerwca 2015 roku w sprawie oceny leku Lemtrada (alemtuzumab),
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA
 Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych wwwaotmgovpl Rekomendacja nr 52/2014 z dnia 24 lutego 2014 r Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonapeptyl
Agencja Oceny Technologii Medycznych wwwaotmgovpl Rekomendacja nr 52/2014 z dnia 24 lutego 2014 r Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Gonapeptyl
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 61/2013 z dnia 15 kwietnia 2013 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Przezcewnikowa nieoperacyjna
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 61/2013 z dnia 15 kwietnia 2013 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Przezcewnikowa nieoperacyjna
ZASADY PROFILAKTYKI, ROZPOZNAWANIA I LECZENIA OSTEOPOROTYCZNYCH Z AMAÑ KOŒCI
 STRONY KRAJOWEGO KONSULTANTA W DZIEDZINIE ORTOPEDII I TRAUMATOLOGII NARZ DU RUCHU I PREZESA POLSKIEGO TOWARZYSTWA ORTOPEDYCZNEGO I TRAUMATOLOGICZNEGO Ortopedia Traumatologia Rehabilitacja MEDSPORTPRESS,
STRONY KRAJOWEGO KONSULTANTA W DZIEDZINIE ORTOPEDII I TRAUMATOLOGII NARZ DU RUCHU I PREZESA POLSKIEGO TOWARZYSTWA ORTOPEDYCZNEGO I TRAUMATOLOGICZNEGO Ortopedia Traumatologia Rehabilitacja MEDSPORTPRESS,
www.aotm.gov.pl Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM
 XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
Analiza racjonalizacyjna Wersja 1.0. Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/5 02-516 Warszawa Tel. 22 542 41 54 E-mail: biuro@mahta.
 Adcetris (brentuksymab vedotin) w leczeniu dorosłych oraz dzieci od 12 r.ż. chorych na nawrotowego lub opornego na leczenie chłoniaka Hodgkina CD30+ oraz układowego chłoniaka anaplastycznego z dużych komórek
Adcetris (brentuksymab vedotin) w leczeniu dorosłych oraz dzieci od 12 r.ż. chorych na nawrotowego lub opornego na leczenie chłoniaka Hodgkina CD30+ oraz układowego chłoniaka anaplastycznego z dużych komórek
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 4/2015 z dnia 16 stycznia 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 4/2015 z dnia 16 stycznia 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 5/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Targin,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 5/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Targin,
Nie wszystko co się liczy może być policzone, nie wszystko co może być policzone liczy się
 (BIA) komu i po co Nie wszystko co się liczy może być policzone, nie wszystko co może być policzone liczy się Not everything that can be counted counts, and not everything that counts can be counted A.
(BIA) komu i po co Nie wszystko co się liczy może być policzone, nie wszystko co może być policzone liczy się Not everything that can be counted counts, and not everything that counts can be counted A.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2013 z dnia 21 stycznia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Levetiracetam
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 7/2013 z dnia 21 stycznia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Levetiracetam
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 264/2014 z dnia 29 grudnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esmya,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 264/2014 z dnia 29 grudnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esmya,
Cezary Strugała. Dr n.med. Cezary Strugała. Po prostu potknęłam się i złamałam nadgarstek Opis przypadku klinicznego
 Poradnia Leczenia Osteoporozy N.Z.O.Z. Nowy Szpital Świecie n/wisłą Poradnia Leczenia Osteoporozy N.Z.O.Z. Euromedica Grudziądz Dr n.med. Cezary Strugała Po prostu potknęłam się i złamałam nadgarstek Opis
Poradnia Leczenia Osteoporozy N.Z.O.Z. Nowy Szpital Świecie n/wisłą Poradnia Leczenia Osteoporozy N.Z.O.Z. Euromedica Grudziądz Dr n.med. Cezary Strugała Po prostu potknęłam się i złamałam nadgarstek Opis
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 1/2014 z dnia 7 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją i ustalenia urzędowej ceny
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 1/2014 z dnia 7 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją i ustalenia urzędowej ceny
ANALIZA PROBLEMU DECYZYJNEGO ZASTOSOWANIE DENOSUMABU W LECZENIU OSTEOPOROZY POMENOPAUZALNEJ
 ANALIZA PROBLEMU DECYZYJNEGO ZASTOSOWANIE DENOSUMABU W LECZENIU OSTEOPOROZY POMENOPAUZALNEJ Wersja 1.00 Kraków listopad 2013 HTA Consulting 2014 (www.hta.pl) Strona 2 SPIS TREŚCI 1. WSTĘP... 9 1.1. Cel
ANALIZA PROBLEMU DECYZYJNEGO ZASTOSOWANIE DENOSUMABU W LECZENIU OSTEOPOROZY POMENOPAUZALNEJ Wersja 1.00 Kraków listopad 2013 HTA Consulting 2014 (www.hta.pl) Strona 2 SPIS TREŚCI 1. WSTĘP... 9 1.1. Cel
Produkty złożone (combo) stosowane w nadciśnieniu tętniczym a system refundacji leków ocena potencjału oszczędności
 Produkty złożone (combo) stosowane w nadciśnieniu tętniczym a system refundacji leków ocena potencjału oszczędności MIEJ SERCE I PATRZAJ W SERCE... I TĘTNICE HEALTH PROJECT MANAGEMENT 23 maja 2016 r. Nieprzestrzeganie
Produkty złożone (combo) stosowane w nadciśnieniu tętniczym a system refundacji leków ocena potencjału oszczędności MIEJ SERCE I PATRZAJ W SERCE... I TĘTNICE HEALTH PROJECT MANAGEMENT 23 maja 2016 r. Nieprzestrzeganie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 79/2013 z dnia 1 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esbriet
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 79/2013 z dnia 1 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Esbriet
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 89/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania produktu leczniczego Nexavar (sorafenib),
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 89/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania produktu leczniczego Nexavar (sorafenib),
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 195/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Nplate,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 195/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Nplate,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 127/2013 z dnia 8 lipca 2013 r. w sprawie zasadności finansowania leku Benlysta (belimumab) 120 mg, EAN 5909990881123
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 127/2013 z dnia 8 lipca 2013 r. w sprawie zasadności finansowania leku Benlysta (belimumab) 120 mg, EAN 5909990881123
www.aotm.gov.pl Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 171/2013 z dnia 9 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Silgard,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 171/2013 z dnia 9 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Silgard,
Krótko na temat obowiązujących aktów prawnych, które regulują HTA. Co nowego wprowadziły minimalne wymagania i ustawa refundacyjna?
 KRYTYCZNE ETAPY OPRACOWYWANIA HTA DOSSIER - CZYLI JAK UNIKNĄĆ ODRZUCENIA Z PRZYCZYN METODOLOGICZNYCH? FORMALNE WYMOGI ANALITYCZNE PRZY SKŁADANIU WNIOSKÓW REFUNDACYJNYCH KUCHNIA ANALIZ ; WPŁYW ZMIAN LEGISLACYJNYCH
KRYTYCZNE ETAPY OPRACOWYWANIA HTA DOSSIER - CZYLI JAK UNIKNĄĆ ODRZUCENIA Z PRZYCZYN METODOLOGICZNYCH? FORMALNE WYMOGI ANALITYCZNE PRZY SKŁADANIU WNIOSKÓW REFUNDACYJNYCH KUCHNIA ANALIZ ; WPŁYW ZMIAN LEGISLACYJNYCH
Osteoporoza. (skrypt z najważniejszymi informacjami dla studentów nieobecnych na wykładzie)
 1 Osteoporoza (skrypt z najważniejszymi informacjami dla studentów nieobecnych na wykładzie) 1. Osteoporoza jest chorobą metaboliczną kości, charakteryzująca się zmniejszoną mineralną gęstością kości,
1 Osteoporoza (skrypt z najważniejszymi informacjami dla studentów nieobecnych na wykładzie) 1. Osteoporoza jest chorobą metaboliczną kości, charakteryzująca się zmniejszoną mineralną gęstością kości,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 120/2013 z dnia 9 września 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Vpriv
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 120/2013 z dnia 9 września 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Vpriv
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2013 z dnia 29 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Halaven
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2013 z dnia 29 lipca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Halaven
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 205/2013 z dnia 30 września 2013 r. w sprawie oceny leku Padolten (tramadol+paracetamol) (EAN: 5909990806294)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 205/2013 z dnia 30 września 2013 r. w sprawie oceny leku Padolten (tramadol+paracetamol) (EAN: 5909990806294)
Problemy kostne u chorych ze szpiczakiem mnogim doświadczenia własne
 Problemy kostne u chorych ze szpiczakiem mnogim doświadczenia własne dr n.med. Piotr Wojciechowski Szpiczak Mnogi Szpiczak Mnogi (MM) jest najczęstszą przyczyną pierwotnych nowotworów kości u dorosłych.
Problemy kostne u chorych ze szpiczakiem mnogim doświadczenia własne dr n.med. Piotr Wojciechowski Szpiczak Mnogi Szpiczak Mnogi (MM) jest najczęstszą przyczyną pierwotnych nowotworów kości u dorosłych.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 379/2013 z dnia 30 grudnia 2013 r. w sprawie zasadności dalszego finansowania produktów leczniczych zawierających
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 379/2013 z dnia 30 grudnia 2013 r. w sprawie zasadności dalszego finansowania produktów leczniczych zawierających
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 106/2014 z dnia 22 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Decaldol
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 106/2014 z dnia 22 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Decaldol
ANALIZA RACJONALIZACYJNA
 ANALIZA RACJONALIZACYJNA PALIWIZUMAB (SYNAGIS ) W ZAPOBIEGANIU CIĘŻKIEJ CHOROBIE DOLNYCH DRÓG ODDECHOWYCH WYWOŁANEJ WIRUSEM RS U DZIECI Z ISTOTNĄ HEMODYNAMICZNIE WRODZONĄ WADĄ SERCA Wersja 1.00 Kraków
ANALIZA RACJONALIZACYJNA PALIWIZUMAB (SYNAGIS ) W ZAPOBIEGANIU CIĘŻKIEJ CHOROBIE DOLNYCH DRÓG ODDECHOWYCH WYWOŁANEJ WIRUSEM RS U DZIECI Z ISTOTNĄ HEMODYNAMICZNIE WRODZONĄ WADĄ SERCA Wersja 1.00 Kraków
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 239/2014 z dnia 17 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego:
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 239/2014 z dnia 17 listopada 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego:
Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych
 Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych experience makes the difference Robert Plisko Świadczenie gwarantowane Świadczenie gwarantowane - świadczenie opieki zdrowotnej finansowane
Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych experience makes the difference Robert Plisko Świadczenie gwarantowane Świadczenie gwarantowane - świadczenie opieki zdrowotnej finansowane
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 13/2012 z dnia 26 marca 2012 r w zakresie zasadności zakwalifikowania leków Clatra (bilastinum) 20 mg, tabletki,
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 13/2012 z dnia 26 marca 2012 r w zakresie zasadności zakwalifikowania leków Clatra (bilastinum) 20 mg, tabletki,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 169/2013 z dnia 19 sierpnia 2013 r. w sprawie oceny produktu leczniczego Cervarix we wskazaniu: profilaktyka zmian
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 169/2013 z dnia 19 sierpnia 2013 r. w sprawie oceny produktu leczniczego Cervarix we wskazaniu: profilaktyka zmian
GŁÓWNE POWODY NEGATYWNYCH REKOMENDACJI AOTMIT. Izabela Pieniążek. Krakowskie Sympozjum HTA/MA 2015
 GŁÓWNE POWODY NEGATYWNYCH REKOMENDACJI AOTMIT Izabela Pieniążek Krakowskie Sympozjum HTA/MA 2015 1 ZAKRES ANALIZY REKOMENDACJI REFUNDACYJNYCH Zlecenia Ministra Zdrowia dotyczące przygotowania analizy weryfikacyjnej
GŁÓWNE POWODY NEGATYWNYCH REKOMENDACJI AOTMIT Izabela Pieniążek Krakowskie Sympozjum HTA/MA 2015 1 ZAKRES ANALIZY REKOMENDACJI REFUNDACYJNYCH Zlecenia Ministra Zdrowia dotyczące przygotowania analizy weryfikacyjnej
RAPORT OSTEOPOROZA - CICHA EPIDEMIA W POLSCE
 Europejska Fundacja Osteoporozy i Chorób Mięśniowo-Szkieletowych Polskie Towarzystwo Ortopedyczne i Traumatologiczne RAPORT OSTEOPOROZA - CICHA EPIDEMIA W POLSCE Kraków 2015-02-10 Spis treści 1. Zagrożenie
Europejska Fundacja Osteoporozy i Chorób Mięśniowo-Szkieletowych Polskie Towarzystwo Ortopedyczne i Traumatologiczne RAPORT OSTEOPOROZA - CICHA EPIDEMIA W POLSCE Kraków 2015-02-10 Spis treści 1. Zagrożenie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 169/2014 z dnia 7 lipca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktów leczniczych: Kiovig,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 169/2014 z dnia 7 lipca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktów leczniczych: Kiovig,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 349/2014 z dnia 1 grudnia 2014 r. w sprawie niezasadności zakwalifikowania świadczenia opieki zdrowotnej Wprowadzenie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 349/2014 z dnia 1 grudnia 2014 r. w sprawie niezasadności zakwalifikowania świadczenia opieki zdrowotnej Wprowadzenie
Warszawa, dnia 11 stycznia 2013 r. Poz. 44 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 20 grudnia 2012 r.
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 stycznia 2013 r. Poz. 44 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 20 grudnia 2012 r. w sprawie wzorów wniosków w zakresie refundacji leku, środka
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 stycznia 2013 r. Poz. 44 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 20 grudnia 2012 r. w sprawie wzorów wniosków w zakresie refundacji leku, środka
Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 53/2015 z dnia 27 kwietnia 2015 roku w sprawie oceny leku Diohespan (diosminum),
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 53/2015 z dnia 27 kwietnia 2015 roku w sprawie oceny leku Diohespan (diosminum),
15. KWALIFIKACJA DO LECZENIA FARMAKOLOGICZNEGO OSTEOPOROZY NA PODSTAWIE METODY FRAX I METODY JAKOŚCIOWEJ. BADANIE POMOST
 15. KWALIFIKACJA DO LECZENIA FARMAKOLOGICZNEGO OSTEOPOROZY NA PODSTAWIE METODY FRAX I METODY JAKOŚCIOWEJ. BADANIE POMOST J. Przedlacki, K. Księżopolska-Orłowska, A. Grodzki, T. Bartuszek, D. Bartuszek,
15. KWALIFIKACJA DO LECZENIA FARMAKOLOGICZNEGO OSTEOPOROZY NA PODSTAWIE METODY FRAX I METODY JAKOŚCIOWEJ. BADANIE POMOST J. Przedlacki, K. Księżopolska-Orłowska, A. Grodzki, T. Bartuszek, D. Bartuszek,
MINISTER ZDROWIA Warszawa,
 MINISTER ZDROWIA Warszawa, 2015-07-22 MD-L.070.25.2015(BK) Pani Małgorzata Kidawa - Błońska Marszałek Sejmu Rzeczypospolitej Polskiej W związku z interpelacją nr 33138 przedłożoną przez Pana Jerzego Sądela,
MINISTER ZDROWIA Warszawa, 2015-07-22 MD-L.070.25.2015(BK) Pani Małgorzata Kidawa - Błońska Marszałek Sejmu Rzeczypospolitej Polskiej W związku z interpelacją nr 33138 przedłożoną przez Pana Jerzego Sądela,
Osteoporoza. Opracowanie: dr n. med. Bogdan Bakalarek www.ortopeda.biz.pl Strona: 1 /5
 Osteoporoza Osteoporoza jest chorobą cywilizacyjną. Zagraża ona co dziesiątej osobie. Polega na nadmiernej utracie masy kostnej połączonej z osłabieniem wytrzymałości kości. Kości stają się kruche i łatwo
Osteoporoza Osteoporoza jest chorobą cywilizacyjną. Zagraża ona co dziesiątej osobie. Polega na nadmiernej utracie masy kostnej połączonej z osłabieniem wytrzymałości kości. Kości stają się kruche i łatwo
65 letnia kobieta leczona od 5 lat leczona alendronianem
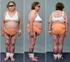 Piotr Głuszko NIGRR 65 letnia kobieta leczona od 5 lat leczona alendronianem obecnie neck T-score - 4,3 Kobieta lat 65, wzrost 160 cm, BMI 26, obecnie na emeryturze (nauczycielka), u której rozpoznano
Piotr Głuszko NIGRR 65 letnia kobieta leczona od 5 lat leczona alendronianem obecnie neck T-score - 4,3 Kobieta lat 65, wzrost 160 cm, BMI 26, obecnie na emeryturze (nauczycielka), u której rozpoznano
w zakresie refundacji leków z importu równoległego, która maja charakter jedynie techniczny i wpisuje się w ogólną filozofię i konstrukcję Projektu
 Propozycja SIRPL do projektu ustawy o zmianie ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych oraz niektórych innych ustaw (Projekt z dnia
Propozycja SIRPL do projektu ustawy o zmianie ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych oraz niektórych innych ustaw (Projekt z dnia
OSTEOPOROZA. bez tajemnic. Ulotka informacyjna.
 OSTEOPOROZA bez tajemnic Ulotka informacyjna www.wygrajmyzdrowie.pl Osteoporoza uznana została przez Światową Organizację Zdrowia (WHO) za jedną z głównych chorób cywilizacyjnych. Narażona jest na nią
OSTEOPOROZA bez tajemnic Ulotka informacyjna www.wygrajmyzdrowie.pl Osteoporoza uznana została przez Światową Organizację Zdrowia (WHO) za jedną z głównych chorób cywilizacyjnych. Narażona jest na nią
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Pozytywne skutki wdrożenia ustawy refundacyjnej - stanowisko rządu
 Warszawa, 23 marca 2017 r. Stanowisko organizacji wspierających pacjentów onkologicznych do sprawozdania z wykonania ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia
Warszawa, 23 marca 2017 r. Stanowisko organizacji wspierających pacjentów onkologicznych do sprawozdania z wykonania ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia
ANALIZA PROBLEMU DECYZYJNEGO ZASTOSOWANIE DENOSUMABU W LECZENIU OSTEOPOROZY U KOBIET PO MENOPAUZIE ORAZ U MĘŻCZYZN
 ANALIZA PROBLEMU DECYZYJNEGO ZASTOSOWANIE DENOSUMABU W LECZENIU OSTEOPOROZY U KOBIET PO MENOPAUZIE ORAZ U MĘŻCZYZN Wersja 2.0 Kraków grudzień 2015 HTA Consulting 2015 (www.hta.pl) Strona 2 SPIS TREŚCI
ANALIZA PROBLEMU DECYZYJNEGO ZASTOSOWANIE DENOSUMABU W LECZENIU OSTEOPOROZY U KOBIET PO MENOPAUZIE ORAZ U MĘŻCZYZN Wersja 2.0 Kraków grudzień 2015 HTA Consulting 2015 (www.hta.pl) Strona 2 SPIS TREŚCI
Rada Przejrzystości. Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji. Uzasadnienie. działająca przy
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 51/2015 z dnia 20 kwietnia 2015 roku w sprawie oceny leku Abilify Maintena
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 51/2015 z dnia 20 kwietnia 2015 roku w sprawie oceny leku Abilify Maintena
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 10/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego i
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 10/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego i
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia
 Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
ANEKS I 0BCHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I 0BCHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prolia 60 mg roztwór do wstrzykiwań w ampułkostrzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułkostrzykawka zawiera 60
ANEKS I 0BCHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prolia 60 mg roztwór do wstrzykiwań w ampułkostrzykawce 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda ampułkostrzykawka zawiera 60
10 postulatów pacjentów onkologicznych do systemu refundacyjnego. Spotkanie w Ministerstwie Zdrowia
 10 postulatów pacjentów onkologicznych do systemu refundacyjnego Spotkanie w Ministerstwie Zdrowia 22.11.2016 10 postulatów pacjentów onkologicznych do systemu refundacyjnego Postulaty środowiska pacjentów
10 postulatów pacjentów onkologicznych do systemu refundacyjnego Spotkanie w Ministerstwie Zdrowia 22.11.2016 10 postulatów pacjentów onkologicznych do systemu refundacyjnego Postulaty środowiska pacjentów
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 8/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją i ustalenia urzędowej ceny
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 8/2014 z dnia 13 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją i ustalenia urzędowej ceny
Czy AOTM uczestniczy w procesie kształtowania dostępności do szczepień ochronnych? Magdalena Władysiuk MD, MBA
 Czy AOTM uczestniczy w procesie kształtowania dostępności do szczepień ochronnych? Magdalena Władysiuk MD, MBA Immunoprofilaktyka chorób zakaźnych Uniknięcie negatywnych konsekwencji zdrowotnych związanych
Czy AOTM uczestniczy w procesie kształtowania dostępności do szczepień ochronnych? Magdalena Władysiuk MD, MBA Immunoprofilaktyka chorób zakaźnych Uniknięcie negatywnych konsekwencji zdrowotnych związanych
Agencja Oceny Technologii Medycznych Wydział do Spraw Systemów Ochrony Zdrowia
 Agencja Oceny Technologii Medycznych Wydział do Spraw Systemów Ochrony Zdrowia Wniosek o objęcie refundacją leku Forsteo (teryparatyd) we wskazaniu: leczenie osteoporozy spowodowanej długotrwałym stosowaniem
Agencja Oceny Technologii Medycznych Wydział do Spraw Systemów Ochrony Zdrowia Wniosek o objęcie refundacją leku Forsteo (teryparatyd) we wskazaniu: leczenie osteoporozy spowodowanej długotrwałym stosowaniem
