(62) Numer zgłoszenia, z którego nastąpiło wydzielenie: (86) Data i numer zgłoszenia międzynarodowego:
|
|
|
- Bronisław Domagała
- 6 lat temu
- Przeglądów:
Transkrypt
1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) (21) Numer zgłoszenia: (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: (62) Numer zgłoszenia, z którego nastąpiło wydzielenie: (86) Data i numer zgłoszenia międzynarodowego: , PCT/EP02/ (87) Data i numer publikacji zgłoszenia międzynarodowego: , WO02/ (51) Int.Cl. A61K 39/295 ( ) A61K 39/385 ( ) A61P 31/04 ( ) A61P 31/12 ( ) (54) Wieloważna kompozycja immunogenna i sposób jej wytwarzania (30) Pierwszeństwo: , GB, (43) Zgłoszenie ogłoszono: BUP 10/00 (45) O udzieleniu patentu ogłoszono: WUP 07/12 (73) Uprawniony z patentu: GLAXOSMITHKLINE BIOLOGICALS S.A., Rixensart, BE (72) Twórca(y) wynalazku: DOMINIQUE BOUTRIAU, Rixensart, BE CARINE CAPIAU, Rixensart, BE PIERRE MICHEL DESMONS, Rixensart, BE DOMINIQUE LEMOINE, Rixensart, BE JAN POOLMAN, Rixensart, BE (74) Pełnomocnik: rzecz. pat. Zofia Sulima PL B1
2 2 PL B1 Opis wynalazku Przedmiotem wynalazku jest wieloważna kompozycja immunogenna do wytworzenia u pacjenta ochrony przeciw chorobie wywołanej przez Haemophilus influenzae i Streptococcus pneumoniae oraz ta kompozycja do stosowania w leku oraz sposób jej wytwarzania. Wynalazek należy do dziedziny nowych skojarzonych preparatów szczepionkowych. Szczepionki skojarzone (które zapewniają ochronę przeciwko wielu patogenom) są bardzo pożądane w celu zminimalizowania liczby szczepień wymaganych dla zapewnienia ochrony przeciw wielu patogenom, aby zmniejszyć koszty podawania oraz zwiększyć wskaźnik przyjęcia szczepionki i zasięg szczepienia. Dobrze udokumentowane zjawisko współzawodnictwa (lub interferencji) antygenowego komplikuje opracowywanie wieloskładnikowych szczepionek. Interferencja antygenowa odnosi się do obserwacji, że podawanie wielu antygenów często wywołuje obniżenie odpowiedzi na pewne antygeny względem odpowiedzi immunologicznej obserwowanej gdy takie antygeny podaje się pojedynczo. Znane są szczepionki skojarzone, które mogą zapobiegać Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae oraz ewentualnie wirusowi zapalenia wątroby typu B i/lub Haemophilus influenzae typu b (patrz np. WO 93/24148 i WO 97/00697). Wynalazek dotyczy wieloważnej kompozycji immunogennej do wytwarzania u pacjenta ochrony przeciw chorobie wywołanej przez Haemophilus influenzae i Streptococcus pneumoniae, charakteryzującej się tym, że zawiera: (a) koniugat białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego H. influenzae typu B, oraz (b) jeden lub większą liczbę koniugatów białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego Streptococcus pneumoniae. Korzystnie kompozycja immunogenna zawiera dwa lub większą liczbę koniugatów białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego Streptococcus pneumoniae. Korzystniej kompozycja immunogenna zawiera ponad siedem koniugatów białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego Streptococcus pneumoniae. Korzystnie polisacharyd(y) lub oligosacharyd(y) otoczkowy(e) Streptococcus pneumoniae jest (są) z serotypu wybranego z grupy obejmującej: 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F i 33F. Korzystnie kompozycja immunogenna zawiera koniugaty białka nośnikowego i polisacharydów lub oligosacharydów otoczkowych Streptococcus pneumoniae serotypu 1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F. Korzystnie kompozycja immunogenna ponadto zawiera adiuwant. Korzystnie polisacharyd lub oligosacharyd otoczkowy H. influenzae typu B nie jest zaadsorbowany na adiuwancie z soli glinu. Korzystnie polisacharydy lub oligosacharydy otoczkowe S. pneumoniae są zaadsorbowane na adiuwancie z soli glinu. Korzystnie zarówno polisacharyd lub oligosacharyd otoczkowy H. influenzae typu B, jak i polisacharydy lub oligosacharydy otoczkowe S. pneumoniae nie są zaadsorbowane na adiuwancie z soli glinu. Korzystnie stosowane białko (białka) nośnikowe jest (są) wybrane z grupy obejmującej: anatoksynę tężcową, anatoksynę błoniczą, CRM197, rekombinowaną toksynę błoniczą, OMPC z N. meningitidis, pneumolizynę z S. pneumoniae i białko D z H. influenzae. Korzystnie polisacharyd lub oligosacharyd otoczkowy H. influenzae typu B i polisacharyd lub oligosacharyd otoczkowy z Streptococcus pneumoniae nie są sprzężone na tym samym nośniku. Korzystnie polisacharyd lub oligosacharyd otoczkowy H. influenzae typu B i polisacharyd lub oligosacharyd otoczkowy Streptococcus pneumoniae nie wszystkie są sprzężone z CRM197. Korzystnie białkiem nośnikowym polisacharydu lub oligosacharydu otoczkowego H. influenzae typu B jest anatoksyna tężcowa. Korzystnie białkiem nośnikowym dla wszystkich polisacharydów lub oligosacharydów otoczkowych S. pneumoniae jest białko D. Korzystnie kompozycja immunogenna jest formułowana jako szczepionka do podawania in vivo pacjentowi w taki sposób, że poszczególne składniki kompozycji formułuje się tak, że immunogenność poszczególnych składników nie jest zasadniczo osłabiona przez inne poszczególne składniki kompozycji.
3 PL B1 3 Korzystnie kompozycja immunogenna jest formułowana jako szczepionka do podawania in vivo pacjentowi, która wywołuje miano przeciwciał wyższe niż kryterium seroprotekcji dla każdego składnika antygenowego w akceptowalnym procencie pacjentów będących ludźmi. Wynalazek dotyczy także kompozycji immunogennej, zdefiniowanej powyżej do stosowania w leku. Wynalazek dotyczy również sposobu wytwarzania wieloważnej kompozycji immunogennej według obejmującego etap mieszania ze sobą poszczególnych składników. Możliwe jest wytwarzanie najbardziej, jak dotychczas, pożądanych szczepionek wieloważnych, których podawanie może zapobiegać lub leczyć zakażenia przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B i N. meningitidis oraz korzystnie także Haemophilus influenzae, Streptococcus pneumoniae, wirus zapalenia wątroby typu A i/lub wirus polio, przy czym składniki szczepionki nie wykazują znaczącej interferencji z aktywnościami immunologicznymi któregokolwiek ze składników szczepionki. Wraz z kompozycją według wynalazku można ewentualnie stosować wieloważną kompozycję immunogenną do zapewniania pacjentowi ochrony przeciw chorobie wywołanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio i N. meningitidis zawierającą: (a) uśmiercone całe komórki Bordetella pertussis (Pw), lub dwa lub większą liczbę bezkomórkowych składników krztuścowych (Pa) [korzystnie te drugie], (b) anatoksynę tężcową (TT lub T), (c) anatoksynę błoniczą (DT lub D), (d) antygen powierzchniowy wirusa zapalenia wątroby typu B (HepB lub HB), (e) inaktywowany wirus polio (IPV) i (f) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC). (g) ewentualnie koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib). Powyższa kompozycja immunogenna może ponadto zawierać jeden, dwa, trzy, cztery, pięć lub sześć składników wybranych z poniższej listy: polisacharyd N. meningitidis typu A [MenA] (korzystnie sprzężony), polisacharyd N. meningitidis typu W [MenW] (korzystnie sprzężony), polisacharyd Vi Salmonella typhi, pęcherzyki błony zewnętrznej N. meningitidis (korzystnie serotypu B), jedno lub większą liczbę z białek błony zewnętrznej (eksponowanych na powierzchni) N. meningitidis (korzystnie serotypu B) oraz uśmiercony, atenuowany wirus zapalenia wątroby typu A (HepA - korzystnie produkt znany jako Havrix [SmithKline Beecham Biologicals]) bez zasadniczych problemów interferencji dla któregokolwiek z antygenów kompozycji. Kompozycje według wynalazku można stosować w zestawach zawierających dwie lub trzy wieloważne kompozycje immunogenne, które to zestawy są zdolne do wytworzenia u pacjenta ochrony przeciw chorobie wywoływanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio i Streptococcus pneumoniae oraz ewentualnie także N. meningitidis i Haemophilus influenzae. Zgodnie z opisem można wytworzyć zestaw zawierający dwie wieloważne kompozycje immunogenne do wytwarzania u pacjenta ochrony przeciw chorobie wywoływanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio i Streptococcus pneumoniae oraz ewentualnie także N. meningitidis i Haemophilus influenzae. Zestaw zawiera pierwszy pojemnik zawierający: (a) uśmiercone całe komórki Bordetella pertussis (Pw), lub dwa lub większą liczbę bezkomórkowych składników krztuścowych (Pa) [korzystnie te drugie], (b) anatoksynę tężcową (TT lub T), (c) anatoksynę błoniczą (DT lub D), (d) antygen powierzchniowy wirusa zapalenia wątroby typu B (HepB lub HB) i (e) inaktywowany wirus polio (IPV), oraz drugi pojemnik zawierający: (2a) jeden lub większą liczbę koniugatów białka nośnikowego i polisacharydu otoczkowego Streptococcus pneumoniae [gdzie polisacharyd otoczkowy pochodzi korzystnie z pneumokokowego serotypu wybranego z grupy obejmującej 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F i 33F].
4 4 PL B1 W kolejnych korzystnych postaciach powyższego zestawu pierwszy pojemnik dodatkowo zawiera: (f) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC) oraz (g) koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib); lub drugi pojemnik dodatkowo zawiera: (2b) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC) oraz (2c) koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib); lub pierwszy pojemnik dodatkowo zawiera: (f) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC) oraz drugi pojemnik dodatkowo zawiera (2b) koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib); lub pierwszy pojemnik dodatkowo zawiera (f) koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib) oraz drugi pojemnik dodatkowo zawiera (2b) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC). Można wytworzyć również zestaw zawierający dwie wieloważne kompozycje immunogenne do wytwarzania u pacjenta ochrony przeciw chorobie wywoływanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio, N. meningitidis i Haemophilus influenzae. Zestaw zawiera pierwszy pojemnik zawierający: (a) uśmiercone całe komórki Bordetella pertussis (Pw), lub dwa lub większą liczbę bezkomórkowych składników krztuścowych (Pa) [korzystnie te drugie], (b) anatoksynę tężcową (TT lub T), (c) anatoksynę błoniczą (DT lub D), (d) antygen powierzchniowy wirusa zapalenia wątroby typu B (HepB lub HB) i (e) inaktywowany wirus polio (IPV), oraz drugi pojemnik zawierający: (2a) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC) oraz (2b) koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib). Można wytworzyć również zestaw zawierający trzy wieloważne kompozycje immunogenne do wytwarzania u pacjenta ochrony przeciw chorobie wywoływanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio, N. meningitidis, Haemophilus influenzae i Streptococcus pneumoniae. Zestaw zawiera pierwszy pojemnik zawierający: (a) uśmiercone całe komórki Bordetella pertussis (Pw), lub dwa lub większą liczbę bezkomórkowych składników krztuścowych (Pa) [korzystnie te drugie], (b) anatoksynę tężcową (TT lub T), (c) anatoksynę błoniczą (DT lub D), (d) antygen powierzchniowy wirusa zapalenia wątroby typu B (HepB lub HB) i (e) inaktywowany wirus polio (IPV), oraz drugi pojemnik zawierający: (2a) jeden lub większą liczbę koniugatów białka nośnikowego i polisacharydu otoczkowego Streptococcus pneumoniae [gdzie polisacharyd otoczkowy pochodzi korzystnie z pneumokokowego serotypu wybranego z grupy obejmującej 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F i 33F], oraz trzeci pojemnik zawierający: (3a) którykolwiek z lub obydwa z koniugatów białka nośnikowego i polisacharydu otoczkowego bakterii wybranej z grupy N. meningitidis typu Y (MenY) i N. meningitidis typu C (MenC) oraz (3b) koniugat białka nośnikowego i polisacharydu otoczkowego H. influenzae typu B (Hib) Którykolwiek z powyższych pojemników powyższych zestawów może ponadto zawierać jeden, dwa, trzy, cztery, pięć, sześć lub siedem składników wybranych z poniższej listy: polisacharyd N. meningitidis typu A [MenA] (korzystnie sprzężony), polisacharyd N. meningitidis typu W [MenW] (korzystnie sprzężony), polisacharyd Vi Salmonella typhi, pęcherzyki błony zewnętrznej N. meningitidis (korzystnie serotypu B), jedno lub większą liczbę z białek błony zewnętrznej (eksponowanych na powierzchni) N. meningitidis (korzystnie serotypu B), HepA (jak opisano powyżej) oraz jedno lub większą
5 PL B1 5 liczbę z białek (eksponowanych na powierzchni) S. pneumoniae bez zasadniczych problemów interferencji dla któregokolwiek z antygenów kompozycji. Pojemniki zestawu mogą być zapakowane osobno lub korzystnie zapakowane razem. Korzystnie zestaw dostarcza się wraz z instrukcjami dotyczącymi podawania szczepionek w dwóch lub większej liczbie pojemników. Gdy pojemnik w zestawie zawiera pewien koniugat polisacharydowy korzystne jest, aby taki sam koniugat nie był obecny w innych pojemnikach zestawu. Obecnie stwierdzono, że zestaw dostarczony w powyższy sposób korzystnie prezentuje różne antygeny układowi immunologicznemu pacjenta w optymalny sposób. Zestaw umożliwia lekarzowi medycyny zastosowanie optymalnej metody immunizacji pacjenta mającej jedną lub większą liczbę poniższych zalet (korzystnie 2 lub 3, a najkorzystniej wszystkie): skuteczność ochronna dla wszystkich antygenów, minimalna reaktogenność, minimalna interferencja związana z supresją nośnikową, minimalna interferencja adiuwant/antygen lub minimalna interferencja antygen/antygen. W ten sposób cele te można osiągnąć z minimalną liczbą (dwóch) szczepień, korzystnie przeprowadzanych podczas tej samej wizyty u lekarza. Chociaż w korzystnej postaci szczepionki z pierwszego i drugiego (i trzeciego, gdy ma to zastosowanie) pojemnika są podawane równocześnie w różne miejsca (jak opisano poniżej), przewiduje się jednak, że alternatywnie zawartość pierwszego i drugiego pojemnika może być zmieszana (korzystnie bezpośrednio) przed podaniem w pojedynczej szczepionce. Antygeny stosowane w kompozycjach według wynalazku opisano poniżej. Sposoby wytwarzania anatoksyny tężcowej (TT) są dobrze znane. Przykładowo TT korzystnie wytwarza się przez oczyszczenie toksyny z hodowli Clostridium tetani, a następnie poddanie jej chemicznej detoksykacji, ale alternatywnie wytwarza się przez oczyszczanie rekombinowanego lub genetycznie detoksykowanego analogu toksyny (np. jak opisano w EP ). Określenie anatoksyna tężcowa obejmuje także immunogenne fragmenty białka pełnej długości (np. Fragment C - patrz EP ). Sposoby wytwarzania anatoksyny błoniczej (DT) są również dobrze znane. Przykładowo DT korzystnie wytwarza się przez oczyszczenie toksyny z hodowli Corynebacterium diphtheriae, a następnie poddaje chemicznej detoksykacji, ale alternatywnie wytwarza się przez oczyszczanie rekombinowanego lub genetycznie detoksykowanego analogu toksyny (np. CRM197 lub inne mutanty opisane w opisach patentowych US , , i ). Wraz z kompozycją według wynalazku można stosować ewentualnie kompozycje zawierające antygeny opisane poniżej. Bezkomórkowe składniki krztuścowe (Pa) są dobrze znane. Przykłady obejmują anatoksynę krztuścową (PT), hemaglutyninę włókienkową (FHA), pertaktynę (PRN) i aglutynogeny 2 i 3. Antygeny te są częściowo lub całkowicie oczyszczone. Korzystnie w szczepionce stosuje się 2 lub większą liczbę bezkomórkowych składników krztuścowych. Korzystniej do szczepionki wprowadza się 2, 3, 4 lub wszystkie 5 powyższych przykładowych bezkomórkowych składników krztuścowych. Najkorzystniej wprowadza się PT, FHA i PRN. PT można wytwarzać na wiele różnych sposobów, np. przez oczyszczanie toksyny z hodowli B. pertussis, a następnie chemiczną detoksykację, lub alternatywnie przez oczyszczanie genetycznie detoksykowanego analogu PT (np. jak opisano w opisie patentowym US ). Sposoby wytwarzania uśmierconych całych komórek Bordetella pertussis (Pw) ujawniono w WO 93/24148, jak również odpowiednie sposoby wytwarzania szczepionek DT-TT-Pw-HepB i DT-TT-Pa-HepB. Inaktywowany wirus polio (IPV) korzystnie zawiera typy 1, 2 i 3, co jest typowe w dziedzinie szczepionek. Najkorzystniejsza jest szczepionka przeciw polio Salka. Zazwyczaj szczepionka przeciw Streptococcus pneumoniae według wynalazku zawiera antygeny polisacharydowe (korzystnie sprzężone), przy czym polisacharydy pochodzą z co najmniej czterech serotypów pneumokoków wybranych z grupy obejmującej 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F i 33F. Korzystnie te cztery serotypy obejmują 6B, 14, 19F i 23F. Korzystniej co najmniej siedem serotypów jest włączonych do preparatu, np. te pochodzące z serotypów 4, 6B, 9V, 14, 18C, 19F i 23F. Najkorzystniej więcej niż siedem serotypów jest włączonych do preparatu, np. co najmniej jedenaście serotypów. Przykładowo preparat w jednej postaci zawiera jedenaście polisacharydów otoczkowych pochodzących z serotypów 1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F (korzystnie sprzężonych). W korzystnej postaci wynalazku włączonych jest
6 6 PL B1 co najmniej 13 antygenów polisacharydowych (korzystnie sprzężonych), choć dalsze antygeny polisacharydowe, np, 23-ważne (takie jak serotypy 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F i 33F) są także uwzględniane w wynalazku. Do szczepienia osób starszych (np. w profilaktyce zapalenia płuc) korzystne jest włączenie serotypów 8 i 12F (a najkorzystniej także 15 i 22) do korzystnej 11-ważnej kompozycji antygenowej opisanej powyżej z wytworzeniem postaci 13/15-ważnej szczepionki, natomiast w przypadku niemowląt lub małych dzieci (gdy zapalenie ucha środkowego jest ważniejszą obawą) korzystnie włącza się serotypy 6A i 19A z wytworzeniem 13-ważnej szczepionki. Polisacharydy lub oligosacharydy stosuje się w zestawach w postaci koniugatów. Koniugaty bakteryjnego polisacharydu otoczkowego mogą zawierać jakikolwiek nośnikowy peptyd, polipeptyd lub białko zawierające co najmniej jeden epitop dla limfocytów T pomocniczych. Korzystnie stosowane nośnikowe białko (białka) jest (są) wybrane z grupy obejmującej: anatoksynę tężcową, anatoksynę błoniczą, CRM197, rekombinowaną toksynę błoniczą (jak opisano w którymkolwiek z opisów patentowych US , WO 93/25210, WO 95/33481 lub WO 00/48638), pneumolizynę (korzystnie chemicznie detoksykowaną lub detoksykowany mutant) z S. pneumoniae, OMPC z N. meningitidis oraz białko D z H. influenzae (EP ). Ze względu na znany efekt supresji nośnikowej korzystne jest, aby w każdej kompozycji według wynalazku antygeny polisacharydowe w niej zawarte ( n antygenów) były sprzężone z więcej niż jednym nośnikiem. Zatem (n-1) polisacharydów może być przeniesione (oddzielnie) na jednym typie nośnika, a 1 na innym nośniku, lub (n-2) na jednym, 2 na dwóch różnych nośnikach itd. Przykładowo w szczepionce zawierającej 4 koniugaty polisacharydów bakteryjnych, 1, 2 lub wszystkie 4 mogą być sprzężone z różnymi nośnikami). Jednak w kompozycjach według wynalazku jako nośnik korzystnie stosuje się białko D, ze względu na to, że może być ono stosowane do różnych (2, 3, 4 lub większej liczby) polisacharydów w kompozycji bez zaznaczonego efektu supresji nośnikowej. Najkorzystniej Hib jest obecny w postaci koniugatu TT, polisacharydy pneumokokowe są koniugatami z białkiem D, DT lub CRM197, a MenA, MenC, MenY i MenW są koniugatami z TT lub PD. Białko D jest także użytecznym nośnikiem gdyż stanowi ono kolejny antygen, który może zapewnić ochronę przeciwko H. influenzae. Polisacharyd może być sprzężony z białkiem nośnikowym jakąkolwiek znaną metodą (np. Likhite, opis patentowy US oraz Armor i in., opis patentowy US ). Korzystnie przeprowadza się sprzęganie metodą CDAP (WO 95/08348). W metodzie CDAP odczynnik cyjanylujący, tetrafluoroboran 1-cyjanodimetyloaminopirydyny (CDAP), korzystnie stosuje się do syntezy koniugatów polisacharyd-białko. Reakcję cyjanylacji można przeprowadzić w stosunkowo łagodnych warunkach, co zapobiega hydrolizie polisacharydów wrażliwych na zasady. Synteza ta pozwala na bezpośrednie sprzęganie z białkiem nośnikowym. Kompozycje immunogenne według wynalazku korzystnie formułuje się jako szczepionki do podawania in vivo pacjentowi w taki sposób, że poszczególne składniki kompozycji formułuje się tak, że immunogenność poszczególnych składników nie jest zasadniczo osłabiona przez inne poszczególne składniki kompozycji. Określenie nie jest zasadniczo osłabiona oznacza, że po zaszczepieniu uzyskiwane miano przeciwciał (np. IgG) przeciw każdemu składnikowi jest większe niż 60%, korzystnie większe niż 70%, korzystniej większe niż 80%, jeszcze korzystniej większe niż 90%, a najkorzystniej z zakresu % miana uzyskiwanego gdy antygen podaje się osobno. Co ciekawe, dla kompozycji w zestawach opisanych powyżej, po zaszczepieniu możliwe jest uzyskanie mian przeciwciał przeciw polisacharydowi otoczkowemu Hib lub pewnym polisacharydom pneumokokowym wynoszącego prawie lub ponad 100% miana uzyskiwanego gdy koniugat Hib podaje się oddzielnie. Kompozycje immunogenne według wynalazku korzystnie formułuje się jako szczepionki do podawania in vivo pacjentowi, tak że wywołują one miano przeciwciał większe niż kryterium seroprotekcji dla każdego składnika antygenowego w akceptowalnym procencie pacjentów będących ludźmi. Jest to ważny test w ocenie skuteczności szczepionki w populacji. Antygeny łącznie ze skojarzonym z nimi mianem przeciwciał, powyżej którego uważa się, że pacjent przeszedł serokonwersję przeciw antygenowi, są dobrze znane i takie miana są opublikowane przez organizacje takie jak WHO. Korzystnie ponad 80% istotnej statystycznie próbki osobników przechodzi serokonwersję, korzystniej ponad 90%, jeszcze korzystniej ponad 93% i najkorzystniej %. Kompozycje immunogenne według wynalazku są korzystnie adiuwantowane. Korzystne adiuwanty obejmują sól glinu, taką jak żel wodorotlenku glinu (ałun) lub fosforan glinu, ale mogą być także
7 PL B1 7 solą wapnia, żelaza lub cynku, lub mogą być nierozpuszczalną zawiesiną acylowanej tyrozyny lub acylowanych cukrów, kationowych lub anionowych pochodnych polisacharydów lub polifosfazenów. Adiuwant można także wybrać tak, by był preferencyjnym induktorem odpowiedzi typu TH1, aby ułatwić komórkową gałąź odpowiedzi immunologicznej. Wysoki poziom cytokin typu Th1 sprzyja indukcji komórkowej odpowiedzi immunologicznej na dany antygen, podczas gdy wysoki poziom cytokin typu Th2 sprzyja indukcji humoralnej odpowiedzi immunologicznej na antygen. Odpowiednie układy adiuwantów, które powodują głównie odpowiedź Th1 obejmują monofosforylolipid A lub jego pochodną, a zwłaszcza 3-de-O-acylowany monofosforylolipid A, połączenia monofosforylolipidu A, korzystnie 3-de-O-acylowanyego monofosforylolipidu A (3D-MPL) z solą glinu. Wzmocniony układ zawiera połączenie monofosforylolipidu A z pochodną saponiny, w szczególności połączenie QS21 i 3D-MPL, jak ujawniono w WO 94/00153, lub mniej reaktogenną kompozycję gdzie działanie QS21 jest tłumione przez cholesterol, jak ujawniono w WO 96/ Szczególnie silny preparat adiuwantowy zawierający QS21, 3D-MPL i tokoferol w emulsji typu olej w wodzie opisano w WO 95/ Szczepionka może dodatkowo zawierać saponinę, korzystniej QS21. Preparat może także zawierać emulsję typu olej w wodzie i tokoferol (WO 95/17210). Oligonukleotydy zawierające niemetylowane CpG (WO 96/02555) są także preferencyjnymi induktorami odpowiedzi TH1 i są odpowiednie do stosowania zgodnie z wynalazkiem. W powyższych kompozycjach immunogennych korzystnymi adiuwantami są sole glinu. W szczególności HepB powinien korzystnie być zaadsorbowany na fosforanie glinu przed zmieszaniem z innymi składnikami. Pertaktyna jest korzystnie zaadsorbowana na wodorotlenku glinu przed zmieszaniem z innymi składnikami. Aby zminimalizować poziom adiuwantu (w szczególności soli glinu) w kompozycji według wynalazku, koniugaty polisacharydowe mogą być nieadiuwantowane. Sposób wytwarzania preparatu szczepionki obejmuje etap mieszania składników szczepionki razem z farmaceutycznie dopuszczalną zaróbką. Szczególnie korzystna kompozycja DTPa (do stosowania wraz z kompozycją według wynalazku lub jako zawartość pierwszego pojemnika jednego z powyżej opisanych zestawów) zawiera: TT, DT, Pa (korzystnie obejmujące PT, FHA i PRN - z PRN korzystnie zaadsorbowaną na wodorotlenku glinu), HepB (korzystnie zaadsorbowany na fosforanie glinu), IPV, MenC (korzystnie sprzężony z którymkolwiek spośród białka D, TT, DT lub CRM197) i ewentualnie MenY (korzystnie sprzężony z którymkolwiek spośród białka D, TT, DT lub CRM197). Preparat może także dodatkowo zawierać Hib (korzystnie sprzężony z TT i/lub niezaadsorbowany na adiuwancie). Korzystnie szczepionkę można dostarczać w 2 fiolkach, z których pierwsza zawiera DTPa-IPV-HepB w postaci płynnej, druga zawiera MenC (i ewentualnie MenY i/lub Hib) w postaci liofilizowanej, korzystnie w obecności środka przeciwzbrylającego, takiego jak sacharoza, laktoza lub trehaloza. Zawartość fiolek można zmieszać w jednym pojemniku bezpośrednio przed podaniem pacjentowi pojedynczego podania/zastrzyku. Preparat może być także stosowany w zestawie powyżej opisanym (zawartość pierwszego pojemnika), W przypadku zestawów zawierających pojemnik zawierający Hib (korzystnie sprzężony z TT i/lub niezaadsorbowany na adiuwancie) i/lub którykolwiek z lub obydwa z MenC i MenY (korzystnie sprzężone na którymkolwiek z białka D, TT, DT lub CRM197 i/lub niezaadsorbowane na adiuwancie) preparat może być korzystnie przechowywany w postaci liofilizowanej, korzystnie w obecności środka przeciwzbrylającego, takiego jak sacharoza, laktoza lub trehaloza. W przypadku preparatów DTPa (do do stosowania wraz z kompozycją według wynalazku lub jako zawartość pierwszego pojemnika jednego z powyżej opisanych zestawów) zawierających pojemnik zawierający DTPa i Hib i/lub którykolwiek z lub obydwa z MenC i MenY, gdzie składniki Hib i/lub Men są sprzężone z TT, korzystne jest zrównoważenie zawartości TT w szczepionce, tak żeby zawartość TT w pojedynczym pojemniku nie była większa niż krytyczna wartość progowa (taka jak 40, 45, 50, 60, 70 lub 80 μg TT), aby zmniejszyć, zminimalizować lub zapobiec interferencji immunologicznej TT lub supresji nośnikowej polisacharydów sprzężonych z TT. Korzystnie ta wartość progowa wynosi 50 μg. Obecnie stwierdzono, że stosunek polisacharyd:tt może być zmniejszony w powyższych koniugatach do 1:0,5-1,5 wagowo (korzystnie 1:0,6-1,2, najkorzystniej około 1:1), aby był korzystny w tym przypadku. Przykładowo w szczepionce DTPa-HB-IPV-Hib(TT)-MenC(TT) ilość T w DTPa powinna być korzystnie obniżona poniżej zwykłej ilości (korzystnie o około jeden do trzech czwartych, najkorzystniej o około połowę normalnej ilości) do np μg TT, korzystnie μg TT. Przykładowo gdy ilość TT sprzężonego z Hib wynosi około 12 μg TT, a ilość sprzężonego z MenC wynosi około 5 μg TT, a ilość niesprzężonego TT wynosi 24 μg, całkowita ilość TT wynosi około 41 pg.
8 8 PL B1 Szczególnie korzystny preparat Hib/polisacharyd pneumokokowy (do niezależnego stosowania lub jako zawartość drugiego pojemnika jednego z powyżej opisanych zestawów) zawiera: Hib (korzystnie sprzężony z TT i/lub niezaadsorbowany na adiuwancie) lub więcej (np. więcej niż 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 lub 11) koniugatów polisacharydów pneumokokowych (np. te połączenia opisane powyżej w paragrafie szczepionka przeciw Streptococcus pneumoniae ). Najkorzystniej włączonych jest 11 polisacharydów (z serotypów 1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F). Korzystnie polisacharydy pneumokokowe są sprzężone z PD, DT, CRM197 lub TT. W korzystnej postaci, antygen polisacharydowy Hib nie jest zaadsorbowany na adiuwancie, w szczególności na solach glinu. Jednakże antygen(-y) polisacharydu pneumokokowego może (mogą) być adiuwantowany(-e) (korzystnie na fosforanie glinu), ale może (mogą) on (one) także nie być zaadsorbowany(-e) na adiuwancie, w szczególności na solach glinu. W szczególnej postaci kompozycja według wynalazku nie zawiera glinowej soli adiuwantowanej. Do preparatów według wynalazku mogą być włączone kolejne antygeny (np. koniugat polisacharydu otoczkowego N. meningitidis typu C [korzystnie sprzężony z którymkolwiek z białka D, TT, DT lub CRM197 i/lub niezaadsorbowany na adiuwancie]), jednakże w alternatywnej postaci, koniugaty Hib i polisacharydu pneumokokowego są jedynymi antygenami obecnymi w preparacie. W dalszej specyficznej postaci powyższych preparatów, Hib i polisacharydy pneumokokowe nie są sprzężone z takim samym nośnikiem (w szczególności gdy nośnikiem jest CRM197). Szczepionka może być dostarczana w jednym pojemniku (z zawartością w postaci płynnej lub liofilizowanej) lub w dwóch pojemnikach, pierwszym zawierającym Hib (korzystnie liofilizowany) i drugim zawierającym antygeny pneumokokowe (korzystnie w postaci płynnej). Preparaty liofilizowane są korzystnie w obecności środka przeciwzbrylającego, takiego jak sacharoza, laktoza lub trehaloza. Zawartość fiolek może być mieszana w pojedynczym pojemniku bezpośrednio przed podaniem pacjentowi w pojedynczym zastrzyku. Przy takim formułowaniu możliwe jest, po zaszczepieniu, uzyskanie miana przeciwciał przeciw polisacharydowi otoczkowemu Hib wynoszącego prawie lub często ponad 100% miana uzyskiwanego gdy koniugat Hib podaje się osobno. W korzystnych postaciach brak jest (istotnego) szkodliwego efektu wywieranego na koniugaty polisacharydu pneumokokowego (w odniesieniu do skuteczności ochronnej) w połączeniu, w porównaniu z podawaniem ich osobno. Można to ocenić mierząc średnie geometryczne stężeń przeciwciał (GMC) przeciw-polisacharydowych po podstawowych podaniach szczepionki, po jednym miesiącu od podania ostatniej dawki podstawowej (przy czym dawki podstawowe są pierwotnymi podaniami - zazwyczaj trzema - w pierwszym roku życia). GMC (w μg/ml) dla szczepionki według wynalazku powinna korzystnie wynosić ponad 55% (korzystniej ponad 60, 70, 80 lub 90%) GMC gdy polisacharydy pneumokokowe podaje się bez koniugatu Hib. Innym wskazaniem, że nie wystąpił żaden efekt szkodliwy jest fakt, że % osobników ze stężeniem przeciwciał nie mniejszym niż 0,5 μg/ml różni się nie więcej niż 10% (korzystnie mniej niż 9, 7, 5, 3 lub 1%) przy porównaniu danych po jednym miesiącu po podstawowych podaniach szczepionki według wynalazku względem szczepionki bez koniugatu Hib. Jakkolwiek powyższe stwierdzenia dotyczą polisacharydów Hib, pneumokokowych i meningokokowych, przewiduje się, że wynalazek można rozszerzyć na skrócone polisacharydy i oligosacharydy (polisacharydy o zmniejszonej wielkości dla zwiększenia łatwości w posługiwaniu się, ale nadal zdolne do wywoływania ochronnej odpowiedzi immunologicznej u pacjenta) Hib i pneumokokowe, które są dobrze znane w dziedzinie szczepionek (patrz np. EP ). W tych dodatkowych kompozycjach MenY może być obecny jako koniugat oligosacharydu z oligosacharydem o masie wynoszącej 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8 lub 0,9 masy cząsteczkowej natywnego polisacharydu. Immunogenna kompozycję lub szczepionkę tutaj ujawnioną można stosować w leku Opisane kompozycje można stosować do wytwarzania leku do leczenia lub profilaktyki chorób wywołanych przez zakażenia Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio i N. meningitidis (i dodatkowo Haemophilus influenzae). Ponadto możliwe jest zastosowanie kompozycji immunogennych według wynalazku do wytwarzania zestawu szczepionkowego do leczenia lub profilaktyki chorób wywołanych przez zakażenie Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio, Haemophilus influenzae, Streptococcus pneumoniae i N. meningitidis. Szczepienie pacjenta będącego człowiekiem przeciw chorobie wywołanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio i N. meningitidis (i ewentualnie Haemophilus influenzae) można przeprowadzić sposobem polegającym na podawaniu pacjentowi immunoochronnej dawki opisanej kompozycji immunogennej.
9 PL B1 9 Kompozycje można włączyć do zestawów i zastosować w sposobie szczepienia pacjenta będącego człowiekiem przeciw chorobie wywołanej przez Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, wirus zapalenia wątroby typu B, wirus polio oraz jeden lub większą liczbę z Haemophilus influenzae, Streptococcus pneumoniae i N. meningitidis, z użyciem opisanych powyżej zestawów według wynalazku, który to sposób obejmuje schemat równoczesnego podawania, jak zdefiniowano poniżej. Taki schemat obejmuje etap podawania pacjentowi immunoochronnej dawki kompozycji immunogennej z pierwszego pojemnika zestawu (np. jednego z zestawów zawierających kompozycję według wynalazku) w inne miejsce, drenowane przez inne węzły limfatyczne, niż miejsce w które podaje się kompozycję immunogenna z drugiego (lub trzeciego) pojemnika zestawu. Korzystnie różnymi miejscami są różne kończyny. Korzystnie podawanie szczepionek przeprowadza w ciągu 24 godzin, korzystniej tego samego dnia, a najkorzystniej podczas tej samej wizyty pacjenta u lekarza. Korzystnie pacjentowi równocześnie podaje się obydwie (lub wszystkie) podstawowe dawki w ten sam sposób jeden lub większą (korzystnie 2) ilość kolejnych razy, z czego każda dawka jest oddzielone o 2-12 tygodni (korzystnie o około 1 miesiąc). Często trzecia dawka podstawowa może być podana po 2 tygodniach do 7 miesięcy po drugiej dawce. Przykładowo szczepionkę można podać jak powyżej według normalnego schematu podawania szczepionek DTP (takiego jak system 3 wizyt, z czego każda z wizyt jest oddzielona o jeden miesiąc, np. schemat podawania w wieku 3, 4 i 5 miesięcy; lub 3, 5 i 11; lub 3, 5 i 12 miesięcy). Taki schemat podawania pozwala zoptymalizować odpowiedź immunologiczną przeciw antygenom w obydwu (lub wszystkich) pojemnikach zestawu. Dawkę przypominającą szczepionki można podać w ten sam sposób kiedykolwiek zaczynając od 2 roku życia do dorosłości. Podczas gdy dawki podstawowe korzystnie podaje się na drodze domięśniowej, dawkę przypominającą korzystnie można podać na drodze dośluzówkowej, ewentualnie w obecności adiuwantu śluzówkowego (korzystnie laureth-9 lub termolabilna toksyna [LT] z E. coli i jej mutanty lub fragmenty), (np. donosowe dawkowanie szczepionek jest łatwe w podawaniu i może działać wyjątkowo dobrze szczególnie gdy podstawową dawkę podawano pacjentowi pozajelitowe) i miejsce podawania szczepionek nie powinno być drenowane do innych węzłów limfatycznych. W sposobie wytwarzania zestawu szczepionkowego do równoczesnego podawania przewiduje się także zastosowanie kompozycji immunogennych według wynalazku w pojemnikach. Zestawy mogą zawierać TT w dwóch lub większej liczbie pojemników. W zestawach szczepionkowych do równoczesnego podawania (jak zdefiniowano powyżej) zawartość TT w jednej lub większej liczbie pojemników może być zrównoważona, aby korzystnie obniżyć, zminimalizować lub zapobiec interferencji immunologicznej TT lub supresji nośnikowej polisacharydów sprzężonych z TT. TT jest wyjątkowo dobrym nośnikiem, jednakże wiadomo, że ma ograniczenia gdy jest stosowana w nadmiarze w kompozycji szczepionki, szczególnie gdy jest obecna także wolna TT. Gdy jest ona stosowana nadmiernie, wszystkie antygeny sprzężone z TT wykazują obniżone miana przeciwciał. Zatem w dziedzinie wynalazku istnieje osobny problem dotyczący tego jak należy stosować TT na wiele różnych sposobów (np. jako wolny antygen i jako nośnik dla wielu antygenów polisacharydowych) w dużej szczepionce skojarzonej bez powyższych niekorzystnych cech. Obecnie opracowano optymalny sposób rozwiązania tego problemu; to znaczy dzięki zastosowaniu schematu równoczesnego podawania zestawu kompozycji (jak zdefiniowano powyżej) można podawać szczepionkę w pierwszym pojemniku zawierającym TT w ilości nie większej niż krytyczna wartość progowa, przy której występuje interferencja immunologiczna lub supresja nośnikowa, wraz ze szczepionką w drugim (i ewentualnie trzecim) pojemniku zawierającym TT w ilości nie większej niż krytyczna wartość progowa przy której występuje interferencja immunologiczna lub supresja nośnikowa, tak że całkowita ilość TT równocześnie podawanej jest powyżej swojej krytycznej wartości progowej i interferencja immunologiczna (lub supresja nośnikowa) jest zminimalizowana (tj. niższa niż gdyby składniki były podane w jednym zastrzyku), a korzystnie w ogóle nie występuje. Krytyczna wartość progowa może wynosić 40, 45, 50, 60, 70 lub 80 μg TT i korzystnie wynosi 50 μg TT. Zatem maksymalna całkowita ilość TT, która może być podana jest zbliżona do wartości wyprowadzonej z liczby pojemników zestawu (dwa lub trzy) pomnożonej przez krytyczną wartość progową. Zestaw może zawierać dwa (lub trzy) pojemniki zawierające dwie (lub trzy) kompozycje immunogenne do równoczesnego podawania, z których każdy zawiera TT w postaci wolnej i/lub koniugatu, przy czym ilość TT w każdym pojemniku nie jest większa niż krytyczna wartość progowa, aby przeciwdziałać lub zminimalizować efekty interferencji immunologicznej TT (lub supresji nośnikowej), ale całkowita ilość TT we wszystkich pojemnikach jest większa niż ta krytyczna wartość progowa.
10 10 PL B1 Korzystnie co najmniej jeden z pojemników powinien zawierać wolną (niesprzężoną) TT, najkorzystniej w kontekście wieloważnej szczepionki DTPa lub DTPw. Pomimo tego, że wolna TT może być obecna w ilości zbliżonej do poziomu około 42 μg, kolejną zaletą zestawu jest możliwość, aby obecne były mniejsze ilości (10-30 lub μg, np. 10, 15, 20, 25 lub 30 μg), a optymalne miana przeciwciał przeciw-tt nadal mogą być wytworzone przy minimalnych efektach interferencji immunologicznej lub supresji nośnikowej (lub przy ich braku). Korzystnie co najmniej jeden (możliwie 2 lub 3) pojemnik powinien zawierać co najmniej jeden (możliwie 2, 3, 4, 5, 6, 7 lub większą liczbę) polisacharyd sprzężony z TT. Gdy wolna TT jest obecna w jednym pojemniku korzystne jest, aby co najmniej jeden polisacharyd sprzężony z TT był w jednym z pojemników zestawu. Polisacharydem może być którykolwiek z opisanych tu polisacharydów, korzystnie jeden lub większa liczba polisacharydów pneumokokowych (jak opisano powyżej) lub MenC, MenY lub Hib. Korzystnie zestaw jest którymkolwiek z zestawów, jak opisano powyżej. Korzystnie jeden, dwa, trzy lub wszystkie koniugaty polisacharyd-tt obecne w zestawie są takie, że stosunek polisacharyd-tt jest obniżony (w porównaniu z typowymi koniugatami) do 1:0,5-1,5 wagowo (korzystnie 1:0,6-1,2, najkorzystniej około 1:1), tak że koniugaty są nadal funkcjonalne immunologicznie, ale efekty interferencji immunologicznej TT lub supresji nośnikowej są zminimalizowane lub uniemożliwione. Ponadto możliwy jest sposób immunizacji pacjenta będącego człowiekiem z użyciem powyższego zestawu, przez podawanie pacjentowi dawki immunoochronnej kompozycji immunogennej z pierwszego pojemnika w pierwsze miejsce, podawanie pacjentowi dawki immunoochronnej kompozycji immunogennej z drugiego pojemnika w drugie miejsce (oraz ewentualnie podawanie pacjentowi dawki immunoochronnej kompozycji immunogennej z trzeciego pojemnika w trzecie miejsce), przy czym pierwsze i drugie (oraz trzecie) miejsce są drenowane przez różne węzły limfatyczne. Równoczesne podawanie powinno być przeprowadzone jak opisano powyżej. Korzystnie pierwsze i drugie (oraz trzecie) miejsce stanowią różne kończyny pacjenta. Korzystnie kompozycja immunogenna z pierwszego i drugiego (oraz trzeciego) pojemnika podaje się tego samego dnia. Korzystnie pacjent jest następnie szczepiony w ten sam sposób jeden lub większą liczbę razy, z czego każde szczepienie jest oddzielone od siebie o 2-12 tygodni, korzystniej dwa kolejne razy, z czego każde szczepienie jest oddzielone od siebie o okres około 1-2 miesięcy. Zestawy mogą zawierać DT lub CRM197 w dwóch lub większej liczbie pojemników. W zestawach szczepionkowych do równoczesnego podawania (jak zdefiniowano powyżej) zawartość DT (włącznie z DT i immunologicznie identycznymi mutantami, takimi jak CRM197) w jednym lub większej liczbie pojemników może być zrównoważona, aby korzystnie podwyższyć miana przeciwciał przeciw DT (lub CRM197) sprzężonej z polisacharydem przy minimalizacji reaktogenności (tj. niższej reaktogenności niż występująca gdy składniki pojemników podaje się w pojedynczym zastrzyku). DT i CRM197 są wyjątkowo dobrymi nośnikami, jednakże wiadomo, że DT w dużym stopniu odpowiada za reaktogenność szczepionek zawierających ją. Obecnie stwierdzono, że przez zastosowanie schematu podawania zestawu (jak zdefiniowano powyżej), szczepionka w pierwszym pojemniku zawiera DT (i/lub CRM197) korzystnie w dużej ilości ( μg, korzystnie μg, korzystniej μg, najkorzystniej około 95 μg), gdy równocześnie podaje się szczepionkę w drugim (lub dodatkowo trzecim) pojemniku zawierającą polisacharyd sprzężony z DT lub CRM197. Zalety są takie, że a) pomimo tego, że zawartość DT jest wysoka w pierwszym pojemniku nie jest wystarczająco wysoka, aby zaindukować interferencję immunologiczną DT lub supresję nośnikową, b) koniugat DT- lub CRM197-polisacharyd jest oddzielony od pierwszego pojemnika, tak że reaktogenność szczepionki w pierwszym pojemniku nie jest podwyższona, ale c) miano przeciwciał przeciw polisacharydowi sprzężonemu z DT lub CRM197 nie jest obniżone i może być podwyższone (wyższe miana w porównaniu z występującymi gdy koniugat podaje się osobno lub w porównaniu z występującymi gdy mniejsze ilości DT są obecne w pierwszym pojemniku). Zestaw może zawierać dwa (lub trzy) pojemniki zawierające dwie (lub trzy) kompozycje immunogenne do równoczesnego podawania (jak zdefiniowano powyżej), przy czym pierwszy pojemnik zawiera wysoką ilość DT (DT plus CRM197; korzystnie wolną lub niesprzężoną) (jak zdefiniowano powyżej) oraz drugi (i trzeci) pojemnik zawiera jeden lub większą liczbę polisacharydów sprzężonych z DT i/lub CRM197. Korzystnie pierwszy pojemnik powinien zawierać wolną (niesprzężoną) DT, najkorzystniej w kontekście wieloważnej szczepionki DTPa lub DTPw.
11 PL B1 11 Polisacharydem(-ami) sprzężonym(-i) z DT/CRM197 może być którykolwiek opisany tu polisacharyd, korzystnie jeden lub większa liczba z poniższej listy: polisacharydy pneumokokowe 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F lub 33F, MenC, MenY lub Hib. Korzystnie odpowiedź przeciwciał (miana przeciwciał) przeciw jednemu lub większej liczbie tych polisacharydów jest utrzymywana na poziomie porównywalnym jak przy podawaniu samego koniugatu, a najkorzystniej jest podwyższona. Korzystnie zestaw jest którymkolwiek z zestawów według wynalazku, jak opisano powyżej. Korzystnie jeden, dwa, trzy lub wszystkie koniugaty polisacharyd-dt (lub CRM197) obecne w zestawie są takie, że stosunek polisacharyd:dt/crm197 jest obniżony (w porównaniu z typowymi koniugatami) do 1:0,5-1,5 wagowo (korzystnie 1:0,6-1,2, najkorzystniej około 1:1). Ponadto możliwy jest sposób immunizacji pacjenta będącego człowiekiem z użyciem powyższego zestawu, przez podawanie pacjentowi dawki immunoochronnej kompozycji immunogennej z pierwszego pojemnika w pierwsze miejsce, na podawaniu pacjentowi dawki immunoochronnej kompozycji immunogennej z drugiego pojemnika w drugie miejsce (oraz ewentualnie na podawaniu pacjentowi dawki immunoochronnej kompozycji immunogennej z trzeciego pojemnika w trzecie miejsce), przy czym pierwsze i drugie (oraz trzecie) miejsce są drenowane przez różne węzły limfatyczne. Równoczesne podawanie powinno być przeprowadzone jak opisano powyżej. Korzystnie pierwsze i drugie (oraz trzecie) miejsce stanowią różne kończyny pacjenta. Korzystnie kompozycje immunogenne z pierwszego i drugiego (oraz trzeciego) pojemnika podaje się tego samego dnia. Korzystnie pacjent jest następnie szczepiony w ten sam sposób jeden lub większą liczbę razy, z czego każde szczepienie jest oddzielone od siebie o 2-12 tygodni, korzystniej dwa kolejne razy, z czego każde szczepienie jest oddzielone od siebie o okres około 1-2 miesięcy. Preparaty szczepionkowe według wynalazku można stosować do ochrony lub leczenia ssaka podatnego na zakażenie, przez podawanie wspomnianej szczepionki drogą ogólnoustrojową lub dośluzówkową. To podawanie może obejmować wstrzykiwanie na drodze domięśniowej, śródotrzewnowej, śródskórnej lub podskórnej; lub podawanie dośluzówkowe doustnie/do przewodu pokarmowego, do dróg oddechowych (np. donosowo), do dróg moczowo-płciowych. Ilość antygenu w każdej dawce szczepionki jest wybrana jako ilość, która wywołuje odpowiedź immunologiczną bez znaczących szkodliwych działań ubocznych w typowych szczepionkach. Taka ilość będzie różnić się zależnie od tego jaki konkretny immunogen jest stosowany oraz jak jest on prezentowany. Ogólnie oczekuje się, że każda dawka będzie zawierać 0,1-100 μg polisacharydu, korzystnie 0,1-50 μg korzystnie 0,1-10 μg, z czego 1-5 μg jest najkorzystniejszym zakresem. Zawartość antygenów białkowych w szczepionce zazwyczaj będzie z zakresu μg, korzystnie 5-50 μg, najczęściej z zakresu 5-25 μg. Po podstawowym szczepieniu pacjenci mogą otrzymać jedną lub kilka immunizacji przypominających odpowiednio od siebie oddzielonych. Wytwarzanie szczepionek ogólnie opisano w Vaccine Design ( The subunit and adjuvant approach (red. Powell MR i Newman MJ.) (1995) Plenum Press New York). Zamykanie w liposomach opisał Fullerton, opis patentowy US Wynalazek ilustrują następujące przykłady Przykłady zamieszczono głównie w celu zilustrowania wynalazku i nie ograniczają one jego zakresu. P r z y k ł a d 1. Wytwarzanie szczepionki DT-TT-Pa-IPV-HepB (DTPalPVHepB) Szczepionkę wytworzono w sposób opisany w WO 93/ Szczepionka jest dostępna w handlu pod nazwą Infanrix-PeNTa (SmithKline Beecham Biologicals). P r z y k ł a d 2. Wytwarzanie szczepionki MenC lub MenC-MenY MenC: polisacharyd otoczkowy N. meningitidis typu C sprzężony z białkiem D lub TT (metodą CDAP) obecny w ilości 5 μg polisacharydu w koniugacie na 0,5 ml dawkę dla człowieka. Odczyn doprowadzono do ph 6,1 i przeprowadzono liofilizację w obecności sacharozy. MenCMenY: polisacharyd otoczkowy N. meningitidis typu C sprzężony z białkiem D lub TT (metodą CDAP) i polisacharyd otoczkowy N. meningitidis typu Y sprzężony z białkiem D lub TT (metodą CDAP) zmieszano w ilości 5 μg polisacharydu w każdym koniugacie na 0,5 ml dawkę dla człowieka. Odczyn doprowadzono do ph 6,1 i przeprowadzono liofilizację w obecności sacharozy.
12 12 PL B1 P r z y k ł a d 3. Wytwarzanie szczepionki DT-TT-Pa-IPV-HepB-MenC-MenY (DTPalPVHepB/MenCMenY) lub DT-TT-Pa-IPV-HepB-MenC (DTPalPVHepB/MenC) Szczepionki z przykładu 1 i przykładu 2 zmieszano bezpośrednio (tego samego dnia) przed użyciem. P r z y k ł a d 4. Wytwarzanie szczepionki Hib - 11-ważny koniugat pneumokokowy (Hib/Strep11V) Polisacharyd otoczkowy H. influenzae typu b sprzężony z TT (10 μg polisacharydu w koniugacie na dawkę), który poddano liofilizacji w ph 6,1 w obecności laktozy [Hiberix (SmithKline Beecham Biologicals)] bezpośrednio (tego samego dnia) przed użyciem rozpuszczono w roztworze wodnym 11- -ważnego pneumokokowego polisacharydu otoczkowego (serotypy 1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F) sprzężonego z PD (1 μg polisacharydu w każdym koniugacie na dawkę). Szczepionkę pneumokokową wcześniej zaadsorbowano na 0,5 mg Al 3+ (w postaci AIPO 4 ). P r z y k ł a d 5. Próby kliniczne Badania szczepionki z przykładu 4 Szczepionkę z przykładu 4 i szczepionkę kontrolną podano w schemacie trójdawkowym (trzeci, czwarty, piąty miesiąc życia) niemieckim niemowlętom. Wyniki odpowiedzi immunologicznej (zmierzone 1 miesiąc po ostatniej dawce podstawowej) były następujące. Przeciwciała IgG przeciw-pneumokokowe: GCM(μg/ml)(Elisa) PS Grupa A Grupa D Przeciwciało Czas N S+[%] GMC N S+[%] GMC Przeciw-1 PIII , ,99 Przeciw-3 PIII , ,0 1,20 Przeciw-4 PIII , ,03 Przeciw-5 PIII , ,34 Przeciw-6B PIII , ,62 Przeciw-7F PIII , ,33 Przeciw-9V PIII , ,21 Przeciw-14 PIII , ,32 Przeciw-18C PIII , ,04 Przeciw-19F PIII , ,92 Przeciw-23F PIII 30 96,7 0, ,76 Grupa A = 11Pn-PD + Infanrix-HeXa (Infanrix-Penta plus dodany koniugat Hib-DTPa-HB-IPV-Hib) Grupa D = 11Pn-PD/Hib + Infanrix-PeNTa (DTPa-HB-IPV) + wskazuje podawanie raczej równoczesne (w różne kończyny) niż połączone. Procent osobników ze stężeniem przeciwciał nie niższym niż 0,5 μg/ml Grupa PS B 7F 7V 14 18C 19F 23F D 84,8 87,9 87,9 90,9 51,5 90,9 93,9 97,0 81,8 97,0 72,7 A 86,7 96,7 76,7 90,0 50,0 93,3 90,0 90,0 80,0 96,7 66,7
13 PL B1 13 Przeciwciała przeciw PRP: GMC (μg/ml)(elisa) Grupa D (N - 34) n 1 μg/ml [%] GMC [μg/ml] Przeciw- PRP PIH ,75 100% osobników miało stężenie przeciwciał przeciw-prp (polisacharyd Hib) nie niższe niż 1,0 μg/ml. Hiberix (niezaadsorbowany koniugat Hib-TT) wykazywał GMC po podobnym schemacie podania około 6 μg/ml. Odpowiedź immunologiczna, w odniesieniu do przeciwciał według ELISA, u niemowląt które otrzymywały szczepionkę 11Pn-PD/Hib była podobna do obserwowanej u niemowląt otrzymujących szczepionkę 11Pn-PD dla wszystkich serotypów, z wyjątkiem serotypów 1, 3 i 9V, dla których tendencję do obniżenia geometrycznych średnich stężeń obserwowano w przypadku szczepionki 11Pn- -PD/Hib. Jednakże różnice te nie były istotne, jak pokazały pokrywające się 95% przedziały ufności. Szczepionka 11Pn-PD/Hib indukowała podobne (opsonofagocytowe) przeciwciała dla wszystkich 11 serotypów. Połączenie szczepionki Hib ze szczepionką z koniugatem pneumokokowym nie wpływało istotnie na pneumokokową odpowiedź immunologiczną oraz nieoczekiwanie wzmacniało odpowiedź przeciw PRP w porównaniu z obydwiema zarejestrowanymi szczepionkami Infanrix-HeXa i Hiberix. Badania szczepionek z przykładu 3 lub równoczesnego podawania szczepionek z przykładu 3 i przykładu 4 Badanie 1 Można ocenić bezpieczeństwo i immunogenność szczepionki Infanrix-PeNTa zmieszanej z koniugatem MenC podanej ze szczepionką Hib lub równocześnie z 11-ważną szczepionką pneumokokową zmieszaną z Hiberix. Obydwa nośniki PD i TT można ocenić pod względem sprzęgania z MenC. Szczepionki można podawać jako szczepionki trójdawkowe u dzieci. Równoczesne wstrzyknięcie można wykonać do różnych kończyn, podając szczepionki podczas tej samej wizyty u lekarza. Badanie 2 Można ocenić bezpieczeństwo i immunogenność szczepionki Infanrix-PeNTa zmieszanej z koniugatem MenC-MenY podanej ze szczepionką Hib lub równocześnie z 11-ważną szczepionką pneumokokową zmieszaną z Hiberix. Obydwa nośniki PD i TT można ocenić pod względem sprzęgania z MenC i MenY. Szczepionki można podawać jako szczepionki trójdawkowe u dzieci. Równoczesne wstrzyknięcie można wykonać do różnych kończyn, podając szczepionki podczas tej samej wizyty u lekarza. Zastrzeżenia patentowe 1. Wieloważna kompozycja immunogenna do wytworzenia u pacjenta ochrony przeciw chorobie wywołanej przez Haemophilus influenzae i Streptococcus pneumoniae, znamienna tym, że zawiera: (a) koniugat białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego H. influenzae typu B, oraz (b) jeden lub większą liczbę koniugatów białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego Streptococcus pneumoniae. 2. Kompozycja immunogenna według zastrz. 1, znamienna tym, że zawiera dwa lub większą liczbę koniugatów białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego Streptococcus pneumoniae. 3. Kompozycja immunogenna według zastrz. 2, znamienna tym, że zawiera ponad siedem koniugatów białka nośnikowego i polisacharydu lub oligosacharydu otoczkowego Streptococcus pneumoniae. 4. Kompozycja immunogenna według zastrz. 1-3, znamienna tym, że polisacharyd(y) lub oligosacharyd(y) otoczkowy(e) Streptococcus pneumoniae jest (są) z serotypu wybranego z grupy obejmującej: 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F i 33F.
PL B1. GlaxoSmithKline BIOLOGICALS S.A., Rixensart, BE , GB,
 PL 211958 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 211958 (21) Numer zgłoszenia: 374106 (22) Data zgłoszenia: 28.03.2002 (86) Data i numer zgłoszenia
PL 211958 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 211958 (21) Numer zgłoszenia: 374106 (22) Data zgłoszenia: 28.03.2002 (86) Data i numer zgłoszenia
(12) OPIS PATENTOWY (19)PL (11)188460
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19)PL (11)188460 (21) Numer zgłoszenia: 333127 (13) B1 (22) Data zgłoszenia: 04.11.1997 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19)PL (11)188460 (21) Numer zgłoszenia: 333127 (13) B1 (22) Data zgłoszenia: 04.11.1997 (86) Data i numer zgłoszenia
Pakiet 1 Załącznik nr 5. Nazwa handlowa
 Pakiet 1 Załącznik nr 5 L..p j.m. Przedmiot zamówienia 1. Szczepionka skojarzona przeciw błonicy, tężcowi i krztuścowi acelularna zawierająca : antytoksynę błonniczą, antytoksynę tężcową i trzy antygeny
Pakiet 1 Załącznik nr 5 L..p j.m. Przedmiot zamówienia 1. Szczepionka skojarzona przeciw błonicy, tężcowi i krztuścowi acelularna zawierająca : antytoksynę błonniczą, antytoksynę tężcową i trzy antygeny
(12) OPIS PATENTOWY (19) PL (11)
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 190729 (21) Numer zgłoszenia: 344137 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej ( S ) Data zgłoszenia: 27.04.1999 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 190729 (21) Numer zgłoszenia: 344137 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej ( S ) Data zgłoszenia: 27.04.1999 (86) Data i numer zgłoszenia
Postać leku Dawka. Kod EAN oferowanego produktu / inny kod produktu Postać leku
 FORMULARZ CENOWY, OPIS PRZEDMIOTU ZAMÓWIENIA Składając w imieniu... ofertę na: dostawę leków i szczepionek w postępowaniu o zamówienie publiczne w trybie... dla Centrum Medycznego "Żelazna" Sp. z o.o.,
FORMULARZ CENOWY, OPIS PRZEDMIOTU ZAMÓWIENIA Składając w imieniu... ofertę na: dostawę leków i szczepionek w postępowaniu o zamówienie publiczne w trybie... dla Centrum Medycznego "Żelazna" Sp. z o.o.,
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE
 WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
ZP.II /13 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis
(72) Twórcy wynalazku:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 174130 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej Numer zgłoszenia. 300859 (22) Data zgłoszenia: 26.10.1993 (51) IntCl6: A61K 39/116 A61K
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 174130 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej Numer zgłoszenia. 300859 (22) Data zgłoszenia: 26.10.1993 (51) IntCl6: A61K 39/116 A61K
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciw błonicy (D), tężcowi (T), krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciw błonicy (D), tężcowi (T), krztuścowi
Pieczęć Wykonawcy Załącznik nr 1 Nr sprawy SPZOZ.U.147/2016 FORMULARZ ASORTYMENTOWO CENOWY PAKIET NR I
 PAKIET NR I Lp Opis 1 Szczepionka skojarzona przeciwko błonicy, tężcowi, krztuścowi, polio i Haemophilus influenzae typ b,wzw - b zawierająca toksoid błoniczy, toksoid tężcowy, polio typ 1, 2 i 3, trzy
PAKIET NR I Lp Opis 1 Szczepionka skojarzona przeciwko błonicy, tężcowi, krztuścowi, polio i Haemophilus influenzae typ b,wzw - b zawierająca toksoid błoniczy, toksoid tężcowy, polio typ 1, 2 i 3, trzy
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP00/02467 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 203917 (21) Numer zgłoszenia: 355264 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 17.03.2000 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 203917 (21) Numer zgłoszenia: 355264 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 17.03.2000 (86) Data i numer zgłoszenia
dres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 dres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.spzozjozefow.pl Józefów: Przedmiotem zamówienia jest sprzedaż i sukcesywna dostawa szczepionek
dres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.spzozjozefow.pl Józefów: Przedmiotem zamówienia jest sprzedaż i sukcesywna dostawa szczepionek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
ZP.II.3331-01/11 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
FORMULARZ OFERTOWY. Termin wykonania zamówienia: od dnia zawarcia umowy do 31 grudnia 2015 roku. /nazwa firmy/ /adres siedziby/
 Załącznik nr 1 do SIWZ FORMULARZ OFERTOWY dotyczący postępowania o udzielenie zamówienia publicznego w trybie przetargu nieograniczonego na zakup i dostawę szczepionek do Samodzielnego Zakładu Opieki Zdrowotnej
Załącznik nr 1 do SIWZ FORMULARZ OFERTOWY dotyczący postępowania o udzielenie zamówienia publicznego w trybie przetargu nieograniczonego na zakup i dostawę szczepionek do Samodzielnego Zakładu Opieki Zdrowotnej
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Strona 1 z 7 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzoz.metronet.pl Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień
Strona 1 z 7 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzoz.metronet.pl Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP03/012160
 PL 213647 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 213647 (21) Numer zgłoszenia: 376950 (22) Data zgłoszenia: 30.10.2003 (86) Data i numer zgłoszenia
PL 213647 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 213647 (21) Numer zgłoszenia: 376950 (22) Data zgłoszenia: 30.10.2003 (86) Data i numer zgłoszenia
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Strona 1 z 9 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.pabianmed.pl Pabianice: Przetrag nieograniczony na dostawę szczepionek dla Samodzielnego
Strona 1 z 9 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.pabianmed.pl Pabianice: Przetrag nieograniczony na dostawę szczepionek dla Samodzielnego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
Odporność przeciwzakaźna. Profilaktyka chorób zakaźnych.
 Odporność przeciwzakaźna. Profilaktyka chorób zakaźnych. Odporność swoista Czynna naturalna przechorowanie lub przebycie zakażenia bezobjawowego sztuczna - szczepienie Bierna naturalna - matka - płód,
Odporność przeciwzakaźna. Profilaktyka chorób zakaźnych. Odporność swoista Czynna naturalna przechorowanie lub przebycie zakażenia bezobjawowego sztuczna - szczepienie Bierna naturalna - matka - płód,
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 z 5 2015-06-22 13:01 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzozchelm.pl/przetargi.html Chełm: Sukcesywne dostawy szczepionek do wykonywania
z 5 2015-06-22 13:01 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzozchelm.pl/przetargi.html Chełm: Sukcesywne dostawy szczepionek do wykonywania
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-DTPa, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis ex elementis praeparatum adsorbatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-DTPa, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis ex elementis praeparatum adsorbatum
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA HANDLOWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań. Szczepionka przeciwko błonicy (D), tężcowi
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA HANDLOWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań. Szczepionka przeciwko błonicy (D), tężcowi
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.bip.mzoz.pl Włocławek: ZP/11/2014 Sukcesywna dostawa szczepionek dla MZOZ Sp. z o. o. we Włocławku
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.bip.mzoz.pl Włocławek: ZP/11/2014 Sukcesywna dostawa szczepionek dla MZOZ Sp. z o. o. we Włocławku
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA
 NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA WSTĘP Zaaprobowane wskazania do stosowania preparatu Procomvax to szczepienie przeciw
NAUKOWE WNIOSKI I PODSTAWY DO ZMIANY POZWOLENIA NA DOPUSZCZENIE DO OBROTU PREPARATU PROCOMVAX, PRZEDSTAWIONE PRZEZ EMEA WSTĘP Zaaprobowane wskazania do stosowania preparatu Procomvax to szczepienie przeciw
Historia i przyszłość szczepień
 IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana)
 EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
Wiek Szczepienie przeciw Uwagi
 Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
I. 1) NAZWA I ADRES: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej w Chełmie, ul. Wołyńska 11,
 http://bzp0.portal.uzp.gov.pl/index.php?ogloszenie=show&pozycja=70074&rok= Strona 1 z 6 Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień ochronnych zamiennie bądź poza obowiązkowymi szczepieniami
http://bzp0.portal.uzp.gov.pl/index.php?ogloszenie=show&pozycja=70074&rok= Strona 1 z 6 Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień ochronnych zamiennie bądź poza obowiązkowymi szczepieniami
CZYM JEST SZCZEPIONKA?
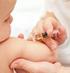 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
SEKCJA III: INFORMACJE O CHARAKTERZE PRAWNYM, EKONOMICZNYM, FINANSOWYM I TECHNICZNYM
 Strona 1 z 5 Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień ochronnych zamiennie bądź poza obowiązkowymi szczepieniami ochronnymi wynikającymi z kalendarza szczepień dla potrzeb Miejskiego
Strona 1 z 5 Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień ochronnych zamiennie bądź poza obowiązkowymi szczepieniami ochronnymi wynikającymi z kalendarza szczepień dla potrzeb Miejskiego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
(86) Data i numer zgłoszenia międzynarodowego: , PCT/EP00/02468 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204890 (21) Numer zgłoszenia: 355180 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 17.03.2000 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204890 (21) Numer zgłoszenia: 355180 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 17.03.2000 (86) Data i numer zgłoszenia
4. Chorym przygotowywanym do zabiegów operacyjnych. GlaxoSmithKline. 60,00 wirusowemu zapaleniu wątroby typu B (WZW typu B) - stosowana u młodzieży
 Lp. Nazwa szczepionki Wskazania Szczególne zalecenia Producent Uwagi Cena szczepionki w PLN Szczepionka przeciw wirusowemu zapaleniu wątroby typu B (WZW typu 1 Engerix B 20mcg B) - stosowana u młodzieży
Lp. Nazwa szczepionki Wskazania Szczególne zalecenia Producent Uwagi Cena szczepionki w PLN Szczepionka przeciw wirusowemu zapaleniu wątroby typu B (WZW typu 1 Engerix B 20mcg B) - stosowana u młodzieży
Charakterystyka produktu leczniczego. 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce.
 Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PENTAXIM, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułko-strzykawce Vaccinum diphtheriae, tetani, pertussis sine
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PENTAXIM, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułko-strzykawce Vaccinum diphtheriae, tetani, pertussis sine
Dostawy
 Dostawy - 433546-2018 05/10/2018 S192 - - Dostawy - Ogłosze o zamówieniu - Procedura otwarta I. II. III. IV. VI. Polska-Poznań: Szczepionki 2018/S 192-433546 Ogłosze o zamówieniu Dostawy Legal Basis: Dyrektywa
Dostawy - 433546-2018 05/10/2018 S192 - - Dostawy - Ogłosze o zamówieniu - Procedura otwarta I. II. III. IV. VI. Polska-Poznań: Szczepionki 2018/S 192-433546 Ogłosze o zamówieniu Dostawy Legal Basis: Dyrektywa
PL 204536 B1. Szczepanik Marian,Kraków,PL Selmaj Krzysztof,Łódź,PL 29.12.2003 BUP 26/03 29.01.2010 WUP 01/10
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
Technologie wytwarzania szczepionek
 Technologie wytwarzania szczepionek Szczepionki preparaty biofarmaceutyczne chroniące organizm przed czynnikami infekcyjnymi poprzez pobudzenie jego odpowiedzi immunologicznej. Szczepionki klasyczne (I
Technologie wytwarzania szczepionek Szczepionki preparaty biofarmaceutyczne chroniące organizm przed czynnikami infekcyjnymi poprzez pobudzenie jego odpowiedzi immunologicznej. Szczepionki klasyczne (I
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO . AZWA PRODUKTU LECZICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO . AZWA PRODUKTU LECZICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
LANGUAGE: NO_DOC_EXT: SOFTWARE VERSION: 9.2.1
 LANGUAGE: PL CATEGORY: ORIG FORM: F02 VERSION: R2.0.9.S01 SENDER: ENOTICES CUSTOMER: WSSEPOZNAN NO_DOC_EXT: 2016-134995 SOFTWARE VERSION: 9.2.1 ORGANISATION: ENOTICES COUNTRY: EU PHONE: / E-mail: miroslaw.piana@wssepoznan.pl
LANGUAGE: PL CATEGORY: ORIG FORM: F02 VERSION: R2.0.9.S01 SENDER: ENOTICES CUSTOMER: WSSEPOZNAN NO_DOC_EXT: 2016-134995 SOFTWARE VERSION: 9.2.1 ORGANISATION: ENOTICES COUNTRY: EU PHONE: / E-mail: miroslaw.piana@wssepoznan.pl
(86) Data i numer zgłoszenia międzynarodowego: 13.12.1999,PCT/EP99/09864 (87) Data i numer publikacji zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202483 (21) Numer zgłoszenia: 349335 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.12.1999 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 202483 (21) Numer zgłoszenia: 349335 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.12.1999 (86) Data i numer zgłoszenia
Szczepienia u dzieci. Agnieszka Wegner MD, PhD Department of Pediatric Neurology Medical University of Warsaw
 Szczepienia u dzieci Agnieszka Wegner MD, PhD Department of Pediatric Neurology Medical University of Warsaw Szczepienia 1. Szczepienie uodpornienie czynne, immunizacja polegająca na wprowadzeniu do ciała
Szczepienia u dzieci Agnieszka Wegner MD, PhD Department of Pediatric Neurology Medical University of Warsaw Szczepienia 1. Szczepienie uodpornienie czynne, immunizacja polegająca na wprowadzeniu do ciała
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY
 Starogard Gdański, 06 września 2013r. ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY Samodzielny Publiczny Zakład Opieki Zdrowotnej Przychodnia Lekarska w Starogardzie Gdańskim, ul. Hallera 21 informuje
Starogard Gdański, 06 września 2013r. ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY Samodzielny Publiczny Zakład Opieki Zdrowotnej Przychodnia Lekarska w Starogardzie Gdańskim, ul. Hallera 21 informuje
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
Formularz asortymentowy. oznaczenie sprawy KC/AIDS/270-6/2011
 załącznik nr 1 Formularz asortymentowy nr zadania data dostawy do odbiorców docelowych nazwa i adres odbiorcy docelowego opis przedmiotu zamówienia - 14 dni od daty zawarcia umowy 30-06- 30-09- 15-11-
załącznik nr 1 Formularz asortymentowy nr zadania data dostawy do odbiorców docelowych nazwa i adres odbiorcy docelowego opis przedmiotu zamówienia - 14 dni od daty zawarcia umowy 30-06- 30-09- 15-11-
ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY
 Starogard Gdański, 12 września 2014r. ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY Samodzielny Publiczny Zakład Opieki Zdrowotnej Przychodnia Lekarska w Starogardzie Gdańskim, ul. Hallera 21 informuje
Starogard Gdański, 12 września 2014r. ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY Samodzielny Publiczny Zakład Opieki Zdrowotnej Przychodnia Lekarska w Starogardzie Gdańskim, ul. Hallera 21 informuje
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1896062 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 23.06.06 067496.2 (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1896062 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 23.06.06 067496.2 (97)
Ulotka dołączona do opakowania: informacja dla użytkownika. POLIORIX, roztwór do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
DANE O LICZBIE LUDNOŚCI w roku 2018
 DANE O LICZBIE LUDNOŚCI w roku 2018 Nazwa placówki.. Liczba ludności ogółem. Noworodki.. (prognozowana liczba urodzeń w 2018 r.) Liczba dzieci urodzonych w 2017 r.... (prognozowana liczba urodzeń w 2017
DANE O LICZBIE LUDNOŚCI w roku 2018 Nazwa placówki.. Liczba ludności ogółem. Noworodki.. (prognozowana liczba urodzeń w 2018 r.) Liczba dzieci urodzonych w 2017 r.... (prognozowana liczba urodzeń w 2017
PL B1 (12) O P I S P A T E N T O W Y (19) P L (11) (13) B 1 A61K 9/20. (22) Data zgłoszenia:
 R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
(62) Numer zgłoszenia, z którego nastąpiło wydzielenie: (86) Data i numer zgłoszenia międzynarodowego: , PCT/EP03/014562
 PL 215257 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 215257 (21) Numer zgłoszenia: 377710 (22) Data zgłoszenia: 18.12.2003 (62) Numer zgłoszenia,
PL 215257 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 215257 (21) Numer zgłoszenia: 377710 (22) Data zgłoszenia: 18.12.2003 (62) Numer zgłoszenia,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 53/2014 z dnia 24 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Synflorix
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 53/2014 z dnia 24 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Synflorix
KALKULACJA CENY OFERTY. Część I Szczepionka p/wirusowemu zapaleniu wątroby typu B
 Część I Szczepionka p/wirusowemu zapaleniu wątroby typu B Szczepionka p/wirusowemu zapaleniu wątroby typu B - inaktywowana dla dorosłych i młodzieży powyżej 5 r. ż., cykl szczepień 0-6 m-cy, cykl przyspieszony,
Część I Szczepionka p/wirusowemu zapaleniu wątroby typu B Szczepionka p/wirusowemu zapaleniu wątroby typu B - inaktywowana dla dorosłych i młodzieży powyżej 5 r. ż., cykl szczepień 0-6 m-cy, cykl przyspieszony,
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
Menitorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b i meningokokom grupy C, skoniugowana
 1. NAZWA PRODUKTU LECZNICZEGO Menitorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b i meningokokom grupy C, skoniugowana 2. SKŁAD JAKOŚCIOWY
1. NAZWA PRODUKTU LECZNICZEGO Menitorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b i meningokokom grupy C, skoniugowana 2. SKŁAD JAKOŚCIOWY
Nazwa. Menitorix 5 µg Hib PRP + 12,5 µg TT + 5 µg MenC PSC
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCY, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCY, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
Celestynów: DOSTAWA SZCZEPIONEK W PODZIALE NA ZADANIA Numer ogłoszenia: ; data zamieszczenia: OGŁOSZENIE O ZAMÓWIENIU - dostawy
 Celestynów: DOSTAWA SZCZEPIONEK W PODZIALE NA ZADANIA Numer ogłoszenia: 22651-2014; data zamieszczenia: 05.02.2014 OGŁOSZENIE O ZAMÓWIENIU - dostawy Zamieszczanie ogłoszenia: obowiązkowe. Ogłoszenie dotyczy:
Celestynów: DOSTAWA SZCZEPIONEK W PODZIALE NA ZADANIA Numer ogłoszenia: 22651-2014; data zamieszczenia: 05.02.2014 OGŁOSZENIE O ZAMÓWIENIU - dostawy Zamieszczanie ogłoszenia: obowiązkowe. Ogłoszenie dotyczy:
Toksoid błoniczy nie mniej niż 20 j.m. 2 Toksoid tężcowy nie mniej niż 40 j.m. 2 Antygeny Bordetella pertussis
 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacjio bezpieczeństwie. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie
Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacjio bezpieczeństwie. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1896063 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 23.06.06 067499.6 (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1896063 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 23.06.06 067499.6 (97)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. nie mniej niż 30 j.m. nie mniej niż 40 j.m.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
1. NAZWA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
1. NAZWA PRODUKTU LECZNICZEGO Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
1 dawka (0,5 ml) zawiera: Oligosacharyd Neisseria meningitidis grupy C (szczep C11) 10 mikrogramów sprzężony z białkiem CRM 197
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meningitec, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum meningococcale classis C coniugatum Szczepionka meningokokowa grupy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meningitec, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum meningococcale classis C coniugatum Szczepionka meningokokowa grupy
ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY
 Starogard Gdański, 07 września 2015r. ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY Samodzielny Publiczny Zakład Opieki Zdrowotnej Przychodnia Lekarska w Starogardzie Gdańskim, ul. Hallera 21 informuje
Starogard Gdański, 07 września 2015r. ZAWIADOMIENIE O WYBORZE NAJKORZYSTNIEJSZEJ OFERTY Samodzielny Publiczny Zakład Opieki Zdrowotnej Przychodnia Lekarska w Starogardzie Gdańskim, ul. Hallera 21 informuje
Anna Skop. Zachęcam do zapoznania się z prezentacja na temat szczepień.
 W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
Szczepionkę Nimenrix należy stosować zgodnie z dostępnymi oficjalnymi zaleceniami.
 . AZWA PRODUKTU LECZICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom grupy A, C, W-35 i Y 2. SKŁAD JAKOŚCIOWY I
. AZWA PRODUKTU LECZICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom grupy A, C, W-35 i Y 2. SKŁAD JAKOŚCIOWY I
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hexacima, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hexacima, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona),
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE
 WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO 1 1. AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO 1 1. AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO 1 1. AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO 1 1. AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
Formularz asortymentowo-cenowy pełna nazwa Wykonawcy. ... adres siedziby wykonawcy. Nr tel...; Nr faksu...; ... adres do korespondencji
 Nr 1 Nr 2 Nr 3 Nr 4 Nr 5 Nr 6 Nr 7 Nr 8 Nr 9 Nr 10 Nr 11 Nr 12 Nr 13 Nr 14 Nr 15 Nr 16 Samodzielny Publiczny Miejski Zakład Opieki Zdrowotnej 32-700 Bochnia, ul. Floris 16 tel. 14-612-44-67; 14-611-70-28;
Nr 1 Nr 2 Nr 3 Nr 4 Nr 5 Nr 6 Nr 7 Nr 8 Nr 9 Nr 10 Nr 11 Nr 12 Nr 13 Nr 14 Nr 15 Nr 16 Samodzielny Publiczny Miejski Zakład Opieki Zdrowotnej 32-700 Bochnia, ul. Floris 16 tel. 14-612-44-67; 14-611-70-28;
ZAMAWIAJĄCY: OFERTA. składam ofertę na wykonanie zamówienia na części. strona: posiada) (imię i nazwisko, tel., ew.
 ... pieczęć Wykonawcy ZAMAWIAJĄCY: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej ul. Żymirskiego 2 05-230 Kobyłka OFERTA W nawiązaniu do ogłoszenia o przetargu nieograniczonym na: DOSTAWA SZCZEPIONEK
... pieczęć Wykonawcy ZAMAWIAJĄCY: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej ul. Żymirskiego 2 05-230 Kobyłka OFERTA W nawiązaniu do ogłoszenia o przetargu nieograniczonym na: DOSTAWA SZCZEPIONEK
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO . AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO . AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
III. INFORMACJE UZUPEŁNIAJĄCE. A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B)
 III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609. (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609 (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.2 (13) (51) T3 Int.Cl. A61K 38/17 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609 (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.2 (13) (51) T3 Int.Cl. A61K 38/17 (2006.01)
Dr med. Paweł Grzesiowski
 DOSTĘPNOŚĆ DO SZCZEPIEŃ OCHRONNYCH W WYBRANYCH KRAJACH EUROPY CENTRALNEJ MECHANIZMY FINANSOWANIA SZCZEPIEŃ I OCENY ICH EFEKTYWNOŚCI Dr med. Paweł Grzesiowski FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ WARSZAWA,
DOSTĘPNOŚĆ DO SZCZEPIEŃ OCHRONNYCH W WYBRANYCH KRAJACH EUROPY CENTRALNEJ MECHANIZMY FINANSOWANIA SZCZEPIEŃ I OCENY ICH EFEKTYWNOŚCI Dr med. Paweł Grzesiowski FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ WARSZAWA,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Synflorix zawiesina do wstrzykiwań w ampułkostrzykawce Synflorix zawiesina do wstrzykiwań Synflorix zawiesina do wstrzykiwań
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Synflorix zawiesina do wstrzykiwań w ampułkostrzykawce Synflorix zawiesina do wstrzykiwań Synflorix zawiesina do wstrzykiwań
Przewidywana ilość. zakupów w ciągu 1. roku Zadanie nr 1 Szczepionki 1 Szczepionka przeciwko wirusowemu 1 zapaleniu wątroby typ B Engerix B,
 ... Zadanie Przedmiot zamówienia na ilość j.m. Producent j.m. j.m. zakupów w ciągu VAT roku Uwagi Zadanie nr Szczepionki Szczepionka przeciwko wirusowemu zapaleniu wątroby typ B Engerix B, szt. 350 dawka
... Zadanie Przedmiot zamówienia na ilość j.m. Producent j.m. j.m. zakupów w ciągu VAT roku Uwagi Zadanie nr Szczepionki Szczepionka przeciwko wirusowemu zapaleniu wątroby typ B Engerix B, szt. 350 dawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1787644 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.11.2006 06123574.3
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1787644 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.11.2006 06123574.3
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Produkt leczniczy bez ważnego pozwolenia na dopuszczenie do obrotu
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
Zakażenia bakteriami otoczkowymi Polsce epidemiologia, możliwości profilaktyki. Anna Skoczyńska KOROUN, Narodowy Instytut Leków
 Zakażenia bakteriami otoczkowymi Polsce epidemiologia, możliwości profilaktyki Anna Skoczyńska KOROUN, Narodowy Instytut Leków Liczba izolatów/pcr+ Liczba przypadków zakażeń inwazyjnych potwierdzonych
Zakażenia bakteriami otoczkowymi Polsce epidemiologia, możliwości profilaktyki Anna Skoczyńska KOROUN, Narodowy Instytut Leków Liczba izolatów/pcr+ Liczba przypadków zakażeń inwazyjnych potwierdzonych
