CHARAKTERYSTKA PRODUKTU LECZNICZEGO
|
|
|
- Wiktoria Maj
- 6 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Venolyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: 500 ml 1000 ml Sodu octan trójwodny 2,32 g 4,63 g Sodu chlorek 3,01 g 6,02 g Potasu chlorek 0,15 g 0,30 g Magnezu chlorek sześciowodny 0,15 g 0,30 g Elektrolity: Na + K + Mg ++ Cl - CH 3 COO - 137,0 mmol/l 4,0 mmol/l 1,5 mmol/l 110,0 mmol/l 34,0 mmol/l Teoretyczna osmolarność: 286,5 mosm/l Kwasowość miareczkowa: 2,5 mmol NaOH/l ph: 6,9 7,9 Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Roztwór do infuzji Przezroczysty, bezbarwny roztwór 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Venolyte jest wskazany: głównie w odwodnieniu pozakomórkowym, bez względu na przyczynę (wymioty, biegunka, przetoka itp.); w hipowolemii, niezależnie od jej przyczyny (wstrząs krwotoczny, oparzenia, okołooperacyjna utrata wody i elektrolitów); w łagodnej kwasicy metabolicznej. 4.2 Dawkowanie i sposób podawania Dawkowanie Pacjenci dorośli, dzieci i młodzież Dawka i szybkość infuzji zależą od wieku, masy ciała, stanu klinicznego i parametrów biologicznych pacjenta (włączając równowagę kwasowo-zasadową) oraz od terapii skojarzonej.
2 Zalecane dawki Maksymalna dawka dobowa odpowiada zapotrzebowaniu pacjenta na płyny i elektrolity. W celu tymczasowego uzupełnienia krwi konieczne jest podanie objętości 3- do 5-krotnie większej niż utracona ilość krwi. Zalecana dawka w typowych przypadkach Pacjenci dorośli, w podeszłym wieku i młodzież (w wieku 12 lat i powyżej): 500 ml do 3 litrów/24 godziny. Niemowlęta, małe dzieci i dzieci (w wieku od 28 dni do 11 lat): 20 ml/kg mc. do 100 ml/kg mc./24 godziny. Szybkość podawania W długotrwałym leczeniu pacjentów dorosłych, poza ciężką utratą płynów, szybkość infuzji zwykle wynosi 40 ml/kg mc./24 godziny. U dzieci i młodzieży szybkość infuzji zwykle wynosi 5 ml/kg mc./godz., ale szybkość różni się w zależności od wieku: niemowlęta 6 do 8 ml/kg mc./godz., małe dzieci 4 do 6 ml/kg mc./godz., dzieci w wieku szkolnym 2 do 4 ml/kg mc./godz. Sposób podawania Do podawania dożylnego. 4.3 Przeciwwskazania Ten produkt leczniczy jest przeciwwskazany w następujących sytuacjach: nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1; przeciążenie płynami (przewodnienie), zwłaszcza w przypadku obrzęku płuc i zastoinowej niewydolności serca; ciężka niewydolność nerek; zasadowica metaboliczna; hiperkaliemia. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Należy kontrolować stan kliniczny pacjenta i parametry laboratoryjne (równowagę płynową, elektrolity we krwi i w moczu oraz równowagę kwasowo-zasadową), szczególnie podczas stosowania większych objętości roztworu. Należy unikać przeciążenia płynami spowodowanego przedawkowaniem. Należy uwzględnić zwiększone ryzyko wystąpienia przewodnienia szczególnie u pacjentów z niewydolnością serca lub ciężkimi zaburzeniami czynności nerek. Należy odpowiednio dostosować dawkowanie. W zasadowicy metabolicznej i w sytuacjach klinicznych, w których należy unikać alkalizacji, należy wybierać roztwory, takie jak 0,9% roztwór chlorku sodu, zamiast roztworów alkalizujących, takich jak Venolyte. Należy zachować szczególną ostrożność u pacjentów z ciężkimi zaburzeniami elektrolitowymi, takimi jak hipernatremia, hipermagnezemia i hiperchloremia. Roztwory zawierające chlorek sodu należy stosować ostrożnie u pacjentów z nadciśnieniem, niewydolnością serca, obrzękiem obwodowym lub obrzękiem płucnym, zaburzeniami czynności nerek, stanem przedrzucawkowym, aldosteronizmem lub z innymi chorobami lub podczas leczenia (np. kortykosteroidami i(lub) steroidami) związanego z zatrzymaniem sodu (patrz punkt 4.5). Ponieważ ten roztwór zawiera potas, nie zaleca się leczenia skojarzonego z lekami moczopędnymi oszczędzającymi potas. Stężenie potasu w osoczu należy uważnie kontrolować u pacjentów z ryzykiem wystąpienia hiperkaliemii, np. w przypadku ciężkiej, przewlekłej niewydolności nerek (patrz punkt 4.5). NL/H/1364/001/IB/006 2
3 Należy zachować ostrożność podczas leczenia skojarzonego z inhibitorami konwertazy angiotensyny, antagonistami receptora angiotensyny II, suksametonium, takrolimusem, cyklosporyną lub w przypadku ciężkiego zatrucia naparstnicą (ryzyko wystąpienia objawów kardiologicznych). Mimo, że stężenie potasu w produkcie leczniczym Venolyte jest podobne do stężenia w osoczu, to jest niewystarczające do skutecznego uzupełnienia potasu w przypadku ciężkiego jego niedoboru. Nie należy stosować produktu leczniczego Venolyte w tym celu. Należy zachować ostrożność podczas stosowania roztworów zawierających sole magnezu u pacjentów z zaburzeniami czynności nerek, ciężkimi zaburzeniami rytmu serca lub miastenią. Należy kontrolować pacjentów pod kątem wystąpienia klinicznych objawów spowodowanych nadmiarem magnezu, szczególnie podczas leczenia rzucawki. Należy zachować ostrożność podczas podawania produktu leczniczego w okresie pooperacyjnym po zastosowaniu blokady nerwowo-mięśniowej, z uwagi na możliwość rekuraryzacji po podaniu soli magnezu (patrz punkt 4.5). Z uwagi na zawartość jonów octanowych, Venolyte może powodować zasadowicę metaboliczną. Nie należy go jednak stosować w leczeniu ciężkiej kwasicy metabolicznej lub oddechowej. Podczas długotrwałego leczenia pozajelitowego pacjent musi otrzymywać odpowiednie składniki odżywcze. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Interakcje związane z obecnością sodu Połączenia niezalecane (patrz punkt 4.4): kortykosteroidy i(lub) steroidy oraz karbenoksolon ze względu na ryzyko zatrzymania sodu i wody w organizmie (z obrzękiem i nadciśnieniem). Interakcje związane z obecnością potasu Następujące połączenia zwiększają stężenie potasu w osoczu i mogą prowadzić do potencjalnie śmiertelnej hiperkaliemii, szczególnie w przypadku niewydolności nerek pogłębiającej skutki hiperkaliemii: Połączenia niezalecane (patrz punkt 4.4): leki moczopędne oszczędzające potas: amiloryd, spironolakton, triamteren w monoterapii lub terapii skojarzonej; inhibitory konwertazy angiotensyny (inhibitory ACE) oraz antagoniści receptora angiotensyny II; takrolimus, cyklosporyna; suksametonium. Interakcje związane z obecnością magnezu Połączenia niezalecane (patrz punkt 4.4): blokery kompetytywne i depolaryzacyjne przewodnictwa nerwowo-mięśniowego. Alkalizacja moczu Należy zachować ostrożność, gdyż alkalizacja moczu wywołana wodorowęglanami pochodzącymi z metabolizmu octanu zwiększa eliminację określonych produktów leczniczych (takich jak salicylany, lit) i zmniejsza wydalanie leków zasadowych, np. sympatykomimetyków (takich jak amfetamina). 4.6 Wpływ na płodność, ciążę i laktację Brak wystarczających danych dotyczących stosowania produktu leczniczego Venolyte u kobiet w okresie ciąży lub podczas karmienia piersią. Zastosowanie fizjologicznej dawki którejkolwiek z substancji czynnych produktu leczniczego Venolyte nie wpływa na reprodukcję zwierząt. Venolyte może być bezpiecznie stosowany w okresie ciąży i podczas karmienia piersią tak długo, jak bilans płynowy jest kontrolowany. NL/H/1364/001/IB/006 3
4 W przypadku dodania innego produktu leczniczego do produktu leczniczego Venolyte, należy oddzielnie rozważyć jego właściwości i stosowanie w okresie ciąży oraz podczas karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Venolyte nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn. 4.8 Działania niepożądane Częstość występowania działań niepożądanych określono następująco: bardzo często ( 1/10), często ( 1/100 do 1/10), niezbyt często ( 1/1 000 do 1/100), rzadko ( 1/ do 1/1 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych). Podczas stosowania podobnych produktów leczniczych odnotowano następujące działania niepożądane: Zaburzenia metabolizmu i odżywiania Podczas podawania roztworów elektrolitów odnotowano następujące działania niepożądane: przewodnienie i niewydolność serca u pacjentów z zaburzeniami serca lub obrzękiem płuc (bardzo często); obrzęk spowodowany przeciążeniem wodą i(lub) sodem (częstość nieznana). Zaburzenia ogólne i stany w miejscu podania Działania niepożądane mogą być związane ze sposobem podania, co obejmuje: gorączkę, zakażenie w miejscu wkłucia, miejscowy ból lub reakcję, podrażnienie żyły, zakrzepicę żył lub zapalenie żył rozprzestrzeniające się od miejsca wkłucia oraz wynaczynienie. Badania diagnostyczne Po podaniu dużych dawek, efekt rozcieńczenia może często prowadzić do podobnego rozcieńczenia składników krwi, np. czynników krzepnięcia i innych białek osocza oraz do zmniejszenia hematokrytu. Działania niepożądane mogą być związane z produktem leczniczym dodanym do roztworu. Prawdopodobieństwo wystąpienia działań niepożądanych zależy od właściwości dodanego produktu leczniczego. W przypadku wystąpienia działania niepożądanego (działań niepożądanych) należy przerwać infuzję. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, Warszawa tel.: faks: ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie W przypadku niezamierzonego przedawkowania należy przerwać leczenie i obserwować pacjenta pod kątem wystąpienia objawów przedmiotowych i podmiotowych związanych z podanym produktem leczniczym. W razie potrzeby należy zastosować leczenie objawowe i uzupełniające, np. podanie leku moczopędnego. W przypadku stosowania u pacjentów z oligurią lub anurią, w celu usunięcia nadmiaru płynów może być konieczne zastosowanie hemofiltracji lub dializy. NL/H/1364/001/IB/006 4
5 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: elektrolity, kod ATC: B05BB01. Venolyte jest izotonicznym roztworem elektrolitów. Składniki produktu leczniczego Venolyte i ich stężenia dostosowano tak, aby były zgodne z występującymi w osoczu. Produkt leczniczy jest stosowany do wyrównania zaburzeń równowagi elektrolitowej w surowicy oraz równowagi kwasowo-zasadowej. Roztwory elektrolitów podaje się w celu osiągnięcia lub utrzymania prawidłowego ciśnienia osmotycznego w przestrzeni zewnątrz- i wewnątrzkomórkowej. Octan jest metabolizowany do wodorowęglanu w wątrobie oraz tkankach pozawątrobowych (np. w mięśniach i tkankach obwodowych) i wywołuje łagodne działanie alkalizujące. Ze względu na zawartość metabolizowanych anionów, Venolyte można stosować u pacjentów ze skłonnością do kwasicy. Właściwości farmakologiczne roztworów do infuzji dożylnej o podobnym składzie są znane dzięki długoletniemu stosowaniu w medycynie klinicznej i ratunkowej. Właściwości farmakodynamiczne roztworu są takie, jak jego składników (woda, sód, potas, magnez, octan i chlorki). Główny efekt działania produktu leczniczego Venolyte to zwiększenie przestrzeni zewnątrzkomórkowej łącznie z płynem śródmiąższowym i wewnątrznaczyniowym. Jony, takie jak jony sodowe, przenikają przez błonę komórkową poprzez różne mechanizmy transportu, w tym za pomocą pompy sodowej (Na + /K + ATP-aza). Sód odgrywa ważną rolę w przekaźnictwie nerwowym i w procesach elektrofizjologicznych zachodzących w sercu. Potas jest niezbędny w licznych procesach metabolicznych i fizjologicznych, w tym w przekaźnictwie nerwowym, kurczliwości mięśni i regulacji gospodarki kwasowo-zasadowej. Prawidłowe stężenie potasu w osoczu wynosi około 3,5 do 5,0 mmol/l. Potas jest głównym kationem wewnątrzkomórkowym, występującym przede wszystkim w mięśniach; jedynie około 2% występuje w płynie zewnątrzkomórkowym. Przenikanie potasu do komórek i retencja wbrew gradientowi stężeń wymaga aktywnego transportu z udziałem Na + /K + ATP-azy. Jon chlorkowy to głównie anion zewnątrzkomórkowy, w niewielkich stężeniach występujący w kościach i w wysokich stężeniach w niektórych strukturach tkanki łącznej, takich jak kolagen. Duże wewnątrzkomórkowe stężenie jonu chlorkowego występuje w czerwonych krwinkach i błonie śluzowej żołądka. Równowaga między anionami a kationami jest regulowana przez nerki. Wchłanianie zwrotne jonu chlorkowego zwykle następuje po wchłanianiu zwrotnym sodu. Magnez jest aktywatorem licznych układów enzymatycznych i dzięki temu odgrywa istotną rolę w procesach metabolicznych. Bierze udział w metabolizmie węglowodanów i tłuszczów, syntezie białek oraz transporcie przez błony i integralności błon komórkowych. Od magnezu zależy przewodnictwo nerwowe i kurczliwość mięśni. 5.2 Właściwości farmakokinetyczne Właściwości farmakokinetyczne roztworu są takie, jak jego poszczególnych składników (woda, sód, potas, magnez, octan i chlorki). Właściwości farmakokinetyczne roztworów do infuzji dożylnych o podobnym składzie są znane dzięki długoletniemu stosowaniu w medycynie klinicznej i ratunkowej oraz dzięki zrozumieniu podstaw regulacji równowagi wodno-elektrolitowej i procesów metabolicznych organizmu. Kationy Na + i aniony Cl - są głównymi elektrolitami płynu pozakomórkowego. Utrzymanie prawidłowej równowagi sodowej ma podstawowe znaczenie dla prawidłowej objętości krwi i dystrybucji wody w organizmie. Równowaga płynów jest regulowana przez różne, wzajemnie powiązane systemy. Zdrowy organizm może dostosować się do bardzo zróżnicowanego spożycia wody i chlorku sodu dzięki regulacji NL/H/1364/001/IB/006 5
6 wydalania. Główną rolę w procesach regulacji odgrywają nerki, nadnercza, przysadka mózgowa, płuca oraz współczulny układ nerwowy. Regulacja równowagi wodnej w organizmie związana jest z kationami Na +. W rezultacie, zaburzenia gospodarki wodnej wywołują zmiany gospodarki sodowej, i odwrotnie. Ponadto, sód bierze udział we wszystkich procesach bioelektrycznych oraz w funkcjonowaniu licznych układów enzymatycznych. Jony chlorkowe są niezbędne do utrzymywania odpowiedniej równowagi kwasowo-zasadowej oraz odgrywają ważną rolę w utrzymaniu równowagi płynowej. Wysokie stężenie jonów chlorkowych występuje w soku żołądkowym. Utrata tych jonów podczas biegunki, wymiotów lub innych zaburzeń może prowadzić do hipochloremii i zasadowicy metabolicznej. Zmniejszone stężenie chlorków w produkcie leczniczym Venolyte, w porównaniu do 0,9% roztworu chlorku sodu, obniża ryzyko wystąpienia hiperchloremicznej kwasicy metabolicznej. Czynniki wpływające na transport potasu pomiędzy płynami wewnątrz- i zewnątrzkomórkowymi, takie jak zaburzenia równowagi kwasowo-zasadowej, mogą zmieniać stosunek między stężeniami w osoczu i całkowitą zawartością w organizmie. Potas wydalany jest głównie przez nerki; wydzielany jest w kanalikach dalszych w procesie wymiany z jonami sodu lub wodoru. Zdolność nerek do oszczędzania potasu jest niewielka i jego wydalanie występuje nawet w przypadku znacznego niedoboru potasu. Pewna ilość potasu jest wydalana z kałem, a niewielkie ilości mogą być także wydalane z potem. Octan jest prekursorem wodorowęglanów w przemianach metabolicznych. Jest szybko przekształcany do acetylo-coa i uczestniczy w szlakach metabolicznych, ulegając rozkładowi do dwutlenku węgla. Wodorowęglan jest głównym buforem przestrzeni zewnątrzkomórkowej organizmu, pozostającym w dynamicznej równowadze z dwutlenkiem węgla i niezdysocjowanym kwasem węglowym. Pojemność buforowa tego układu głównie zapewnia utrzymanie ph krwi o prawidłowej, lekko zasadowej wartości. Octan, po przemianie do wodorowęglanu w stosunku jednomolowym, wykazuje działanie zapobiegające kwasicy. 5.3 Przedkliniczne dane o bezpieczeństwie Przedkliniczne dane o bezpieczeństwie produktu leczniczego Venolyte uzyskane w badaniach na zwierzętach są nieistotne, ponieważ roztwór zawiera fizjologiczne składniki występujące w osoczu ludzi i zwierząt. Nie należy oczekiwać wystąpienia toksycznego działania produktu leczniczego podawanego w warunkach klinicznych zgodnie z zaleceniami. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu wodorotlenek (do ustalenia ph) Kwas solny (do ustalenia ph) Woda do wstrzykiwań 6.1 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności. 6.2 Okres ważności a) Okres ważności produktu leczniczego w opakowaniu do sprzedaży: worek freeflex: 3 lata butelka KabiPac: 3 lata NL/H/1364/001/IB/006 6
7 b) Okres ważności po pierwszym otwarciu: Produkt leczniczy należy zużyć bezpośrednio po otwarciu. 6.4 Specjalne środki ostrożności podczas przechowywania Nie przechowywać w lodówce ani nie zamrażać. 6.5 Rodzaj i zawartość opakowania Worki poliolefinowe (freeflex) w ochronnym opakowaniu z folii: 20 x 500 ml, 10 x 1000 ml. Butelki LDPE (KabiPac): 10 x 500 ml, 20 x 500 ml, 10 x 1000 ml. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Wyłącznie do jednorazowego użycia. Należy zużyć bezpośrednio po otwarciu butelki lub worka. Wszelkie niewykorzystane resztki roztworu należy usunąć. Stosować tylko przezroczysty roztwór, bez widocznych cząstek, z nieuszkodzonych opakowań. Przed użyciem usunąć ochronne opakowanie z folii z worka poliolefinowego (freeflex). Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Fresenius Kabi Polska Sp. z o.o. Al. Jerozolimskie Warszawa 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU Pozwolenie nr DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: r. Data ostatniego przedłużenia pozwolenia: r. 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO r. NL/H/1364/001/IB/006 7
CHARAKTERYSTKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Venolyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: 500 ml 1000 ml Sodu octan trójwodny 2,32 g 4,63
CHARAKTERYSTKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Venolyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: 500 ml 1000 ml Sodu octan trójwodny 2,32 g 4,63
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Chlorek sodu Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Chlorek sodu Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
Ulotka dołączona do opakowania: informacja dla użytkownika. Venolyte, roztwór do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Venolyte, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla
Ulotka dołączona do opakowania: informacja dla użytkownika Venolyte, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN RINGERA FRESENIUS, (8,6 mg + 0,3 mg + 0,33 mg)/ml, roztwór do infuzji (Natrii chloridum + Kalii chloridum + Calcii chloridum dihydricum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN RINGERA FRESENIUS, (8,6 mg + 0,3 mg + 0,33 mg)/ml, roztwór do infuzji (Natrii chloridum + Kalii chloridum + Calcii chloridum dihydricum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NATRIUM CHLORATUM 0,9 % FRESENIUS, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 9,0 mg sodu chlorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NATRIUM CHLORATUM 0,9 % FRESENIUS, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 9,0 mg sodu chlorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Kalii chloridum 0,15% + Natrii chloridum 0,9% Kabi, (1,5 mg + 9 mg)/ml, roztwór do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Kalii chloridum 0,15% + Natrii chloridum 0,9% Kabi, (1,5 mg + 9 mg)/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Potasu chlorek:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Kalii chloridum 0,15% + Natrii chloridum 0,9% Kabi, (1,5 mg + 9 mg)/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Potasu chlorek:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
Ulotka dołączona do opakowania: informacja dla użytkownika. PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS roztwór do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Fresenius Kabi Polska Sp. z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY mg/1000 ml jony mmol/1000
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY mg/1000 ml jony mmol/1000
Fresenius Kabi Polska Sp. z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SOLUTIO RINGERI LACTATE FRESENIUS, roztwór do infuzji 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY 1 ml roztworu zawiera 6,01 mg chlorku sodu (Natrii
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SOLUTIO RINGERI LACTATE FRESENIUS, roztwór do infuzji 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY 1 ml roztworu zawiera 6,01 mg chlorku sodu (Natrii
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Fresenius Kabi Polska Sp. z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM 5% ET NATRIUM CHLORATUM 0,9% 2:1 FRESENIUS, (33,3 mg + 3,0 mg)/ml, roztwór do infuzji 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM 5% ET NATRIUM CHLORATUM 0,9% 2:1 FRESENIUS, (33,3 mg + 3,0 mg)/ml, roztwór do infuzji 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Supliven, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Supliven zawiera: 1 ml 1 ampułka (10 ml) chromu(iii)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Supliven, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Supliven zawiera: 1 ml 1 ampułka (10 ml) chromu(iii)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Benelyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu do infuzji zawiera: sodu chlorek potasu chlorek wapnia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Benelyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu do infuzji zawiera: sodu chlorek potasu chlorek wapnia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
Ulotka dołączona do opakowania: informacja dla użytkownika. Aminoven Infant 10%, roztwór do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Aminoven Infant 10%, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Aminoven Infant 10%, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Sodu chlorek Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Sodu chlorek Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 12,00 g 8,51 g) 5,176 g 4,20 g) 0,70 g 0,52 g)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminoven Infant 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera: L-izoleucyna L-leucyna L-lizyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminoven Infant 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera: L-izoleucyna L-leucyna L-lizyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vaminolact, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Substancje czynne: L-alanina L-arginina L-asparaginowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vaminolact, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Substancje czynne: L-alanina L-arginina L-asparaginowy
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GELOPLASMA, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Żelatyna w postaci zmodyfikowanej płynnej żelatyny* ilość wyrażona jako
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GELOPLASMA, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Żelatyna w postaci zmodyfikowanej płynnej żelatyny* ilość wyrażona jako
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. INJ. NATRII CHLORATI 10% POLPHARMA, 100 mg/ml, koncentrat do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO INJ. NATRII CHLORATI 10% POLPHARMA, 100 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO INJ. NATRII CHLORATI 10% POLPHARMA, 100 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rehydron, proszek do przygotowywania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 saszetka zawiera: Glukoza bezwodna 6,75 g Chlorek sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rehydron, proszek do przygotowywania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 saszetka zawiera: Glukoza bezwodna 6,75 g Chlorek sodu
Ulotka dołączona do opakowania: informacja dla użytkownika. Benelyte, roztwór do infuzji Produkt złożony
 Ulotka dołączona do opakowania: informacja dla użytkownika, roztwór do infuzji Produkt złożony Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika, roztwór do infuzji Produkt złożony Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
ULOTKA DLA PACJENTA. Ulotka dołączona do opakowania: informacja dla pacjenta. Glukoza 5 Braun, 50 mg/ml, roztwór do infuzji (Glucosum)
 ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Glukoza 5 Braun, 50 mg/ml, roztwór do infuzji (Glucosum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Glukoza 5 Braun, 50 mg/ml, roztwór do infuzji (Glucosum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Potassium Chloride 0,15% + Sodium Chloride 0,9% B. Braun, 1,5 g/l + 9,0 g/l, roztwór do infuzji Potassium Chloride 0,3% + Sodium Chloride
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Potassium Chloride 0,15% + Sodium Chloride 0,9% B. Braun, 1,5 g/l + 9,0 g/l, roztwór do infuzji Potassium Chloride 0,3% + Sodium Chloride
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon Advance, (1000 mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Natrium chloratum 0,9% Kabi, 9 mg/ml, rozpuszczalnik do sporządzania leków parenteralnych
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Natrium chloratum 0,9% Kabi, 9 mg/ml, rozpuszczalnik do sporządzania leków parenteralnych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Natrium chloratum 0,9% Kabi, 9 mg/ml, rozpuszczalnik do sporządzania leków parenteralnych 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
Część VI: Streszczenie Planu Zarządzania Ryzykiem
 Część VI: Streszczenie Planu Zarządzania Ryzykiem Produkty lecznicze: Kalii chloridum 0,15% + Natrii chloridum 0,9% Kabi, (1,5 mg + 9 mg)/ml, roztwór do infuzji Kalii chloridum 0,3% + Natrii chloridum
Część VI: Streszczenie Planu Zarządzania Ryzykiem Produkty lecznicze: Kalii chloridum 0,15% + Natrii chloridum 0,9% Kabi, (1,5 mg + 9 mg)/ml, roztwór do infuzji Kalii chloridum 0,3% + Natrii chloridum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sterofundin ISO, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml produktu leczniczego Sterofundin ISO, roztwór do infuzji zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sterofundin ISO, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml produktu leczniczego Sterofundin ISO, roztwór do infuzji zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: czerwień koszenilowa (E 124), metylu parahydroksybenzoesan, sód.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 100 g. Roztwór do infuzji Roztwór przezroczysty do nieznacznie opalizującego, bezbarwny do lekko żółtego.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Voluven 10%, 10% + 0,9%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera: Poli(O-2-hydroksyetylo)skrobia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Voluven 10%, 10% + 0,9%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera: Poli(O-2-hydroksyetylo)skrobia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
Aminomel 10E 12,5E Substancje czynne: L-izoleucyna 5,85 g 7,31 g L-leucyna 6,24 g 7,80 g L-lizyny octan (w przeliczeniu na L-lizynę)
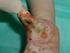 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMINOMEL 10E roztwór do infuzji. AMINOMEL 12,5E roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMINOMEL 10E roztwór do infuzji. AMINOMEL 12,5E roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera:
Magnokal Asparaginian, 250 mg mg, tabletki
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Magnokal Asparaginian, 250 mg + 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg magnezu wodoroasparaginianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Magnokal Asparaginian, 250 mg + 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg magnezu wodoroasparaginianu
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 150 mg potasu chlorku (15% w/v) co odpowiada 2 mmol jonów potasu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Kalium chloratum 15% Kabi, 150 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Kalium chloratum 15% Kabi, 150 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lactulosum Aflofarm, 7,5 g/15 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 15 ml syropu zawiera 7,5 g laktulozy ciekłej (Lactulosum liquidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lactulosum Aflofarm, 7,5 g/15 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 15 ml syropu zawiera 7,5 g laktulozy ciekłej (Lactulosum liquidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty, (500 mg mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 10 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 10 ml produktu
Duosol zawierający 4 mmol/l potasu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Duosol zawierający 4 mmol/l potasu 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Mniejsza komora Roztwór elektrolitów 555 ml na Większa komora Roztwór
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Duosol zawierający 4 mmol/l potasu 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Mniejsza komora Roztwór elektrolitów 555 ml na Większa komora Roztwór
Produkt stosowany pomocniczo w dolegliwościach związanych ze stanami zapalnymi stawów oraz w stanach bólowych po stłuczeniach.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Accusol 35. Accusol 35
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Accusol 35 Potassium 4 mmol/l Roztwór do hemofiltracji, hemodializy i hemodiafiltracji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład Komora duża
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Accusol 35 Potassium 4 mmol/l Roztwór do hemofiltracji, hemodializy i hemodiafiltracji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład Komora duża
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Potassium Chloride 0,15% + Glucose 5% B. Braun, 1,5 g/l + 55,0 g/l, roztwór do infuzji Potassium Chloride 0,3% + Glucose 5% B. Braun,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Potassium Chloride 0,15% + Glucose 5% B. Braun, 1,5 g/l + 55,0 g/l, roztwór do infuzji Potassium Chloride 0,3% + Glucose 5% B. Braun,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Moxalole, 13,125 g + 350,7 mg + 46,6 mg + 178,5 mg, proszek do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Moxalole, 13,125 g + 350,7 mg + 46,6 mg + 178,5 mg, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Moxalole, 13,125 g + 350,7 mg + 46,6 mg + 178,5 mg, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dipeptiven, 200 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera: Substancja czynna
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dipeptiven, 200 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera: Substancja czynna
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal 15%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera Izoleucyna Leucyna Lizyna jednowodna (zawartość
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal 15%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera Izoleucyna Leucyna Lizyna jednowodna (zawartość
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Dettol Med, 4,8 mg/100 mg, koncentrat do sporządzania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Chloroksylenol 4,8 mg na 100 mg koncentratu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Dettol Med, 4,8 mg/100 mg, koncentrat do sporządzania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Chloroksylenol 4,8 mg na 100 mg koncentratu
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Kalium chloratum 15% Kabi, 150 mg/ml, koncentrat do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Kalium chloratum 15% Kabi, 150 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Kalium chloratum 15% Kabi, 150 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1000 ml produktu leczniczego Sterofundin ISO, roztwór do infuzji zawiera:
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sterofundin ISO, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml produktu leczniczego Sterofundin ISO, roztwór do infuzji zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sterofundin ISO, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml produktu leczniczego Sterofundin ISO, roztwór do infuzji zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BALS SULPHUR ŻEL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BALS SULPHUR ŻEL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu BALS SULPHUR zawiera 96,5 g 2,1% wody chlorkowo- sodowej (solanki) siarczkowej,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO BALS SULPHUR ŻEL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 g żelu BALS SULPHUR zawiera 96,5 g 2,1% wody chlorkowo- sodowej (solanki) siarczkowej,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GEALCID, (350 mg + 120 mg + 100 mg), tabletki do rozgryzania i żucia 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera: 350 mg kwasu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GEALCID, (350 mg + 120 mg + 100 mg), tabletki do rozgryzania i żucia 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera: 350 mg kwasu
6,00 g 6,40 g 10,27 g. 4,59 g 5,53 g 5,13 g 2,05 g 5,13 g 3,02 g 3,88 g 2,59 g 2,16 g 1,29 g 1,66 g 2,59 0,54 g. 0,37 g
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminomel Nephro roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: L-izoleucyna L-leucyna L-lizyny octan (odpowiada
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminomel Nephro roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: L-izoleucyna L-leucyna L-lizyny octan (odpowiada
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 3 mg Hypromellosum (hypromelozy) i 1 mg Dextranum (dekstranu 70).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tears Naturale II, (3 mg + 1 mg)/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Hypromellosum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tears Naturale II, (3 mg + 1 mg)/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Hypromellosum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Catosal 10%, roztwór do wstrzykiwań dla psów, kotów i koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Catosal 10%, roztwór do wstrzykiwań dla psów, kotów i koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal B. Braun 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: Aminokwasy: w 1 ml w 250 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal B. Braun 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: Aminokwasy: w 1 ml w 250 ml
