Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań
|
|
|
- Edyta Orzechowska
- 6 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka zawiera 11,25 mg tryptoreliny (Triptorelinum) w postaci tryptoreliny pamoinianu Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Rak gruczołu krokowego. Leczenie raka gruczołu krokowego kiedy wymagane jest obniżenie stężenia testosteronu do stężenia charakterystycznego dla braku czynności gruczołów płciowych (stężenia kastracyjnego). Pacjenci, którzy uprzednio nie byli poddawani terapii hormonalnej, lepiej reagują na leczenie tryptoreliną. Przedwczesne dojrzewanie płciowe pochodzenia ośrodkowego (przed 8. rokiem życia u dziewcząt i przed 10. rokiem życia u chłopców). 4.2 Dawkowanie i sposób podawania Rak gruczołu krokowego Jedno wstrzyknięcie domięśniowe preparatu o przedłużonym uwalnianiu co 3 miesiące. Czas trwania leczenia: patrz punkt 5.1 Przedwczesne dojrzewanie płciowe pochodzenia ośrodkowego Leczenie dzieci za pomocą tryptoreliny powinno odbywać się pod wszechstronnym nadzorem endokrynologa dziecięcego albo pediatry lub endokrynologa z doświadczeniem w leczeniu przedwczesnego dojrzewania płciowego pochodzenia ośrodkowego. Dzieci o masie ciała powyżej 20 kg: jedno wstrzyknięcie domięśniowe produktu Diphereline SR 11,25 mg podawane co 3 miesiące. Leczenie należy przerwać w okolicy fizjologicznego wieku dojrzewania płciowego u chłopców i dziewcząt. Nie należy kontynuować leczenia u dziewcząt, u których wiek kostny przekracza 12 lat. Istnieją ograniczone dane dotyczące optymalnego czasu odstawienia leczenia w oparciu o wiek kostny u chłopców, jednakże zaleca się przerwanie leczenia u chłopców, u których wiek kostny wynosi lat. 4.3 Przeciwwskazania 1
2 Nadwrażliwość na GnRH, jej analogi lub jakikolwiek inny składnik produktu leczniczego (patrz punkt 4.8). Ciąża i okres karmienia piersią. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Stosowanie analogów GnRH może zmniejszać gęstość mineralną kości. U mężczyzn wstępne dane wskazują, że stosowanie bisfosfonianów w skojarzeniu z analogami GnRH może zmniejszyć utratę gęstości kości. Zachowanie szczególnej ostrożności jest konieczne u pacjentów z dodatkowymi czynnikami ryzyka osteoporozy (np. przewlekłe nadużywanie alkoholu, palenie papierosów, długoterminowa terapia lekami zmniejszającymi gęstość mineralną kości, np. leki przeciwdrgawkowe lub kortykosteroidy, dodatni wywiad rodzinny w kierunku osteoporozy, niedożywienie). Przed rozpoczęciem leczenia należy upewnić się, że pacjentka nie jest w ciąży. W rzadkich przypadkach stosowanie analogów GnRH może ujawnić obecność wcześniej nierozpoznanego gruczolaka wywodzącego się z komórek gonadotropowych przysadki. U pacjentów tych może wystąpić udar przysadki, objawiający się nagłym bólem głowy, wymiotami, zaburzeniami widzenia i porażeniem mięśni oka. Zgłaszano zmiany nastroju, w tym depresję. Pacjenci z depresją powinni być ściśle kontrolowani podczas terapii. Rak gruczołu krokowego Na początku leczenia tryptorelina, podobnie jak inne analogi GnRH, powoduje przemijający wzrost stężenia testosteronu w surowicy. W rezultacie w pierwszych tygodniach leczenia w izolowanych przypadkach okazjonalnie rozwijało się przemijające nasilenie przedmiotowych i podmiotowych objawów raka gruczołu krokowego. W początkowej fazie leczenia należy rozważyć dodatkowe podanie odpowiedniego antyandrogenu, aby przełamać początkowy wzrost stężenia testosteronu w surowicy i nasilenie objawów klinicznych. U niewielkiej liczby pacjentów może dojść do przejściowego nasilenia podmiotowych i przedmiotowych objawów raka gruczołu krokowego (przejściowe zaostrzenie objawów nowotworu) i przejściowego nasilenia bólu związanego z chorobą nowotworową (ból związany z przerzutami), które można leczyć objawowo. Podobnie jak w przypadku innych analogów GnRH obserwowano izolowane przypadki ucisku (kompresji) rdzenia kręgowego lub niedrożności cewki moczowej. Jeżeli rozwinie się ucisk (kompresja) rdzenia kręgowego lub niewydolność nerek, należy wdrożyć standardowe leczenie, a w ekstremalnych przypadkach należy rozważyć wykonanie pilnej orchidektomii (wycięcie jądra). W pierwszych tygodniach leczenia wskazane jest staranne monitorowanie terapii, szczególnie u pacjentów z przerzutami do kręgosłupa, narażonych na ryzyko ucisku rdzenia kręgowego oraz u pacjentów z niedrożnością układu moczowego. Po kastracji chirurgicznej tryptorelina nie indukuje dalszego zmniejszenia stężenia testosteronu w surowicy. Długotrwała deprywacja androgenu, zarówno po obustronnej orchidektomii (wycięcie jądra), jak i po podaniu analogów GnRH, związana jest ze zwiększonym ryzykiem utraty masy kostnej i może prowadzić do osteoporozy oraz wzrostu ryzyka złamań kości. Ponadto, w badaniach epidemiologicznych obserwowano, że u pacjentów może dojść do zmian metabolicznych (np. nietolerancja glukozy) lub może zwiększać się ryzyko choroby układu krążenia w 2
3 czasie terapii z deprywacją androgenu. Jednakże prospektywne dane nie potwierdziły związku pomiędzy analogami GnRH i wzrostem śmiertelności z przyczyn sercowych. Pacjentów z dużym ryzykiem chorób metabolicznych i chorób układu krążenia należy starannie ocenić przed włączeniem leczenia i w odpowiedni sposób kontrolować w czasie terapii z deprywacją androgenu. Podawanie tryptoreliny w dawkach terapeutycznych powoduje supresję osi przysadkowo-gonadalnej. Normalna funkcja powraca zwykle po zaprzestaniu leczenia. Dlatego testy diagnostyczne gonadalnej funkcji przysadki w czasie leczenia i po zaprzestaniu terapii za pomocą analogów mogą być mylące. Na początku leczenia stwierdza się przemijające zwiększenie aktywności fosfatazy kwaśnej. W czasie leczenia zaleca się: okresowe sprawdzanie stężenia testosteronu we krwi, które nie powinno przekraczać 1 ng/ml, przeprowadzać ocenę reakcji układu kostnego za pomocą scyntygrafii i (lub) tomografii komputerowej, natomiast ocenę reakcji gruczołu krokowego na leczenie przeprowadza się za pomocą USG i (lub) tomografii komputerowej oraz badania klinicznego i per rectum. Dzieci i młodzież Przedwczesne dojrzewanie płciowe pochodzenia ośrodkowego Leczenie u dzieci z postępującymi guzami mózgu powinno w każdym przypadku być poprzedzone staranną analizą ryzyka i korzyści. U dziewcząt początkowa stymulacja jajników po rozpoczęciu leczenia, w wyniku którego dochodzi do zmniejszenia stężenia estrogenów, może prowadzić w pierwszym miesiącu leczenia do krwawień z dróg rodnych o łagodnym do umiarkowanego nasileniu. Po zaprzestaniu leczenia pojawią się charakterystyczne objawy dojrzewania. Informacje dotyczące płodności w przyszłości są nadal ograniczone. U większości dziewcząt regularne miesiączki występują przeciętnie po roku od zakończenia terapii. Należy wykluczyć pseudo-przedwczesne dojrzewanie płciowe (guz lub przerost gonad lub nadnerczy) oraz niezależne od gonadotropin przedwczesne dojrzewanie płciowe (toksykoza jądrowa, rodzinny przerost komórek Leydiga). W czasie terapii za pomocą analogów GnRH z powodu przedwczesnego dojrzewania płciowego pochodzenia ośrodkowego może dojść do zmniejszenia gęstości mineralnej kości. Jednakże po przerwaniu leczenia gromadzenie masy kostnej jest zachowane, a leczenie nie wydaje się wpływać na szczytową masę kostną w późnym okresie dojrzewania. Po odstawieniu leczenia analogami GnRH można zaobserwować złuszczanie głowy kości udowej. Według sugerowanej teorii małe stężenia estrogenów w czasie leczenia analogami GnRH osłabiają chrząstkę nasadową. Zwiększenie szybkości wzrostu po zaprzestaniu leczenia powoduje w rezultacie zmniejszenie siły koniecznej do przemieszczenia chrząstki. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Należy zachować ostrożność w przypadku jednoczesnego podawania tryptoreliny z lekami wpływającymi na wydzielanie gonadotropin; zaleca się kontrolowanie stanu hormonalnego pacjenta. 4.6 Wpływ na płodność, ciążę i laktację Ciąża 3
4 Tryptoreliny nie należy stosować w okresie ciąży, jako że stosowanie analogów GnRH jest związane z teoretycznym ryzykiem poronienia lub wystąpienia nieprawidłowości u płodu. Przed leczeniem potencjalnie płodne kobiety należy starannie zbadać w celu wykluczenia ciąży. W czasie leczenia tryptoreliną należy stosować niehormonalne metody antykoncepcji do czasu powrotu miesiączek. Karmienie piersią Tryptoreliny nie należy stosować w okresie karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie prowadzono badań nad wpływem produktu leczniczego na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednakże, zdolność prowadzenia pojazdów i obsługiwania maszyn może być upośledzona, jeśli u pacjenta wystąpią zawroty głowy, senność i zaburzenia widzenia, będące działaniami niepożądanymi leczenia lub wynikające z choroby podstawowej. 4.8 Ogólna tolerancja u mężczyzn (patrz punkt 4.4) Jak obserwowano przy stosowaniu innych analogów GnRH lub po chirurgicznej kastracji, najczęściej stwierdzane działania, związane z leczeniem za pomocą tryptoreliny, były następujące: początkowy wzrost stężenia testosteronu, a następnie prawie całkowita supresja testosteronu. obejmowały uderzenia gorąca (50%), zaburzenia wzwodu (4%) i spadek libido (3%). Zgłaszano następujące działania, uważane za związane w sposób co najmniej prawdopodobny z leczeniem tryptoreliną. Wiadomo, że większość z nich jest związana z biochemiczną lub chirurgiczną kastracją. Częstość występowania działań niepożądanych sklasyfikowano w następujący sposób: bardzo ( 1/10); ( 1/100 do <1/10); niezbyt ( 1/1000 do <1/100); rzadko ( 1/10000 do <1/1000). Klasyfikacja układów i narządów krwi i układu chłonnego ucha i błędnika endokrynologiczne oka bardzo niezbyt rzadko 10% 1% -<10% 0.1% -<1% 0.01% -<0.1% Plamica Szum w uszach Zawroty głowy Cukrzyca Nieprawidłowe uczucie w obrębie oczu widzenia Dodatkowe działania stwierdzone w okresie po wprowadzeniu do obrotu Ginekomastia Zamazane widzenie żołądka i Nudności Ból brzucha Wzdęcie 4
5 Klasyfikacja układów i narządów jelit ogólne i stany w miejscu podania układu immunologicznego bardzo niezbyt rzadko 10% 1% -<10% 0.1% -<1% 0.01% -<0.1% Zaparcie brzucha Biegunka Suchość w jamie Wymioty ustnej Zaburzenie smaku Wzdęcie z oddawaniem Osłabienie Nadmierna potliwość Zmęczenie Rumień w miejscu iniekcji Stan zapalny w miejscu iniekcji Ból w miejscu iniekcji Reakcja w miejscu iniekcji Obrzęk Letarg Ból Sztywność Senność wiatrów Ból w klatce piersiowej Trudność stania Objawy grypopodobne Gorączka Reakcja anafilaktyczna Nadwrażliwość Dodatkowe działania stwierdzone w okresie po wprowadzeniu do obrotu Złe samopoczucie Reakcja nadwrażliwości Zakażenia zarażenia pasożytnicze Badania diagnostyczne i Wzrost stężenia aminotransferazy alaninowej Wzrost stężenia aminotransferazy asparaginowej Wzrost stężenia kreatyniny we krwi Wzrost stężenia mocznika we krwi Wzrost masy ciała Zapalenie jamy nosowej i gardła Wzrost stężenia fosfatazy alkalicznej we krwi Wzrost temperatury ciała Spadek masy ciała Wzrost ciśnienia krwi metabolizmu odżywiania i Jadłowstręt Dna Wzrost apetytu mięśniowoszkieletowe i tkanki łącznej Ból pleców Ból układu mięśniowoszkieletowego Ból kończyn Ból stawów Skurcze mięśni Osłabienie mięśniowe Ból mięśniowy Sztywność stawów Obrzęk stawów Sztywność układu mięśniowoszkieletowego Ból kostny 5
6 Klasyfikacja układów i narządów nerwowego psychiczne układu bardzo niezbyt rzadko 10% 1% -<10% 0.1% -<1% 0.01% -<0.1% Zapalenie kości i stawów Parestezje w kończynach dolnych Zawroty głowy Ból głowy Parestezje Depresja Bezsenność Drażliwość Wahania nastroju Upośledzenie pamięci Stan splątania Zmniejszenie aktywności Euforyczny nastrój Dodatkowe działania stwierdzone w okresie po wprowadzeniu do obrotu Niepokój i stan splątania układu rozrodczego i piersi układu oddechowego, klatki piersiowej i śródpiersia skóry i tkanki podskórnej Nadmierna potliwość Zaburzenie wzwodu Utrata libido Ginekomastia Ból sutków wytrysku (gruczołów piersiowych) Atrofia jąder Ból jąder Duszność Duszność w pozycji leżącej Trądzik Łysienie Świąd Wysypka Powstawanie pęcherzy Obrzęk naczynioruchowy Pokrzywka naczyniowe Uderzenia gorąca Nadciśnienie tętnicze Krwawienie z nosa Spadek ciśnienia Tryptorelina powoduje przemijający wzrost stężenia krążącego testosteronu w ciągu pierwszego tygodnia po pierwszej iniekcji postaci o przedłużonym uwalnianiu. Przy takim początkowym wzroście stężenia krążącego testosteronu u niewielkiego odsetka pacjentów ( 5%) może dojść do przemijającego nasilenia podmiotowych i przedmiotowych objawów raka prostaty (przejściowe zaostrzenie objawów nowotworu), które zwykle objawia się nasileniem objawów ze strony układu moczowego (< 2%) oraz bólu związanego z obecnością przerzutów (5%), które można leczyć objawowo. Objawy te są przemijające i zwykle ustępują w ciągu jednego-dwóch tygodni. W izolowanych przypadkach wystąpiło zaostrzenie objawów choroby, manifestujące się niedrożnością cewki moczowej lub uciskiem (kompresją) rdzenia kręgowego, związaną z obecnością przerzutów. Dlatego pacjentów z przerzutami do kręgosłupa i (lub) niedrożnością górnego lub dolnego odcinka dróg moczowych należy ściśle obserwować w pierwszych tygodniach terapii (patrz punkt 4.4). Stosowanie analogów GnRH w terapii raka gruczołu krokowego może wiązać się ze zwiększoną utratą masy kostnej i może prowadzić do osteoporozy oraz wzrostu ryzyka złamań kości. Ogólna tolerancja u dzieci (patrz punkt 4.4.) Jak zaobserwowano przy stosowaniu innych analogów GnRH, najczęściej stwierdzanymi w badaniach klinicznych działaniami niepożądanymi, związanymi z leczeniem tryptoreliną były działania związane 6
7 z oczekiwanymi działaniami farmakologicznymi analogów GnRH. te obejmowały krwawienie z dróg rodnych, w tym plamienie. Zgłaszano następujące działania, uważane za związane w sposób co najmniej prawdopodobny z leczeniem tryptoreliną. Częstość występowania działań niepożądanych sklasyfikowano w następujący sposób: bardzo ( 1/10); ( 1/100 do <1/10); niezbyt ( 1/1000 do <1/100). Klasyfikacja układów i narządów oka żołądka i jelit ogólne i stany w miejscu podania układu immunologicznego Badania diagnostyczne metabolizmu i odżywiania mięśniowoszkieletowe i tkanki łącznej układu nerwowego psychiczne układu rozrodczego i piersi układu oddechowego, klatki piersiowej i śródpiersia skóry i tkanki podskórnej Dodatkowe działania bardzo niezbyt stwierdzone w okresie po wprowadzeniu do obrotu 10% 1% do <10% 0,1% do < 1% ść nieznana widzenia Ból brzucha Wymioty Zaparcie Nudności Krwawienie z pochwy, w tym plamienie Reakcja w miejscu iniekcji (w tym ból w miejscu iniekcji, rumień w miejscu iniekcji, stan zapalny w miejscu iniekcji) Zwiększenie masy ciała Ból głowy Złe samopoczucie Nadwrażliwość Otyłość Ból szyi Zmiany nastroju Ból piersi Krwawienie z nosa Wstrząs anafilaktyczny (obserwowany u dorosłych mężczyzn i kobiet) Ból mięśniowy Depresja Świąd, pokrzywka, wysypka, trądzik Uderzenia gorąca Nadciśnienie 7
8 Klasyfikacja układów i narządów naczyniowe Dodatkowe działania bardzo niezbyt stwierdzone w okresie po wprowadzeniu do obrotu 10% 1% do <10% 0,1% do < 1% ść nieznana tętnicze W pierwszym miesiącu po wstrzyknięciu może wystąpić krwawienie z pochwy. U pacjentów leczonych za pomocą analogu GnRH zgłaszano zwiększenie liczby limfocytów. Ta wtórna limfocytoza jest najwyraźniej związana z kastracją indukowaną przez analogi GnRH i wydaje się wskazywać, że hormony płciowe są włączone w proces inwolucji grasicy. 4.9 Przedawkowanie W przypadku przedawkowania wskazane jest leczenie objawowe. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: analogi gonadoliberyny; tryptorelina; kod ATC: L02 AE 04 Tryptorelina substancja czynna produktu Diphereline SR 11,25 mg to syntetyczny dekapeptyd, analog naturalnego hormonu GnRH - gonadoliberyny. Długotrwałe podawanie tryptoreliny, po początkowej stymulacji, powoduje zahamowanie wydzielania hormonów gonadotropowych, co w konsekwencji prowadzi do zahamowania czynności gonad (jąder i jajników). Podawanie jednej dawki preparatu może na początku leczenia doprowadzić do wzrostu stężenia LH i FSH we krwi (początkowa aktywacja), a w konsekwencji do zwiększenia poziomu testosteronu. Kontynuacja leczenia doprowadza do zmniejszenia stężenia LH i FSH, a w konsekwencji do obniżenia stężenia hormonów steroidowych w ciągu 20 dni do poziomu odpowiadającego kastracji. Stan ten zależy od czasu podawania preparatu. W randomizowanym badaniu III fazy z udziałem 970 pacjentów z miejscowo zaawansowanym rakiem gruczołu krokowego (T2c T4) badano, czy radioterapia w połączeniu z krótkotrwałą deprywacją androgenu (6 miesięcy, n = 483) jest równoważna radioterapii powiązanej z długotrwałą deprywacją androgenu (3 lata, n = 487). Tryptorelina podawana była u 62,2% pacjentów, zaś inni agoniści GnRH u 37,8% pacjentów. W badaniu nie stosowano stratyfikacji pod względem typu agonisty GnRH. Ogólnie, całkowita śmiertelność po 5 latach w grupie krótkotrwałego leczenia hormonalnego i długotrwałego leczenia hormonalnego wyniosła odpowiednio 19,0% i 15,2%, a względne ryzyko 1,42 (przedział ufności [CI] 95,71% = 1,79; 95,71% CI = [1,09; 1,85], p = 0,65 dla równoważności leczenia i p = 0,0082 dla testu post-hoc różnicy między grupami terapeutycznymi). Pięcioletnia śmiertelność wyraźnie związana z gruczołem krokowym w grupie krótkotrwałego leczenia hormonalnego i długotrwałego leczenia hormonalnego wyniosła odpowiednio 4,78% i 3,2%, a ryzyko względne 1,71 (95% CI [1,14 do 2,57], p = 0,002). Analiza post hoc przeprowadzona pod względem całkowitej śmiertelności w podgrupie otrzymującej tryptorelinę wykazała tendencję w tym samym kierunku leczenia (ryzyko względne dla krótkotrwałego leczenia 1,28; 95,71% CI = [0,89; 1,84], p = 0,38 i p = 0,08 odpowiednio dla testów post-hoc równoważności leczenia i różnicy między grupami terapeutycznymi). 8
9 Badanie to wskazuje, że skojarzenie radioterapii i długotrwałej deprywacji androgenu (3 lata) jest korzystniejsze wobec skojarzenia radioterapii i krótkotrwałej deprywacji androgenu (6 miesięcy). Dzieci i młodzież przedwczesne dojrzewanie płciowe Zahamowanie nadmiernej aktywności gonadotropowej przysadki u obu płci manifestuje się supresją wydzielania estradiolu i testosteronu, zmniejszeniem szczytowego stężenia LH oraz poprawą współczynnika wzrost dla wieku/wiek kostny. Początkowa stymulacja gonad może spowodować niewielkie krwawienie z narządów rodnych wymagające leczenia medroksyprogesteronem lub octanem cyproteronu. 5.2 Właściwości farmakokinetyczne Po domięśniowym wstrzyknięciu preparatu Diphereline SR 11,25 mg pacjentom z rakiem gruczołu krokowego maksymalne stężenie tryptoreliny w osoczu jest obserwowane w ciągu 3 godzin od wstrzyknięcia. Po spadku stężenia, które trwa przez pierwszy miesiąc, poziom tryptoreliny pozostaje stały do 90 dnia po podaniu. W związku z tym stężenie testosteronu odpowiadające kastracji występuje po około 20 dniach od chwili wstrzyknięcia preparatu i utrzymuje się na podobnym poziomie przez okres uwalniania substancji czynnej. 5.3 Przedkliniczne dane o bezpieczeństwie Omawiany związek nie wykazywał żadnych specyficznych właściwości toksycznych w toksykologicznych badaniach na zwierzętach. Obserwowane efekty były związane z farmakologicznym wpływem substancji na układ wydzielania wewnętrznego. Preparat ulega całkowitej resorpcji w ciągu 120 dni. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Fiolka z proszkiem: Polimer laktydowo-koglikolidowy Mannitol Karmeloza sodowa Polisorbat 80 Ampułka z rozpuszczalnikiem: Mannitol Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie dotyczy 6.3 Okres ważności 3 lata 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25 C. 9
10 Zawiesinę wstrzykiwać bezpośrednio po sporządzeniu. Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. 6.5 Rodzaj i zawartość opakowania Fiolka (szkło typ I) z proszkiem i ampułka (szkło typ I) z rozpuszczalnikiem Pudełko zawierające 1 fiolkę i 1 ampułkę z 1 strzykawką (z polipropylenu) i 2 igłami. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Jednorodna zawiesina do wstrzykiwań o mlecznej konsystencji jest rekonstytuowana poprzez delikatne wstrząsanie. Należy dokładnie przestrzegać instrukcji rekonstytucji podanej poniżej oraz w ulotce informacyjnej. Wyłącznie do jednorazowego użycia. Niewykorzystaną zawiesinę należy wyrzucić. Igły zużyte do iniekcji należy utylizować w przeznaczonym do tego celu pojemniku na odpady z ostrymi elementami. Pozostały produkt należy wyrzucić. Proszek należy odtworzyć w 2 ml roztworu mannitolu: Za pomocą jednej z igieł należy pobrać rozpuszczalnik z ampułki do załączonej strzykawki i przenieść go do fiolki zawierającej proszek. Fiolkę należy delikatnie wstrząsnąć do całkowitego rozprowadzenia proszku w rozpuszczalniku tak, aby uzyskać jednorodną zawiesinę o mlecznej konsystencji. Otrzymaną zawiesinę należy następnie pobrać do strzykawki. Następnie należy wymienić igłę i za pomocą nowej igły jak najszybciej wstrzyknąć zawiesinę pacjentowi. Zawiesinę należy wyrzucić, jeśli nie zostanie podana pacjentowi niezwłocznie po rekonstytucji. Patrz również punkt PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Ipsen Pharma 65 Quai Georges Gorse Boulogne Billancourt Francja 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU Pozwolenie nr DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA r./ r./ r./ r. 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO: 10
1 fiolka zawiera 11,25 mg tryptoreliny (Triptorelinum) w postaci tryptoreliny pamoinianu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD
Ulotka dołączona do opakowania: informacja dla użytkownika. Diphereline 0,1 mg 0,1 mg proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika Diphereline 0,1 mg 0,1 mg proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Triptorelinum Należy zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika Diphereline 0,1 mg 0,1 mg proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Triptorelinum Należy zapoznać się z treścią ulotki
1 fiolka zawiera 11,25 mg tryptoreliny (Triptorelinum) w postaci tryptoreliny pamoinianu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 fiolka zawiera 0,1 mg tryptoreliny (Triptorelinum) w postaci tryptoreliny octanu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline 0,1 mg; 0,1 mg; proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline 0,1 mg; 0,1 mg; proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 fiolka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 11,25 mg; 11,25 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 3,75; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 3,75; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 fiolka zawiera 3,75 mg tryptoreliny (Triptorelinum) w postaci tryptoreliny octanu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 3,75; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 3,75; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 fiolka zawiera 3,75 mg tryptoreliny (Triptorelinum) w postaci tryptoreliny octanu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 3,75; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 3,75; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Diphereline SR 11,25 mg 11,25 mg proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań Triptorelinum Należy
Ulotka dołączona do opakowania: informacja dla użytkownika Diphereline SR 11,25 mg 11,25 mg proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań Triptorelinum Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 22,5 mg, proszek i rozpuszczalnik do sporządzenia zawiesiny o przedłużonym uwalnianiu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diphereline SR 22,5 mg, proszek i rozpuszczalnik do sporządzenia zawiesiny o przedłużonym uwalnianiu do wstrzykiwań. 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ampułkostrzykawka zawiera 105 μg tryptoreliny octanu (Triptorelini acetas), co odpowiada 95,6 μg tryptoreliny.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DECAPEPTYL 0,1 mg; 0,1 mg/ml; roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułkostrzykawka zawiera 105 μg tryptoreliny octanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DECAPEPTYL 0,1 mg; 0,1 mg/ml; roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułkostrzykawka zawiera 105 μg tryptoreliny octanu
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Miacalcic, 50 j.m./ml, roztwór do wstrzykiwań Miacalcic, 100 j.m./ml, roztwór do wstrzykiwań Calcitoninum salmonis Należy zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta Miacalcic, 50 j.m./ml, roztwór do wstrzykiwań Miacalcic, 100 j.m./ml, roztwór do wstrzykiwań Calcitoninum salmonis Należy zapoznać się z treścią
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
Ulotka dołączona do opakowania: informacja dla użytkownika
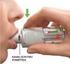 Ulotka dołączona do opakowania: informacja dla użytkownika Diphereline SR 3,75 3,75 mg proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań Triptorelinum Należy uważnie
Ulotka dołączona do opakowania: informacja dla użytkownika Diphereline SR 3,75 3,75 mg proszek i rozpuszczalnik do sporządzania zawiesiny o przedłużonym uwalnianiu do wstrzykiwań Triptorelinum Należy uważnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ampułkostrzykawka zawiera 100 μg octanu tryptoreliny (Triptorelini acetas), co odpowiada 95,6 μg tryptoreliny.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DECAPEPTYL 0,1 mg, 0,1 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułkostrzykawka zawiera 100 μg octanu tryptoreliny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DECAPEPTYL 0,1 mg, 0,1 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułkostrzykawka zawiera 100 μg octanu tryptoreliny
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań (Triptorelinum) Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań (Triptorelinum) Należy zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO
 CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO KLIMAFEMIN, 1 ml/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 ml wyciągu z Cimcifuga racemosa
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO KLIMAFEMIN, 1 ml/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 ml wyciągu z Cimcifuga racemosa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. sodu glutaminian (E 621)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Zoladex LA, 10,8 mg, implant podskórny. Goserelinum
 ULOTKA DLA PACJENTA ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Zoladex LA, 10,8 mg, implant podskórny Goserelinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę
ULOTKA DLA PACJENTA ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Zoladex LA, 10,8 mg, implant podskórny Goserelinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę
ULOTKA DLA PACJENTA. Strona 1 z 9
 ULOTKA DLA PACJENTA Strona 1 z 9 Ulotka dołączona do opakowania: informacja dla pacjenta DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Triptorelinum Należy
ULOTKA DLA PACJENTA Strona 1 z 9 Ulotka dołączona do opakowania: informacja dla pacjenta DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Triptorelinum Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Biosteron, 5 mg, tabletki Biosteron, 10 mg, tabletki Biosteron, 25 mg, tabletki (Dehydroepiandrosteronum) Należy
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA Biosteron, 5 mg, tabletki Biosteron, 10 mg, tabletki Biosteron, 25 mg, tabletki (Dehydroepiandrosteronum) Należy
ULOTKA DLA PACJENTA - 1 -
 ULOTKA DLA PACJENTA - 1 - Ulotka dołączona do opakowania: informacja dla pacjenta MENOGON; 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy uważnie
ULOTKA DLA PACJENTA - 1 - Ulotka dołączona do opakowania: informacja dla pacjenta MENOGON; 75 IU FSH + 75 IU LH, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Menotropinum Należy uważnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
Ulotka dołączona do opakowania: informacja dla pacjenta. DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla pacjenta DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Triptorelinum Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta DECAPEPTYL DEPOT, 3,75 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Triptorelinum Należy uważnie zapoznać się z treścią
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. DECAPEPTYL DEPOT; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DECAPEPTYL DEPOT; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułkostrzykawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DECAPEPTYL DEPOT; 3,75 mg; proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ampułkostrzykawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nizoral 20 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g kremu zawiera 20 mg ketokonazolu (Ketoconazolum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nizoral 20 mg/g krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 g kremu zawiera 20 mg ketokonazolu (Ketoconazolum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
Ulotka dołączona do opakowania: informacja dla użytkownika. UNIBEN 1,5 mg/ml, aerozol do stosowania w jamie ustnej (Benzydamini hydrochloridum)
 Ulotka dołączona do opakowania: informacja dla użytkownika UNIBEN 1,5 mg/ml, aerozol do stosowania w jamie ustnej (Benzydamini hydrochloridum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika UNIBEN 1,5 mg/ml, aerozol do stosowania w jamie ustnej (Benzydamini hydrochloridum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI
 Załącznik nr 11 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI ICD-10 E 22.8 Przedwczesne dojrzewanie płciowe
Załącznik nr 11 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE PRZEDWCZESNEGO DOJRZEWANIA PŁCIOWEGO U DZIECI ICD-10 E 22.8 Przedwczesne dojrzewanie płciowe
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Leuprostin, 5 mg, implant 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden implant zawiera 5 mg leuproreliny (Leuprorelinum) w postaci octanu. Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Leuprostin, 5 mg, implant 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden implant zawiera 5 mg leuproreliny (Leuprorelinum) w postaci octanu. Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Produktu nie należy stosować pod opatrunkiem okluzyjnym lub w postaci okładów.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO LOCOID, 1 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jeden mililitr roztworu zawiera 1 mg 17-maślanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO LOCOID, 1 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Jeden mililitr roztworu zawiera 1 mg 17-maślanu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Leuprostin, 3,6 mg, implant 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden implant zawiera 3,6 mg leuproreliny (Leuprorelinum) w postaci octanu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Leuprostin, 3,6 mg, implant 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden implant zawiera 3,6 mg leuproreliny (Leuprorelinum) w postaci octanu.
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NIZAX ACTIV, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NIZAX ACTIV, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum submite, Polyvaccinum mite, Polyvaccinum forte Zawiesina do wstrzykiwań. Nieswoista szczepionka bakteryjna. 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum submite, Polyvaccinum mite, Polyvaccinum forte Zawiesina do wstrzykiwań. Nieswoista szczepionka bakteryjna. 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ISMIGEN tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7 mg lizatu bakterii: Staphylococcus aureus
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ISMIGEN tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7 mg lizatu bakterii: Staphylococcus aureus
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum Plus (525 mg + 60 mg + 20 mg)/g, roztwór do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g roztworu do kąpieli zawiera 525 mg parafiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum Plus (525 mg + 60 mg + 20 mg)/g, roztwór do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g roztworu do kąpieli zawiera 525 mg parafiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Glypressin, 1 mg, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna ampułka z 8,5 mililitrami roztworu zawiera 1 mg terlipresyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Glypressin, 1 mg, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna ampułka z 8,5 mililitrami roztworu zawiera 1 mg terlipresyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
Ulotka dołączona do opakowania: informacja dla pacjenta. EXACYL, 100 mg/ml, roztwór do wstrzykiwań Acidum tranexamicum
 Ulotka dołączona do opakowania: informacja dla pacjenta EXACYL, 100 mg/ml, roztwór do wstrzykiwań Acidum tranexamicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta EXACYL, 100 mg/ml, roztwór do wstrzykiwań Acidum tranexamicum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 g żelu zawiera 10 mg klindamycyny (Clindamycinum) w postaci klindamycyny fosforanu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO KLINDACIN T, 10 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg klindamycyny (Clindamycinum) w postaci klindamycyny fosforanu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO KLINDACIN T, 10 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 10 mg klindamycyny (Clindamycinum) w postaci klindamycyny fosforanu.
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Biosteron, 5 mg, tabletki Biosteron, 10 mg, tabletki Biosteron, 25 mg, tabletki (Dehydroepiandrosteronum) Należy
Ulotka dołączona do opakowania: informacja dla pacjenta Biosteron, 5 mg, tabletki Biosteron, 10 mg, tabletki Biosteron, 25 mg, tabletki (Dehydroepiandrosteronum) Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Moxalole, 13,125 g + 350,7 mg + 46,6 mg + 178,5 mg, proszek do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Moxalole, 13,125 g + 350,7 mg + 46,6 mg + 178,5 mg, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Moxalole, 13,125 g + 350,7 mg + 46,6 mg + 178,5 mg, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Glypressin, 1 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Glypressin, 1 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Glypressin, 1 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna fiolka zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. FORLAX 10 g, proszek do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORLAX 10 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna saszetka zawiera 10 g makrogolu 4000. Makrogol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORLAX 10 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna saszetka zawiera 10 g makrogolu 4000. Makrogol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: czerwień koszenilowa (E 124), metylu parahydroksybenzoesan, sód.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
Aneks III. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Ulotka dołączona do opakowania: informacja dla pacjenta. AROMEK 2,5 mg, tabletki powlekane. Letrozolum
 Ulotka dołączona do opakowania: informacja dla pacjenta AROMEK 2,5 mg, tabletki powlekane Letrozolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta AROMEK 2,5 mg, tabletki powlekane Letrozolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika. ZYX, 5 mg, tabletki powlekane. Levocetirizini dihydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ZYX, 5 mg, tabletki powlekane Levocetirizini dihydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
