Agencja Oceny Technologii Medycznych
|
|
|
- Nadzieja Wojciechowska
- 8 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 75/2011 z dnia 22 sierpnia 2011r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub sposobu finansowania, lub warunków realizacji świadczenia opieki zdrowotnej Leczenie ostrej białaczki limfoblastycznej przy wykorzystaniu produktu leczniczego zawierającego substancję czynną idarubicinum (Zavedos ) Rada Konsultacyjna uważa za zasadne pozostawienie dotychczasowego sposobu finansowania świadczenia gwarantowanego Leczenie ostrej białaczki limfoblastycznej przy wykorzystaniu produktu leczniczego zawierającego substancję czynną idarubicinum (Zavedos ) pod warunkiem obniżenia ceny leku do poziomu daunorubicyny. Uzasadnienie Rada wzięła pod uwagę, że podstawą leczenia w ostrej białaczce limfoblastycznej są antracykliny, z reguły wchodzące w skład protokołów chemioterapii skojarzonej. Obecnie są to daunorubicyna i epirubicyna, a w ramach ratunkowego protokołu FLAG-Ida idarubicyna. W razie niedostępności innych antracyklin (daunorubicyny i epirubicyny) idarubicyna może być lekiem zamiennym w protokołach leczenia ostrej białaczki limfoblastycznej. Ponadto lek jest stosunkowo rzadko stosowany, wobec czego usuwanie go z listy leków gwarantowanych będzie miało niewielkie skutki ekonomiczne. Lek jest podobnie skuteczny w opiniowanym wskazaniu jak inne antracykliny, choć istnieją pewne zastrzeżenia co do jego bezpieczeństwa w porównaniu z daunorubicyną (patrz analiza bezpieczeństwa). Tryb przygotowania stanowiska Niniejsze stanowisko opracowane zostało przez Radę Konsultacyjną na podstawie zlecenia Ministra Zdrowia z dnia (znak pisma: MZ-PLE /GB/10) oraz raportu ws. oceny świadczenia opieki zdrowotnej Zavedos (idarubicyna) leczenie ostrej białaczki limfoblastycznej nr AOTM-OT Problem zdrowotny Ostre białaczki to grupa chorób, które wiążą się z niekontrolowanym namnażaniem zmienionych nowotworowo, niedojrzałych komórek (blastów), które powstają w szpiku kostnym. 2 W ostrej białaczce limfoblastycznej (ang. acute lymphoblastic leukemia-all, ICD-10: C91.0) komórki nowotworowe związane są z prekursorami (limfoblastami) limfocytów linii B lub T. Składają się z komórek blastycznych małego i średniego rozmiaru, z niewielką ilością cytoplazmy o zróżnicowanej gęstości chromatyny i niewielkimi jąderkami. Usytuowane są one głównie w szpiku i krwi (ostre białaczki limfoblastyczne linii B lub T ALL-B/T), a w mniejszych ilościach również w węzłach i tkankach pozawęzłowych (chłoniaki limfoblastyczne linii B lub T LBL-B/T). 2 Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa, tel fax sekretariat@aotm.gov.pl
2 W przebiegu ALL w limfoblastach powstają zmiany genetyczne (mutacje), które blokują dojrzewanie tych komórek, powodują nadmierne ich namnażanie i gromadzenie się w szpiku oraz innych narządach. Mutacje następują w genach, w których zapisane są informacje związane z funkcjonowaniem komórek organizmu. Przyczyny powstania mutacji są najczęściej nieznane. Sporadycznie udaje się ustalić obecność czynników determinujących mutacje prowadzące do rozwoju ALL. Do czynników tych należą: zakażenia niektórymi wirusami, promieniowanie jonizujące, substancje toksyczne (np. benzol, pestycydy). 3 W odróżnieniu od przewlekłych białaczek, ostre białaczki rozwijają się w ciągu kilku tygodni i szybko determinują wystąpienie ciężkich objawów. Wobec tego szybkie rozpoznanie jest niezwykle istotne. 3 Zakres niezbędnych badań w kierunku diagnostyki ALL obejmuje: 2 badanie płynu mózgowo rdzeniowego z oceną cytologiczną i w razie potrzeby badaniami charakteru komórek z użyciem metod biologiczno molekularnych lub cytometrii. Na podstawie wyników wykonanych badań ocenia się obecność czynników zagrożenia i określa wstępnie przynależność do grup wysokiego lub standardowego ryzyka. Ostateczna stratyfikacja uwzględnia również odpowiedź na leczenie, w tym ocenę minimalnej choroby resztkowej; badania HLA klasy I i II chorego (i rodziców, jeśli to możliwe) oraz rodzeństwa w specjalistycznych pracowniach (w przypadku konieczności poszukiwania dawcy niespokrewnionego wykonane z użyciem techniki biologii molekularnej o wysokiej rozdzielczości). Obecna standardowa terapia 1,2 Leczenie ALL polega na stosowaniu chemioterapii. Poza chemioterapią istotne znaczenie ma również leczenie wspomagające, które obejmuje: przetaczanie składników krwi (koncentratu krwinek czerwonych, koncentratu płytek krwi), stosowanie antybiotyków i innych leków w tym czynników stymulujących tworzenie kolonii granulocytów (ang. granulocyte colony-stimulating factor, G-CSF). Leczenie ALL składa się zazwyczaj z kilku etapów: leczenia indukcyjnego, leczenia konsolidującego i leczenia podtrzymującego (w przypadku dużego ryzyka nawrotu choroby, leczenie podtrzymujące może być zastąpione przeszczepieniem szpiku). Leczenie jest ponadto zróżnicowane w zależności od typu białaczki. W terapii wstępnej przed rozpoczęciem leczenia właściwego przez 3 7 dni stosuje się glikokortykosteroidy: prednizon (PRED) lub deksametazon. Leczenie indukujące remisję (czterotygodniowy blok) obejmuje terapię z użyciem winkrystyny (VIN), antracykliny, glikokortykosteroidów i L asparaginazy (L-Asp) w formie natywnej lub sprzężonej z glikolem polietylenowym (np. program PALG ). Leczenie konsolidujące obejmuje: sekwencyjne podanie co najmniej 4 kursów chemioterapii obejmujących między innymi wysokie dawki cytarabiny (Ara C), wysokie lub pośrednie dawki metotreksatu (MTX), cyklofosfamidu (CTX), etopozydu, 6 merkaptopuryny (6-MP) oraz ewentualnie L asparaginazy i glikokortykosteroidów (np. program PALG ). Leczenie poremisyjne (podtrzymujące) w grupie standardowego ryzyka można stosować przez 2 lata. Terapia obejmuje stosowanie: 6 MP codziennie, MTX raz w tygodniu; co 6 tygodni: antracyklinę, VIN i PRED. Według zaleceń postępowania diagnostyczno-terapeutycznego PUO leczenie nawrotu ALL u dzieci prowadzone jest według protokołu BFM ALL REZ Jest to protokół badania klinicznego przeprowadzonego przez ośrodki niemieckie (ClinicalTrials.gov NCT ). Zgodnie z tym protokołem chorych z pierwszym nawrotem kwalifikuje się do jednej z czterech grup ryzyka S1-S4 w zależności od: czasu wystąpienia wznowy, lokalizacji wznowy, immunofenotypu wznowy, kariotypu wznowy. Plan leczenia zależy od grupy rokowniczej i składa się z indukcji, konsolidacji i leczenia podtrzymującego. 2/7
3 Plan leczenia dla grupy S1 obejmuje stosowanie po cytoredukcyjnej profazie z deksametazonem bloków indukcyjnych F1 i F2. W razie wznowy w OUN wprowadza się wzmocnioną terapię dokanałową. Dalsze leczenie prowadzi się w formie 6 bloków, zaczynających się od R2. Do tego leczenia dołącza się specyficzną lokalną terapię. Leczenie podtrzymujące trwa 12 miesięcy bez pulsów reindukcji i składa się z zalecanego cotygodniowo doustnego podawania MTX i codziennego podawania 6 merkaptopuryny (6 MP). Plan leczenia dla grupy S2 obejmuje stosowanie po cytoredukcyjnej profazie z deksametazonem bloków indukcyjnych F1 i F2. Dalsze leczenie prowadzi się w formie 8 bloków, zaczynających się od R2. W razie wystąpienia pozaszpikowego do terapii włącza się specyficzne lokalne leczenie. U wszystkich dzieci z izolowaną lub złożoną wznową szpikową stosuje się profilaktycznie naświetlanie OUN w dawkach zależnych od wieku. Następnie przeprowadza się leczenie podtrzymujące remisję, trwające 24 miesiące z pulsami rendukcji (VP16). W przypadku dzieci zaliczonych do grupy S2, z zajęciem szpiku kostnego, należy pilnie sprawdzić, czy mają one rodzeństwo ze zgodnym HLA mogące być dawcami szpiku. Przeszczep można przeprowadzić po piątym bloku R. Jeżeli niemożliwe jest przeprowadzenie diagnostyki MRD z powodów technicznych lub logistycznych, należy określić wskazania do przeszczepu na podstawie znanych kryteriów (S2A D). Plan leczenia dla grupy S3 obejmuje stosowanie po cytoredukcyjnej profazie z deksametazonem bloków indukcyjnych F1 i F2. Dalsze leczenie przeprowadza się w formie trzech bloków, zaczynających się od R2. Należy szczególnie uważać w czasie trwania pierwszych czterech bloków. W grupie tej wskazanie do BMT jest obowiązkowe. Pilnie należy ustalić, czy istnieje dawca (w pierwszej linii spokrewniony, w drugiej niespokrewniony) o zgodnym układzie HLA. Po osiągnięciu całkowitej remisji należy dokonać przeszczepu po trzecim bloku R. W przypadku braku odpowiedniego dawcy spokrewnionego lub niespokrewnionego powinno się przeprowadzić przeszczep eksperymentalny. Grupę S4 obowiązują te same wytyczne jak grupę S3. Ważnym celem jest poprawa wskaźnika remisji przez zastosowanie bloków F. W przypadku nieuzyskania poprawy wskaźnika remisji w przebiegu badań w grupie S4 przewiduje się przeprowadzenie eksperymentalnej terapii indukującej. U dorosłych z ostrą białaczką limfoblastyczną, u których doszło do nawrotu choroby po leczeniu chemioterapią i leczeniu podtrzymującym, należy rozważyć reindukcję wraz z allogenicznym przeszczepem szpiku kostnego. Chorzy, u których nie ma zgodności w zakresie antygenów HLA są odpowiednimi kandydatami do wzięcia udziału w badaniach klinicznych obejmujących autotransplantacje, immunomodulacje oraz innowacyjne chemioterapeutyki lub leki biologiczne. Niskie dawki radioterapii powinny zostać rozważone, jako leczenie paliatywne u chorych ze stwierdzonymi nawrotami z lub bez zmian poza centralnym układem nerwowym. Powyższe zalecenia oparto na wytycznych klinicznych, zarówno polskich (PUO 2009, 4,5 PALG ), jak i światowych (NCI ,8 ). Opis świadczenia 9 Idarubicyna (Zavedos ), kod ATC: L01DB06, jest antracykliną wbudowującą się w cząsteczkę DNA, wchodzącą w interakcję z enzymem topoizomerazą II, co powoduje hamowanie syntezy kwasów nukleinowych. Zmiana w pozycji 4 cząsteczki antracykliny nadaje związkowi wysoki poziom lipofilności, a w konsekwencji zwiększa stopień jego penetracji do komórki w porównaniu do doksorubicyny i daunorubicyny. Została po raz pierwszy dopuszczona do obrotu 14 lipca 1993 r. Idarubicyna jest produktem antymiototycznym i cytotoksycznym powszechnie stosowanym w chemioterapii w połączeniu z innymi substancjami. Produkt leczniczy Zavedos jest wskazany w leczeniu następujących nowotworów: ostra białaczka nielimfoblastyczna (ANLL; określana również jako ostra białaczka szpikowa u dorosłych idarubicyna wywołuje remisje zarówno w terapii pierwszego rzutu, jak i u chorych z nawrotami choroby lub nieodpowiadających na terapię); ALL u dorosłych i dzieci, jako lek drugiego rzutu. Idarubicynę należy podawać dożylnie w postaci rozcieńczonego roztworu z proszku. Wlew należy wykonać w ciągu 5 do 10 minut przez wprowadzone wcześniej cewniki, przez które przepływa roztwór 0,9% sodu chlorku lub 5% dekstrozy. Bezpośrednie szybkie wstrzyknięcie produktu nie jest 3/7
4 zalecane, ze względu na ryzyko wynaczynienia. W monoterapii w leczeniu ALL sugerowana dawka dla dorosłych wynosi: 12 mg/m 2 na dobę, dożylnie przez 3 dni; z kolei dla dzieci: 10 mg/m 2 na dobę, dożylnie, przez 3 dni. Konieczne jest dostosowanie sugerowanego dawkowania do zaburzeń hematologicznych u danego chorego, a w przypadku leczenia skojarzonego do dawek pozostałych leków cytotoksycznych. Aktualnie idarubicyna jest finansowana w ramach katalogu substancji czynnych, stosowanych w chemioterapii nowotworów w następujących wskazaniach: nowotwory złośliwe nerwów obwodowych i autonomicznego układu nerwowego (C47, C47.0-9), nowotwory złośliwe tkanki łącznej i innych tkanek miękkich (C49, C49.0-9), nowotwory złośliwe nadnerczy (C74, C74.0-1, C74.9), nowotwór złośliwy umiejscowień innych i niedokładnie określonych (C76, C76.0-5, C76.7-8), inne i nieokreślone postacie chłoniaków nieziarniczych (C85, C85.0-1, C85.7, C85.9), białaczka limfatyczna (C91, C91.0-5, C91.7, C91.9), białaczka szpikowa (C92, C92.0-5, C92.7, C92.9), białaczka monocytowa (C93, C93.0-2, C93.7, C93.9), inne białaczki określonego rodzaju (C94, C94.0-5, C94.7), białaczka z komórek nieokreślonego rodzaju (C95, C95.0-2, C95.7, C95.9), inny i nieokreślony nowotwór złośliwy tkanki limfatycznej, krwiotwórczej i tkanek pokrewnych (C96, C96.0-3, C96.7, C96.9), zespoły mielodysplastyczne(d46, D46.0-4, D46.7, D46.9). Efektywność kliniczna 1 Podmiot odpowiedzialny przedłożył analizę efektywności klinicznej, zawierającą przegląd systematyczny badań pierwotnych. W oparciu o 2 RCT oraz 1 badanie nierandomizowane, dwuramienne dokonano oceny klinicznej skuteczności idarubicyny (IDA) w porównaniu z daunorubicyną (DAU) w leczeniu dzieci i dorosłych z ALL. W badaniu skuteczności IDA w leczeniu dorosłych z ALL zarówno IDA (9 mg/m 2 przez 4 dni), jak i DUA (30 mg/m 2 przez 5 dni) w fazie indukcji były stosowane w schemacie z VIN+CTX+PRED. Analiza punktów końcowych związanych z osiągnięciem całkowitej odpowiedzi na leczenie oraz niepowodzeniem leczenia pomiędzy chorymi przyjmującymi w fazie indukcji schemat zawierający IDA+VIN+CTX+PRED (IDA+CHEMIA) lub DUA+VIN+CTX+PRED (DUA+CHEMIA) wykazała brak istotnych statystycznie (i.s.) różnic pomiędzy grupami. W odniesieniu do przeżycia bez objawów choroby (DFS) wynik był granicznie nieistotny (IDA+CHEMIA: 31,1%, DUA+CHEMIA: 18,2%). Dla trzy- i pięcioletniego DFS z uwagi na brak wystarczających danych umożliwiających przeprowadzenie obliczeń nie można było określić i.s. wykazanej w badaniu różnicy wyników. W badaniu skuteczności IDA w leczeniu dzieci z ALL, IDA (dawka 10 i 12,5 mg/m 2 przez 3 dni) oraz DUA (45 mg/m 2 przez 3 dni) stosowano w schemacie z VIN+L-Asp+PRED w fazie indukcji. Następnie chorzy otrzymywali przejściową terapię podtrzymującą (VIN+MTX+L-Asp), w trakcie której kwalifikowano chorych do przeszczepu szpiku kostnego. Dzieciom, które nie miały wskazania do wykonania przeszczepu, podawano terapię podtrzymującą, na którą składały się dwie fazy. Faza I: Ara-C+L-Asp+IDA lub DUA. Faza II: VIN+MTX+L-Asp. Analiza wyników dla punktów końcowych związanych z całkowitą drugą remisją, przeżywalnością chorych i nawrotem choroby w grupach IDA (IDA 10 i 12,5 mg/m 2 ) i DAU wykazała w przypadku większości punktów końcowych brak i.s. różnic. Istotne statystycznie różnice na korzyść schematu IDA (12,5 mg/m 2 ) odnotowano w przypadku rocznego prawdopodobieństwa osiągnięcia czasu wolnego od zdarzenia (EFS) [OR=3,18 (95% CI: 1,10;9,20)]. Wyniki dla dwuletniego EFS w podgrupie pacjentów, u których wykonano przeszczep szpiku nie wykazały i.s. różnicy pomiędzy grupami IDA i DAU w prawdopodobieństwie osiągnięcia dwuletniego EFS. Różnica była i.s. na korzyść IDA w podgrupie pacjentów, u których stosowano terapię podtrzymującą [OR=7,45 (95% CI: 1,26; 44,13)]. Analiza prawdopodobieństwa osiągnięcia drugiej całkowitej remisji nie wykazała i.s. różnic pomiędzy analizowanymi grupami. Bezpieczeństwo stosowania 1 Analizę bezpieczeństwa oparto na 6 badaniach (2 RCT). Dodatkowe źródło informacji stanowiła ChPL. Analiza wyników związanych z występowaniem działań niepożądanych w grupach dorosłych chorych stosujących IDA+CHEMIA i DAU+CHEMIA wykazała i.s. różnice na korzyść schematu DAU w odniesieniu do częstości występowania infekcji (IDA: 27%, DUA: 11%) oraz zapalenia śluzówki jamy ustnej (IDA: 22%, DUA: 8%). 4/7
5 W ocenie bezpieczeństwa schematów IDA+CHEMIA vs DAU+CHEMIA w leczeniu dzieci z ALL i.s. różnice wystąpiły w przypadku porównania częstości występowania zgonów w fazie indukcji pomiędzy grupami IDA (10 i 12,5 mg/m 2 ) i DAU [OR=9,14 (95% CI: 1,76; 47,47)] oraz IDA (12,5 mg/m 2 ) i DAU [OR=20,31 (95% CI: 3,07; 134,25)] w obu przypadkach różnica była na korzyść DAU. Ponadto i.s. różnice odnotowano w przypadku następujących punktów końcowych: infekcje zagrażające życiu dla porównań IDA (10 mg/m 2 ) vs DAU [OR=15,71 (95% CI: 1,63; 151,88)], IDA (12,5 mg/m 2 ) vs DAU [OR=10,48 (95% CI: 2,46; 44,70)], IDA (15 mg/m 2 ) vs DAU [OR=7,86 (95% CI: 1,30; 47,34)] oraz łącznie grupami IDA (10 i 12,5 mg/m 2 ) vs DAU [OR=11,79 (95% CI: 3,29; 42,16)] we wszystkich przypadkach przewaga na korzyść DAU; zgony w fazie indukcji dla porównania IDA (15 mg/m 2 ) vs DAU [OR=33,35 (95% CI: 3,98; 282,04)] przewaga DAU; zgony w fazie indukcji w podgrupie chorych z zajętym OUN dla porównania IDA (12,5 mg/m 2 ) vs DAU [OR=403,43 (95% CI: 2,10; ,45)] przewaga DAU; czas trwania hospitalizacji dla porównania IDA (10 i 12,5 mg/m 2 ) vs DAU [OR=14,00 (95% CI: -23,65; 51,65)] przewaga DAU. Dodatkowo działaniami niepożądanymi najczęściej raportowanymi były: infekcje, nudności i wymioty. Zgodnie z ChPL leczenie antracyklinami niesie ze sobą ryzyko kardiotoksyczności, która może objawiać się powikłaniami wczesnymi (tj. ostrymi) lub późnymi (tj. opóźnionymi). Wczesne objawy toksycznego wpływu idarubicyny na serce obejmują głównie tachykardię zatokową i (lub) nieprawidłowości w zapisie EKG, takie jak niespecyficzne zmiany odcinka ST-T. Opisywano również przypadki tachyarytmii, w tym przedwczesnych skurczów komorowych i tachykardii komorowej, bradykardii oraz bloku przedsionkowo-komorowego i bloku odnogi pęczka Hisa. Jednakże objawy te z reguły nie zwiększają ryzyka kardiotoksyczności późnej, rzadko są istotne klinicznie i zazwyczaj nie stanowią wskazania do przerwania leczenia idarubicyną. Natomiast powikłania późne to: kardiotoksyczność późna zwykle rozwijająca się w późniejszym okresie leczenia lub w ciągu 2-3 miesięcy po jego zakończeniu. Jej objawy obserwowano jednak również po kilku miesiącach, a nawet latach po zakończeniu terapii. Późna kardiomiopatia manifestuje się obniżoną frakcją wyrzutową lewej komory (LVEF) i (lub) objawami zastoinowej niewydolności serca (CHF), takimi jak duszność, obrzęk płuc, obrzęki ortostatyczne, powiększenie serca i wątroby, oliguria, wodobrzusze, wysięk opłucnowy oraz rytm cwałowy serca. Obserwowano również podostre objawy w postaci zapalenia osierdzia/mięśnia sercowego. Najcięższą postacią kardiomiopatii wywołanej stosowaniem antracyklin jest zagrażająca życiu zastoinowa niewydolność serca, będąca efektem toksyczności zależnej od wielkości dawki kumulacyjnej. Z kolei u niemowląt oraz dzieci podatność na kardiotoksyczność antracyklin wydaje się być większa, dlatego też konieczne jest prowadzenie długoterminowych, okresowych badań czynności serca u tych pacjentów. 9 Koszty świadczenia i jego wpływ na budżet płatnika 1 Analiza ekonomiczna, przedłożona przez podmiot odpowiedzialny, dotyczyła oszacowania efektywności kosztowej zastosowania IDA, finansowanej w ramach katalogu substancji czynnych stosowanych w chemioterapii nowotworów, w porównaniu z DAU u chorych na ALL w Polsce. Analizę przeprowadzono z perspektywy wspólnej płatnika publicznego (NFZ) i pacjenta. Przyjęto 28- dniowy horyzont czasowy. Przeprowadzono zestawienie kosztów i konsekwencji oraz analizę kosztów-efektywności. Oceniano odsetki unikniętych zdarzeń niekorzystnych, do których zaliczono: odsetek unikniętych infekcji w co najmniej 3. stopniu nasilenia (populacja dorosłych); odsetek unikniętych infekcji w 4. stopniu nasilenia (populacja dzieci); odsetek unikniętych zapaleń śluzówki jamy ustnej (populacja dorosłych) W analizie uwzględniono koszty leków oraz koszty leczenia działań niepożądanych. Na podstawie analizy w populacji dorosłych różniący koszt całkowity IDA oszacowano na zł, a w przypadku DAU zł. Natomiast w populacji dzieci różniący koszt całkowity IDA oszacowano na zł, a w przypadku DAU zł. Koszt leczenia działań niepożądanych w populacji dorosłych przyjmujących IDA oszacowano na zł, a w przypadku DAU zł. Z kolei w populacji dzieci przyjmujących IDA koszt leczenia działań niepożądanych oszacowano na zł, a w przypadku DAU zł. 5/7
6 Według podmiotu odpowiedzialnego IDA w porównaniu z DAU pod względem generowanych kosztów związanych z częstością występowania infekcji w 4. stopniu nasilenia w populacji dzieci jest technologią mniej opłacalną. Natomiast w populacji dorosłych, zarówno pod względem częstości występowania infekcji w co najmniej 3. stopniu nasilenia, jak i częstości występowania zapaleń śluzówki jamy ustnej, IDA może generować dodatkowe korzyści zdrowotne. W dolnej granicy 95% przedziału ufności parametr ICER przyjmuje wartości zł za uniknięcie infekcji oraz zł za uniknięcie zapalenia śluzówki jamy ustnej. Wartości parametrów ICER w górnej granicy 95% przedziałów ufności oznaczają, że IDA jest technologią mniej efektywną kosztowo. Wyniki analizy wskazują, że dla każdego z ocenianych efektów zdrowotnych IDA jest technologią mniej opłacalną w stosunku do DAU. IDA jest zarówno droższa, jak i generuje więcej niekorzystnych dla pacjenta zdarzeń niepożądanych, względem DAU. Przedstawiona przez wnioskodawcę analiza wpływu na budżet została przeprowadzona z perspektywy NFZ dla 3-letniego horyzontu czasowego. Analiza miała na celu określenie wpływu na system ochrony zdrowia w Polsce decyzji o kontynuacji finansowania IDA w leczeniu chorych na ALL w ramach katalogu substancji czynnych stosowanych w chemioterapii nowotworów. W analizie uwzględniono koszty bezpośrednie medyczne, tj. koszt stosowania antracyklin, natomiast nie wzięto pod uwagę kosztów leczenia działań niepożądanych. Rozpatrywano dwa nowe scenariusze: I zakładający zaprzestanie finansowania terapii IDA oraz kontynuowanie terapii chorych na ALL przy zastosowaniu pozostałych antracyklin finansowanych w leczeniu ALL: epirubicyny, daunorubicyny, doksorubicyny, doksorubicyny lizosomalnej oraz mitoksantronu, oraz II zakładający zaprzestanie finansowania terapii idarubicyną oraz kontynuowanie terapii chorych na ALL wyłącznie lekami z grupy antrakcyklin liposomalnych (doksorubicyna lizosomalna. W przypadku realizacji założeń scenariusza I, wydatki NFZ, w porównaniu z ponoszonymi obecnie w wariancie prawdopodobnym (minimalnym; maksymalnym), ulegną zmniejszeniu o zł w I roku, zł w II roku oraz zł w III roku. W przypadku realizacji założeń scenariusza II, wydatki NFZ, w porównaniu z ponoszonymi obecnie w wariancie prawdopodobnym, ulegną zmniejszeniu o zł w I roku, zł w II roku oraz zł w III roku. Na podstawie wyników analizy można przypuszczać, że kontynuacja finansowania IDA w ramach katalogu substancji czynnych stosowanych w chemioterapii nowotworów będzie wiązała się z wyższymi wydatkami NFZ w porównaniu z realizacją założeń scenariusza nowego I bądź II. Należy zaznaczyć, że wartości z przedstawionej analizy podmiotu wnioskującego (za 2010 r.) dotyczące leków z grupy antracyklin wykorzystywanych w leczeniu ALL znacząco odbiegają od danych NFZ (2010 r.). Dodatkowo dane płatnika dotyczą wyłącznie wskazania C91.0, tj. ALL (zgodnie z przedmiotem zlecenia MZ), zaś dane podmiotu odpowiedzialnego oparto na danych sprzedażowych, które uniemożliwiają wyodrębnienie odsetka pacjentów stosujących IDA oraz pozostałe leki z grupy antracyklin w poszczególnych wskazaniach. Jednocześnie należy mieć na uwadze, że zgodnie z katalogiem substancji czynnych stosowanych w chemioterapii IDA może być stosowana także w wielu innych chorobach (off label). Francuskie HAS (2006) 10 rekomenduje finansowanie w ramach lecznictwa szpitalnego idarubicynę w leczeniu ostrej białaczki szpikowej, u pacjentów powyżej 60 roku życia oraz w przypadkach gdy istnieją przeciwwskazania do chemioterapii dożylnej oraz ryzyko związane z występowaniem przedłużonej aplazji jest większe niż potencjalne korzyści. Biorąc pod uwagę powyższe argumenty, Rada Konsultacyjna przyjęła stanowisko jak na wstępie. Prof. dr hab. n. med. Tomasz Pasierski Przewodniczący Rady Konsultacyjnej 6/7
7 Piśmiennictwo 1. Raport ws. oceny świadczenia opieki zdrowotnej Zavedos (idarubicyna) leczenie ostrej białaczki limfoblastycznej nr AOTM-OT Agencja Oceny Technologii Medycznych: Warszawa, sierpień Szczeklik A, et.al. Wybrane zagadnienia onkologii klinicznej. Choroby wewnętrzne. Stan wiedzy na rok Medycyna Praktyczna, Kraków Europejska Sieć Białaczkowa. Informacja dla dorosłych pacjentów z ostrą białaczką limfoblastyczną European LeukemiaNet Kowalczyk JR. Ostra białaczka limfoblastyczna. Polska Unia Onkologii (PUO) Chybicka A. Zalecenia w zakresie postępowania diagnostyczno-terapeutycznego w pierwszej wznowie ostrej białaczki limfoblastycznej u dzieci. Polska Unia Onkologii (PUO) Hołowiecki J. Nowotwory z limfoidalnych komórek prekursorowych. Ostre białaczki limfoblastyczne. Polska Grupa ds. Leczenia Białaczek u Dorosłych (PALG) National Cancer Institute. Adult Acute Lymphoblastic Leukemia Treatment (PDQ ). NCI National Cancer Institute Childhood Acute Lymphoblastic Leukemia Treatment (PDQ ). NCI Charakterystyka produktu leczniczego Zavedos. 10. Haute Atorite de Sante (HAS). Zavedos 5 mg, capsules Bottle of 1 capsule (CIP code: ); Zavedos 10 mg, capsules Bottle of 1 capsule (CIP code: ); Zavedos 25 mg, capsules Bottle of 1 capsule (CIP code: ) zavedos ang pdf 7/7
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 60/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 22 sierpnia 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 60/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 22 sierpnia 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych
 Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie?
 Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 204/2014 z dnia 25 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ I OSTRĄ BIAŁACZKĘ SZPIKOWĄ
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka szpikowa OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ I OSTRĄ BIAŁACZKĘ SZPIKOWĄ Dasatinib Dasatinib jest wskazany do leczenia dorosłych pacjentów z:
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka szpikowa OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ I OSTRĄ BIAŁACZKĘ SZPIKOWĄ Dasatinib Dasatinib jest wskazany do leczenia dorosłych pacjentów z:
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 10/2011 z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 10/2011 z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub
Rada Konsultacyjna. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 3/2012 z dnia 16 stycznia 2012 r. w sprawie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie ostrej
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 3/2012 z dnia 16 stycznia 2012 r. w sprawie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie ostrej
Część VI: Streszczenie Planu Zarządzania Ryzykiem dla produktu:
 Część VI: Streszczenie Planu Zarządzania Ryzykiem dla produktu: Mitoxantron Accord, 2 mg/ml, koncentrat do sporządzania roztworu do infuzji VI.2 Podsumowanie planu zarządzania ryzykiem dotyczące produktu
Część VI: Streszczenie Planu Zarządzania Ryzykiem dla produktu: Mitoxantron Accord, 2 mg/ml, koncentrat do sporządzania roztworu do infuzji VI.2 Podsumowanie planu zarządzania ryzykiem dotyczące produktu
Hematoonkologia w liczbach. Dr n med. Urszula Wojciechowska
 Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
LECZENIE SZPICZAKA PLAZMATYCZNO KOMÓRKOWEGO (PLAZMOCYTOWEGO) (ICD-10 C 90)
 Załącznik B.13. LECZENIE SZPICZAKA PLAZMATYCZNO KOMÓRKOWEGO (PLAZMOCYTOWEGO) (ICD-10 C 90) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia bortezomibem 1.1 Leczenie bortezomibem nowo zdiagnozowanych
Załącznik B.13. LECZENIE SZPICZAKA PLAZMATYCZNO KOMÓRKOWEGO (PLAZMOCYTOWEGO) (ICD-10 C 90) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia bortezomibem 1.1 Leczenie bortezomibem nowo zdiagnozowanych
IDARUBICIN. Załącznik C.30. NAZWA SUBSTANCJI CZYNNEJ ORAZ, JEŻELI DOTYCZY- DROGA PODANIA. Dziennik Urzędowy Ministra Zdrowia 1078 Poz.
 Dziennik Urzędowy Ministra Zdrowia 1078 Poz. 66 Załącznik C.30. IDARUBICIN 1 IDARUBICIN C47 NOWOTWORY ZŁOŚLIWE NERWÓW OBWODOWYCH I AUTONOMICZNEGO UKŁADU NERWOWEGO 2 IDARUBICIN C47.0 NERWY OBWODOWE GŁOWY,
Dziennik Urzędowy Ministra Zdrowia 1078 Poz. 66 Załącznik C.30. IDARUBICIN 1 IDARUBICIN C47 NOWOTWORY ZŁOŚLIWE NERWÓW OBWODOWYCH I AUTONOMICZNEGO UKŁADU NERWOWEGO 2 IDARUBICIN C47.0 NERWY OBWODOWE GŁOWY,
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
chorych na ITP Krzysztof Chojnowski Warszawa, 27 listopada 2009 r.
 Współczesne leczenie chorych na ITP Krzysztof Chojnowski Klinika Hematologii UM w Łodzi Warszawa, 27 listopada 2009 r. Dlaczego wybór postępowania u chorych na ITP może być trudny? Choroba heterogenna,
Współczesne leczenie chorych na ITP Krzysztof Chojnowski Klinika Hematologii UM w Łodzi Warszawa, 27 listopada 2009 r. Dlaczego wybór postępowania u chorych na ITP może być trudny? Choroba heterogenna,
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
Rysunek. Układ limfatyczny.
 Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Terapeutyczne Programy Zdrowotne 2012 Leczenie glejaków mózgu Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51)
 Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
LECZENIE CHOROBY GAUCHERA ICD-10 E
 załącznik nr 19 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHOROBY GAUCHERA ICD-10 E 75 Zaburzenia przemian sfingolipidów i inne zaburzenia spichrzania
załącznik nr 19 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHOROBY GAUCHERA ICD-10 E 75 Zaburzenia przemian sfingolipidów i inne zaburzenia spichrzania
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Zaobserwowano częstsze przypadki stosowania produktu leczniczego Vistide w niezatwierdzonych wskazaniach i (lub) drogach podawania.
 Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Rysunek. Układ limfatyczny.
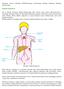 Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych
 Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych Jadwiga Dwilewicz-Trojaczek Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa
Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych Jadwiga Dwilewicz-Trojaczek Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Rysunek. Układ limfatyczny.
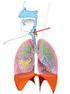 Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 75/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 24 października 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 75/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 24 października 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 115/2012 z dnia 12 listopada w sprawie zasadności finansowania leku Procoralan (EAN 5909990340439) we wskazaniu:
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 115/2012 z dnia 12 listopada w sprawie zasadności finansowania leku Procoralan (EAN 5909990340439) we wskazaniu:
Specjalności. Warunki GINEKOLOGIA ONKOLOGICZNA HEMATO-ONKOLOGIA DZIECIĘCA TRYB AMBULATORYJNY ENDOKRYNOLOGIA HOSPITALIZACJA
 Katalog chemioterapii nie stanowi źródła wiedzy medycznej, a jest jedynie narzędziem sprawozdawczo-rozliczeniowym NFZ. W każdym przypadku za wdrożenie odpowiedniej terapii zgodnie z aktualną wiedzą medyczną
Katalog chemioterapii nie stanowi źródła wiedzy medycznej, a jest jedynie narzędziem sprawozdawczo-rozliczeniowym NFZ. W każdym przypadku za wdrożenie odpowiedniej terapii zgodnie z aktualną wiedzą medyczną
Ostra niewydolność serca
 Ostra niewydolność serca Prof. dr hab. Jacek Gajek, FESC Uniwersytet Medyczny we Wrocławiu Niewydolność serca Niewydolność rzutu minutowego dla pokrycia zapotrzebowania na tlen tkanek i narządów organizmu.
Ostra niewydolność serca Prof. dr hab. Jacek Gajek, FESC Uniwersytet Medyczny we Wrocławiu Niewydolność serca Niewydolność rzutu minutowego dla pokrycia zapotrzebowania na tlen tkanek i narządów organizmu.
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
CHOROBY ROZROSTOWE UKŁADU KRWIOTWÓRCZEGO BIAŁACZKI WIEKU DZIECIĘCEGO
 CHOROBY ROZROSTOWE UKŁADU KRWIOTWÓRCZEGO BIAŁACZKI WIEKU DZIECIĘCEGO ZWIĘKSZONE RYZYKO WYSTĄPIENIA BIAŁACZKI Zakażenia wirusowe Promieniowanie jonizujące Związki chemiczne (benzen- ANLL) Środki alkilujące
CHOROBY ROZROSTOWE UKŁADU KRWIOTWÓRCZEGO BIAŁACZKI WIEKU DZIECIĘCEGO ZWIĘKSZONE RYZYKO WYSTĄPIENIA BIAŁACZKI Zakażenia wirusowe Promieniowanie jonizujące Związki chemiczne (benzen- ANLL) Środki alkilujące
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 190/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 190/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0)
 Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Fluorochinolony i ryzyko wydłużenia odstępu QT. <X>: gemifloksacyna i moksyfloksacyna [+ sparfloksacyna, grepaflkosacyna, gatyfloksacyna]
![Fluorochinolony i ryzyko wydłużenia odstępu QT. <X>: gemifloksacyna i moksyfloksacyna [+ sparfloksacyna, grepaflkosacyna, gatyfloksacyna] Fluorochinolony i ryzyko wydłużenia odstępu QT. <X>: gemifloksacyna i moksyfloksacyna [+ sparfloksacyna, grepaflkosacyna, gatyfloksacyna]](/thumbs/24/4402652.jpg) Fluorochinolony i ryzyko wydłużenia odstępu QT : gemifloksacyna i moksyfloksacyna [+ sparfloksacyna, grepaflkosacyna, gatyfloksacyna] CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 4.3 Przeciwwskazania Zarówno
Fluorochinolony i ryzyko wydłużenia odstępu QT : gemifloksacyna i moksyfloksacyna [+ sparfloksacyna, grepaflkosacyna, gatyfloksacyna] CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 4.3 Przeciwwskazania Zarówno
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zavedos, 5 mg, proszek do sporządzania roztworu do wstrzykiwań Zavedos, 10 mg, proszek do sporządzania roztworu do wstrzykiwań 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zavedos, 5 mg, proszek do sporządzania roztworu do wstrzykiwań Zavedos, 10 mg, proszek do sporządzania roztworu do wstrzykiwań 2. SKŁAD
Aneks II. Niniejsza Charakterystyka Produktu Leczniczego oraz ulotka dla pacjenta stanowią wynik procedury arbitrażowej.
 Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI
 WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację?
 Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
Nowotwory złośliwe u dzieci w 2006 roku
 Nowotwory złośliwe u dzieci w 2006 roku Joanna Didkowska, Urszula Wojciechowska, Zakład Epidemiologii i Prewencji Nowotworów, Centrum Onkologii Instytut, Warszawa Krajowy Rejestr Nowotworów Niniejsze opracowanie
Nowotwory złośliwe u dzieci w 2006 roku Joanna Didkowska, Urszula Wojciechowska, Zakład Epidemiologii i Prewencji Nowotworów, Centrum Onkologii Instytut, Warszawa Krajowy Rejestr Nowotworów Niniejsze opracowanie
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
CHŁONIAKI ZŁOŚLIWE U DZIECI
 Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego.
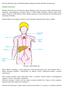 Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Rysunek. Układ Limfatyczny.
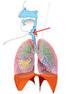 Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
MINISTERSTWO ZDROWIA DEPARTAMENT POLITYKI ZDROWOTNEJ NARODOWY PROGRAM ZWALCZANIA CHORÓB NOWOTWOROWYCH
 Załącznik nr 1 opis programu MINISTERSTWO ZDROWIA DEPARTAMENT POLITYKI ZDROWOTNEJ Nazwa programu: NARODOWY PROGRAM ZWALCZANIA CHORÓB NOWOTWOROWYCH Nazwa zadania: WDROŻENIE PROGRAMU KONTROLI JAKOŚCI W DIAGNOSTYCE
Załącznik nr 1 opis programu MINISTERSTWO ZDROWIA DEPARTAMENT POLITYKI ZDROWOTNEJ Nazwa programu: NARODOWY PROGRAM ZWALCZANIA CHORÓB NOWOTWOROWYCH Nazwa zadania: WDROŻENIE PROGRAMU KONTROLI JAKOŚCI W DIAGNOSTYCE
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
PRZEWODNIK DLA FARMACEUTY JAK WYDAWAĆ LEK INSTANYL
 PRZEWODNIK DLA FARMACEUTY JAK WYDAWAĆ LEK INSTANYL WAŻNE INFORMACJE DOTYCZĄCE BEZPIECZEŃSTWA: INSTANYL, AEROZOL DO NOSA LEK STOSOWANY W LECZENIU PRZEBIJAJĄCEGO BÓLU NOWOTWOROWEGO Szanowny Farmaceuto, Należy
PRZEWODNIK DLA FARMACEUTY JAK WYDAWAĆ LEK INSTANYL WAŻNE INFORMACJE DOTYCZĄCE BEZPIECZEŃSTWA: INSTANYL, AEROZOL DO NOSA LEK STOSOWANY W LECZENIU PRZEBIJAJĄCEGO BÓLU NOWOTWOROWEGO Szanowny Farmaceuto, Należy
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 2/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 16 stycznia 2012 r. w sprawie zmiany sposobu finansowania świadczenia opieki
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 2/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 16 stycznia 2012 r. w sprawie zmiany sposobu finansowania świadczenia opieki
ostrym reumatoidalnym zapaleniem stawów (choroba powodująca stan zapalny stawów), gdzie produkt MabThera podaje się dożylnie z metotreksatem;
 EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Diagnostyka zakażeń EBV
 Diagnostyka zakażeń EBV Jakie wyróżniamy główne konsekwencje kliniczne zakażenia EBV: 1) Mononukleoza zakaźna 2) Chłoniak Burkitta 3) Potransplantacyjny zespół limfoproliferacyjny Jakie są charakterystyczne
Diagnostyka zakażeń EBV Jakie wyróżniamy główne konsekwencje kliniczne zakażenia EBV: 1) Mononukleoza zakaźna 2) Chłoniak Burkitta 3) Potransplantacyjny zespół limfoproliferacyjny Jakie są charakterystyczne
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
ALLOPRZESZCZEPIENIE KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH w PRZEWLEKŁEJ BIAŁACZCE LIMFOCYTOWEJ w POLSCE ANKIETA WIELOOŚRODKOWA
 ALLOPRZESZCZEPIENIE KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH w PRZEWLEKŁEJ BIAŁACZCE LIMFOCYTOWEJ w POLSCE ANKIETA WIELOOŚRODKOWA Ośrodek koordynujący: Śląskiego Uniwersytetu Medycznego w Katowicach Kierownik
ALLOPRZESZCZEPIENIE KRWIOTWÓRCZYCH KOMÓREK MACIERZYSTYCH w PRZEWLEKŁEJ BIAŁACZCE LIMFOCYTOWEJ w POLSCE ANKIETA WIELOOŚRODKOWA Ośrodek koordynujący: Śląskiego Uniwersytetu Medycznego w Katowicach Kierownik
w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich
 ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 30 kwietnia 2004 r. w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich (Dz. U. z dnia 1 maja 2004 r.) Na podstawie art. 37h ust. 2 ustawy z dnia
ROZPORZĄDZENIE MINISTRA ZDROWIA z dnia 30 kwietnia 2004 r. w sprawie sposobu prowadzenia badań klinicznych z udziałem małoletnich (Dz. U. z dnia 1 maja 2004 r.) Na podstawie art. 37h ust. 2 ustawy z dnia
