CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Sławomir Majewski
- 6 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Invisipatch, 10 mg/ 16 h system transdermalny, plaster Nicorette Invisipatch, 15 mg/ 16 h system transdermalny, plaster Nicorette Invisipatch, 25 mg/ 16 h system transdermalny, plaster 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden plaster (system transdermalny) 10 mg/ 16 godzin (rozmiar = 9.0 cm 2 ) zawiera jako substancję czynną mg nikotyny. Jeden plaster (system transdermalny) 15 mg/ 16 godzin (rozmiar = 13.5 cm 2 ) zawiera jako substancję czynną mg nikotyny. Jeden plaster (system transdermalny) 25 mg/ 16 godzin (rozmiar = 22.5 cm 2 ) zawiera jako substancję czynną mg nikotyny. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA System transdermalny do stosowania na skórę dostępny w postaci plastrów wielkości 9.0 cm 2, 13.5 cm 2 i 22.5 cm 2. Nicorette Invisipatch to półprzezroczysty, beżowy plaster, składający się ze spodniej warstwy pomocniczej (pre-coated baking), warstwy zawierającej nikotynę oraz warstwy przyklejanej do skóry, zabezpieczonej podkładką pokrytą aluminium i silikonem. Nadruk na plastrze jest w kolorze jasnobrązowym. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Produkt leczniczy jest wskazany w leczeniu uzależnienia od wyrobów tytoniowych u osób zdecydowanych na rzucenie nałogu poprzez złagodzenie głodu nikotynowego i objawów odstawiennych, występujących po zaprzestaniu palenia (patrz punkt 4.9 Przedawkowanie). 4.2 Dawkowanie i sposób podawania Jeśli wystąpią jakiekolwiek objawy przyjęcia zbyt dużej dawki nikotyny, należy tymczasowo przerwać jej podawanie. Jeśli objawy te nie ustąpią, należy ograniczyć dawkowanie nikotyny, zmniejszając częstotliwość jej stosowania lub podawaną dawkę. Zaleca się pacjentom podjęcie wysiłku całkowitego zaprzestania palenia tytoniu podczas leczenia produktem leczniczym Nicorette Invisipatch. Należy korzystać z porad grup wsparcia, gdyż mogą one wspomóc proces rzucania palenia i zakończyć terapię sukcesem. Dorośli i osoby w podeszłym wieku Plaster należy przykleić rano, po przebudzeniu, na nieuszkodzoną powierzchnię skóry, a zdjąć przed pójściem spać. Leczenie za pomocą plastrów (systemu transdermalnego) imituje wahania stężenia nikotyny u palaczy w ciągu dnia i bez przyjmowania nikotyny podczas snu. Stosowanie plastra w ciągu dnia nie powoduje zaburzeń snu, obserwowanych podczas stosowania nikotyny podczas snu. 1
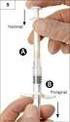
2 U osób o dużym stopniu uzależnienia zaleca się rozpocząć leczenie od Kroku 1, tj. plastra 25 mg/16 h stosowanego raz na dobę przez osiem tygodni. Następnie należy rozpocząć stopniowe odstawianie plastrów (systemu transdermalnego). Należy stosować raz na dobę plaster 15 mg/16 h przez dwa tygodnie, a następnie 10 mg/16 h raz na dobę przez kolejne dwa tygodnie. U osób o małym stopniu uzależnienia zaleca się rozpocząć leczenie od Kroku 2, tj. plastra 15 mg/ 16 h stosowanego raz na dobę przez osiem tygodni, a następnie kontynuować leczenie za pomocą plastra 10 mg/16 h (Krok 3) stosowanego przez kolejne 4 tygodnie. Tabela stosowania Duży stopień uzależnienia Niski stopień uzależnienia Wielkość dawki Czas terapii Wielkość dawki Czas terapii Krok 1 Nicorette Invisipatch, 25 mg/16 h pierwsze 8 tygodni Krok 2 Krok 3 Nicorette Invisipatch, 15 mg/16 h Nicorette Invisipatch,10 mg/16 h kolejne 2 tygodnie ostatnie 2 tygodnie Krok 2 Nicorette Invisipatch, 15 mg/16 h Krok 3 Nicorette Invisipatch, 10 mg/ 16 h pierwsze 8 tygodni ostatnie 4 tygodnie Nie zaleca się stosowania plastrów dłużej niż przez sześć miesięcy. Jednak niektórzy byli palacze mogą wymagać dłuższego okresu leczenia, aby nie wrócić do nałogu. Czasami korzystne może być równoczesne wykorzystanie więcej niż jednej formy nikotynowej terapii zastępczej. Terapia kombinowana skierowana jest do osób palących, które powróciły do nałogu palenia pomimo stosowania w przeszłości monoterapii NTZ lub które mają trudności w opanowaniu chęci zapalenia papierosa podczas stosowania monoterapii. Dlatego, jeśli to konieczne, plaster Nicorette Invisipatch 15 mg/16 h i nikotynowa guma 2 mg mogą być stosowane łącznie. Plaster Nicorette Invisipatch 15 mg/16 h należy przykleić rano, po przebudzeniu i odkleić po 16 godzinach przed pójściem spać. Należy go stosować zgodnie z dawkowaniem zatwierdzonym dla stosowania w monoterapii. Nikotynową gumę 2 mg należy żuć ad libitum, kiedy osoba paląca poczuje silną chęć zapalenia, nie przekraczając maksymalnej dawki dobowej 15 gum. Guma może być stosowana ad libitum przez okres 12 tygodni, następnie należy stopniowo ograniczać stosowanie gum. Maksymalny czas stosowania gum wynosi 12 miesięcy. Dzieci i młodzież Bez zalecenia lekarza nie należy stosować produktu leczniczego Nicorette Invisipatch u osób poniżej 18 lat. Dane dotyczące leczenia osób z tej grupy wiekowej produktem Nicorette Invisipatch są ograniczone. Jak należy stosować plastry Plaster Nicorette Invisipatch należy stosować na czystą, suchą, nieuszkodzoną, nieowłosioną skórę, na przykład w obrębie pośladków, górnej części ramienia lub klatki piersiowej. Należy zmieniać miejsce przyklejenia plastra każdego dnia, to samo miejsce nie powinno być stosowane przez kolejne dni. Można się kąpać i brać prysznic jak zwykle. 1. Umyć ręce przez przyklejeniem plastra. 2. Rozciąć nożyczkami opakowanie wzdłuż, zgodnie z oznakowaniem. Wybrać okolicę ciała, na której skóra jest czysta, sucha, nieuszkodzona i nieowłosiona, na przykład w obrębie pośladków, górnej części ramienia lub klatki piersiowej. 3. Zdjąć z plastra część srebrnej, aluminiowej folii ochronnej. Nie dotykać palcami lepkiej strony plastra na tyle, na ile to możliwe. 4. Przykleić plaster ostrożnie do skóry i odkleić pozostałą część srebrnej, aluminiowej folii ochronnej. 2
3 5. Mocno przycisnąć plaster do skóry dłonią lub palcami. 6. Potrzeć palcami brzegi plastra w celu upewnienia się, że jest on właściwie przyklejony. Po odklejeniu zużyte plastry należy wyrzucić. 4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą, wymienioną w punkcie Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Odpowiedni przedstawiciel personelu medycznego powinien dokonać oceny stosunku ryzyka do korzyści związanych z leczeniem u osób z następującymi dolegliwościami: Uzależnione osoby palące, które niedawno przebyły zawał mięśnia sercowego, osoby z niestabilną lub nasilającą się dławicą piersiową, w tym dławicą Prinzmetala, ciężkimi zaburzeniami rytmu serca, niewyrównanym nadciśnieniem tętniczym lub niedawno przebytym zaburzeniem krążenia mózgowego należy zachęcać do zaprzestania palenia za pomocą metod niefarmakologicznych (takich jak poradnictwo). W przypadku niepowodzenia takiego postępowania można rozważyć użycie leczniczej gumy do żucia. Z powodu ograniczonych danych dotyczących bezpieczeństwa stosowania produktu leczniczego w tych grupach pacjentów należy rozpoczynać leczenie pod ścisłą kontrolą lekarza. Cukrzyca: Pacjentom z cukrzycą należy zalecić częstsze niż zwykle wykonywanie pomiarów stężenia glukozy we krwi po zaprzestaniu palenia i rozpoczęciu NTZ, ponieważ zmniejszone uwalnianie amin katecholowych, spowodowane przez nikotynę, może wpłynąć na metabolizm węglowodanów. Zaburzenia czynności nerek i wątroby: Stosować ostrożnie u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby i (lub) ciężkimi zaburzeniami czynności nerek ze względu na możliwe zmniejszenie klirensu nikotyny lub jej metabolitów, co może powodować nasilone działania niepożądane. Guz chromochłonny nadnerczy i niewyrównana nadczynność tarczycy: Stosować ostrożnie u pacjentów z niewyrównaną nadczynnością tarczycy lub guzem chromochłonnym nadnerczy, ponieważ nikotyna powoduje uwolnienie amin katecholowych. Choroby przewodu pokarmowego: Nikotyna może spowodować zaostrzenie objawów u pacjentów z zapaleniem przełyku lub chorobą wrzodową żołądka albo dwunastnicy, w związku z tym produkty NTZ należy stosować ostrożnie w przypadku występowania tych dolegliwości. Plaster Nicorette Invisipatch należy usunąć przed wykonaniem obrazowania metodą rezonansu magnetycznego (MRI), aby zapobiec oparzeniom. Zagrożenie u małych dzieci: Dawki nikotyny tolerowane przez osoby dorosłe i nastoletnie palące tytoń mogą być bardzo toksyczne dla małych dzieci, co może prowadzić do zgonu. Produktów zawierających nikotynę nie należy pozostawiać w miejscach, w których mogą być dotykane lub połknięte przez dzieci, patrz punkt 4.9 Przedawkowanie. Przeniesienie uzależnienia: Może nastąpić przeniesienie uzależnienia, jest jednak ono zarówno mniej szkodliwe, jak i łatwiejsze do przerwania, niż uzależnienie od palenia tytoniu. Zaprzestanie palenia: Policykliczne aromatyczne węglowodory zawarte w dymie tytoniowym mogą indukować metabolizm leków metabolizowanych z udziałem izoenzymu CYP 1A2. Zaprzestanie palenia przez osobę palącą może doprowadzić do spowolnienia metabolizmu i do związanego z tym zwiększenia stężenia takich leków we krwi. Dotyczy to niektórych istotnych kliniczne leków 3
4 o wąskim indeksie terapeutycznym, np. teofiliny, takryny, klozapiny i ropinirolu. Po zaprzestaniu palenia może również zwiększyć się w osoczu stężenie innych leków metabolizowanych częściowo przez izoenzym CYP 1A2, np. imipraminy, olanzapiny, klomipraminy i fluwoksaminy, chociaż brak danych potwierdzających te obserwacje i nie wiadomo, jakie jest ewentualne znaczenie kliniczne tego efektu dla działania tych leków. Ograniczone dane wskazują, że palenie może indukować metabolizm flekainidu i pentazocyny. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie stwierdzono w sposób jednoznaczny istotnych klinicznie interakcji między nikotynową terapią zastępczą a innymi produktami leczniczymi. Nikotyna może jednak zwiększać działanie hemodynamiczne adenozyny, czyli zwiększać ciśnienie tętnicze krwi i częstość rytmu serca, a także nasilać wrażliwość na ból (ból w klatce piersiowej związany z dławicą piersiową) wskutek podawania adenozyny. Więcej informacji na temat zmiany metabolizmu określonych leków wskutek zaprzestania palenia patrz punkt 4.4 Zaprzestanie palenia. 4.6 Wpływ na płodność, ciążę i laktację Płodność U kobiet palenie tytoniu opóźnia czas zapłodnienia, powoduje zmniejszenie wskaźnika udanych prób zapłodnienia in vitro i istotnie zwiększa ryzyko bezpłodności. U mężczyzn palenie tytoniu powoduje zmniejszenie produkcji nasienia, zwiększenie stresu oksydacyjnego i uszkodzenie DNA. Plemniki osób palących wykazują zmniejszoną zdolność zapładniania. Nie wiadomo, w jakim stopniu do tych oddziaływań u ludzi przyczynia się sama nikotyna. Ciąża Palenie tytoniu w trakcie ciąży wiąże się z takimi zagrożeniami jak opóźnienie wzrostu wewnątrzmacicznego, przedwczesny poród lub poród martwego płodu. Zaprzestanie palenia jest najskuteczniejszą, pojedynczą interwencją, poprawiającą zdrowie zarówno palącej kobiety w ciąży, jaki i jej dziecka. Im wcześniej uda się zerwać z nałogiem, tym lepiej. Nikotyna przenika do organizmu płodu i wpływa na jego oddychanie i krążenie. Wpływ na krążenie jest zależny od dawki. Palącej kobiecie w ciąży należy bezwzględnie zalecić, aby zaprzestała palenia bez stosowania NTZ. Ryzyko kontynuowania palenia może powodować większe zagrożenie dla płodu niż stosowanie produktów NTZ w ramach kontrolowanego programu zaprzestania palenia. Stosowanie Nicorette Invisipatch u palącej kobiety w ciąży można rozpocząć wyłącznie po konsultacji z lekarzem. Karmienie piersią Nikotyna swobodnie przenika do mleka matki w ilościach, mogących oddziaływać na dziecko, nawet gdy stosuje się ją w terapeutycznych dawkach. Dlatego należy unikać stosowania Nicorette Invisipatch w okresie karmienia piersią. Jeśli nie uda się zaprzestać palenia, stosowanie Nicorette Invisipatch przez karmiącą kobietę można rozpocząć wyłącznie po konsultacji z lekarzem. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nicorette Invisipatch nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. 4.8 Działania niepożądane Bez względu na stosowane środki znane są różnorodne objawy związane z rzucaniem nałogowego palenia tytoniu. Zalicza się do nich zaburzenia emocjonalne i poznawcze, takie jak dysforia lub pogorszenie nastroju, bezsenność, drażliwość, frustracja lub gniew, niepokój, problemy z koncentracją, nerwowość lub zniecierpliwienie. Mogą wystąpić również objawy fizyczne, takie jak obniżona częstość akcji serca, zwiększone łaknienie lub zwiększenie masy ciała, zawroty głowy lub 4
5 objawy przedomdleniowe, kaszel, zaparcia, krwawienie dziąseł, owrzodzenia aftowe lub zapalenie jamy nosowo gardłowej. Znaczenie kliniczne ma także głód nikotynowy połączony z chęcią zapalenia. Większość działań niepożądanych zgłaszanych przez pacjentów występuje w ciągu pierwszych tygodni po rozpoczęciu leczenia. Głównie zależą one od dawki nikotyny. W trakcie stosowania Nicorette Invisipatch rzadko mogą pojawić się reakcje alergiczne (w tym objawy anafilaksji). U około 20% pacjentów stosujących plastry Nicorette Invisipatch podczas pierwszych tygodni leczenia występują łagodne, miejscowe reakcje skórne. Działania niepożądane obserwowane w badaniach klinicznych z użyciem nikotynowych plastrów są podobne do tych związanych ze stosowaniem nikotyny w innym sposób. Dane z badań klinicznych Działania niepożądane z badań klinicznych dotyczące nikotyny w postaci plastrów przedstawione są w Tabeli 1. Tabela 1: Działania niepożądane występujące z częstotliwością 1 % Klasyfikacja układów i narządów Działanie niepożądane Substancja czynna Placebo N=1366 (%) N = 3917 (%) Zaburzenia żołądka i jelit Nudności a# Wymioty a 4,7 1,5 6,1 0,1 Zaburzenia ogólne i stany w miejscu Zmęczenie a*# 0,4 1,0 podania Zaburzenia układu immunologicznego Nadwrażliwość a* 0,4 0,2 Zaburzenia układu nerwowego Ból głowy a# Parestezja a* 5,2 0,4 6,1 0,3 Zaburzenia skóry i tkanki podskórnej Świąd 18,0 10,7 a Objawy ogólnoustrojowe * Chociaż częstość występowania jest <1%, działanie niepożądane wystąpiło z częstością 1 % w przypadku innych postaci. # Chociaż częstość występowania dla substancji czynnej jest mniejsza niż dla placebo, to w przypadku innych postaci częstość była wyższa w przypadku substancji czynnej niż placebo. Dane po wprowadzeniu do obrotu Działania niepożądane dotyczące nikotyny stwierdzone w okresie po wprowadzeniu do obrotu przedstawiono w Tabeli 2. Częstość występowania określono zgodnie z następującym schematem: Często ( 1/100 do <1/10) ( 1/1 000 do <1/100) Nieznana (częstość nie może być określona na podstawie dostępnych danych) Jeżeli było to możliwe, kategorię częstości oparto na podstawie częstości występowania w odpowiednio zaprojektowanych badaniach klinicznych lub epidemiologicznych. Jeżeli częstość występowania nie była określona, kategorię częstości określono jako nieznana. Tabela 2: Działania niepożądane stwierdzone po wprowadzeniu produktu leczniczego do obrotu według kategorii częstości oszacowanej na podstawie badań klinicznych Klasyfikacja układów i narządów Działanie niepożądane Częstość występowania Zaburzenia serca Palpitacje ** Tachykardia ** Zaburzenia żołądka i jelit 5
6 Nieznana Dyskomfort żołądkowo-jelitowy * Zaburzenia ogólne i stany w miejscu podania Reakcje w miejscu podania ** Astenia ** Dyskomfort i ból w klatce piersiowej ** Złe samopoczucie ** Zaburzenia układu immunologicznego Nieznana Reakcja anafilaktyczna ** Zaburzenia mięśniowo-szkieletowe Nieznana Ból mięśni * Ból kończyn Zaburzenia psychiczne Niezwykłe sny ** Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Duszność ** Zaburzenia skóry i tkanki podskórnej Nieznana Nieznana Często Często Zaburzenia naczyniowe * W okolicy plastra ** Objawy ogólnoustrojowe Obrzęk naczynioruchowy ** Rumień ** Nadmierne pocenie ** Wysypka ** Pokrzywka ** Zaczerwienienie twarzy ** Nadciśnienie ** Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem: Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C Warszawa Tel.: Faks: ndl@urpl.gov.pl 4.9 Przedawkowanie W przypadku stosowania Nicorette Invisipatch objawy przedawkowania nikotyny mogą wystąpić u pacjentów, którzy przed rozpoczęciem leczenia przyjmowali niewielką dawkę nikotyny lub jeśli jednocześnie przyjmują nikotynę z innych źródeł. Ostra lub przewlekła toksyczność nikotyny u człowieka jest w dużym stopniu zależna od sposobu i drogi podania. Wiadomo, że tolerancja nikotyny (np. u osób palących) znacząco wzrasta w porównaniu do osób niepalących. Uważa się, że najmniejsza śmiertelna doustna dawka nikotyny w ostrym zatruciu u dzieci wynosi od 40 do 60 mg (doustne przyjęcie tytoniu z papierosów) lub od 0,8 do 1,0 mg/kg u osób dorosłych. Objawy przedawkowania są takie same jak po ostrym zatruciu nikotyną i obejmują nudności, wymioty, nadmierne ślinienie, ból brzucha, biegunkę, nadmierne pocenie się, ból głowy, zawroty 6
7 głowy, zaburzenia słuchu oraz znaczne osłabienie. Po dużych dawkach objawom tym może towarzyszyć niedociśnienie, słabe i niemiarowe tętno, trudności w oddychaniu, wyczerpanie, zapaść krążeniowa i uogólnione drgawki. Dawki nikotyny tolerowane przez osoby dorosłe podczas leczenia mogą powodować objawy ciężkiego zatrucia u małych dzieci i mogą być śmiertelne. Podejrzenie zatrucia nikotyną u dziecka należy uznać za stan wymagający pilnej interwencji medycznej, należy przystąpić do jego natychmiastowego leczenia. Postępowanie w razie przedawkowania Należy natychmiast przerwać podawanie nikotyny, pacjent powinien być leczony objawowo. W przypadku połknięcia nadmiernej ilości nikotyny węgiel aktywowany zmniejsza żołądkowojelitowe wchłanianie nikotyny. Należy usunąć plaster i przemyć miejsce aplikacji wodą. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki stosowane w leczeniu uzależnienia od nikotyny. Kod ATC: N07B A01. Nagłe odstawienie produktów zawierających nikotynę po długim okresie codziennego ich stosowania może spowodować wystąpienie charakterystycznego zespołu odstawiennego, obejmującego cztery lub więcej z następujących objawów: zaburzenia nastroju lub obniżony nastrój, bezsenność, drażliwość, frustracja lub złość, niepokój, trudności w koncentracji uwagi, niepokój ruchowy lub niecierpliwość, zmniejszona częstość akcji serca, zwiększenie apetytu lub zwiększenie masy ciała. Głód nikotynowy, uznawany za istotny klinicznie objaw, jest ważnym elementem występującym przy rzucaniu palenia. Badania kliniczne wykazały, że nikotynowa terapia zastępcza może ułatwić palaczom powstrzymywanie się od palenia. 5.2 Właściwości farmakokinetyczne Na opakowaniach wszystkich plastrów zapisano średnią ilość nikotyny wchłanianej przez przeciętnego pacjenta w ciągu 16 godzin. Istnieje liniowa zależność pomiędzy ilością wchłanianej nikotyny (dawka) w dawkach terapeutycznych od 10 do 25 mg/ 16 h a stężeniem w osoczu. Przeciętne maksymalne stężenie nikotyny w osoczu można przeliczyć w następujący sposób: Dawka nikotyny (mg/16 h) C max (ng/ml) Wyliczone maksymalne stężenia w osoczu są w takim samym przedziale jak rzeczywiste, zmierzone maksymalne stężenia w osoczu: 11 ng/ml dla plastra 10 mg oraz 25 ng/ml dla plastra 25 mg. W wyniku interpolacji daje maksymalne stężenie w osoczu 16 ng/ml dla plastra 15 mg. Stężenie maksymalne w osoczu jest osiągane po około 9 godzinach (T max ) po podaniu. Stężenie maksymalne jest osiągane po południu/wieczorem, kiedy ryzyko powrotu do nałogu jest największe. Objętość dystrybucji po podaniu dożylnym nikotyny wynosi około 2 do 3 l/kg mc., a okres półtrwania wynosi około 2 do 3 godzin. Głównym narządem eliminującym nikotynę jest wątroba, średni klirens osoczowy wynosi około 70 l/godz. Nerki i płuca również metabolizują nikotynę. Zidentyfikowano ponad 20 metabolitów nikotyny i wszystkie one są uważane za mniej aktywne niż nikotyna. 7
8 Nikotyna wiąże się z białkami osocza w mniej niż 5%. Dlatego zmiany stopnia wiązania z białkami osocza w następstwie jednoczesnego stosowania leków lub zmiany dotyczące białek osocza nie powodują znaczącej zmiany kinetyki nikotyny. Głównym metabolitem nikotyny w osoczu jest kotynina, której okres półtrwania wynosi od 15 do 20 godzin i która osiąga stężenia 10-krotnie większe niż stężenia nikotyny. Głównymi metabolitami wydalanymi w moczu są kotynina (12% dawki) oraz trans-3-hydroksykotynina (37% dawki). Około 10% nikotyny wydalane jest z moczem w postaci niezmienionej. Postępująca ciężka niewydolność nerek powoduje zmniejszenie całkowitego klirensu nikotyny. Zwiększenie stężenia nikotyny obserwowano u palących pacjentów poddawanych hemodializie. Farmakokinetyka nikotyny nie zmienia się u pacjentów z marskością wątroby o lekkim nasileniu (5 wg Childa) i jest mniejsza w przypadku pacjentów z umiarkowaną marskością wątroby (7 wg Childa). Nieznaczne zmniejszenie całkowitego klirensu nikotyny wykazano u zdrowych osób w podeszłym wieku, jednak w stopniu niewymagającym zmiany dawkowania. Stężenia nikotyny w osoczu są proporcjonalne w zależności od dawki nikotyny w danym plastrze. 5.3 Przedkliniczne dane o bezpieczeństwie Badania niekliniczne z zastosowaniem Nicorette Invisipatch potwierdzają bezpieczeństwo stosowania nikotyny w nikotynowej terapii zastępczej oraz profil bezpieczeństwa substancji pomocniczych. Nie istnieją bezpośrednie dowody genotoksyczności lub mutagenności nikotyny. Dobrze udokumentowane działanie rakotwórcze dymu tytoniowego jest związane głównie z obecnością substancji wytwarzanych podczas rozkładu termicznego tytoniu. Żadna z nich nie występuje w plastrze (systemie transdermalnym) Nicorette Invisipatch. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Warstwa nośna: Triglicerydy o średniej długości łańcucha Kopolimer metakrylanu butylu zasadowy Warstwa zewnętrzna ochronna: Politeraftalan etylenu (PET) 19 µm Warstwa akrylowa, przylegająca: Roztwór akrylowy adhezyjny Durotak Potasu wodorotlenek Kroskarmeloza sodowa Acetyloacetonian glinu Warstwa ochronna, usuwana przed umieszczeniem plastra na skórze: Politeraftalan etylenu (PET) 100 µm 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 3 lata 8
9 6.4 Specjalne środki ostrożności przy przechowywaniu Przechowywać w temperaturze poniżej 25 C. 6.5 Rodzaj i zawartość opakowania Wielkości opakowań: 10 mg/16 godzin - 7, 14 lub 28 plastrów pakowanych w osobne saszetki 15 mg/16 godzin - 7, 14 lub 28 plastrów pakowanych w osobne saszetki 25 mg/16 godzin - 7, 14 lub 28 plastrów pakowanych w osobne saszetki Saszetki z folii laminowanej (papier, folia PET, aluminium, kopolimer akrylonitrylowy) w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie. 6.6 Specjalne środki ostrożności dotyczące usuwania Brak szczególnych wymagań. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU McNeil AB, SE Helsingborg, Szwecja 8. NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU Nicorette Invisipatch 25 mg/16 h Nicorette Invisipatch 15 mg/16 h Nicorette Invisipatch 10 mg/16 h 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA / DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 9
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. NICORETTE INVISIPATCH 10 mg/ 16 h system transdermalny, plaster Nicotinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA 10 mg/ 16 h system transdermalny, plaster 15 mg/ 16 h system transdermalny, plaster 25 mg/ 16 h system transdermalny, plaster Należy przeczytać uważnie całą
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA 10 mg/ 16 h system transdermalny, plaster 15 mg/ 16 h system transdermalny, plaster 25 mg/ 16 h system transdermalny, plaster Należy przeczytać uważnie całą
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA. NICORETTE INVISIPATCH 10 mg/ 16 h system transdermalny, plaster Nicotinum
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA NICORETTE INVISIPATCH 10 mg/ 16 h system transdermalny, plaster Nicotinum NICORETTE INVISIPATCH 15 mg/ 16 h system transdermalny, plaster Nicotinum
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA NICORETTE INVISIPATCH 10 mg/ 16 h system transdermalny, plaster Nicotinum NICORETTE INVISIPATCH 15 mg/ 16 h system transdermalny, plaster Nicotinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
1.1 Wskazania do stosowania
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Freshdrops, 2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 2 mg nikotyny (w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Freshdrops, 2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 2 mg nikotyny (w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Classic Gum, 2 mg, guma do żucia, lecznicza Nicorette Classic Gum, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Classic Gum, 2 mg, guma do żucia, lecznicza Nicorette Classic Gum, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTRYSTYKA PRODUKTU LECZNICZEGO. Jedna guma zawiera jako substancję czynną 2 mg nikotyny, w postaci nikotyny z kationitem.
 CHARAKTRYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette FreshMint Gum, 2 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 2 mg
CHARAKTRYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette FreshMint Gum, 2 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 2 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Microtab Lemon, 2 mg, tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nicotinum Jedna tabletka zawiera dwuwodny dwuwinian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Microtab Lemon, 2 mg, tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nicotinum Jedna tabletka zawiera dwuwodny dwuwinian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna guma zawiera jako substancję czynną 4 mg nikotyny, w postaci nikotyny z kationitem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nicorette Icy White Gum, 4 mg, guma do żucia, lecznicza 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 4 mg nikotyny,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nicorette Icy White Gum, 4 mg, guma do żucia, lecznicza 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 4 mg nikotyny,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna guma zawiera jako substancję czynną 4 mg nikotyny, w postaci nikotyny z kationitem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nicorette FreshMint Gum, 4 mg, guma do żucia, lecznicza 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 4 mg nikotyny,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nicorette FreshMint Gum, 4 mg, guma do żucia, lecznicza 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 4 mg nikotyny,
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nicorette Icy White Gum, 2 mg, guma do żucia, lecznicza 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 2 mg nikotyny,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nicorette Icy White Gum, 2 mg, guma do żucia, lecznicza 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna guma zawiera jako substancję czynną 2 mg nikotyny,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Exmo fruit, 2 mg, guma do żucia, lecznicza Exmo fruit, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Exmo fruit, 2 mg:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Exmo fruit, 2 mg, guma do żucia, lecznicza Exmo fruit, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Exmo fruit, 2 mg:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: etanol (mniej niż 100 mg na dawkę).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Spray, 1 mg/dawkę, aerozol do stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka dostarcza 1 mg nikotyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Spray, 1 mg/dawkę, aerozol do stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka dostarcza 1 mg nikotyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: czerwień koszenilowa (E 124), metylu parahydroksybenzoesan, sód.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
Informacja o leku dla pacjenta
 Informacja o leku dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. lek ten jest dostępny bez recepty, aby pacjent mógł leczyć niektóre schorzenia
Informacja o leku dla pacjenta Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. lek ten jest dostępny bez recepty, aby pacjent mógł leczyć niektóre schorzenia
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. sodu glutaminian (E 621)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
System transdermalny. Okrągły plaster z perforowaną matrycą pakowany w folię o kolorze żółtawo-rdzawym. 7 mg/24 h jest oznaczony PF 10.
 1. NAZWA PRODUKTU LECZNICZEGO 7 mg/24 h, 7 mg/24 h, system transdermalny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy system transdermalny o powierzchni przylegania 10 cm 2 zawiera 17,5 mg nikotyny i uwalnia
1. NAZWA PRODUKTU LECZNICZEGO 7 mg/24 h, 7 mg/24 h, system transdermalny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy system transdermalny o powierzchni przylegania 10 cm 2 zawiera 17,5 mg nikotyny i uwalnia
Nico Fruit 2 mg: Każda guma do żucia zawiera 2 mg nikotyny w postaci nikotyny z kationitem.
 1. NAZWA PRODUKTU LECZNICZEGO Nico Fruit, 2 mg, guma do żucia, lecznicza Nico Fruit, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nico Fruit 2 mg: Każda guma do żucia zawiera 2 mg nikotyny
1. NAZWA PRODUKTU LECZNICZEGO Nico Fruit, 2 mg, guma do żucia, lecznicza Nico Fruit, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nico Fruit 2 mg: Każda guma do żucia zawiera 2 mg nikotyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Nicorette Cool Berry, 13,6 mg/ml, aerozol do stosowania w jamie ustnej, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Cool Berry, 13,6 mg/ml, aerozol do stosowania w jamie ustnej, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka dostarcza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Cool Berry, 13,6 mg/ml, aerozol do stosowania w jamie ustnej, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka dostarcza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan max, 1000 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 1000 mg zmikronizowanej diosminy (Diosminum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
Produktu nie należy stosować pod opatrunkiem okluzyjnym lub w postaci okładów.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
Ulotka dołączona do opakowania: informacja dla użytkownika. Desmoxan 1,5 mg, kapsułki twarde. (Cytisinum)
 Ulotka dołączona do opakowania: informacja dla użytkownika Desmoxan 1,5 mg, kapsułki twarde (Cytisinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Desmoxan 1,5 mg, kapsułki twarde (Cytisinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika. Desmoxan 1,5 mg, kapsułki twarde Cytisinum
 Ulotka dołączona do opakowania: informacja dla użytkownika Desmoxan 1,5 mg, kapsułki twarde Cytisinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Desmoxan 1,5 mg, kapsułki twarde Cytisinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
Produkt stosowany pomocniczo w dolegliwościach związanych ze stanami zapalnymi stawów oraz w stanach bólowych po stłuczeniach.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA. NICORETTE CLASSIC GUM 2 mg, guma do żucia, lecznicza Nicotinum
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA NICORETTE CLASSIC GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE CLASSIC GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy uważnie zapoznać
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA NICORETTE CLASSIC GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE CLASSIC GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy uważnie zapoznać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
Stopień 2 Tygodnie 7. do 9. Stopień 3 Tygodnie 10. do 12. Początkowy etap leczenia Etap leczenia ze zmniejszeniem dawki
 1. NAZWA PRODUKTU LECZNICZEGO NiQuitin Miętowe Listki, 2,5 mg, lamelka rozpadająca się w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 lamelka rozpadająca się w jamie ustnej zawiera 2,5 mg nikotyny. Zawiera
1. NAZWA PRODUKTU LECZNICZEGO NiQuitin Miętowe Listki, 2,5 mg, lamelka rozpadająca się w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 lamelka rozpadająca się w jamie ustnej zawiera 2,5 mg nikotyny. Zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. NICORETTE FRESHMINT GUM 2 mg, guma do żucia, lecznicza Nicotinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NICORETTE FRESHMINT GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE FRESHMINT GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy przeczytać uważnie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NICORETTE FRESHMINT GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE FRESHMINT GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy przeczytać uważnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
Liczba alergików rośnie z roku na rok. Na alergie cierpi prawie ¼ społeczeństwa. czyli 8,5 miliona Polaków!
 Liczba alergików rośnie z roku na rok. Na alergie cierpi prawie ¼ społeczeństwa czyli 8,5 miliona Polaków! Dlaczego tak się dzieje? Rośnie liczba dużych miast. Rośnie też ilość samochodów, bloków mieszkalnych,
Liczba alergików rośnie z roku na rok. Na alergie cierpi prawie ¼ społeczeństwa czyli 8,5 miliona Polaków! Dlaczego tak się dzieje? Rośnie liczba dużych miast. Rośnie też ilość samochodów, bloków mieszkalnych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: alkohol cetostearylowy, glikol propylenowy, kwas benzoesowy.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA 7 mg/24 h, 7 mg/24 h, system transdermalny,, system transdermalny 21 mg/24 h, 21 mg/24 h, system transdermalny Nicotinum Należy przeczytać uważnie całą ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA 7 mg/24 h, 7 mg/24 h, system transdermalny,, system transdermalny 21 mg/24 h, 21 mg/24 h, system transdermalny Nicotinum Należy przeczytać uważnie całą ulotkę,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. NICORETTE CLASSIC GUM 2 mg, guma do żucia, lecznicza Nicotinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NICORETTE CLASSIC GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE CLASSIC GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy przeczytać uważnie całą
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NICORETTE CLASSIC GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE CLASSIC GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy przeczytać uważnie całą
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. NICORETTE FRESHFRUIT GUM 2 mg, guma do żucia, lecznicza Nicotinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NICORETTE FRESHFRUIT GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE FRESHFRUIT GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy przeczytać uważnie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NICORETTE FRESHFRUIT GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE FRESHFRUIT GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy przeczytać uważnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. [Dla 2 mg] Każda lecznicza guma do żucia zawiera 2 mg nikotyny (w postaci 13,2 mg nikotyny z kationitem).
![CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. [Dla 2 mg] Każda lecznicza guma do żucia zawiera 2 mg nikotyny (w postaci 13,2 mg nikotyny z kationitem). CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. [Dla 2 mg] Każda lecznicza guma do żucia zawiera 2 mg nikotyny (w postaci 13,2 mg nikotyny z kationitem).](/thumbs/35/17322713.jpg) CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Niccorex Mint, 2 mg, guma do żucia, lecznicza Niccorex Mint, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY [Dla 2 mg]
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Niccorex Mint, 2 mg, guma do żucia, lecznicza Niccorex Mint, 4 mg, guma do żucia, lecznicza 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY [Dla 2 mg]
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NiQuitin Przezroczysty 114 mg; 21 mg/24 godz. system transdermalny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nicotinum Jeden plaster o powierzchni
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NiQuitin Przezroczysty 114 mg; 21 mg/24 godz. system transdermalny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nicotinum Jeden plaster o powierzchni
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
30 saszetek po 5,0 g Kod kreskowy EAN UCC: Wskazania do stosowania: Zaparcia. Stany, w których wskazane jest ułatwienie wypróżnienia.
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO TEKTUROWE Nasienie płesznika Psyllii semen Skład saszetki: Nasienie płesznika (Psyllii semen) 5,0 g Zioła, 5,0 g/saszetkę 30 saszetek po 5,0
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO TEKTUROWE Nasienie płesznika Psyllii semen Skład saszetki: Nasienie płesznika (Psyllii semen) 5,0 g Zioła, 5,0 g/saszetkę 30 saszetek po 5,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA PYLOX 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA PYLOX 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA PYLOX 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każda tabletka do ssania zawiera 2 mg nikotyny (w postaci nikotyny z kationitem).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Coolmint, 2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 2 mg nikotyny (w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nicorette Coolmint, 2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka do ssania zawiera 2 mg nikotyny (w postaci
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Dettol Med, 4,8 mg/100 mg, koncentrat do sporządzania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Chloroksylenol 4,8 mg na 100 mg koncentratu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Dettol Med, 4,8 mg/100 mg, koncentrat do sporządzania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Chloroksylenol 4,8 mg na 100 mg koncentratu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924 mg butamiratu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Histigen, 8 mg, tabletki Histigen, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Histigen: jedna tabletka zawiera 8 mg dichlorowodorku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Histigen, 8 mg, tabletki Histigen, 16 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Histigen: jedna tabletka zawiera 8 mg dichlorowodorku
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NiQuitin Przezroczysty 14 mg/24 godz. (78 mg) system transdermalny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nicotinum Jeden plaster o powierzchni
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NiQuitin Przezroczysty 14 mg/24 godz. (78 mg) system transdermalny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Nicotinum Jeden plaster o powierzchni
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO
 CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO KLIMAFEMIN, 1 ml/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 ml wyciągu z Cimcifuga racemosa
CHARAKTERYSTYKAPRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO KLIMAFEMIN, 1 ml/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 ml wyciągu z Cimcifuga racemosa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon Advance, (1000 mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty, (500 mg mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 10 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 10 ml produktu
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA. NICORETTE FRESHMINT GUM 2 mg, guma do żucia, lecznicza Nicotinum
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA NICORETTE FRESHMINT GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE FRESHMINT GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy uważnie
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA PACJENTA NICORETTE FRESHMINT GUM 2 mg, guma do żucia, lecznicza Nicotinum NICORETTE FRESHMINT GUM 4 mg, guma do żucia, lecznicza Nicotinum Należy uważnie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TANAKAN, 40 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: Każda tabletka zawiera 40 mg suchego wyciągu z miłorzębu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani hydrobromidum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TUSSIDEX, 30 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TUSSIDEX, 30 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna kapsułka miękka zawiera 30 mg dekstrometorfanu bromowodorku (Dextromethorphani
