CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Joanna Sobczyk
- 8 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO STALORAL Wyciągi alergenowe pochodzenia roślinnego STALORAL Wyciągi alergenowe pochodzenia zwierzęcego STALORAL Wyciągi alergenowe roztoczy kurzu domowego STALORAL Wyciągi alergenowe grzybów (grzyby pleśniowe, dermatofity, drożdże) STALORAL Mieszanki wyciągów alergenowych (pochodzenia roślinnego, zwierzęcego, roztoczy, grzybów) 0,1; 1; 10; 100 IR/ml lub 0,1; 1; 10; 100 IC/ml Roztwór do stosowania doustnego i podjęzykowego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancję czynną stanowią wyciągi alergenowe lub ich mieszanki w połączeniu z mannitolem. Ilość mannitolu nie przekracza 40 mg/ml. 1 fiolka (10 ml) roztworu zawiera wyciągi alergenowe (zgodnie z załącznikiem nr 1) o stężeniu: 0,1; 1; 10; 100 IR*/ml (standaryzowany wyciąg alergenowy) lub 0,1; 1; 10; 100 IC**/ml (niestandaryzowany wyciąg alergenowy) Skład jakościowy substancji czynnej może być dobierany indywidualnie dla pacjenta w zakresie alergenów wymienionych w załączniku nr 1. Pełny wykaz substancji pomocniczych, patrz punkt 6.1. * IR (wskaźnik reaktywności): wyciąg alergenowy posiada aktywność równą 100 IR/ml, jeżeli w teście skórnym punktowym za pomocą igły do nakłuwania Stallerpoint powoduje powstanie rumienia o średnicy 7 mm (średnia geometryczna) u 30 uczulonych na dany alergen osób. Dodatkowo wrażliwość badanych osób jest potwierdzona dodatnią reakcją na fosforan kodeiny 9% lub dichlorowodorek histaminy o stężeniu 10 mg/ml w teście skórnym punktowym. ** IC (wskaźnik stężenia): wyciąg alergenowy posiada miano równe 100 IC/ml, gdy jego stężenie odpowiada stężeniu 100 IR referencyjnego, standaryzowanego alergenu należącego do tej samej grupy. Jeśli nie ma standaryzowanego wyciągu dla danej rodziny alergenów, wartość 100 IC/ml odpowiada stopniowi rozcieńczenia określonemu na podstawie doświadczenia lekarskiego. 3. POSTAĆ FARMACEUTYCZNA Roztwór do stosowania doustnego i podjęzykowego Klarowny roztwór bezbarwny do żółto-brązowego w zależności od rodzaju alergenu i stężenia 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Schorzenia alergiczne o charakterze sezonowym lub całorocznym (typ I alergii wg klasyfikacji Gella i Coombsa), objawiające się nieżytem nosa, zapaleniem spojówek, nieżytem nosa i spojówek lub astmą (o przebiegu łagodnym do umiarkowanego). 1
2 4.2 Dawkowanie i sposób podawania Swoista immunoterapia jest tym skuteczniejsza im w młodszym wieku jest rozpoczęta. Nie zaleca się stosowania immunoterapii alergenowej u dzieci w wieku poniżej 5 lat. Dawkowanie należy ustalić indywidualnie dla każdego pacjenta. Wielkość dawki nie zależy od wieku, lecz od stopnia indywidualnej reaktywności pacjenta. W przypadku alergii sezonowej, zaleca się rozpocząć leczenie 2 do 3 miesięcy przed sezonem pylenia i kontynuować aż do końca sezonu. W przypadku alergii całorocznej, zaleca się kontynuować leczenie przez cały rok. Leczenie dzieli się na dwa etapy: - leczenie podstawowe ze stopniowym zwiększaniem dawki - leczenie podtrzymujące za pomocą stałej dawki. Przed każdorazowym podaniem produktu leczniczego należy dokładnie sprawdzić informacje na fiolce (nazwisko pacjenta, skład, stężenie produktu, termin przydatności do użycia). Leczenie podstawowe ze zwiększaniem dawki Ten produkt leczniczy należy przyjmować w trakcie dnia, do pustych ust, bez jedzenia i picia. Krople produktu należy podać bezpośrednio pod język i utrzymać pod językiem przez około dwie minuty przed połknięciem (droga podjęzykowa). Dzieciom należy go podawać pod kontrolą osób dorosłych. Ten produkt leczniczy stosuje się codziennie, zwiększając każdego dnia dawkę, aż do osiągnięcia dawki podtrzymującej według poniższego schematu: TYDZIEŃ PIERWSZY TYDZIEŃ DRUGI TYDZIEŃ TRZECI 1 IR/ml lub 1 IC/ml zielone wieczko 10 IR/ml lub 10 IC/ml niebieskie wieczko 100 IR/ml lub 100 IC/ml czerwone wieczko Dzień Liczba kropli Dzień Liczba kropli Dzień Liczba kropli Powyższy schemat dawkowania należy uważać za wskazówkę i przykład leczenia. Leczenie można modyfikować w zależności od stanu pacjenta i jego reakcji na leczenie. U niektórych pacjentów, bardzo wrażliwych, leczenie można rozpocząć od mniejszych dawek: 0,1 IR/ml lub 0,1 IC/ml (żółte wieczko): 2
3 TYDZIEŃ PIERWSZY 0,1 IR/ml lub 0,1 IC/ml żółte wieczko Dzień Liczba kropli Leczenie podtrzymujące dawka stała Maksymalna, dobrze tolerowana dawka powinna być przyjmowana codziennie lub 3 razy w tygodniu. Na ogół, codzienne przyjmowanie tego produktu pozwala na lepsze przestrzeganie zaleconego dawkowania. Z tego względu zaleca się codzienne przyjmowanie tego produktu leczniczego. Czas trwania leczenia Na ogół, leczenie odczulające stosuje się przez 3 do 5 lat. W razie braku istotnej poprawy objawów po roku (alergia całoroczna) lub po pierwszym sezonie pylenia (alergia sezonowa), schemat leczenia należy poddać ponownej ocenie. Czasowe przerwanie leczenia W przypadku przerwania stosowania tego produktu na krócej niż tydzień, zaleca się kontynuować leczenie stosując ostatnią dawkę. W przypadku przerwania leczenia na dłużej niż tydzień, zaleca się kontynuować leczenie rozpoczynając od jednej dawki z ostatnio używanej fiolki, a następnie należy zwiększać dawkę zgodnie ze schematem dawkowania, aż do osiągnięcia dawki podtrzymującej. 4.3 Przeciwwskazania - Nadwrażliwość na którąkolwiek substancję pomocniczą wymienioną w punkcie Choroby autoimmunologiczne, choroby kompleksów immunologicznych, niedobory odporności - Choroby nowotworowe - Niekontrolowana lub ciężka astma (FEV1<70% wartości przewidywanej) - Zapalenia jamy ustnej, takie jak liszaj płaski jamy ustnej, wrzody jamy ustnej lub grzybica jamy ustnej. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Pacjenci powinni poinformować lekarza o współistniejących chorobach występujących w ostatnim czasie lub nasileniu się alergii. Przed rozpoczęciem leczenia, należy ustabilizować objawy alergii stosując odpowiednie leczenie objawowe, jeśli istnieje taka konieczność. Jeżeli w momencie rozpoczęcia leczenia występują ciężkie objawy kliniczne choroby alergicznej należy odroczyć leczenie w czasie. Jeśli podczas stosowania STALORAL wystąpią ciężkie lub uporczywe objawy żołądkowo-przełykowe, w tym dysfagia lub ból w klatce piersiowej, leczenie produktem leczniczym STALORAL powinno zostać przerwane, a stan zdrowia pacjenta powinien zostać oceniony przez lekarza, ponieważ zgłaszano występowanie eozynofilowego zapalenia przełyku w powiązaniu z immunoterapią podjęzykową. Leczenie może zostać wznowione tylko na zalecenie lekarza. 3
4 W przypadku wystąpienia objawów alergicznych, może być konieczne stosowanie leków, takich jak kortykosteroidy, leki przeciwhistaminowe H1 i leki β2-adrenergiczne. Należy uważnie rozważyć leczenie odczulające u pacjentów przyjmujących trójcykliczne leki przeciwdepresyjne i inhibitory monoaminooksydazy (MAO). W przypadku grzybicy, aft, zmian w błonie śluzowej, braków w uzębieniu lub chirurgicznych zabiegów w jamie ustnej, w tym zabiegów usunięcia zębów, należy odstawić STALORAL, do czasu całkowitego wygojenia. Należy uważnie rozważyć rozpoczęcie leczenia odczulającego produktem leczniczym STALORAL u pacjentów przyjmujących beta-adrenolityki, ponieważ antagonizują one działanie epinefryny. W przypadku wystąpienia ciężkich reakcji alergicznych u pacjentów stosujących beta-adrenolityki, działanie epinefryny może być mniej skuteczne. Jedna fiolka (10 ml roztworu) produktu STALORAL zawiera 590 mg chlorku sodu, o czym należy pamiętać przy podawaniu pacjentom będącym na diecie ograniczającej spożycie sodu, zwłaszcza w przypadku dzieci. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Nie przeprowadzono badań interakcji z innymi produktami leczniczymi. Podczas badań klinicznych, w których stosowano STALORAL nie zgłoszono interakcji z innymi produktami leczniczymi. Przed rozpoczęciem leczenia należy wziąć pod uwagę konieczność użycia epinefryny w przypadku wystąpienia ciężkich reakcji alergicznych. U pacjentów przyjmujących trójcykliczne leki przeciwdepresyjne lub inhibitory monoaminooksydazy (MAO) istnieje większe ryzyko wystąpienia działań niepożądanych w wyniku stosowania epinefryny, nawet ze skutkiem śmiertelnym. Nie ma doświadczenia klinicznego odnośnie równoczesnego szczepienia profilaktycznego w trakcie leczenia produktem STALORAL. Szczepienie profilaktyczne można wykonać bez przerywania leczenie po ocenie ogólnego stanu zdrowia pacjenta. 4.6 Wpływ na płodność, ciążę i laktację Ciąża Nie ma dostępnych danych klinicznych dotyczących stosowania produktu STALORAL u kobiet w ciąży. Badania na zwierzętach nie wykazują szkodliwego wpływu na reprodukcję (patrz punkt 5.3). W celu zachowania ostrożności, zaleca się nie rozpoczynać leczenia produktem STALORAL w trakcie ciąży. Jeśli pacjentka zajdzie w ciążę w trakcie leczenia, leczenie może być kontynuowane pod ścisłą kontrolą. Karmienie piersią Nie wiadomo czy STALORAL jest wydzielany do mleka matki. Nie przeprowadzono badań na zwierzętach w celu oceny wydzielania produktu STALORAL do mleka. Nie można wykluczyć ryzyka dla noworodków/niemowląt. Należy rozważyć decyzję o kontynuowaniu karmienia piersią lub odstawieniu produktu STALORAL, pod kątem korzyści karmienia piersią dla dziecka i korzyści leczenia dla kobiety. Płodność Nie przeprowadzono badań płodności na zwierzętach z zastosowaniem produktu STALORAL. Natomiast, ocena histopatologiczna męskich i żeńskich organów rozrodczych w wybranych badaniach toksyczności po podaniu wielokrotnym wyciągów pyłków roślin i roztoczy kurzu domowego zawartych w STALORAL nie wykazały niekorzystnego wpływu. 4
5 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn STALORAL nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. 4.8 Działania niepożądane W trakcie leczenia pacjenci są narażeni na działanie alergenów, które mogą wywołać reakcje bezpośrednio po podaniu lub z opóźnieniem. Tak jak w przypadku każdej immunoterapii mogą wystąpić ciężkie reakcje alergiczne, w tym ciężkie zaburzenia krtaniowo-gardłowe lub układowe reakcje alergiczne (tj. ostry początek choroby skóry, błon śluzowych lub obu, choroba układu oddechowego, przewlekle objawy żołądkowo-jelitowe lub obniżenie ciśnienia tętniczego krwi i (lub) powiązane objawy). Należy poinformować pacjentów o powiązanych objawach oraz o konieczności natychmiastowego zgłoszenia się do lekarza po ich wystąpieniu i przerwaniu leczenia. Leczenie należy kontynuować na wyraźne zalecenia lekarza. Tolerancja na daną dawkę przez pacjenta może się z czasem zmienić, w zależności od stanu zdrowia i otoczenia pacjenta. Leczenie poprzedzone stosowaniem produktów przeciwalergicznych (np. leków przeciwhistaminowych) może zmniejszyć częstość występowania oraz nasilenie działań niepożądanych. W przypadku wystąpienia działania niepożądanego, należy ponownie zweryfikować schemat leczenia. Działania niepożądane przedstawiono zgodnie z preferowaną terminologią MedDRA i sklasyfikowano według klasyfikacji układów i narządów MedDRA oraz uszeregowano według częstości występowania: Bardzo często ( 1/10) Często ( 1/100 do < 1/10) Niezbyt często ( 1/1000 do < 1/100) Rzadko ( 1/ do < 1/1000) Bardzo rzadko (< 1/10 000) Klasyfikacja układów i narządów Częstość Działanie niepożądane Zaburzenia krwi i układu chłonnego rzadko powiększenie węzłów chłonnych Zaburzenia układu immunologicznego Zaburzenia układu nerwowego Zaburzenia oka rzadko rzadko często nadwrażliwość objawy podobne do objawów choroby posurowiczej parastezje ból głowy świąd oka zapalenie spojówek 5
6 Zaburzenia ucha i błędnika często świąd ucha Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia często podrażnienie gardła, obrzęk gardła, pęcherze jamy ustno-gardłowej, nieżyt nosa, kaszel astma, duszność, dysfonia, zapalenie części nosowej gardła Zaburzenia żołądka i jelit często obrzęk warg, obrzęk języka, świąd jamy ustnej, obrzęk jamy ustnej, parastezje jamy ustnej, dyskomfort w jamie ustno-gardłowej, zapalenie jamy ustnej, zaburzenia gruczołów ślinowych, nudności, wymioty, ból brzucha, biegunka Zaburzenia skóry i tkanki podskórnej Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Zaburzenia ogólne i stany w miejscu podania często rzadko rzadko rzadko ból w jamie ustnej, zapalenie żołądka, skurcz przełyku świąd, rumień pokrzywka egzema ból stawów, ból mięśni osłabienie, gorączka W każdym przypadku, należy poinformować lekarza o wystąpieniu działania niepożądanego w trakcie przyjmowania produktu leczniczego STALORAL. Dodatkowo po wprowadzeniu do obrotu, zgłaszano następujące spontaniczne działania niepożądane: suchość w jamie ustnej, zaburzenia smaku, obrzęk jamy ustno-gardłowej, obrzęk krtani, obrzęk naczynioruchowy, zawroty głowy, wstrząs anafilaktyczny, eozynofilowe zapalenie przełyku. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C Warszawa tel. (22) , fax. (22) , ndl@urpl.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. 4.9 Przedawkowanie Stosowanie dawek większych niż zalecane może zwiększyć ryzyko wystąpienia i nasilenia działań niepożądanych. 6
7 5 WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: alergeny, ekstrakty alergenów Kod ATC: V01AA Dokładny mechanizm działania alergenów podawanych podczas swoistej immunoterapii nie jest do końca znany. Wykazano, że immunoterapia indukuje zmiany w odpowiedzi limfocytów T, podwyższa poziom swoistych przeciwciał IgG4 i (lub) IgG1, a czasem IgA oraz obniża poziom specyficznych przeciwciał IgE. Wczesną i prawdopodobnie również późną odpowiedź immunologiczną stanowią zmiany aktywności limfocytów T. Ponadto, immunoterapia swoista wywołuje trwałą odpowiedź immunologiczną, poprzez mechanizm swoistej pamięci immunologicznej. 5.2 Właściwości farmakokinetyczne Większa część alergenów w produkcie leczniczym STALORAL jest mieszaniną białek i glikoprotein. Z tego powodu nie można wykonać badania biodostępności tych alergenów po podaniu podjęzykowym. Nie przeprowadzono badań farmakokinetycznych na zwierzętach lub u ludzi w celu oceny profilu farmakokinetycznego i metabolizmu wyciągów alergenowych. 5.3 Przedkliniczne dane bezpieczeństwa Dane niekliniczne uzyskane na podstawie konwencjonalnych badań z zastosowaniem wyciągów alergenowych zawartych w produkcie STALORAL dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności i toksycznego wpływu na reprodukcję i rozwój, nie ujawniają występowania szczególnego zagrożenia dla człowieka. 6 DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Sodu chlorek Glicerol Woda oczyszczona 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 18 miesięcy. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w lodówce (2 0 C C). 7
8 6.5 Rodzaj i zawartość opakowań Fiolki z ciemnego szkła typu I z korkami z gumy chlorobutylowej i kolorowymi wieczkami (inny kolor dla każdego stężenia). Zestaw do leczenia podstawowego: 4 fiolki po 10 ml (stężenie od 0,1 IR/ml do 100 IR/ml lub stężenie od 0,1 IC/ml do 100 IC/ml) żółte wieczko stężenie: 0,1 IR/ml lub 0,1 IC/ml zielone wieczko stężenie: 1 IR/ml lub 1 IC/ml niebieskie wieczko stężenie: 10 IR/ml lub 10 IC/ml czerwone wieczko stężenie: 100 IR/ml lub 100 IC/ml 4 kroplomierze. Zestaw do leczenia podtrzymującego: 2 fiolki po 10 ml (stężenie 100 IR/ml lub 100 IC/ml) czerwone wieczka: 2 kroplomierze. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania W trakcie transportu fiolki należy zawsze przenosić w pozycji pionowej. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU STALLERGENES S.A.S. 6, rue Alexis de Tocqueville Antony, Francja 8. NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU STALORAL -Wyciągi alergenowe pochodzenia roślinnego 8196 STALORAL -Wyciągi alergenowe pochodzenia zwierzęcego 8197 STALORAL -Wyciągi alergenowe roztoczy kurzu domowego 8198 STALORAL -Wyciągi alergenowe grzybów (grzyby pleśniowe, dermatofity, drożdże) 8199 STALORAL -Mieszanki wyciągów alergenowych (pochodzenia roślinnego, zwierzęcego, roztoczy, grzybów) DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 14 lipiec Data ostatniego przedłużenia pozwolenia: 13 wrzesień DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 8
9 STALORAL ZAŁĄCZNIK NR 1 I. Wyciągi alergenowe pochodzenia roślinnego Chwasty 641 Alfalfa (Medicago sativa) IC/ml 664 Mniszek pospolity (Taraxacum vulgare) IC/ml 623 Komosa biała(chenopodium album) IC/ml 673 Nawłoć kanadyjska (Solidago canadensis) IC/ml 636 Chmiel pospolity (Humulus lupulus) IC/ml 605 Bylica pospolita (Artemisia vulgaris) IR/ml 646 Gorczyca czarna (Brassica nigra) IC/ml 654 Pokrzywa zwyczajna (Urtica dioica) IC/ml 643 Złocień właściwy (Chrysanthemum leucanthemum) IC/ml 665 Babka zwyczajna (Plantago) IC/ml 604 Ambrozja (Ambrosia elatior) IR/ml 625 Kapusta ogrodowa (Brassica oleifera) IC/ml 710 Solanka kolczysta (Salsola kali) IC/ml 655 Szczaw zwyczajny (Rumex acetosa) IC/ml 678 Słonecznik zwyczajny (Helianthus annus) IC/ml 657 Parietaria lekarska (Parietaria officinalis) IR/ml Trawy 601 Mietlica pospolita (Agrostis vulgaris) IC/ml 705 Trawa bermudzka (Cynodon dactylon) IR/ml 627 Kupkówka (Rżniączka) pospolita (Dactylis glomerata) IR/ml 624 Perz właściwy (pełzający)(agropyron repens) IC/ml 630 Kostrzewa łąkowa (Festuca elatior) IC/ml 658 Wiechlina łąkowa (Poa pratensis) IR/ml 638 Życica trwała (Lolium perenne) IR/ml 631 Tomka wonna (Anthoxantum odoratum) IR/ml 661 Tymotka łąkowa (Brzanka pastewna) (Phleum pratense) IR/ml 637 Kłosówka wełnista (Holcus latanus) IC/ml Zboża 652 Jęczmień pospolity (Hordeum vulgare) IC/ml 642 Kukurydza (Zea mays) IC/ml 610 Owies (Avena sativa) IC/ml 671 Żyto (Secale cereale) IR/ml 614 Pszenica (Triticum vulgare) IC/ml 106 Mąka pszenna IC/ml Drzewa 609 Olcha czarna (Alnus glutinosa) IR/ml 632 Jesion wyniosły (Fraxinus excelsior) IC/ml 635 Buk zwyczajny (Fagus sylvatica) IC/ml 615 Brzoza biała (Betula alba) IR/ml 620 Kasztan zwyczajny (Castanea vulgaris) IC/ml 626 Cyprys (Cupressus sempervirens) IC/ml 675 Bez dziki czarny (Sambucus nigra) IC/ml 653 Wiąz pospolity polny (Ulmus campestris) IC/ml 667 Robinia akacjowa (Grochodrzew) (Robinia pseudoacacia) IC/ml 649 Leszczyna (orzech laskowy) (Corylus avellana) IR/ml 619 Grab zwyczajny (Carpinus betulus) IR/ml 644 Kasztanowiec (Aesculus hippocastanum) IC/ml 9
10 634 Jałowiec pospolity (Juniperus communis) IC/ml 677 Lipa wielkolistna (Tilia platyphyllos) IC/ml 629 Klon jaworowy (Acer pseudoplatanus) IC/ml 645 Akacja srebrzysta (Acacia dealbata) IC/ml 647 Morwa biała (Morus alba) IC/ml 621 Dąb szypułkowy (Quercus robur) IC/ml 651 Oliwka europejska (Olea europea) IR/ml 662 Sosna zwyczajna (Pinus sylvestris) IC/ml 666 Platan pospolity (Platanus vulgaris) IC/ml 659 Topola biała (Białodrzew) (Populus alba) IC/ml 680 Ligustr pospolity (Ligustrum vulgare) IC/ml 650 Orzech włoski (Juglans regia) IC/ml 669 Wierzba iwa (Iwa) (Salix caprea) IC/ml Tytoń 904 Tytoń (liście) IC/ml II. Wyciągi alergenowe pochodzenia zwierzęcego (sierść, nabłonki, owady) Zwierzęta 507 Kot IR/ml 509 Pies IC/ml 508 Koza IC/ml 510 Świnka morska IC/ml 511 Chomik IC/ml 516 Koń IC/ml 512 Królik IC/ml 505 Wełna owcza IC/ml Owady 301 Karaluch IC/ml 303 Wołek zbożowy IC/ml 310 Mucha końska IC/ml 307 Komar IC/ml III. Wyciągi alergenowe roztoczy kurzu domowego 325 Acarus siro IC/ml 314 Dermatophagoides farinae IR/ml 315 Dermatophagoides pteronyssinus IR/ml 326 Euroglyphus manei IC/ml 324 Glyciphagus domesticus IC/ml 317 Lepidoglyphus destructor IC/ml 318 Tyrophagus putrescentiae IC/ml IV. Wyciągi alergenowe grzybów (grzyby pleśniowe,drożdże, dermatofity) 402 Botrytis cinerea IC/ml 403 Candida albicans IC/ml 407 Chaetomium globosum IC/ml 409 Epicoccum IC/ml 410 Epidermophyton IC/ml 411 Fusarium IC/ml 413 Helminthosporium IC/ml 447 Merulius lacrymans IC/ml 417 Mucor racemosus IC/ml 425 Pullularia pullulans IC/ml 10
11 426 Rhizopus nigricans IC/ml 432 Stemphylium botryosum IC/ml 435 Trichophyton IC/ml 405 Trichothecium roseum (cephalothecium) IC/ml V. Mieszanki wyciągów alergenowych * pochodzenia zwierzęcego 506 Mieszanina piór (kaczka, gęś, kura) IC/ml * pochodzenia roślinnego a) chwasty 719 Mieszanka I - Compositae (Golde rod, Dandelion, Lampourde, Ox-eye-daisy) IC/ml 714 Mieszanka II - Chenopodiaceae (Fat hen, Rough pigweed) IC/ml 706 Mieszanka III - Weed mixtures (Alfalfa, Red clover, Mustard, Nettle, Sorrel) IC/ml b) trawy trawy - (Kupkówka pospolita, Życica trwała, Tymotka łąkowa) IR/ml traw - (Kupkówka pospolita, Wiechlina łąkowa, Życica trwała, Tomka wonna, Tymotka łąkowa) IR/ml traw - (Mietlica pospolita, Trawa bermudzka, Bromus, Kupkówka pospolita, Kostrzewa łąkowa, Wiechlina łąkowa, Trawa owsa, Życica trwała, Tomka wonna, Tymotka łąkowa, Dziki owies, Kłosówka wełnista) IR/ml traw/4 zboża - (Kupkówka pospolita, Wiechlina łąkowa, Życica trwała, Tomka wonna, Tymotka łąkowa/(jęczmień, kukurydza, owies, pszenica) IR/ml zboża - (jęczmień, kukurydza, owies, pszenica) IR/ml c) drzewa 702 Betulaceae (olcha, brzoza, leszczyna, grab) IR/ml 696 Fagaceae (buk, kasztan zwyczajny, dąb) IC/ml 716 Cupressaceae (cyprys, jałowiec) IC/ml 715 Oleaceae (jesion, oliwka, ligustr) IC/ml 717 Salicaceae (topola, wierzba) IC/ml 718 Mieszanina drzew (klon, kasztanowiec, platan, grochodrzew, lipa) IC/ml 917 Pył stolarski (dąb, buk, wiśnia, sosna) IC/ml * roztoczy 350 D. pteronyssinus + D. farinae IR/ml 330 Roztocze spichrzowe (Acarus siro, Glyciphagus domesticus, Lepidoglyphus destructor, Tyrophagus putrescentiae) IC/ml * grzybów 400 Alternaria (alternatalongipes) IC/ml 414 Cladosporium (cladosporoides, herbarum) IC/ml 401 Aspergillus (fumigatus, nidulans, niger) IC/ml 422 Penicillium (digitatum, expansum, notatum) IC/ml 445 Mieszanina drożdży (Saccharomyces cerevisiae, minor) IC/ml 446 Mieszanina śnieci zbożowej (Ustilago avenae, tritici, holci, zeae) IC/ml 11
Celem immunoterapii swoistej jest zapobieganie skutkom klinicznym, wynikającym z kontaktu osoby uczulonej z danym alergenem.
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA STALORAL Wyciągi alergenowe pochodzenia roślinnego STALORAL Wyciągi alergenowe pochodzenia zwierzęcego STALORAL Wyciągi alergenowe roztoczy kurzu domowego
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA STALORAL Wyciągi alergenowe pochodzenia roślinnego STALORAL Wyciągi alergenowe pochodzenia zwierzęcego STALORAL Wyciągi alergenowe roztoczy kurzu domowego
ULOTKA DLA PACJENTA. Roztwór do stosowania podjęzykowego SKŁAD
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
Celem immunoterapii swoistej jest zapobieganie skutkom klinicznym, wynikającym z kontaktu osoby uczulonej z danym alergenem.
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA PHOSTAL Wyciągi alergenowe pochodzenia roślinnego PHOSTAL Wyciągi alergenowe pochodzenia zwierzęcego PHOSTAL Wyciągi alergenowe roztoczy kurzu domowego PHOSTAL
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA PHOSTAL Wyciągi alergenowe pochodzenia roślinnego PHOSTAL Wyciągi alergenowe pochodzenia zwierzęcego PHOSTAL Wyciągi alergenowe roztoczy kurzu domowego PHOSTAL
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO STALORAL 300 Wyciągi alergenowe pochodzenia roślinnego (pyłki roślin) STALORAL 300 Wyciągi alergenowe roztoczy kurzu domowego STALORAL
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO STALORAL 300 Wyciągi alergenowe pochodzenia roślinnego (pyłki roślin) STALORAL 300 Wyciągi alergenowe roztoczy kurzu domowego STALORAL
Celem leczenia lekiem STALORAL jest zwiększenie tolerancji immunologicznej na alergeny, a tym samym złagodzenie reakcji alergicznych.
 Ulotka dołączona do opakowania: informacja dla pacjenta STALORAL Wyciągi alergenowe pochodzenia roślinnego STALORAL Wyciągi alergenowe pochodzenia zwierzęcego STALORAL Wyciągi alergenowe roztoczy kurzu
Ulotka dołączona do opakowania: informacja dla pacjenta STALORAL Wyciągi alergenowe pochodzenia roślinnego STALORAL Wyciągi alergenowe pochodzenia zwierzęcego STALORAL Wyciągi alergenowe roztoczy kurzu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA PHOSTAL Wyciągi alergenowe pochodzenia roślinnego PHOSTAL Wyciągi alergenowe pochodzenia zwierzęcego PHOSTAL Wyciągi alergenowe roztoczy kurzu domowego PHOSTAL
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA PHOSTAL Wyciągi alergenowe pochodzenia roślinnego PHOSTAL Wyciągi alergenowe pochodzenia zwierzęcego PHOSTAL Wyciągi alergenowe roztoczy kurzu domowego PHOSTAL
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALYOSTAL Wyciągi alergenowe alergeny diagnostyczne do testów skórnych punktowych Roztwór do skórnych prób punktowych 100 IR/ml lub 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALYOSTAL Wyciągi alergenowe alergeny diagnostyczne do testów skórnych punktowych Roztwór do skórnych prób punktowych 100 IR/ml lub 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PHOSTAL Wyciągi alergenowe pochodzenia roślinnego PHOSTAL Wyciągi alergenowe pochodzenia zwierzęcego PHOSTAL Wyciągi alergenowe roztoczy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PHOSTAL Wyciągi alergenowe pochodzenia roślinnego PHOSTAL Wyciągi alergenowe pochodzenia zwierzęcego PHOSTAL Wyciągi alergenowe roztoczy
Ulotka dołączona do opakowania: informacja dla pacjenta STALORAL 300
 Ulotka dołączona do opakowania: informacja dla pacjenta STALORAL 300 Wyciągi alergenowe pochodzenia roślinnego (pyłki roślin) Wyciągi alergenowe roztoczy kurzu domowego Mieszanki wyciągów alergenowych
Ulotka dołączona do opakowania: informacja dla pacjenta STALORAL 300 Wyciągi alergenowe pochodzenia roślinnego (pyłki roślin) Wyciągi alergenowe roztoczy kurzu domowego Mieszanki wyciągów alergenowych
ALYOSTAL, roztwór do skórnych prób punktowych, 100 IR/ml lub 100 IC/ml Wyciągi alergenowe alergeny diagnostyczne do testów skórnych punktowych
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ALYOSTAL, roztwór do skórnych prób punktowych, 100 IR/ml lub 100 IC/ml Wyciągi alergenowe alergeny diagnostyczne do testów skórnych punktowych Należy zapoznać
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ALYOSTAL, roztwór do skórnych prób punktowych, 100 IR/ml lub 100 IC/ml Wyciągi alergenowe alergeny diagnostyczne do testów skórnych punktowych Należy zapoznać
Roztwory do testów punktowych. Roztwory do testów prowokacyjnych
 KATALOG PRODUKTÓW DO DIAGNOSTYKI IN-VIVO PAŹDZIERNIK 2014 Roztwory do testów punktowych Roztwory do testów prowokacyjnych Należy wybrać swój zestaw roztworów do testów punktowych korzystając z zamieszczonej
KATALOG PRODUKTÓW DO DIAGNOSTYKI IN-VIVO PAŹDZIERNIK 2014 Roztwory do testów punktowych Roztwory do testów prowokacyjnych Należy wybrać swój zestaw roztworów do testów punktowych korzystając z zamieszczonej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Perosall D, roztwór do stosowania podjęzykowego Mieszanka alergenów pyłku drzew.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Perosall D, roztwór do stosowania podjęzykowego Mieszanka alergenów pyłku drzew.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml roztworu zawiera mieszankę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Perosall D, roztwór do stosowania podjęzykowego Mieszanka alergenów pyłku drzew.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml roztworu zawiera mieszankę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. sodu glutaminian (E 621)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
Numer ogłoszenia: 23538-2012; data zamieszczenia: 25.01.2012 OGŁOSZENIE O ZMIANIE OGŁOSZENIA
 Page 1 of 5 Ogłoszenie powiązane: Ogłoszenie nr 16906-2012 z dnia 2012-01-18 r. Ogłoszenie o zamówieniu - Sosnowiec PAKIET 1 ROZTOCZA Źródło alergenowe /alergen Rodzaj testów Rodzaj opakowania Ilość Acarus
Page 1 of 5 Ogłoszenie powiązane: Ogłoszenie nr 16906-2012 z dnia 2012-01-18 r. Ogłoszenie o zamówieniu - Sosnowiec PAKIET 1 ROZTOCZA Źródło alergenowe /alergen Rodzaj testów Rodzaj opakowania Ilość Acarus
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
Zestawy do oznaczania IgE
 Załącznik nr. 4a. Nr sprawy: ZP/D/11/08 Część asortymentowo cenowa: szczegółowe parametry w zakresie przedmiotu zamówienia ( ilości, opis, parametry), zał.nr. 4a. PAKIET 1. Zestawy do oznaczania IgE Lp.
Załącznik nr. 4a. Nr sprawy: ZP/D/11/08 Część asortymentowo cenowa: szczegółowe parametry w zakresie przedmiotu zamówienia ( ilości, opis, parametry), zał.nr. 4a. PAKIET 1. Zestawy do oznaczania IgE Lp.
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Perosall C, roztwór do stosowania podjęzykowego. Mieszanka alergenów pyłku chwastów. Zestaw do leczenia podstawowego: 0 JS*/ ml, 00 JS/ ml, 000 JS/
Ulotka dołączona do opakowania: informacja dla pacjenta Perosall C, roztwór do stosowania podjęzykowego. Mieszanka alergenów pyłku chwastów. Zestaw do leczenia podstawowego: 0 JS*/ ml, 00 JS/ ml, 000 JS/
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
Produktu nie należy stosować pod opatrunkiem okluzyjnym lub w postaci okładów.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Amol, produkt złożony, płyn doustny, płyn na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g produktu zawiera: Mentholum (mentol) 17,23 mg Citronellae
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ISMIGEN tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7 mg lizatu bakterii: Staphylococcus aureus
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ISMIGEN tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7 mg lizatu bakterii: Staphylococcus aureus
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Catalet D, zawiesina do wstrzykiwań Mieszanka alergoidów pyłku drzew.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Catalet D, zawiesina do wstrzykiwań Mieszanka alergoidów pyłku drzew. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera mieszankę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Catalet D, zawiesina do wstrzykiwań Mieszanka alergoidów pyłku drzew. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera mieszankę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PROSPAN, 26 mg, pastylki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna pastylka miękka zawiera 26 mg wyciągu (w postaci suchego wyciągu)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PROSPAN, 26 mg, pastylki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna pastylka miękka zawiera 26 mg wyciągu (w postaci suchego wyciągu)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu (Clotrimazolum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fungotac 10 mg/ml, krople do uszu, roztwór. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fungotac 10 mg/ml, krople do uszu, roztwór. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
Ulotka dołączona do opakowania: informacja dla użytkownika. Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat.
 Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat. Kontynuacja leczenia Wyciąg alergenów
Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat. Kontynuacja leczenia Wyciąg alergenów
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: czerwień koszenilowa (E 124), metylu parahydroksybenzoesan, sód.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
Ulotka dla pacjenta. ALUTARD SQ (Pozwolenie Nr: 3595) Wyciągi alergenowe jadów owadów błonkoskrzydłych: 801 Jad pszczoły 802 Jad osy
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty,
AUTOIMMUNOLOGIA- SZCZEGÓŁOWA OFERTA BADAŃ PRZETESTUJ SWOJĄ ALERGIĘ
 PRZETESTUJ SWOJĄ ALERGIĘ LM stworzył specjalną ofertę skierowaną do pacjentów zainteresowanych badaniami w kierunku stwierdzenia, bądź potwierdzenia alergii. Krew pobrana od pacjenta jest poddawana badaniu
PRZETESTUJ SWOJĄ ALERGIĘ LM stworzył specjalną ofertę skierowaną do pacjentów zainteresowanych badaniami w kierunku stwierdzenia, bądź potwierdzenia alergii. Krew pobrana od pacjenta jest poddawana badaniu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NIZAX ACTIV, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NIZAX ACTIV, 20 mg/g, szampon leczniczy 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g szamponu leczniczego zawiera 20 mg ketokonazolu (Ketoconazolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
Ulotka dołączona do opakowania: informacja dla użytkownika. ORALAIR 100 IR & 300 IR, 100 IR / 300 IR, tabletki podjęzykowe
 Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 100 IR & 300 IR, 100 IR / 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat Leczenie wstępne
Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 100 IR & 300 IR, 100 IR / 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat Leczenie wstępne
Ulotka dołączona do opakowania: informacja dla użytkownika. ORALAIR 300 IR, tabletki podjęzykowe
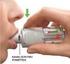 Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat. Kontynuacja leczenia Wyciąg alergenów
Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat. Kontynuacja leczenia Wyciąg alergenów
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. sodu glutaminian (E 621)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom, 3,5 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-85 w tym liofilizowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom, 3,5 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-85 w tym liofilizowane
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy (Lidocainum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Procto-Glyvenol, 400 mg + 40 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 400 mg tribenozydu (Tribenosidum) i 40 mg lidokainy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta ALUTARD SQ zawiesina do wstrzykiwań leczenie podstawowe: 100 SQ-U/ml, 1000 SQ-U/ml, 10 000 SQ-U/ml, 100 000 SQ-U/ml leczenie podtrzymujące: 100 000
Ulotka dołączona do opakowania: informacja dla pacjenta ALUTARD SQ zawiesina do wstrzykiwań leczenie podstawowe: 100 SQ-U/ml, 1000 SQ-U/ml, 10 000 SQ-U/ml, 100 000 SQ-U/ml leczenie podtrzymujące: 100 000
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
Ulotka dołączona do opakowania: informacja dla pacjenta. PURETHAL mieszanki alergoidów pyłków roślin, AUM, zawiesina do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla pacjenta PURETHAL mieszanki alergoidów pyłków roślin, 20 000 AUM, zawiesina do wstrzykiwań Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta PURETHAL mieszanki alergoidów pyłków roślin, 20 000 AUM, zawiesina do wstrzykiwań Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 3 mg Hypromellosum (hypromelozy) i 1 mg Dextranum (dekstranu 70).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tears Naturale II, (3 mg + 1 mg)/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Hypromellosum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tears Naturale II, (3 mg + 1 mg)/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Hypromellosum
Sukcesywna dostawa testów do diagnostyki alergii
 Instytut Medycyny Pracy i Zdrowia Środowiskowego 41-200 Sosnowiec ul. Kościelna 13 Tel. 032 2660885 Fax. 032 2661124 WWW www.imp.sosnowiec.pl Oryginalna treść ogłoszenia Sosnowiec: dla Instytutu Medycyny
Instytut Medycyny Pracy i Zdrowia Środowiskowego 41-200 Sosnowiec ul. Kościelna 13 Tel. 032 2660885 Fax. 032 2661124 WWW www.imp.sosnowiec.pl Oryginalna treść ogłoszenia Sosnowiec: dla Instytutu Medycyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Mieszanki alergenowe (pochodzenia roślinnego, roztoczy kurzu domowego)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALUTARD SQ Mieszanki alergenowe (pochodzenia roślinnego, roztoczy kurzu domowego) zawiesina do wstrzykiwań leczenie podstawowe: 100 SQ-U/ml,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALUTARD SQ Mieszanki alergenowe (pochodzenia roślinnego, roztoczy kurzu domowego) zawiesina do wstrzykiwań leczenie podstawowe: 100 SQ-U/ml,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 Wersja 9, 03/2013 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Tuspan, 7 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera substancję czynną: 7 mg suchego
Wersja 9, 03/2013 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Tuspan, 7 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera substancję czynną: 7 mg suchego
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Wyciągi alergenowe pochodzenia roślinnego (pyłki) Wyciągi alergenowe pochodzenia zwierzęcego (sierść, nabłonki, pierze) Wyciągi alergenowe grzybów pleśniowych
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Wyciągi alergenowe pochodzenia roślinnego (pyłki) Wyciągi alergenowe pochodzenia zwierzęcego (sierść, nabłonki, pierze) Wyciągi alergenowe grzybów pleśniowych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
12 SQ-HDM Grupa farmakoterapeutyczna: Wyciągi alergenowe, kurz domowy; Kod ATC: V01AA03
 SUBSTANCJA CZYNNA (INN) GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU LECZNICZEGO, KTÓREGO DOTYCZY PLAN ZARZĄDZANIA RYZYKIEM 12 SQ-HDM Grupa farmakoterapeutyczna:
SUBSTANCJA CZYNNA (INN) GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU LECZNICZEGO, KTÓREGO DOTYCZY PLAN ZARZĄDZANIA RYZYKIEM 12 SQ-HDM Grupa farmakoterapeutyczna:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon Advance, (1000 mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
Ulotka dołączona do opakowania: informacja dla użytkownika. ORALAIR 100 IR & 300 IR, 100 IR / 300 IR, tabletki podjęzykowe
 Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 100 IR & 300 IR, 100 IR / 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat Leczenie wstępne
Ulotka dołączona do opakowania: informacja dla użytkownika ORALAIR 100 IR & 300 IR, 100 IR / 300 IR, tabletki podjęzykowe Do stosowania u dorosłych, młodzieży i dzieci w wieku powyżej 5 lat Leczenie wstępne
Ulotka dołączona do opakowania: informacja dla użytkownika. UNIBEN 1,5 mg/ml, aerozol do stosowania w jamie ustnej (Benzydamini hydrochloridum)
 Ulotka dołączona do opakowania: informacja dla użytkownika UNIBEN 1,5 mg/ml, aerozol do stosowania w jamie ustnej (Benzydamini hydrochloridum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika UNIBEN 1,5 mg/ml, aerozol do stosowania w jamie ustnej (Benzydamini hydrochloridum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA ALLERGOVIT Alergoidy pyłków roślin Zawiesina do wstrzykiwań Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA 1 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA ALLERGOVIT Alergoidy pyłków roślin Zawiesina do wstrzykiwań Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty, (500 mg mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 10 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 10 ml produktu
Substancje pomocnicze: fenol, sodu chlorek, disodu fosforan dwunastowodny, sodu diwodorofosforan dwuwodny, woda do wstrzykiwań, glinu wodorotlenek.
 Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty, gdy
Ulotka dla pacjenta Należy zapoznać się z treścią ulotki przed zastosowaniem Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty, gdy
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cusicrom 4%, 40 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 40 mg kromoglikanu disodu. Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cusicrom 4%, 40 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 40 mg kromoglikanu disodu. Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: alkohol cetostearylowy, glikol propylenowy, kwas benzoesowy.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hascoderm, 200 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 200 mg kwasu azelainowego (Acidum azelaicum). Substancje pomocnicze
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Syrop z bluszczu Labima 5,4 mg/ml, syrup 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Suchy wyciąg z liści bluszczu (Hedera helix L., folium). 1 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Syrop z bluszczu Labima 5,4 mg/ml, syrup 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Suchy wyciąg z liści bluszczu (Hedera helix L., folium). 1 ml
Nazwa zwyczajowa Ŝyto zwyczajne
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Perosall T, roztwór do stosowania podjęzykowego Mieszanka alergenów pyłku traw.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Perosall T, roztwór do stosowania podjęzykowego Mieszanka alergenów pyłku traw.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
badania laboratoryjne - alergologia i toksykologia
 badania laboratoryjne - alergologia i toksykologia Antygen HLA B-27 202,50 Borany w surowicy ilościowo 94,50 CDA 166,50 Cyklosporyna 97,50 d1 roztocze kurzu domowego D. pteronyssinus 42,00 d2 roztocze
badania laboratoryjne - alergologia i toksykologia Antygen HLA B-27 202,50 Borany w surowicy ilościowo 94,50 CDA 166,50 Cyklosporyna 97,50 d1 roztocze kurzu domowego D. pteronyssinus 42,00 d2 roztocze
Produkt stosowany pomocniczo w dolegliwościach związanych ze stanami zapalnymi stawów oraz w stanach bólowych po stłuczeniach.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
PURETHAL mieszanki alergoidów pyłków roślin, AUM zawiesina do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla pacjenta PURETHAL mieszanki alergoidów pyłków roślin, 20 000 AUM zawiesina do wstrzykiwań Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta PURETHAL mieszanki alergoidów pyłków roślin, 20 000 AUM zawiesina do wstrzykiwań Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Envil katar, (1,5 mg + 2,5 mg)/ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml aerozolu do nosa zawiera 1,5 mg mepiraminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Envil katar, (1,5 mg + 2,5 mg)/ml, aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml aerozolu do nosa zawiera 1,5 mg mepiraminy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tersilat, 10 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden gram kremu zawiera 10 mg terbinafiny chlorowodorku. Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tersilat, 10 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden gram kremu zawiera 10 mg terbinafiny chlorowodorku. Substancja pomocnicza
B. ULOTKA DLA PACJENTA (Łyżeczka z podziałką)
 B. ULOTKA DLA PACJENTA (Łyżeczka z podziałką) 1 Ulotka dołączona do opakowania: informacja dla pacjenta Hedelix, 40 mg/5 ml, syrop (Hederae helicis folii extractum spissum) Należy uważnie zapoznać się
B. ULOTKA DLA PACJENTA (Łyżeczka z podziałką) 1 Ulotka dołączona do opakowania: informacja dla pacjenta Hedelix, 40 mg/5 ml, syrop (Hederae helicis folii extractum spissum) Należy uważnie zapoznać się
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Page 1 of 7 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.imp.sosnowiec.pl Sosnowiec: Sukcesywna dostawa testów do diagnostyki alergii dla
Page 1 of 7 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.imp.sosnowiec.pl Sosnowiec: Sukcesywna dostawa testów do diagnostyki alergii dla
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum Plus (525 mg + 60 mg + 20 mg)/g, roztwór do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g roztworu do kąpieli zawiera 525 mg parafiny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum Plus (525 mg + 60 mg + 20 mg)/g, roztwór do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g roztworu do kąpieli zawiera 525 mg parafiny
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
