(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
|
|
|
- Rafał Małecki
- 7 lat temu
- Przeglądów:
Transkrypt
1 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego: (13) (1) T3 Int.Cl. G01N 33/68 (06.01) G01N 33/8 (06.01) Urząd Patentowy Rzeczypospolitej Polskiej (97) O udzieleniu patentu europejskiego ogłoszono: Europejski Biuletyn Patentowy 12/47 EP B1 (4) Tytuł wynalazku: Sposób identyfikacji agonistycznej aktywności związku docelowego w kanale jonów potasowych () Pierwszeństwo: DE (43) Zgłoszenie ogłoszono: w Europejskim Biuletynie Patentowym nr 09/48 (4) O złożeniu tłumaczenia patentu ogłoszono: Wiadomości Urzędu Patentowego 13/04 (73) Uprawniony z patentu: Grünenthal GmbH, Aachen, DE (72) Twórca(y) wynalazku: PL/EP T3 TIMO STRÜNKER, Köln, DE MARKUS CAVALAR, Herrnburg, DE GREGOR BAHRENBERG, Aachen, DE (74) Pełnomocnik: rzecz. pat. Edward Buczyński POLSERVICE KANCELARIA RZECZNIKÓW PATENTOWYCH SP. Z O.O. ul. Bluszczańska Warszawa Uwaga: W ciągu dziewięciu miesięcy od publikacji informacji o udzieleniu patentu europejskiego, każda osoba może wnieść do Europejskiego Urzędu Patentowego sprzeciw dotyczący udzielonego patentu europejskiego. Sprzeciw wnosi się w formie uzasadnionego na piśmie oświadczenia. Uważa się go za wniesiony dopiero z chwilą wniesienia opłaty za sprzeciw (Art. 99 (1) Konwencji o udzielaniu patentów europejskich).
2 - 1 - OK II-12/P31711PL00 EP B1 Sposób identyfikacji agonistycznej aktywności związku docelowego w kanale jonów potasowych 1 2 Niniejszy wynalazek dotyczy sposobu bądź próby do identyfikacji agonistycznej aktywności związku docelowego w zależnym od napięcia kanale jonów potasowych. Kanały jonowe są zasadnicze dla funkcji komórek nerwowych i mięśniowych jak i większości innych komórek somatycznych. Kanały jonowe uczestniczą w niemal wszystkich procesach fizjologicznych, na przykład w impulsach elektrycznych, leżących u podstaw funkcji sensorycznych i ruchowych w mózgu, w kontroli aktywności kurczliwej serca, mięśni gładkich w naczyniach szkieletu i trzewiach jak i przy przyjmowaniu składników pokarmowych, wydzielaniu hormonów, wydzielaniu komórkowym i rozwoju komórek. Kanały jonowe umożliwiają jonom, przechodzenie hydrofobowej podwójnej warstwy lipidowej błony komórkowej, co jest decydujące dla powstawania i przekazywania sygnałów elektrycznych w żywych komórkach. Kanały jonowe można klasyfikować na podstawie ich selektywności jonowej. Pewne kanały jonowe są przepuszczalne jedynie dla całkiem określonych rodzajów jonów, na przykład dla jonów sodu (Na+), potasu (K+) lub wapnia (Ca 2+ ). Inne kanały za to mogą nie rozróżniać lub jedynie słabo rozróżniać między różnymi rodzajami jonów. Określa się je jako nieselektywne kanały jonowe. Otwieranie lub zamykanie kanałów jonowych może być regulowane przez różne mechanizmy. Na przykład zależne od ligandów kanały jonowe są kontrolowane przez bezpośrednie wiązanie ligan-
3 dów wewnątrz- lub pozakomórkowych. Zależne od napięcia kanały jonowe reagują natomiast na zmiany potencjału membranowego. Potencjał membranowy komórki jest powodowany przez elektryczny gradient i gradient stężenia różnych jonów i naładowanych cząstek z obu stron błony komórkowej. Szczególne znaczenie ma przy tym rozkład jonów sodu i potasu w wewnątrz- i pozakomórkowej pożywce komórki. Rozkład jonów opiera się na selektywnej przepuszczalności błony dla różnych jonów i aktywnym transporcie jonów przy pomocy pomp jonowych. Aktywność tych napędzanych przez ATP "pomp" w komórce prowadzi do nierównego rozkładu różnych jonów - przede wszystkim K+, Na+, Ca 2 +, Cl - i organicznych anionów - z obu stron błony komórkowej i tak do gradientów jonowych przez błonę. W stanie spoczynku znajduje się wskutek tego nadmiar ujemnych ładunków po wewnętrznej stronie błony w porównaniu z zewnętrzną stroną błony. To rozdzielenie ładunków prowadzi do różnicy w potencjale elektrycznym przez błonę komórkową, co jest określane jako potencjał membranowy (V m ). W stanie spoczynku potencjał membranowy w neuronach i komórkach mięśni jest w zakresie -60 mv mv (tzw. spoczynkowy potencjał membranowy). Sygnały elektryczne w neuronach i komórkach mięśni opierają się na krótkotrwałych zmianach potencjału membranowego. Zmiany te są wywoływane przez krótkotrwałe otwieranie i zamykanie kanałów jonowych, co prowadzi do przepływu prądu elektrycznego przez błonę. Jeśli przy tym zmniejsza się rozdzielenie ładunków na błonie, mówi się o depolaryzacji błony - potencjał membranowy staje się mniej ujemny. Zwiększenie rozdzielenia ładunków określa się jako hiperpolaryzację, ponieważ potencjał membranowy ustala
4 się bardziej ujemny niż spoczynkowy potencjał membranowy. Spoczynkowy potencjał membranowy to tzw. potencjał dyfuzyjny i jest on określany przez różne czynniki: nienaładowane cząsteczki jak np. tlen, dwutlenek węgla, mocznik itp. mogą przechodzić bez przeszkód przez hydrofobową podwójną warstwę lipidową błony komórkowej. Jony, naładowane cząstki, natomiast mogą przekraczać błonę komórkową jedynie przy pomocy selektywnych porów, opartych na proteinach (kanały jonowe). Na skutek selektywnej przepuszczalności dla określonych indywiduów jonowych błona komórkowa odpowiada półprzepuszczalnej membranie. Aktywność pomp napędzanych przez ATP w błonie komórki prowadzi do nierównego rozkładu różnych jonów - przede wszystkim K +, Na +, Ca 2+, Cl - i anionów organicznych - z obu stron błony komórkowej i tak do gradientów jonowych przez błonę. W tablicy 1 przedstawiono wewnątrzkomórkowe i zewnątrzkomórkowe stężenie ważnych rodzajów jonów. Półprzepuszczalność błony komórkowej i nierówny rozkład jonów z obu stron błony komórkowej, prowadzą do powstania spoczynkowego potencjału membranowego. Tablica 1: Stężenie najważniejszych rodzajów jonów w obrębie i na zewnątrz komórki Jon stężenie zewnątrzkomórkowe (mm) komórkowe (mm) stężenie wewnątrz- Na K Ca 2+ 1, 0,0001 Cl ,2 Aby uwypuklić ten związek, najpierw w sposób uproszczony potraktuje się komórkę, której błona jest jedynie przepuszczalna dla jednego rodzaju jonów, np. dla jonów potasowych (K+). Jony K+ występują w dużo więk-
5 szym stężeniu w obrębie komórki, w porównaniu z jej otoczeniem. Dlatego jony K+ dyfundują wzdłuż ich gradientu chemicznego z wnętrza komórki na zewnątrz. Dyfuzja K+ z komórki jest jednak samoograniczająca. Wypływ dodatnio naładowanych jonów K+ i wynikający stąd nadmiar nieprzepuszczanych, ujemnie naładowanych anionów w komórce prowadzą do tego, że wnętrze komórki staje się ujemne. Wskutek tego rozdzielenia ładunków rozwija się elektryczna różnica potencjału przez błonę komórkową. Im więcej jonów K+ opuszcza teraz komórkę, tym większe staje się rozdzielenie ładunków i tym większa jest różnica potencjału, wnętrze komórki staje się coraz bardziej ujemne. Ta elektryczna różnica potencjału przeciwdziała w końcu dalszemu wypływowi dodatnio naładowanych jonów K. Oznacza to, że na dyfuzję potasu przez błonę komórkową wpływają dwie przeciwstawne siły: a) chemiczna siła napędowa, która zależy od różnicy stężeń potasu i b) elektryczna siła napędowa, która jest określona przez elektryczną różnicę potencjału przez błonę. Dyfuzja potasu prowadzi zatem po krótkim czasie do potencjału membranowego, przy którym chemiczna siła napędowa, wypierająca jony K+ z komórki, jest dokładnie równa elektrycznej sile napędowej potencjału membranowego, która dem przeciwdziała wypływowi jonów K +. Dokładnie wtedy, gdy ten potencjał membranowy jest osiągnięty, nie zachodzi żaden strumień netto jonów K + błonę. Potencjał ten określa się jako tzw. "potencjał równowagowy potasu" (E K ). 61,4 log Równanie 1: równanie Nernsta dla potasu (w 37 C) przez [jon] = stężenie (a) zewnątrzkomórkowe (i) wewnątrzkomórkowe
6 - - Przy pomocy tzw. równania Nernsta można obliczyć potencjał równowagowy dla jonów potasowych. Według równania Nernsta (równanie 1) potencjał równowagowy potasu określa się z ilorazu stężeń potasu z obu stron błony komórkowej. Jeśli zastosuje się stężenia potasu, podane w tablicy 1, uzyskuje się potencjał równowagowy potasu -98 mv. Potencjał membranowy komórki, której błona jest selektywnie przepuszczalna dla potasu, odpowiadałby zatem dokładnie E K i wynosił - 98 mv. Tablica 2: Zewnątrzkomórkowe i wewnątrzkomórkowe stężenie najważniejszych rodzajów jonów (por. tablica 1) i wynikający stąd potencjał równowagowy jon stężenie zewnątrzkomórkowwnątrzkomórkowwagowy stężenie we- potencjał równo- (mm) (mm) (mv) Na K Ca 2+ 1, Cl , W błonie komórkowej znajdują się z reguły jednak nie tylko kanały jonowe, doprowadzające potas, lecz także kanały dla innych indywiduów jonowych. Jak podano w tablicy 1 i tablicy 2, jest też gradient stężenia przez błonę komórkową dla tych jonów. W konsekwencji można także dla tych jonów wyznaczyć określony potencjał równowagowy. W tablicy 2 są podane potencjały równowagowe najważniejszych jonów. Gradient dla jonów sodu jest np. dokładnie przeciwny dla gradientu jonów potasu. W konsekwencji potencjał równowagowy dla sodu +67mV jest znacznie w zakresie dodatnim. To jaki wkład mają różne gradienty jonowe do spoczynkowego potencjału membranowego komórki, która jest
7 - 6 - przepuszczalna dla jonów potasu, sodu i chlorkowych, jest opisane przez tak zwane równanie napięcia Goldmana-Hodgkina-K atza (równanie 2 ) ,4 Równanie 2: równanie napięcia Goldmana-Hodgkina- Katza (37 C). [jon] = stężenie (a) zewnątrzkomórkowe (i) wewnątrzkomórkowe. P x = przepuszczalność błony dla jonu X. V m = Potencjał membranowy Z równania 2 można wywnioskować, że potencjał membranowy komórki określa się nie tylko z ilorazów stężeń jonów z obu stron błony komórkowej, lecz przede wszystkim z przepuszczalności (P) błony dla danego jonu. Im większa przepuszczalność (często zwana także przewodnictwem) błony dla określonego jonu, tym większy jest także przyczynek tego jonu do potencjału membranowego. Potencjał membranowy stanowi zatem w pewnej mierze ważoną wartość średnią potencjałów równowagowych dla różnych jonów. Przepuszczalność błony dla danego rodzaju jonów określa się jedynie przez liczbę i aktywność odpowiednich kanałów jonowych, które doprowadzają ten jon. W stanie spoczynku znajduje się jedynie bardzo mało otwartych kanałów sodowych, chlorkowych lub wapniowych w błonie komórkowej. Potencjał membranowy większości komórek w spoczynku określa się głównie przez przewodnictwo potasu błony (P K : P Cl: P Na = 1:0,4:0,04). Dlatego neurony i komórki mięśni mają spoczynkowy potencjał membranowy (-60)-(-80) mv (patrz wyżej), blisko potencjału równowagowego dla potasu. Zmiana potencjału membranowego komórki następuje, gdy zmienia się przepuszczalność błony dla jednego rodzaju jonów. Tak więc np. aktywacja kanałów sodowych
8 przesuwa potencjał membranowy w kierunku potencjału równowagowego dla sodu - potencjał membranowy staje się bardziej dodatni. Potencjał membranowy może także przyjąć nową wartość, gdy zmienia się wewnątrzkomórkowe lub zewnątrzkomórkowe stężenie jonu (patrz równanie 2). To jak duża jest zmiana potencjału membranowego w tym przypadku, zależy od tego, jak silnie potencjał membranowy ogółem jest określany przez ten jon. Zmiany pozakomórkowego stężenia sodu, chlorków lub wapnia mają dlatego z reguły jedynie nieznaczny wpływ na potencjał membranowy. Na potencjał membranowy natomiast bardzo wyraźnie wpływa pozakomórkowe stężenie potasu. Ludzki genom zawiera około 0 różnych genów kanału potasowego. Kanały potasowe znajdują się w niemal każdym typie komórki organizmu i stanowią największą i najbardziej zróżnicowaną rodzinę kanałów jonowych. Aktywność jest modulowana stosownie do typu kanału przez różne fizjologiczne bodźce, np. zmiany potencjału membranowego (kanały zależne od napięcia), G-proteiny, jony wapnia, nukleotydy (ATP) itp. W większości komórek spoczynkowy potencjał membranowy określa się przez kanały potasowe (patrz wyżej). Kanały potasowe w neuronach i komórkach mięśni wpływają decydująco na częstość i przebieg czasowy potencjałów czynnościowych, jak i ich przekazywanie. Regulują one przy tym pobudliwość elektryczną tych komórek i odgrywają decydującą rolę w pewnych procesach wydzielania, jak np. wydzielania insuliny. Substancje czynne mogą w różny sposób wpływać na aktywność kanałów potasu. Blokery kanałów blokują przeważnie bezpośrednio pory kanału od wewnątrzkomórkowej lub zewnątrzkomórkowej strony błony.
9 Ponadto np. jednak także oddziaływanie blokera kanału z dodatkowymi podjednostkami może prowadzić do tego, że pory kanału się zamykają bądź nie mogą być otwarte przez bodźce fizjologiczne (np. bloker kanału K ATP ). Otwieracze kanału również przez oddziaływanie z dodatkowymi podjednostkami mogą prowadzić do otwierania porów (np. otwieracz kanału K ATP ). Większość otwieraczy kanałów potasowych, działających na kanały zależne od napięcia, funkcjonują jednak jako "gating modifier". Substancje wpływają na zależność napięciową aktywacji kanałów. Przez wiązanie substancji przesuwa się krzywa aktywacji kanałów do bardziej ujemnych potencjałów. Skutkiem tego jest, że przy równym potencjale membranowym jest otwarte więcej kanałów. Retygabina, znany otwieracz kanału KCNQ działa np. przez ten mechanizm. Farmakologiczne wpływanie na określone kanały potasowe wydaje się być korzystne terapeutyczne przy mnogości chorób i jest w przypadku pewnych schorzeń już jest nawet ustalone jako skuteczna terapia. Kanały potasowe są zatem ważnymi terapeutycznymi "drug targets". Obszarami wskazań są m.in. choroby neurologiczne, jak padaczki (np. kanały KCNQ), lecz także wysokie ciśnienie krwi (np. kanały K ATP, kanały K Ca ), zaburzenia rytmu serca (np. kanały K ATP, kanały herg, kanały KCNQ, kanały HCN), stany bólowe (np. kanały KCNQ), cukrzyca (np. kanały K ATP ), astma, nietrzymanie (np. kanały K ATP ) i inne choroby. W konsekwencji w dostarczaniu związków, aktywujących lub inaktywujących kanały jonowe, mieści się potencjał do opracowywania nowych i wysoce skutecznych idei terapeutycznych. W minionych latach można było zidentyfikować szereg nowych kanałów jonowych bądź podjednostek kanałów
10 jonowych. Stało się to bodźcem dla zainteresowania nowymi substancjami czynnymi, zmieniającymi aktywność takich kanałów. Poszukiwanie nowych substancji czynnych o dużej mocy, wpływających na kanały potasowe, wymaga rozwoju prób, umożliwiających z możliwie wysoką przepustowością, badanie wpływu substancji na aktywność danego typu kanału potasowego (Przegląd: Ford i in., Progress in Drug Research, tom 8, str. 133 i nast., 02). Publikacja US 6,329,367 ujawnia agonistów kanału potasowego, których można zastosować do leczenia różnych chorób, m.in. ośrodkowego układu nerwowego lub układu naczyniowosercowego. Publikacja WO 02/32419 ujawnia agonistów kanału potasowego i ich zastosowanie do celów terapeutycznych. Zawartość opisu publikacji EP polega na przedstawieniu sposobu określenia wpływu substancji badanych na potencjał membranowy mitochondriów. Sposób ten ma także służyć do identyfikacji otwieraczy kanału potasowego. Publikacja "Comparative Study of Membrane Potential-Sensitive Fluorescent Probes and Their Use in Ion Channel Screening Tests", Wolff i In. w: Journal of Biomolecular Screening (tom 8, Nr, 03, Larchmont, NY, US) zajmuje się badaniem porównawczym, w którym zanalizowano cztery różne układy barwników zależne od potencjału membranowego i ich oddziaływanie z ośmioma różnymi modulatorami kanałów w celu identyfikacji nowych kanałów jonowych. W chwili obecnej są do dyspozycji różne techniki, aby mierzyć aktywność kanałów potasowych: do badania aktywności wszystkich rodzajów kanałów jonowych tak zwana technika Patch-Clamp stanowi "Gold Standard" ( złoty wzorzec ).
11 Przez długi czas ta technika wskutek bardzo nieznacznej przepustowości okazywała się nieodpowiednią do skriningu substancji czynnych. Aby technikę Patch-Clamp uczynić użyteczną jako technologię HTS (High Throughput Screening), intensywnie posuwa się naprzód automatyzację tego sposobu. Pierwsze wiele obiecujące próby, np. dla kanałów potasowych herg (human ether-a-go-go related gene), już opracowano z tymi systemami. Przede wszystkim dla prób z kanałami potasowymi aktywowanymi przez napięcie, jak kanały KCNQ, jest ta technologia bardzo wiele obiecująca. Umożliwia ona badanie działania substancji na kanały w warunkach fizjologicznych. Nieinwazyjne próby komórkowe pozwalają jednak obecnie na coraz szybsze poszukiwanie substancji czynnej. Kanały potasowe zwykle przewodzą obok potasu także w pewnej mierze rubid (Rb + ). Jony rubidu mają bardzo podobne właściwości jak jony potasu, dlatego kanały potasowe jedynie słabo mogą rozróżniać między tymi obydwoma jonami. W warunkach fizjologicznych Rb + nie odgrywa żadnej roli, ponieważ występuje jedynie śladowo w organizmie. Przewodnictwo kanałów dla rubidu wykorzystano jednak do rozwoju nieinwazyjnych prób. Dla kanałów potasowych, jak zależne od napięcia kanały KCNQ herg, K v 1.3, jak i kanały K ATP opracowano klasyczne próby przepływu Rb+ w formacie płytek do mikromiareczkowania (np. Scott i in., Analytical Biochemistry, 319 (03), 21-27). Komórki poddające ekspresji dany kanał, ładuje się w tym celu najpierw radioaktywnym rubidem. Następnie mierzy się np. wypływ radioaktywnego rubidu z komórek hodowli po celowej aktywacji danego kanału potasowego. Od tamtego czasu jest także możliwe, by w takich próbach stosować nieradioaktywny rubid. Wypływ rubidu wykazuje się następnie przy pomocy spektroskopii absorpcji atomowej. Nakład eksperymentalny i koszty ta-
12 kich prób są jednak bardzo duże, dlatego te sposoby dotychczas nie mogły się upowszechnić. Zarówno technika Patch-Clamp jak i próby wypływu rubidu zasadniczo nadają się do tego, by poszukiwać blokerów i otwieraczy kanału potasowego. Najszerzej są jednak rozpowszechnione oparte na komórkach technologie prób, w których przy pomocy specjalnych barwników fluorescencyjnych optycznie odczytuje się działanie substancji na kanały potasowe (np. Whiteaker i in. Journal of Biomolecular Screening, tom 6, nr, 01). Stosuje się przy tym tzw. wrażliwe na napięcie barwniki fluorescencyjne. W komórce i w błonie komórkowej pokazują te barwniki intensywną fluorescencję, podczas gdy one w wodnej fazie pozakomórkowej jedynie bardzo słabo fluoryzują. Zmiana potencjału membranowego prowadzi w przypadku tych barwników do zmiany dystrybucji cząsteczek barwnika między fazą pozakomórkową, błoną komórkową i wnętrzem komórki. Wskutek tego zmiana potencjału membranowego prowadzi do zmiany natężenia fluorescencji komórki. Depolaryzacja potencjału membranowego prowadzi przy tym do wzrostu natężenia fluorescencji, podczas gdy natężenie fluorescencji spada, gdy komórka hiperpolaryzuje. Bezwzględna zmiana natężenia fluorescencji może przy tym wynieść ok. 1-2,% na 1 mv zmiany potencjału membranowego, stosownie do barwnika i układu komórkowego. Poniżej przedstawiono, jak przy pomocy wrażliwych na napięcie barwników fluorescencyjnych można poszukiwać substancji czynnych, które wpływają na aktywność kanałów potasowych. "Bezpośrednie" próby potencjału membranowego dla poszukiwania modulatorów kanału potasowego: w przypadku tego rodzaju prób można identyfikować zarówno blokery kanałów potasowych (próba depolaryzacji) jak i otwiera-
13 cze kanałów potasowych (próba hiperpolaryzacji). Wpływ substancji czynnych na potencjał membranowy komórek, które poddają ekspresji odpowiedni kanał potasowy, śledzi się za to bezpośrednio. Komórki w tym celu najpierw inkubuje się barwnikiem fluorescencyjnym, i następnie rejestruje się natężenie fluorescencji komórek przed i po stosowaniu substancji czynnej. Figura 1 pokazuje jako przykład przebieg czasowy natężenia fluorescencji komórek, które poddają ekspresji kanały KCNQ, przed i po stosowaniu nasycającego stężenia XE991, znanego blokera kanału KCNQ. Po stosowaniu blokera kanału KCNQ obserwuje się wzrost natężenia fluorescencji o około %. Blokowanie kanałów KCNQ przez XE991 zmniejsza przepuszczalność błony dla jonów potasowych. Wedle powyższego równania 2, zmniejsza się wskutek tego wpływ potencjału równowagowego potasu na potencjał membranowy komórek, i ustala się nowy, bardziej dodatni potencjał membranowy. Depolaryzacja ta prowadzi do wzrostu natężenia fluorescencji komórek. Stosownie do typu kanału potasowego i układu komórkowego można w takich "próbach depolaryzacji" przez stosowanie blokera kanału potasowego obserwować wzrost natężenia fluorescencji o 0% i więcej. W przypadku zależnych od napięcia kanałów potasowych, jak kanały KCNQ, zmiany fluorescencji bądź potencjału membranowego są jednak raczej mniejsze. Substancje czynne, otwierające kanały potasowe w błonie komórkowej (bądź których zależność napięciową aktywacji przesuwają do bardziej ujemnych potencjałów; tzw. "gating modifier") prowadzą również do zmiany potencjału membranowego. Figura 2 pokazuje przykładowo przebieg czasowy natężenia fluorescencji komórek, które poddają ekspresji kanały KCNQ, przed i po stosowaniu
14 retygabiny, znanego otwieracza kanału KCNQ (bądź "gating modifier"). Stosowanie retygabiny prowadzi do spadku natężenia fluorescencji o około 3-40%. Otwieranie kanałów KCNQ przez retygabinę zwiększa przepuszczalność potasu przez błonę. Wedle powyższego równania 2 zwiększa się wskutek tego wpływ potencjału równowagowego potasu na potencjał membranowy komórek, i ustala się nowy, bardziej ujemny potencjał membranowy. Ta hiperpolaryzacja prowadzi do spadku natężenia fluorescencji komórek. Dynamiczny zakres takich prób hiperpolaryzacji dla poszukiwania otwieraczy kanału potasowego (bądź "gating modifier") jest jednak przeważnie nie większy niż 0%, a zatem raczej nieznaczny. Główną przyczyną tego jest to, że rozmiar hiperpolaryzacji, która może być wywoływana przez otwieracz kanałów potasowych, jest ograniczony. Potencjał membranowy może najwyżej przyjąć wartość potencjału równowagowego potasu, dla tego rozmiaru hiperpolaryzacji przeważnie jest ograniczony do - mv. Obok raczej nieznacznych zakresów dynamicznych zarówno prób depolaryzacji dla blokerów kanałów potasowych jak i prób hiperpolaryzacji dla otwieraczy kanałów potasowych (lub "gating modifier") mają dalsze wady: Stosowane barwniki fluorescencyjne mają tendencję do tego, by oddziaływać z substancjami badanymi. Nierzadko prowadzi to do niespecyficznych zmian fluorescencji barwników aż do % i więcej. Te niespecyficzne zmiany fluorescencji są często jedynie trudne do rozróżnienia od sygnałów specyficznych dla kanałów, co przy wysokowydajnym skriningu może prowadzić do zwiększonych wyników błędnie-ujemnych i błędnie-dodatnich.
15 Dla poszukiwania blokerów kanału potasowego stosuje się zatem przeważnie alternatywny "pośredni" sposób próby, tak zwane próby ion jump. W przypadku tego rodzaju prób potencjału membranowego, które dotychczas wyłącznie stosowano do poszukiwania blokerów kanału potasowego, działanie substancji na dane kanały potasowe wyznacza się pośrednio. Komórki, poddające dany kanał potasowy ekspresji, inkubuje się najpierw wrażliwym na napięcie barwnikiem fluorescencyjnym. W drugim etapie stosuje się substancje czynne. Następnie śledzi się natężenie fluorescencji komórek przed i po stosowaniu jonów potasowych do pożywki pozakomórkowej. Zewnątrzkomórkowe stężenie jonów potasowych zwiększa się przez stosowanie K+ o 1- mm do 0-0 mm. Zwiększenie pozakomórkowego stężenia potasu prowadzi do tego, że potencjał równowagowy dla potasu staje się bardziej dodatni (równanie 1). Ponieważ potencjał membranowy komórek jest współokreślany przez potencjał równowagowy dla potasu, komórki ulegają depolaryzacji wskutek stosowania K +. Rozmiar depolaryzacji zależy jednak od tego, jak duża jest przepuszczalność błony dla potasu (równanie 2). Im mniejsza jest przepuszczalność dla potasu, tym mniejsza jest depolaryzacja i tym mniejsza jest zmiana fluorescencji komórek wskutek stosowania K +. Przepuszczalność błony dla potasu spada, gdy blokuje się kanały potasowe. W konsekwencji w obecności blokera wzrost fluorescencji komórek po stosowaniu K+ jest mniejszy, w porównaniu ze wzrostem fluorescencji przy braku blokera. Figura 3 pokazuje jako przykład odpowiedź fluorescencyjną komórek, które poddają ekspresji kanały KCNQ, na iniekcję potasu do pozakomórkowej pożywki przy braku i przy obecności blokera kanału KCNQ. Przy braku bloke-
16 ra kanału KCNQ (komórki kontrolne) stosowanie potasu prowadzi do wzrostu natężenia fluorescencji o około 80%. W przeciwieństwie do tego w obecności nasycającego stężenia znanego blokera kanału KCNQ XE991 nie obserwuje się wzrostu fluorescencji po stosowaniu potasu. Różnica amplitud odpowiedzi fluorescencji przy braku i przy obecności blokera kanału KCNQ, tak zwany dynamiczny zakres próby, wynosi w tym przypadku około 80%. W przypadku takich prób ion jump, stosownie do typu kanału potasowego i układu komórkowego, amplitudy indukowanej przez K + zmiany fluorescencji przy obecności i przy braku blokera mogą się różnić aż do 0%. Wskutek tego przeważnie dużego zakresu dynamicznego, dużych synałów fluorescencyjnych i dobrej odtwarzalności, próby "ion jump od lat są szeroko stosowane przy poszukiwaniu blokerów kanału potasowego (np. Falconer i in., Journal of Biomolecular Screening, tom 7, nr, 02; Wolff i in., Journal of Biomolecular Screening 8(), 03). Dotychczas nie stosowano ich do poszukiwania otwieraczy kanału potasowego. Dotychczas także nie był znany efekt otwieraczy kanału potasowego w próbach "ion jump". W przypadku uprzednio opisanych prób ion jump chodzi o odporne i ustalone próby do wykrywania blokerów kanału potasowego, tzn. związków, które blokują lub zamykają kanały potasowe. W przeciwieństwie do tego, do wykrywania związków, otwierających kanały jonowe i w szczególności kanały potasowe (tzw. otwieracze kanału lub także agoniści lub także "gating modifier"), do dyspozycji są jedynie przeważnie mało zadowalające i zawodne próby hiperpolaryzacji. W przeciwieństwie do uprzednio opisanych odpornych i ustalonych prób blokera "ion jump", dotychczas znane próby potencjału membranowego dla poszukiwa-
17 nia otwieraczy kanału potasowego, w szczególności zależnych od napięcia kanałów potasowych, jak kanały KC- NQ, są wyraźnie ograniczone. Dynamiczny zakres, niezawodność i powtarzalność są z reguły nieznaczne. Do poszukiwania otwieraczy kanałów stosuje się dotychczas wyłącznie próby hiperpolaryzacji (np. Whiteaker i in., Journal of Biomolecular Screening, tom 6, nr, 01; Gopalakrishnan i in., The Journal of Pharmacology and Experimental Therapeutics, tom 3, nr 1 (02), pp and British Journal of Pharmacology (04) 143, 81-90). Próby te dostarczają przede wszystkim w przypadku zależnych od napięcia kanałów potasowych jedynie bardzo małe okna pomiarowe (mały zakres dynamiczny). Małe okno pomiarowe jest uwarunkowane przez biofizyczne właściwości kanałów: komórki hodowli, jak np. komórki CHO lub HEK mają z reguły potencjał membranowy około (-)-(- 40) mv, bardzo oddalony od potencjału równowagowego potasu. Powodem tego jest, że te komórki niemal nie poddają ekspresji własnych przewodnictw potasu. W konsekwencji, potencjał membranowy tych komórek jest jedynie mało zdominowany przez potencjał równowagowy potasu. Przez heterologiczną ekspresję zależnego od napięcia kanału potasowego zmienia się potencjał membranowy komórek hodowli. Zasadnicza aktywność zależnych od napięcia kanałów potasowych prowadzi do tego, że potencjał membranowy przesuwa się w kierunku potencjału równowagowego potasu - potencjał membranowy staje się bardziej ujemny. Ta hiperpolaryzacja jest jednak samoograniczająca, ponieważ kanały są znowu zamykane przez hiperpolaryzację. W konsekwencji ustala się nowy stan równowagi. W przypadku komórek CHO i HEK ekspresja zależnego od napięcia kanału potasowego prowadzi do tego,
18 że ustala się potencjał membranowy około (-60)-(-70) mv. Jeśli zatem kanały są aktywowane przez otwieracz kanałów potasowych, wtedy przesuwa się potencjał membranowy jeszcze dalej w kierunku potencjału równowagowego potasu, który wynosi około -90 mv. Przy tym potencjał membranowy nie może być bardziej ujemny niż potencjał równowagowy potasu. Ponieważ komórki przez zasadniczą aktywność kanałów potasowych już posiadają potencjał membranowy około (-60)-(-70) mv, amplituda hyperpolaryzacji indukowanej przez otwieracz kanału jest ograniczona do - mv. Ponieważ w przypadku dotychczas stosowanych prób hiperpolaryzacji dla zależnych od napięcia kanałów potasowych dokładnie ta indukowana przez otwieracz kanału hiperpolaryzacja jest bezpośrednio śledzona przy pomocy wrażliwych na napięcie barwników fluorescencyjnych, odpowiadająca temu amplituda odpowiedzi fluorescencyjnych jest również ograniczona. Dlatego dynamiczny zakres dotychczas stosowanych prób hiperpolaryzacji jest dla zależnych od napięcia kanałów potasowych nieznaczny, co dotychczas utrudniało wiarygodną analizę strukturadziałanie. W przypadku kanałów niezależnych od napięcia, jak np. kanałów K ATP lub także pewnych kanałów potasowych aktywowanych wapniem dynamiczny zakres prób hiperpolaryzacji jest przeważnie nieco większy, ponieważ te kanały przy braku otwieracza kanału mają mniejszą zasadniczą aktywność, a zatem potencjał membranowy komórek przy braku otwieracza kanału jest bardziej dodatni. Mały zakres dynamiczny próby hiperpolaryzacji dla otwieraczy kanałów potasowych i także częste niespecyficzne oddziaływania barwnik-substancja czynna mogą uniemożliwiać wiarygodną analizę struktura-działanie
19 substancji czynnych bądź prowadzić do raczej niezadowalających wyników. Istnieje zatem potrzeba prób dla otwieraczy kanałów potasowych, w szczególności otwieraczy kanałów potasowych zależnych napięcia. U podstaw wynalazku leży zatem zadanie, dostarczenia sposobu, przy użyciu którego można łatwo i niezawodnie określić otwieracze kanałów potasowych. Sposób powinien się wyróżniać szybkością, skutecznością i wysoką czułością i powinien być uniwersalnie przydatny do badania dowolnych zależnych od napięcia kanałów potasowych na te otwierające związki. Ponadto sposób powinien nadawać się do badania przydatności dowolnych związków do otwierania zależnego od napięcia kanału potasowego. Ponadto sposób winien wykazywać niski wynik trafień błędnie-dodatnich, prowadzić do niewielu wyników błędnie-ujemnych i wyróżniać się wysoką powtarzalnością. Ponadto sposób powinien nadawać się zarówno do stosowania w skali laboratoryjnej jak i do wysokowydajnego skriningu (High Troughput Screening, HTS) oraz do zautomatyzowania. Ponadto sposób powinien być ekonomiczny i nie prowadzić do żadnego zbędnego obciążenia środowiska, np. przez odczynniki radioaktywne lub toksyczne. Korzystnie sposób powinien nadawać się do poszukiwania otwieraczy kanałów potasowych zależnych od napięcia. Obecnie nieoczekiwanie stwierdzono, że zasada pomiaru próby "ion jump" daje się pomyślnie i z dużą czułością stosować do identyfikacji związków, które otwierają kanały potasowe bądź "gating modifier", które wpływają na zależność napięciową aktywowanych przez napięcie kanałów potasowych. "Gating modifier" działa jako otwieracz kanałów potasowych, gdy zależność napięciową kanałów potasowych bądź półmaksymalne napięcie aktywacji przesuwa się do bardziej ujemnych potencja-
20 łów. Ponadto stwierdzono, że przez modyfikację zasady pomiaru "ion jump" mogła być ustanowiona nowa próba, przy użyciu której łatwo i skutecznie można wyznaczyć aktywność agonistyczną, tzn. aktywność otwierającą bądź aktywność modyfikującą zależność napięciową związku docelowego na kanale potasowym. Stwierdzono, że ten format próby nadaje się do celowej identyfikacji i charakterystyki z dużą czułością otwieraczy kanału potasowego. Ponadto stwierdzono, że zasada pomiaru próby "ion jump" szczególnie nadaje się do identyfikacji związków, które otwierają zależne od napięcia kanały potasowe. Wynalazek dotyczy zatem sposobu identyfikacji agonistycznej aktywności związku docelowego na zależnym od napięcia kanale potasowym, który jest znamienny tym, że a) dostarcza się populację komórek, które poddają ekspresji kanał potasowy,, b) komórki według a) inkubuje się wrażliwym na napięcie barwnikiem fluorescencyjnym, c) związek docelowy dodaje się do mieszaniny reakcyjnej b), d) wyznacza się wartość F 1 natężenia fluorescencji komórek, e) dodaje się jony potasowe w fizjologicznie tolerowanym stężeniu, f) wyznacza się wartość F 2 natężenia fluorescencji komórek, i g) natężenie fluorescencji F 2 porównuje się z natężeniem fluorescencji F1 i stąd wyznacza się agonistyczną aktywność związku docelowego na kanale potasowym. W tym celu F 2 i F 1 przelicza się korzystnie jak następuje: x0 F F % Aby określić, czy substancja posiada aktywność agonistyczną, można np. F porównać z F F komórek kontrolnych. F F F wyznacza się, a) inkubując barwnikiem fluorescencyjnym populację komórek, które poddają ekspresji kanał
21 - - potasowy, b) dodając do mieszaniny reakcyjnej a) w miejsce związku docelowego jedynie prosty roztwór buforowy, c) wyznaczając wartość F 1K natężenia fluorescencji komórek kontrolnych, d) dodając jony potasowe w fizjologicznie tolerowanym stężeniu, e) wyznaczając wartość F 2K natężenia fluorescencji komórek kontrolnych, i f) F 2K i F 1K korzystnie przeliczając jak następuje: x0 % 1 2 Substancja posiada agonistyczną aktywność na kanale potasowym, gdy F F jest większe niż F F : F Niezależnie od porównania F F F > F F z F F, agonistyczną aktywność związku docelowego daje się także wywnioskować, gdy wraz ze wzrastającym dawkowaniem związku docelowego można zaobserwować wzrost F F. Przez aktywność agonistyczną związku docelowego na kanale potasowym należy rozumieć każdą aktywność związku docelowego otwierającą ten kanał. Aktywność otwierająca ma miejsce, gdy zależność napięciowa kanałów bądź półmaksymalne napięcie aktywacji przesuwa się do bardziej ujemnych potencjałów. Zatem ten termin obejmuje także tzw. "gating modifier". Przy użyciu zgodnego z wynalazkiem sposobu można określać wszystkie rodzaje związków otwierających kanał potasowy, niezależnie od tego, czy związki te otwierają kanał całkowicie czy jedynie w pewnym stopniu. Zaskakujące jest, że ta nieznana dotychczas dla otwieraczy kanałów jonowych i w szczególności otwieraczy kanałów potasowych zasada próby znacznie przewyższa znane próby hiperpolaryzacji. Dynamiczny zakres tej nowej próby ion jump wynosi dla kanałów KCNQ około % i zatem jest ponad szcześciokrotnie większy niż dyna-
22 miczny zakres próby hiperpolaryzacji, która dla kanałów KCNQ wynosi jedynie około 3-40%. Ta innowacyjna próba dla otwieracza kanałów potasowych jest skrajnie niezawodna, powtarzalna i umożliwia wiarygodną analizę struktura-działanie. Zgodny z wynalazkiem format próby dla otwieracza kanałów potasowych przewyższa zatem dotychczas stosowane formaty próby hiperpolaryzacji. Zgodna z wynalazkiem próba ma ponadto tę zaletę, że w przypadku zasady "ion jump" nie śledzi się ograniczonej hyperpolaryzacji indukowanej przez otwieracz kanału. W przypadku prób "ion jump" wyznacza się raczej pośrednio aktywność kanałów potasowych przez zależność potencjału membranowego od potasu. Ograniczenia dotychczas stosowanej próby hiperpolaryzacji nie są tu znaczące. Dlatego dynamiczny zakres nowego formatu próby "ion jump" jest znacznie większy niż dotychczasowych prób, co umożliwia bardziej wiarygodne i bardziej czułe poszukiwanie substancji czynnych przede wszystkim dla otwieraczy kanałów potasowych wrażliwych na napięcie. Dlatego nowo opracowana próba ma w szczególności w przypadku poszukiwania otwieraczy kanałów potasowych zależnych od napięcia, przewagę nad dotychczas stosowanymi formatami prób. Bardzo duży dynamiczny zakres nowego sposobu próby umożliwia poza tym, w szczególności identyfikowanie otwieraczy kanałów potasowych wrażliwych na napięcie, które mają jedynie słabe agonistyczne działanie na dane kanały potasowe. Takie substancje czynne można przy użyciu dotychczas stosowanych prób hiperpolaryzacji jedynie bardzo słabo identyfikować, ponieważ dynamiczny zakres tych próba przeważnie jest bardzo nieznaczny. Ponieważ w przypadku nowego sposobu próby dla poszukiwania otwieraczy kanału potasowego działanie sub-
23 stancji na zależne od napięcia kanały potasowe jest ponadto pośrednio odczytywane na podstawie depolaryzacji indukowanej przez potas, można zaniedbać niespecyficzne oddziaływania barwnik-substancja czynna, przy czym zasadniczo można wykorzystać zasadę i zalety barwników wrażliwych na napięcie. Zmniejsza wyraźnie to w porównaniu z dotychczasowymi próbami hiperpolaryzacji występowanie wyników błędnie-dodatnich i błędnie-ujemnych i prowadzi do wyższej czułości zgodnego z wynalazkiem formatu próby. W przypadku zgodnego z wynalazkiem sposobu stosuje się znane już z prób "ion jump" etapy sposobu w sposób znany per se. Poniżej podane modyfikacje próby ion jump można korzystnie przedsiębrać, aby polepszyć bądź zwiększyć przydatność i czułość sposobu zgodnego z wynalazkiem do identyfikacji związków, które otwierają kanał potasowy zależny od napięcia. Zgodnie z wynalazkiem inkubuje się najpierw populację komórek, które poddają ekspresji zależny od napięcia kanał potasowy, wrażliwym na napięcie barwnikiem fluorescencyjnym. Można zastosować dowolne populacje komórek, tak długo jak poddają one ekspresji dany badany kanał jonowy. Takie linie komórkowe są specjaliście dobrze znane. Przykładami na to są przejściowo transfekowane linie komórkowe, trwałe linie komórkowe, pierwotne hodowle komórkowe i komórki tkanek jak i linie komórkowe, które poddają ekspresji endogenny kanał potasowy. Przykładami tych ostatnich są komórki F-11 lub PC-12, które endogennie poddają ekspresji kanały KCNQ. Hodowanie komórek następuje w sposób znany per se w znanych pożywkach. Hodowanie komórek następuje jak to jest znane w dziedzinie techniki dla komórek poddających ekspresji kanał potasowy. Przykładowo komórki CHO (chinese hamster ovary cells) poddające ekspresji kana-
24 ły KCNQ są hodowane w butelkach cylindrycznych jako hodowla w zawiesinie lub adherentnie na szalkach Petriego, korzystnie w butelkach do hodowli komórkowej. Jako pożywkę korzystnie stosuje się pożywkę Minimum Essential (MEM) z dodatkiem Fetal Calf Serum. Szczególnie korzystnie hoduje się komórki w pożywce Minimum Essential Medium (MEM) α Medium x płynna (Invitrogen,) z % Fetal Calf Serum (FCS) (Gibco, heat inactivated) w 37 C, przy % CO 2 i 9% wilgotności powietrza. W celu pasażowania komórki są odrywane mechanicznie lub enzymatycznie, korzystnie enzymatycznie przez trypsynę, całkiem szczególnie korzystnie enzymatycznie przez akkutazę (firma PAA). Przemiana komórek następuje w takim rytmie, że przy wysiewaniu na płytkach pomiarowych osiąga się ok. 70% stadium konfluencji lub korzystnie po stałym Split-Regime. Następnie komórki wysiewa się na płytkach pomiarowych. W celu zbiorów z butelek do hodowli komórkowej, komórki wymywa się odpowiednim buforem i mechanicznie lub enzymatycznie odrywa się od materiału nośnika. Korzystnie stosuje się metodę enzymatyczną/chemiczną z trypsyną i kwasem etylenodiaminoczterooctowym (EDTA). Szczególnie odpowiednie jest, by komórki przy 70-90%- owej konfluencji przemywać buforem o składzie 0,8-2 mm CaCl 2, 1- mm KCl, 1-2 mm KH 2 PO 4 0,2-1 mm MgCl 2, 0-0 mm NaCl, - mm Na 2 HPO 4, 0- mm D-glukoza i 0-0, mm bufor pirogronianu sodu i inkubować komórki nieznacznym stężeniem trypsyny w celu częściowego rozpuszczenia przez 2-1 min w 37 C. Całkiem szczególnie odpowiednie jest, by komórki przy 80%-owej konfluencji przemywać buforem o składzie 0,9 mm CaCl 2, 2,7 mm KCl, 1, mm KH 2 PO 4, 0, mm MgCl 2, 140 mm NaCl i 8 mm Na 2 HPO 4 i komórki inkubować przy użyciu 2 ml akkutazy (PAA) w celu częściowego rozpuszczenia przez 1 min w 37 C.
25 Oddzielone komórki resuspenduje się w odpowiedniej ilości pożywki, korzystnie - ml. określenie liczby komórek następuje w komorze do zliczania lub w liczniku komórek, korzystnie w liczniku komórek CASY (System Schärfe). Wysiewanie następuje na płytki pomiarowe odpowiednie dla pomiarów fluorescencji o 136, 384 lub 96 zagłębieniach, korzystnie na płytkach, których tworzywo sztuczne umożliwia lepsze przyleganie komórek lub które do tego celu są specjalnie powlekane. Korzystnie stosuje się płytki o 96 zagłębieniach z powłoką poli-dlizyny, powłoką poli-l-lizyny, powłoką kolagenu lub powłoką fibronektyny. Całkiem szczególnie korzystne są płytki Corning CellBIND o 96 zagłębieniach (Black with clear bottom). Wysiewa się komórek na zagłębienie na płytki o 96 zagłębieniach. Korzystnie wysiewa się komórek na zagłębienie. Całkiem szczególnie korzystnie wysiewa się.000 komórek w 0 μl pożywki i inkubuje się przez h, korzystnie 24 h w 37 C, przy % CO 2 i 9% wilgotności powietrza. Całkiem szczególnie korzystnie jest, komórki inkubować przed inkubacją w 37 C przez 1 h w temperaturze pokojowej, aby zapewnić równomierne przyleganie komórek. Dla innych komórek poddających ekspresji kanały potasowe mogą się nadawać inne protokoły hodowli komórkowej, które jednak są znane specjaliście. Alternatywnie można także zastosować komórki, które poddają ekspresji zarówno kanał potasowy jak i oparty na proteinie optyczno fluorescencyjny czujnik napięcia. Takie komórki są specjaliście dobrze znane i posiadają tę zaletę, że może wypaść etap inkubacji barwnikiem fluorescencyjnym wrażliwym na napięcie. Przystosowanie tych komórek dla zgodnego z wynalazkiem sposobu można na przykład przedsiębrać na podstawie uprzednio
26 opisanego protokołu dla komórek, które poddają ekspresji kanał potasowy. Następnie komórki ewentualnie inkubuje się bądź załadowuje się wrażliwym na napięcie barwnikiem fluorescencyjnym. Do inkubacji komórek można stosować różne wrażliwe na napięcie barwniki fluorescencyjne. Tego rodzaju barwniki są specjaliście dobrze znane i poniżej przykładowo przytoczone. Wrażliwe na napięcie barwniki fluorescencyjne można zasadniczo podzielić na dwie klasy: barwniki "wolne" i "szybkie". Do "wolnych" barwników wrażliwych na napięcie należą np. dodatnio naładowane barwniki oparte na cyjaninie bądź karbocyjaninie lub rodaminie, lub także anionowe barwniki oksonolowe, barwniki bisoksonolowe lub barwniki merocyjaninowe [np. Membrane Potential Kit, DiS-BAC 2 (3), DiBAC 4 (3), DiOC 2 (3); DisC 3 (3) DisC 3 ()]. W przypadku produktu Membrane Potential Kit chodzi o produkt handlowy firmy Molecular Devices Corporation. Zestaw ten obecnie jest oferowany w dwóch wariantach: Wariant niebieski: Membrane Potential Assay Kit Blue Wariant czerwony: Membrane Potential Assay Kit Red W literaturze zestaw ten określa się także jako "FLIPR Membrane Potential Dye". Obydwa warianty zestawu nadają się do wykonywania zgodnego z wynalazkiem sposobu próby. W komórce i w błonie komórkowej barwniki te wykazują intensywną fluorescencję, podczas gdy w wodnej fazie pozakomórkowej fluoryzują jedynie bardzo słabo. Zmiana napięcia membranowego (V m ) prowadzi w przypadku tych tak zwanych barwników Nernsta do zmiany dystrybucji cząsteczek barwnika między faza pozakomórkową, błoną komórkowąi wnętrzem komórki. Można wskutek tego ob-
27 serwować zależną od napięcia zmianę natężenia fluorescencji komórki. Ponieważ proces zmiany dystrybucji jest stosunkowo wolny, stałe czasowe dla zmian natężenia fluorescencji wynoszą stosownie do barwnika ok. 1- sekund. Bezwzględna zmiana natężenia fluorescencji wynosi dla tej grupy barwników ok. 1-2.% na 1 mv zmiany potencjału membranowego. Do klasy "szybkich" wrażliwych na napięcie barwników zaliczają się np. barwniki styrylowe i także niektóre oksonole (np. di-8-anepps, di-4-anepps, RH-421, RH-237 itp.) i także hemicyjaniny (np. annina-3 i annina -6). Te amfipatyczne cząsteczki praktycznie nie fluoryzują w roztworze wodnym. Odkładają się jednak w błonie komórek i wykazują tam silną fluorescencję. Zmiana V m prowadzi w przypadku tzw. barwników elektrochromowych (np. barwniki styrylowe) do zmiany rozkładu elektronów w cząsteczce barwnika (tzw. "stark shift"). Wskutek tego przesuwa się widmo fluorescencji barwników. Inne "szybkie" barwniki (np. pewne oksonole) zmieniają zależnie od napięcia ich pozycję w membranie, co również prowadzi do zmiany właściwości spektralnych. Stałe czasowe dla tych procesów wynoszą mniej niż jedną milisekundę. Zależne od napięcia przesunięcie widma jest bardzo nieznaczne. Dlatego można nawet przy optymalnym wyborze filtra wykryć przeważnie jedynie nieznaczne (ok. 0,1% na 1 mv) zmiany natężenia fluorescencji. Dla prób HTS są ponadto także interesujące innowacyjne kombinacje barwników zgodnie z wynalazkiem, w których odbywa się zależny od napięcia transfer energii rezonansu Förstera (FRET). Od pewnego czasu takie układy barwników są dostępne do detekcji potencjału membranowego w firmach Invitrogen i Axiom. Ponieważ te systemy FRET opierają się na "wolnych" barwnikach, czułość jest rzędu wielkości wolnych barwników.
28 Obok opisanych tu barwników są także przykłady opartych na proteinach czujników napięciowych. np. tzw. proteiny VSFP-1, Flash, Flare i SPARC. Takie "fluorescent protein voltage sensitive probes (FPvoltage sensors)" mogłyby w przyszłości zastąpić dotychczas stosowane barwniki. Takie czujniki napięciowe zasadniczo nadają się dla sposobu zgodnego z wynalazkiem. Takie oparte na proteinach optycznofluorescencyjne czujniki napięciowe są również poddawane ekspresji przez komórki, które poddają ekspresji kanał potasowy. Dla zgodnego z wynalazkiem układu testowego nadają się w szczególności barwniki z grupy "szybkich" barwników wrażliwych na napięcie, jak np. barwniki styrylowe (barwniki ANEPPS), barwniki oksonolowe (np. RH421) i barwniki hemicyjaninowe (barwniki ANINNE). Także szczególnie dla zgodnego z wynalazkiem formatu próby nadają się oparte na proteinach czujniki napięciowe jak np. proteiny VSFP-1, Flash, Flare i SPARC, przy użyciu których komórki, poddające ekspresji dany kanał potasowy, są przejściowo lub trwale transfekowane. Korzystnie dla zgodnej z wynalazkiem próby stosuje się oparte na FRET kombinacje barwników, opierające się na "wolnych" barwnikach, takie jak oferowane np. przez firmy Invitrogen lub Axiom. Oparty na FRET układ barwników firmy Invitrogen dostępny jest w handlu jako "Voltage Sensor Probes" ("VSP"). Zawiera on barwniki DisBAC 2 (3) lub DisBAC 4 (3) jak i związany z błoną kumaryno-fosfolipid "CC2-DMPE". Również szczególnie odpowiedni jest oparty na FRET układ barwników firmy Axiom Bioscience. Zawiera on kombinację barwników Dis- BAC 1 (3)/DisBAC 1 (). Nadają się także inne układy barwników FRET dla układu próby. Szczególnie korzystnie stosuje się barwniki z grupy "wolnych", wrażliwych na napięcie barwników fluore-
29 scencyjnych, jak np. Membrane Potential Kit lub barwniki DiSBAC 2 (3), DiBAC 4 (3), DiOC 2 (3), DisC 3 (3), DisC 3 (). Korzystnie, w zgodnym z wynalazkiem formacie próby, zmiany potencjału membranowego wyzwala się za pomocą zmian natężenia fluorescencji barwników wrażliwych na napięcie. Jest jednak także możliwe, że w miejsce natężenia fluorescencji stosuje się zależną od napięcia zmianę czasu życia fluorescencji barwników lub fluoryzujących protein jako parametr pomiarowy. Jest znane specjaliście, w jaki sposób komórki poddające ekspresji kanał potasowy w odpowiedni sposób inkubuje się wrażliwym na napięcie barwnikiem fluorescencyjnym. Czas inkubacji, warunki inkubacji jak i stosunki ilościowe komórki/barwnik fluorescencyjny zależą silnie od każdorazowo stosowanego barwnika i mogą być przez specjalistę łatwo wyznaczone przez rutynowe próby. Poniższe wywody są przykładowe dla korzystnych wykonań wynalazku. Aby przykładowo komórki CHO poddające ekspresji kanały KCNQ załadować barwnikiem wrażliwym na napięcie, najpierw usuwa się pożywkę, w której hodowano komórki. Komórki następnie przemywa się odpowiednim buforem. Następnie powleka się komórki barwnikiem rozpuszczonym w buforze i inkubuje się je przez 2 min - 1, h. Barwnik wybiera się przy tym z uprzednich barwników. Korzystnie powinno się komórki inkubować barwnikiem - 4 min. Całkiem szczególnie dobre wyniki osiąga się, gdy komórki inkubuje się 4 min. Jako bufor nadaje się roztwór o składzie 0,8-4 mm CaCl 2, 0-0 mm HEPES, 0,- mm KCl, 0-2 mm KH 2 PO 4, 0,4-4 mm MgCl 2, 0-1 mm MgSO 4, 0-0 mm NaCl, 0-40 mm NaHCO 3, 0- mm Na 2 HPO 4, 0- mm D-glukoza, 0-0,0 mm
30 czerwień fenolowa i 0-0, mm pirogronian sodu. Szczególnie odpowiedni jest bufor o składzie 1-2 mm CaCl 2, 0,-6 mm KCl, 0,-2 mm MgCl 2, 0,2-0, mm MgSO 4, 0- mm NaCl, 2- mm NaHCO 3, 0,2-0, mm Na 2 HPO 4, - mm D- glukoza i -1 mm HEPES. Całkiem szczególnie korzystnie jest gdy komórki przemywa się 0 μl roztworu pozakomórkowego (ES; 1 mm NaCl, 1 mm KCl, mm HEPES, 2 mm CaCl 2, 2 mm MgCl 2, mm glukoza; ph 7,4) i następnie przez 4 min inkubuje się w temperaturze pokojowej 0 μl roztworu barwnika (1 Vial Membrane Potential Test Kit, Red rozpuszczony w 0 ml roztworu ES). Uprzedni przykładowy protokół do inkubacji komórek poddających ekspresji kanał potasowy barwnikiem fluorescencyjnym specjalista może w zależności od stosowanych komórek i stosowanego barwnika określić i dopasować w sposób znany per se bądź przez proste próby rutynowe. Następnie badany związek docelowy dodaje się do mieszaniny reakcyjnej. Związek docelowy dodaje się przy tym jako roztwór w odpowiednim rozpuszczalniku. Ilość związku docelowego zależy odpowiednio od badanego kanału jonów potasowych. Po inkubacji barwnikiem do substancji badanej w odpowiednim buforze dodaje się fizjologicznie tolerowaną ilość rozpuszczalnika/vehiculum i inkubuje się na komórkach około 1 min-2, h. Czas inkubacji zależy od rodzaju badanego kanału jonów potasowych. Korzystne czasy inkubacji wynoszą 1 min-1, h. Szczególnie korzystnie inkubuje się komórki przy użyciu substancji przez min. Stężenie dodanych jonów potasowych wynosi mm- mm (Końcowe stężenie roztworu KCl), korzystnie 80 mm-1 mm, całkiem szczególnie korzystnie 90 mm- 0 mm KCl.
31 - - 1 Przed dodaniem jonów potasowych wyznacza się wartość F 1 natężenia fluorescencji komórek. Określenie natężenia fluorescencji następuje w sposób znany per se w dziedzinie techniki, np. przy pomocy kamery CCD lub Photomultiplier. Pomiary mogą być przeprowadzone każdym dostępnych handlowo czytnikiem fluorescencyjnym, szczególnie przydatne są: BMG-Typ Fluostar lub BMG-Typ Polarstar lub Molecular Devices-Flex. Fluorescencję wzbudza się przy 2 nm i przeprowadza detekcję przy 60 nm. Następnie ponownie wyznacza się natężenie fluorescencji komórek. Zwiększenie wartości fluorescencji F 2 następuje w identycznym punkcie czasowym po depolaryzacji KCl, korzystnie w punkcie czasowym maksimum (Topvalue) depolaryzacji KCl. Wartość F F przynależnej substancji badanej wyznacza się przy zastosowaniu wartości F2 w zagłębieniu dla substancji i wartości fluorescencji w ustalonym i dla wszystkich substancji identycznym punkcie czasowym linii podstawowej zagłębienia dla substancji (F 1 ): x0 F F % 2 Od tej wartości F F specyficznej dla substancji odejmuje się wartość średnią wartości F F prób kontrolnych vehiculum, a zatem ujmuje się specyficzny dla substancji dynamiczny zakres (w procentach). Do tej wartości można następnie dodać udział procentowy efektu (zakres dynamiczny) substancji odniesienia istotnej dla docelowej proteiny.
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu
 Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH
 Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Elektrofizjologia neuronu
 Spis treści Co to jest neuron? 2008-11-13 Spis treści Co to jest neuron? Wstęp Rola jonów w działaniu neronu Potencjał membranowy Stan równowagi Bramki jonowe Dynamika bramek jonowych Model Hodgkina-Huxley
Spis treści Co to jest neuron? 2008-11-13 Spis treści Co to jest neuron? Wstęp Rola jonów w działaniu neronu Potencjał membranowy Stan równowagi Bramki jonowe Dynamika bramek jonowych Model Hodgkina-Huxley
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2259949 (96) Data i numer zgłoszenia patentu europejskiego: 11.02.2009 09727379.1 (13) (51) T3 Int.Cl. B60L 11/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2259949 (96) Data i numer zgłoszenia patentu europejskiego: 11.02.2009 09727379.1 (13) (51) T3 Int.Cl. B60L 11/00 (2006.01)
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Współczynnik przepuszczalności [cm/s] RóŜnice składu jonowego między wnętrzem komórki ssaka a otoczeniem
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 223771 (96) Data i numer zgłoszenia patentu europejskiego: 06.12.08 0886773.1 (13) (1) T3 Int.Cl. A47L 1/42 (06.01) Urząd
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 223771 (96) Data i numer zgłoszenia patentu europejskiego: 06.12.08 0886773.1 (13) (1) T3 Int.Cl. A47L 1/42 (06.01) Urząd
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1505553. (96) Data i numer zgłoszenia patentu europejskiego: 05.08.2004 04018511.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 3 (96) Data i numer zgłoszenia patentu europejskiego: 0.08.04 0401811.8 (13) (1) T3 Int.Cl. G08C 17/00 (06.01) Urząd Patentowy
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 3 (96) Data i numer zgłoszenia patentu europejskiego: 0.08.04 0401811.8 (13) (1) T3 Int.Cl. G08C 17/00 (06.01) Urząd Patentowy
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 213136 (96) Data i numer zgłoszenia patentu europejskiego: 14.03.2008 08723469.6 (13) (1) T3 Int.Cl. F24D 19/ (2006.01) Urząd
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 213136 (96) Data i numer zgłoszenia patentu europejskiego: 14.03.2008 08723469.6 (13) (1) T3 Int.Cl. F24D 19/ (2006.01) Urząd
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2321656 (96) Data i numer zgłoszenia patentu europejskiego:.08.09 09807498.2 (13) (51) T3 Int.Cl. G01R /18 (06.01) G01R 19/
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2321656 (96) Data i numer zgłoszenia patentu europejskiego:.08.09 09807498.2 (13) (51) T3 Int.Cl. G01R /18 (06.01) G01R 19/
Droga impulsu nerwowego w organizmie człowieka
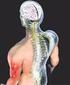 Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 02.05.2005 05747547.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1747298 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 02.05.2005 05747547.7 (51) Int. Cl. C22C14/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1747298 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 02.05.2005 05747547.7 (51) Int. Cl. C22C14/00 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2224595 (96) Data i numer zgłoszenia patentu europejskiego: 10.02.2010 10001353.1 (13) (51) T3 Int.Cl. H03K 17/96 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2224595 (96) Data i numer zgłoszenia patentu europejskiego: 10.02.2010 10001353.1 (13) (51) T3 Int.Cl. H03K 17/96 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2555663 (96) Data i numer zgłoszenia patentu europejskiego: 06.04.2011 11730434.5 (13) (51) T3 Int.Cl. A47L 15/42 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2555663 (96) Data i numer zgłoszenia patentu europejskiego: 06.04.2011 11730434.5 (13) (51) T3 Int.Cl. A47L 15/42 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 221611 (96) Data i numer zgłoszenia patentu europejskiego: 19.01. 000481.1 (13) (1) T3 Int.Cl. B28C /42 (06.01) B60P 3/16
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 221611 (96) Data i numer zgłoszenia patentu europejskiego: 19.01. 000481.1 (13) (1) T3 Int.Cl. B28C /42 (06.01) B60P 3/16
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2127498 (96) Data i numer zgłoszenia patentu europejskiego: 14.02.2008 08716843.1 (13) (51) T3 Int.Cl. H05B 41/288 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2127498 (96) Data i numer zgłoszenia patentu europejskiego: 14.02.2008 08716843.1 (13) (51) T3 Int.Cl. H05B 41/288 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1837599 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.03.2007 07004628.9
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1837599 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.03.2007 07004628.9
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 171472 (96) Data i numer zgłoszenia patentu europejskiego: 19.0.0 07498.6 (13) T3 (1) Int. Cl. F24F11/00 G01N33/00 (06.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 171472 (96) Data i numer zgłoszenia patentu europejskiego: 19.0.0 07498.6 (13) T3 (1) Int. Cl. F24F11/00 G01N33/00 (06.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 198480 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 21.04.08 08007708.4 (1) Int. Cl. B60H1/24 (06.01) (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 198480 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 21.04.08 08007708.4 (1) Int. Cl. B60H1/24 (06.01) (97)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 71811 (96) Data i numer zgłoszenia patentu europejskiego: 29.09.06 06791167.7 (13) (1) T3 Int.Cl. H04Q 11/00 (06.01) Urząd
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 71811 (96) Data i numer zgłoszenia patentu europejskiego: 29.09.06 06791167.7 (13) (1) T3 Int.Cl. H04Q 11/00 (06.01) Urząd
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 172874 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 04.0.2006 0611312. (1) Int. Cl. B23B31/28 (2006.01) (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 172874 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 04.0.2006 0611312. (1) Int. Cl. B23B31/28 (2006.01) (97)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1810954 (96) Data i numer zgłoszenia patentu europejskiego: 06.12.2006 06025226.9 (13) (51) T3 Int.Cl. C03B 9/41 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1810954 (96) Data i numer zgłoszenia patentu europejskiego: 06.12.2006 06025226.9 (13) (51) T3 Int.Cl. C03B 9/41 (2006.01)
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2052830. (96) Data i numer zgłoszenia patentu europejskiego: 21.10.2008 08018365.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 202830 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 21..2008 0801836.0 (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 202830 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 21..2008 0801836.0 (97)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1663252 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 10.09.2004 04786930.0
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2057877 (96) Data i numer zgłoszenia patentu europejskiego: 03.11.2008 08019246.1 (13) (51) T3 Int.Cl. A01C 23/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2057877 (96) Data i numer zgłoszenia patentu europejskiego: 03.11.2008 08019246.1 (13) (51) T3 Int.Cl. A01C 23/00 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1716463 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 2.06.04 04740328.2 (1) Int. Cl. G0B23/02 (06.01) G0B19/406
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1716463 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 2.06.04 04740328.2 (1) Int. Cl. G0B23/02 (06.01) G0B19/406
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1732433 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 27.01.2005 05702820.1
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1732433 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 27.01.2005 05702820.1
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2047071 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 21.07.2007 07786251.4
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2047071 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 21.07.2007 07786251.4
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2353894 (96) Data i numer zgłoszenia patentu europejskiego: 19.02.2010 10001703.7 (13) (51) T3 Int.Cl. B60D 5/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2353894 (96) Data i numer zgłoszenia patentu europejskiego: 19.02.2010 10001703.7 (13) (51) T3 Int.Cl. B60D 5/00 (2006.01)
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Glikokaliks glikokaliks cytoplazma jądro błona komórkowa Mikrografia elektronowa powierzchni limfocytu ludzkiego (wybarwienie
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 161679 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 24.06.0 064.7 (1) Int. Cl. B60R21/01 (06.01) (97) O udzieleniu
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 161679 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 24.06.0 064.7 (1) Int. Cl. B60R21/01 (06.01) (97) O udzieleniu
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2307863. (96) Data i numer zgłoszenia patentu europejskiego: 28.07.2009 09790873.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2307863 (96) Data i numer zgłoszenia patentu europejskiego: 28.07.2009 09790873.5 (13) (51) T3 Int.Cl. G01J 3/44 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2307863 (96) Data i numer zgłoszenia patentu europejskiego: 28.07.2009 09790873.5 (13) (51) T3 Int.Cl. G01J 3/44 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1701111 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 11.03.2005 05090064.6 (51) Int. Cl. F24H9/20 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1701111 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 11.03.2005 05090064.6 (51) Int. Cl. F24H9/20 (2006.01)
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność szybka dyfuzja: O 2, CO 2, N 2, benzen Dwuwarstwa lipidowa - przepuszczalność Współczynnik przepuszczalności [cm/s] 1 Transport
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność szybka dyfuzja: O 2, CO 2, N 2, benzen Dwuwarstwa lipidowa - przepuszczalność Współczynnik przepuszczalności [cm/s] 1 Transport
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2074843. (96) Data i numer zgłoszenia patentu europejskiego: 27.09.2007 07818485.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 74843 (96) Data i numer zgłoszenia patentu europejskiego: 27.09.07 0781848.0 (13) (1) T3 Int.Cl. H04W 4/12 (09.01) Urząd
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 74843 (96) Data i numer zgłoszenia patentu europejskiego: 27.09.07 0781848.0 (13) (1) T3 Int.Cl. H04W 4/12 (09.01) Urząd
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 240040 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 09.07. 007077.0 (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 240040 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 09.07. 007077.0 (97)
c stężenie molowe, V średnia prędkość molekuł
 Elektrodyfuzja, prąd jonowy i biopotencjały elektryczne.. Zjawiska elektryczne towarzyszące dyfuzji jonów oraz różnice ich stężeń powodują, że potencjały elektryczne roztworów po obu stronach błony są
Elektrodyfuzja, prąd jonowy i biopotencjały elektryczne.. Zjawiska elektryczne towarzyszące dyfuzji jonów oraz różnice ich stężeń powodują, że potencjały elektryczne roztworów po obu stronach błony są
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 18761 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 31.03.06 06726163.6 (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 18761 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 31.03.06 06726163.6 (97)
EFEKT SOLNY BRÖNSTEDA
 EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1802536 (96) Data i numer zgłoszenia patentu europejskiego: 20.09.2004 04774954.4 (13) T3 (51) Int. Cl. B65D77/20 B65D85/72
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1802536 (96) Data i numer zgłoszenia patentu europejskiego: 20.09.2004 04774954.4 (13) T3 (51) Int. Cl. B65D77/20 B65D85/72
n liczba moli elektronów E siła elektromotoryczna ogniwa F = en A stała Faradaya C/mol
 Zmiana entalpii swobodnej G podczas reakcji w której zachodzi przepływ elektronów jest pracą nieobjętościową i może być wyrażona jako iloczyn napięcie i ładunku. na przykład procesy oksydo-redukcyjne zachodzące
Zmiana entalpii swobodnej G podczas reakcji w której zachodzi przepływ elektronów jest pracą nieobjętościową i może być wyrażona jako iloczyn napięcie i ładunku. na przykład procesy oksydo-redukcyjne zachodzące
Równowaga kwasowo-zasadowa. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Równowaga kwasowozasadowa Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Krytyka pojęcia ph ph = log [H + ] ph [H+] 1 100 mmol/l D = 90 mmol/l 2 10 mmol/l D = 9 mmol/l 3 1 mmol/l 2 Krytyka pojęcia
Równowaga kwasowozasadowa Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Krytyka pojęcia ph ph = log [H + ] ph [H+] 1 100 mmol/l D = 90 mmol/l 2 10 mmol/l D = 9 mmol/l 3 1 mmol/l 2 Krytyka pojęcia
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1799953 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 18.08.2005 05770398.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1799953 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 18.08.2005 05770398.5
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 28647 (96) Data i numer zgłoszenia patentu europejskiego: 30.03.09 091662.2 (13) (1) T3 Int.Cl. C07D 333/28 (06.01) Urząd
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 28647 (96) Data i numer zgłoszenia patentu europejskiego: 30.03.09 091662.2 (13) (1) T3 Int.Cl. C07D 333/28 (06.01) Urząd
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 25.09.2006 06019976.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 177267 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 2.09.2006 06019976.7 (1) Int. Cl. F16L9/00 (2006.01) (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 177267 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 2.09.2006 06019976.7 (1) Int. Cl. F16L9/00 (2006.01) (97)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1680966 (96) Data i numer zgłoszenia patentu europejskiego: 27.10.2004 04791390.0 (13) T3 (51) Int. Cl. A23L1/172 A23P1/08
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1680966 (96) Data i numer zgłoszenia patentu europejskiego: 27.10.2004 04791390.0 (13) T3 (51) Int. Cl. A23L1/172 A23P1/08
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 PL/EP 1699990 T3 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1699990 (96) Data i numer zgłoszenia patentu europejskiego: 09.11.2004 04800186.1 (13) (51) T3 Int.Cl. E04G
PL/EP 1699990 T3 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1699990 (96) Data i numer zgłoszenia patentu europejskiego: 09.11.2004 04800186.1 (13) (51) T3 Int.Cl. E04G
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1508941 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.08.2004 04018799.9
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1508941 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 07.08.2004 04018799.9
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1614553 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 01.07.2005 05014326.2 (51) Int. Cl. B60C27/06 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1614553 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 01.07.2005 05014326.2 (51) Int. Cl. B60C27/06 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2445326 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 24.10.2011 11186353.6
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2445326 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 24.10.2011 11186353.6
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1680075 (13) T3 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.10.2004
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1680075 (13) T3 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.10.2004
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2143572 (96) Data i numer zgłoszenia patentu europejskiego: 18.05.2009 09160454.6 (13) (51) T3 Int.Cl. B60C 11/13 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2143572 (96) Data i numer zgłoszenia patentu europejskiego: 18.05.2009 09160454.6 (13) (51) T3 Int.Cl. B60C 11/13 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1816307 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:.07.06 060114.3 (1) Int. Cl. E06B9/68 (06.01) (97) O udzieleniu
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1816307 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:.07.06 060114.3 (1) Int. Cl. E06B9/68 (06.01) (97) O udzieleniu
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2337642 (96) Data i numer zgłoszenia patentu europejskiego: 08.09.09 0978272.1 (13) (1) T3 Int.Cl. B21B 4/08 (06.01) B08B
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2337642 (96) Data i numer zgłoszenia patentu europejskiego: 08.09.09 0978272.1 (13) (1) T3 Int.Cl. B21B 4/08 (06.01) B08B
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2122 (96) Data i numer zgłoszenia patentu europejskiego: 2..07 07866441.4 (13) (1) T3 Int.Cl. D21H 19/06 (06.01) Urząd Patentowy
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2122 (96) Data i numer zgłoszenia patentu europejskiego: 2..07 07866441.4 (13) (1) T3 Int.Cl. D21H 19/06 (06.01) Urząd Patentowy
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2383703 (96) Data i numer zgłoszenia patentu europejskiego: 29.04. 40068.1 (13) (1) T3 Int.Cl. G07B 1/06 (11.01) G08G 1/017
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2383703 (96) Data i numer zgłoszenia patentu europejskiego: 29.04. 40068.1 (13) (1) T3 Int.Cl. G07B 1/06 (11.01) G08G 1/017
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1960017 (96) Data i numer zgłoszenia patentu europejskiego: 14.07.2006 0674727.3 (13) (1) T3 Int.Cl. A61M 1/36 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1960017 (96) Data i numer zgłoszenia patentu europejskiego: 14.07.2006 0674727.3 (13) (1) T3 Int.Cl. A61M 1/36 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2328822 (96) Data i numer zgłoszenia patentu europejskiego: 02.09.2009 09782487.4 (13) (51) T3 Int.Cl. B65G 15/38 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2328822 (96) Data i numer zgłoszenia patentu europejskiego: 02.09.2009 09782487.4 (13) (51) T3 Int.Cl. B65G 15/38 (2006.01)
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609. (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609 (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.2 (13) (51) T3 Int.Cl. A61K 38/17 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1879609 (96) Data i numer zgłoszenia patentu europejskiego: 04.05.2006 06742792.2 (13) (51) T3 Int.Cl. A61K 38/17 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1477128 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 14.05.2004 04076445.8 (51) Int. Cl. A61D1/02 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1477128 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 14.05.2004 04076445.8 (51) Int. Cl. A61D1/02 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 200337 (96) Data i numer zgłoszenia patentu europejskiego: 12.06.2007 07011498.8 (13) (1) T3 Int.Cl. F16J 9/26 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 200337 (96) Data i numer zgłoszenia patentu europejskiego: 12.06.2007 07011498.8 (13) (1) T3 Int.Cl. F16J 9/26 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1711158 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 16.11.2004 04806793.8
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1711158 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 16.11.2004 04806793.8
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1859720. (96) Data i numer zgłoszenia patentu europejskiego: 15.02.2007 07003173.
 PL/EP 1859720 T3 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1859720 (96) Data i numer zgłoszenia patentu europejskiego: 15.02.2007 07003173.7 (13) (51) T3 Int.Cl. A47L
PL/EP 1859720 T3 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1859720 (96) Data i numer zgłoszenia patentu europejskiego: 15.02.2007 07003173.7 (13) (51) T3 Int.Cl. A47L
Krwiobieg duży. Krwiobieg mały
 Mięsień sercowy Budowa serca Krązenie krwi Krwiobieg duży Krew (bogata w tlen) wypływa z lewej komory serca przez zastawkę aortalną do głównej tętnicy ciała, aorty, rozgałęzia się na mniejsze tętnice,
Mięsień sercowy Budowa serca Krązenie krwi Krwiobieg duży Krew (bogata w tlen) wypływa z lewej komory serca przez zastawkę aortalną do głównej tętnicy ciała, aorty, rozgałęzia się na mniejsze tętnice,
(12) OPIS PATENTOWY (19) PL (11) (13) B1
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 170013 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 297079 (22) Data zgłoszenia: 17.12.1992 (51) IntCl6: H01L 29/792 (
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 170013 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 297079 (22) Data zgłoszenia: 17.12.1992 (51) IntCl6: H01L 29/792 (
PL B1. POLITECHNIKA GDAŃSKA, Gdańsk, PL BUP 19/09. MACIEJ KOKOT, Gdynia, PL WUP 03/14. rzecz. pat.
 PL 216395 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 216395 (13) B1 (21) Numer zgłoszenia: 384627 (51) Int.Cl. G01N 27/00 (2006.01) H01L 21/00 (2006.01) Urząd Patentowy Rzeczypospolitej
PL 216395 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 216395 (13) B1 (21) Numer zgłoszenia: 384627 (51) Int.Cl. G01N 27/00 (2006.01) H01L 21/00 (2006.01) Urząd Patentowy Rzeczypospolitej
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2776315 (96) Data i numer zgłoszenia patentu europejskiego: 19.07.2013 13753588.6 (13) (51) T4 Int.Cl. B64C 29/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2776315 (96) Data i numer zgłoszenia patentu europejskiego: 19.07.2013 13753588.6 (13) (51) T4 Int.Cl. B64C 29/00 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2326237 (96) Data i numer zgłoszenia patentu europejskiego: 07.07.2009 09780285.4 (13) (51) T3 Int.Cl. A47L 15/50 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2326237 (96) Data i numer zgłoszenia patentu europejskiego: 07.07.2009 09780285.4 (13) (51) T3 Int.Cl. A47L 15/50 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1837003 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 14.03.2007 07005252.7 (51) Int. Cl. A61G5/10 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1837003 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 14.03.2007 07005252.7 (51) Int. Cl. A61G5/10 (2006.01)
(12) OPIS PATENTOWY (19) PL (11)
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 182207 (21) Numer zgłoszenia: 314632 (22) Data zgłoszenia: 05.06.1996 (13) B1 (51) IntCl7 C09K 17/02 (54)
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 182207 (21) Numer zgłoszenia: 314632 (22) Data zgłoszenia: 05.06.1996 (13) B1 (51) IntCl7 C09K 17/02 (54)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 21737 (96) Data i numer zgłoszenia patentu europejskiego: 16.12.2010 10790844.4 (13) (1) T3 Int.Cl. A47L 1/42 (2006.01) A47L
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 21737 (96) Data i numer zgłoszenia patentu europejskiego: 16.12.2010 10790844.4 (13) (1) T3 Int.Cl. A47L 1/42 (2006.01) A47L
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 08.09.2005 05789871.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1791422 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 08.09.2005 05789871.0 (51) Int. Cl. A01N1/02 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1791422 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 08.09.2005 05789871.0 (51) Int. Cl. A01N1/02 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1690923 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 1.02.0 0460002.8 (97)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1690923 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 1.02.0 0460002.8 (97)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1712702 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 28.03.2006 06006359.1 (51) Int. Cl. E04F15/02 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1712702 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 28.03.2006 06006359.1 (51) Int. Cl. E04F15/02 (2006.01)
(96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1690978 (96) Data i numer zgłoszenia patentu europejskiego: 11.02.2005 05101042.9 (13) T3 (51) Int. Cl. D06F81/08 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1690978 (96) Data i numer zgłoszenia patentu europejskiego: 11.02.2005 05101042.9 (13) T3 (51) Int. Cl. D06F81/08 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1890471 (96) Data i numer zgłoszenia patentu europejskiego: 19.10.2006 06791271.7 (13) (51) T3 Int.Cl. H04M 3/42 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1890471 (96) Data i numer zgłoszenia patentu europejskiego: 19.10.2006 06791271.7 (13) (51) T3 Int.Cl. H04M 3/42 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2003466 (96) Data i numer zgłoszenia patentu europejskiego: 12.06.2008 08460024.6 (13) (51) T3 Int.Cl. G01S 5/02 (2010.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2003466 (96) Data i numer zgłoszenia patentu europejskiego: 12.06.2008 08460024.6 (13) (51) T3 Int.Cl. G01S 5/02 (2010.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 182634 (96) Data i numer zgłoszenia patentu europejskiego: 19.04.07 070963.1 (13) T3 (1) Int. Cl. F16H/17 F16H7/04 (06.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 182634 (96) Data i numer zgłoszenia patentu europejskiego: 19.04.07 070963.1 (13) T3 (1) Int. Cl. F16H/17 F16H7/04 (06.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2210706 (96) Data i numer zgłoszenia patentu europejskiego: 21.01.2010 10000580.0 (13) (51) T3 Int.Cl. B24B 21/20 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2210706 (96) Data i numer zgłoszenia patentu europejskiego: 21.01.2010 10000580.0 (13) (51) T3 Int.Cl. B24B 21/20 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) (13) T3 (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 16234 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 18..0 0022716.4 (1) Int. Cl. B6D71/00 (06.01) (97) O udzieleniu
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 16234 (13) T3 (96) Data i numer zgłoszenia patentu europejskiego: 18..0 0022716.4 (1) Int. Cl. B6D71/00 (06.01) (97) O udzieleniu
dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K
![dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K](/thumbs/55/36391740.jpg) RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1947302. (96) Data i numer zgłoszenia patentu europejskiego: 03.12.2007 07122193.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1947302 (96) Data i numer zgłoszenia patentu europejskiego: 03.12.2007 07122193.1 (13) (51) T3 Int.Cl. F01M 11/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1947302 (96) Data i numer zgłoszenia patentu europejskiego: 03.12.2007 07122193.1 (13) (51) T3 Int.Cl. F01M 11/00 (2006.01)
PL B1. AKADEMIA GÓRNICZO-HUTNICZA IM. STANISŁAWA STASZICA W KRAKOWIE, Kraków, PL BUP 14/12
 PL 218561 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 218561 (13) B1 (21) Numer zgłoszenia: 393413 (51) Int.Cl. G01N 27/02 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia:
PL 218561 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 218561 (13) B1 (21) Numer zgłoszenia: 393413 (51) Int.Cl. G01N 27/02 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia:
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2334863. (96) Data i numer zgłoszenia patentu europejskiego: 31.08.2009 09782381.
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2334863 (96) Data i numer zgłoszenia patentu europejskiego: 31.08.2009 09782381.9 (13) (51) T3 Int.Cl. D06F 39/08 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2334863 (96) Data i numer zgłoszenia patentu europejskiego: 31.08.2009 09782381.9 (13) (51) T3 Int.Cl. D06F 39/08 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2528702 (96) Data i numer zgłoszenia patentu europejskiego: 03.12.2010 10796315.9 (13) (51) T3 Int.Cl. B21D 53/36 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2528702 (96) Data i numer zgłoszenia patentu europejskiego: 03.12.2010 10796315.9 (13) (51) T3 Int.Cl. B21D 53/36 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2316460 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 12.05.2005 11001347.1
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2316460 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 12.05.2005 11001347.1
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2179743 (96) Data i numer zgłoszenia patentu europejskiego: 13.07.2009 09460028.5 (13) (51) T3 Int.Cl. A61K 38/18 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2179743 (96) Data i numer zgłoszenia patentu europejskiego: 13.07.2009 09460028.5 (13) (51) T3 Int.Cl. A61K 38/18 (2006.01)
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1854925 (96) Data i numer zgłoszenia patentu europejskiego: 16.12.2005 05826699.0 (13) (51) T3 Int.Cl. E03D 1/00 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1854925 (96) Data i numer zgłoszenia patentu europejskiego: 16.12.2005 05826699.0 (13) (51) T3 Int.Cl. E03D 1/00 (2006.01)
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak)
 Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
(96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 164949 (96) Data i numer zgłoszenia patentu europejskiego: 24.06.2004 04740236.7 (13) T3 (1) Int. Cl. H01R12/04 H01R4/24
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 164949 (96) Data i numer zgłoszenia patentu europejskiego: 24.06.2004 04740236.7 (13) T3 (1) Int. Cl. H01R12/04 H01R4/24
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2190940 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.09.2008 08802024.3
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2190940 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 11.09.2008 08802024.3
