8 k ELEKTROFOREZA. Właściwości elektryczne koloidów
|
|
|
- Kazimiera Adamska
- 7 lat temu
- Przeglądów:
Transkrypt
1 8 k ELEKTROFOREZA Zagadnienia teoretyczne Układy koloidalne. Podział zoli. Budowa cząstki koloidalnej (miceli) koloidu fazowego, cząsteczkowego i asocjacyjnego. Właściwości elektryczne zoli, potencjał elektrokinetyczny,. Elektroforeza i inne efekty elektrokinetyczne (elektroosmoza, potencjał przepływu, potencjał sedymentacji). Wpływ różnych czynników na prędkość migracji elektroforetycznej i elektroosmotycznej. Wykorzystanie efektów elektrokinetycznych w procesie separacji. Właściwości elektryczne koloidów W roztworze koloidalnym na granicy fazy stałej i ciekłej, tzn. granicy występującej pomiędzy powierzchnią cząstki koloidalnej i roztworem ciekłym występuje strefa, która nazywana jest obszarem międzyfazowym (strefą międzyfazową). Ze skryptu dotyczącego Ćw. Nr 6 (Koloidy) można dowiedzieć się, że w takim obszarze ma miejsce proces adsorpcji składników roztworu. Dla zoli istotnym czynnikiem jest adsorpcja jonów na powierzchni cząstki koloidalnej. Adsorpcja ta jest odpowiedzialna za powstawanie ładunku na powierzchni cząstki i w wyniku tego istnienie podwójnej warstwy elektrycznej. Według Sterna w przypadku koloidów hydrofobowych podwójna warstwa elektryczna jest złożona z dwóch części. Jedną część stanowi warstwa jonów trwale z nią związanych. Oznacza to, że warstwa ta może przemieszczać się razem z cząstką koloidalną. Drugą część stanowi warstwa dyfuzyjna o znacznie większej grubości, w której znajdują się w przeważającej ilości jony o znaku przeciwnym do jonów z warstwy adsorpcyjnej (porównaj tekst Ćw. Nr 6). Warstwa dyfuzyjna nie przemieszcza się z razem cząstką koloidalną. Schematyczne przedstawienie modelu podwójnej warstwy elektrycznej jest uwidocznione na rys. 2, Ćw. Nr 6, na przykładzie zolu jodku srebra. Obecność podwójnej warstwy elektrycznej jest odpowiedzialna za powstawanie różnicy (skoku) potencjału pomiędzy powierzchnią cząstki koloidalnej i roztworem (jego głębią). Skok ten jest zilustrowany na rysunku jako funkcja odległości od powierzchni cząstki koloidalnej, rys. 5, Ćw. Nr 6. Wartość różnicy potencjału zmniejsza się w miarę oddalania się od powierzchni cząstki i spada do zera w głębi roztworu. Dla cząstki koloidalnej charakterystyczną wartością jest różnica potencjału (skok potencjału) występująca w warstwie dyfuzyjnej. Nazywana jest ona potencjałem elektrokinetycznym. Na rys. 5, Ćw. Nr 6, potencjał elektrokinetyczny jest zaznaczony 1
2 grecką literą zeta,. Jego wartość rośnie z gęstością ładunku,, zgromadzonego na powierzchni cząstki i z grubością podwójnej warstwy elektrycznej,, a maleje ze wzrostem przenikalności elektrycznej ośrodka zgodnie z równaniem: (1) o r gdzie: o jest przenikalnością elektryczną próżni, r jest stałą dielektryczną roztworu. W odróżnieniu od potencjału elektrokinetycznego potencjał Nernsta,, dotyczy wartości jego skoku pomiędzy powierzchnią fazy stałej i roztworem, dlatego jego wartość jest większa od potencjału elektrokinetycznego. Podwójna warstwa elektryczna i wartość potencjału elektrokinetycznego są odpowiedzialne za występowanie wielu właściwości układów koloidalnych, związanych z przemieszczaniem się naładowanej cząstki koloidalnej w roztworze. Należą do nich: elektroforeza, elektroosmoza, potencjał przepływu, potencjał sedymentacji, równowaga Donnana. Niektóre z nich są poniżej bardziej szczegółowo przedstawione. Elektroforeza Ruch cząstek, obdarzonych ładunkiem elektrycznym, względem fazy ciekłej (roztworu) w polu elektrycznym, wytworzonym przez różnicę potencjału, nazywa się elektroforezą. Zatem w roztworze koloidalnym, w którym są zanurzone elektrody i między nimi występuje różnica potencjału, ma miejsce ruch cząstek naładowanych w kierunku do elektrody o przeciwnym ładunku. Jeżeli cząstki koloidalne posiadają ładunek ujemny, wtedy wędrują do elektrody dodatniej (anody) i proces nazywa się anaforezą. Natomiast w przypadku cząstek naładowanych dodatnio ich ruch jest skierowany w stronę katody, elektrody ujemnej, a proces ten nazywa się kataforezą. Cząstka poruszająca się w procesie elektroforezy niesie ze sobą warstwę trwale z nią związaną, a pozostała część, warstwa dyfuzyjna z nadmiarem jonów o znaku ładunku przeciwnym do jonów warstwy adsorpcyjnej, porusza się w kierunku przeciwnym. Stąd granica pomiędzy warstwą trwale związaną z cząstka koloidalną i warstwą dyfuzyjną nazywa się płaszczyzną poślizgu. Prędkość, eof, cząstek koloidalnych podczas procesu elektroforezy rośnie, gdy potencjał elektrokinetyczny,, przenikalność elektryczna roztworu i natężenie pola elektrycznego, E, mają wyższe wartości. Natomiast, gdy lepkość roztworu rośnie to eof maleje. Zależność tę ilustruje równanie Smoluchowskiego: k o r E eof (2) 2
3 gdzie: k jest stałą zależną od kształtu cząstki. Równanie to można przedstawić w nieco innej postaci: eof E eof k o r (3) gdzie: eof jest ruchliwością elektroforetyczną, tzn. prędkością cząstek koloidalnych w jednostkowym polu elektrycznym. Elektroforeza znalazła olbrzymie zastosowanie w analizie biomedycznej, szczególnie do rozdzielania i określania składu ilościowego i jakościowego próbek zawierających aminokwasy, peptydy, białka, nukleotydy, kwasy nukleinowe itp., a więc substancje, które mogą występować w roztworze jako jony. Pierwsze badania nad rozdzielaniem białek przeprowadził Tiselius w aparacie do elektroforezy swobodnej w kształcie U-rurki. Rurka taka była wypełniana strefami roztworów koloidalnego i buforu. Po przyłożeniu różnicy potencjału do elektrod można było obserwować przemieszczanie się cząstek koloidalnych w zależności od wielkości ich ładunku i kształtu. Jednakże elektroforeza prowadzona w roztworze swobodnym charakteryzuje się bardzo małą efektywnością rozdzielenia z powodu dużego udziału w rozszerzeniu stref substancji dyfuzji termicznej i konwekcji. Znaczny postęp w efektywności rozdzielenia został osiągnięty, gdy do prowadzenia procesu elektroforezy została zastosowana bibuła jako nośnik. Po zwilżeniu paska bibuły odpowiednim buforem nanoszono na linię startową próbkę rozdzielanych substancji i pasek wkładano do komory do elektroforezy. Na rys. 1 jest przedstawiony uproszczony wygląd aparatu do elektroforezy bibułowej. Do niedawna elektroforeza bibułowa była często stosowana do określania profilu białek surowicy krwi. Obecnie coraz częściej stosuje się elektroforezę żelową, w której nośnikiem fazy ciekłej, buforu, jest żel elektroforetyczny, wykonany z agaru, poliakrylamidów lub skrobi (obecnie bardzo rzadko stosowana). Ciekłą próbkę mieszaniny składników umieszcza się we wgłębieniu w warstwie żelu zwilżonej odpowiednim Przykrywa Linia startowa (+) ( ) Bibuła Rys. 1. Schemat urządzenia do elektroforezy bibułowej. Roztwory buforowe 3
4 roztworem buforowym. Następnie umieszcza się całość w polu elektrycznym wytworzonym pomiędzy elektrodami, do których przyłożone jest napięcie polaryzujące od 50 do 2000 V. Zastosowanie elektroforezy żelowej pozwoliło na znaczne zwiększenie efektywności rozdzielenia w stosunku do elektroforezy na bibule. Od przełomu lat siedemdziesiątych i osiemdziesiątych ubiegłego wieku obserwuje się rozwój elektroforezy kapilarnej. Rozdzielanie prowadzi się w rurce kapilarnej o średnicy od 25 do 100 m i długości od 0,2 do 1 m wypełnionej odpowiednim buforem. Do końców rurki, po wprowadzeniu próbki rozdzielanej, przykładane jest napięcie polaryzujące o wartości do 30 kv, które wytwarza pole elektryczne generujące migrację składników próbki obdarzonych ładunkiem. Przy jednym końcu rurki umieszczony jest detektor, który wykrywa i rejestruje rozdzielone składniki. Schematyczny wygląd urządzenia, prezentującego zasadę działa elektroforezy kapilarnej, jest przedstawiony na Rys. 2. Kapilara Detektor Roztwór buforowy + Zasilacz wysokonapięciowy Rys. 2. Schemat urządzenia do elektroforezy kapilarnej. Zaletą elektroforezy kapilarnej jest bardzo krótki czas analizy, bardzo małe zużycie roztworów i możliwość automatyzacji procesu. Od ostatniej dekady ubiegłego wieku bardzo szybko rozwija się zastosowanie elektroforezy w układach miniaturowych (mikroczipach), w których długość dogi rozdzielania może wynosić nawet kilka mm, przy zastosowaniu wysokich wartości natężenia pola elektrycznego. Proces rozdzielenia mieszanin w mikroczipach trwa bardzo krótko, nawet w niektórych przypadkach ułamek sekundy. Dzięki temu możliwe są do osiągnięcia wydajności , a nawet i więcej, analiz w ciągu dnia. Takie wydajności stwarzają olbrzymie możliwości w badaniach biomedycznych i biofarmaceutycznych związanych np. z ustalaniem sekwencji białek i DNA. 4
5 Zjawisko elektroforezy znalazło również zastosowanie w technice do pokrywania powierzchni metali powłokami nie przewodzącymi prądu, np. tlenkami metali, lakierami. Elektroosmoza Elektroosmoza to ruch ośrodka ciekłego (roztworu) względem nieruchomej fazy stałej w wyniku działania pola elektrycznego. Jak wynika z definicji w elektroosmozie faza ciekła porusza się względem fazy stałej, a więc odwrotnie niż w elektroforezie. Powstawanie efektu elektroosmozy można wytłumaczyć na przykładzie kapilary ze stopionej krzemionki wypełnionej roztworem wodnym i umieszczonej pomiędzy elektrodami wytwarzającymi pole elektryczne, tak jak na rys. 3. Ściana kapilary () Przepływ elektroosmotyczny () Ściana kapilary Rys. 3. Ilustracja efektu elektroosmotycznego. Na granicy faz ścianka kapilary roztwór wodny powstaje podwójna warstwa elektryczna z ładunkiem o znaku ujemnym na powierzchni krzemionki, powstałym w wyniku dysocjacji powierzchniowych grup silanolowych (SiOH SiO + H + ). Dysocjacja ta jest całkowita, gdy ph roztworu jest większe od 3. Natomiast roztwór graniczący z powierzchnią kapilary posiada w nadmiarze jony o znaku ładunku przeciwnym, w przykładzie rysunku dodatni, do ładunku powierzchni kapilary. Jeżeli taki układ zostanie poddany działaniu pola elektrycznego, to jony roztworu przy powierzchni kapilary będą migrować w stronę elektrody ujemnej ciągnąc ze sobą roztwór znajdujący się w całej objętości kapilary (zdysocjowane grupy silanolowe o 5
6 ujemnym ładunku są zakotwiczone do powierzchni krzemionki, więc nie mogą się przemieszczać w polu elektrycznym). W ten to sposób powstaje przepływ elektroosmotyczny roztworu w kapilarze. Wielkość liniowej prędkości, eos, tego przepływu jest określana przez równanie Smoluchowskiego, podane wcześniej dla określania prędkości migracji cząstek koloidalnych w procesie elektroforezy: o r E eos (4) Analogicznie do ruchliwości elektroforetycznej została wprowadzona ruchliwość elektroosmotyczna, która jest podana wyrażeniem: eos E eos o r (5) Ostatnie równania pozwalają na wyznaczenie potencjału elektrokinetycznego na podstawie zmierzonego przepływu elektroosmotycznego. Efekt elektroosmotyczny jest wykorzystywany w stosunkowo młodej metodzie rozdzielania i analizy mieszanin substancji szczególnie leków i pochodzenia biologicznego. Metoda ta to elektrochromatografia kapilarna. Posiada bardzo dużo podobieństwa do wysokosprawnej chromatografii cieczowej, HPLC. Zasadnicza różnica między tymi metodami polega na tym, że w HPLC przepływ eluentu jest powodowany mechanicznie tłoczeniem fazy ruchomej przez kolumnę chromatograficzną za pomocą pompy wysokociśnieniowej. Natomiast w elektrochromatografii kapilarnej przepływ fazy ruchomej wywołuje efekt elektroosmotyczny. Zestaw do elektrochromatografii kapilarnej jest praktycznie identyczny z zestawem do elektroforezy kapilarnej, rys. 2. Konstrukcyjna różnica polega na zastosowaniu innej kolumny rozdzielczej, która powinna zawierać odpowiednią fazę stacjonarną sprzyjającą wywoływaniu efektu elektroosmotycznego. Należy też zaznaczyć, że metodę tę można zastosować do rozdzielania zarówno substancji jonowych jak i obojętnych. Ponadto efekt elektroosmozy znalazł zastosowanie do usuwania wody tam gdzie jest niepożądana, np. z zagrzybionych ścian budynków, z torfu, z drzewa przeznaczanego na meble itp. 6
7 Elektroforeza białek Jak wiadomo, zarówno koloidy hydrofilowe, jak i hydrofobowe mają dodatni lub ujemny ładunek elektryczny, mogą więc poruszać się w polu elektrycznym do katody lub anody. Białka posiadają zarówno grupy o charakterze kwasowym COOH, jak i zasadowym NH2. W zależności od ph środowiska występują one w formie jonu o ładunku ujemnym lub dodatnim. Rozpatrzmy ten problem na przykładzie aminokwasu będącego składnikiem białka. R CH COOH H + NH 3 + R CH COOH NH 2 OH - R CH COO - + H 2 O NH 2 Jak wynika z reakcji, w środowisku kwaśnym białka wykazują ładunek dodatni dzięki jonizacji grupy NH2 do NH3 + i cofniętej dysocjacji grupy COOH, natomiast w środowisku zasadowym uzyskują ładunek ujemny dzięki dysocjacji grupy COOH. Z równania wynika również, że musi istnieć takie ph przy którym obydwie grupy funkcyjne COOH i NH2 są w jednakowym stopniu zjonizowane. Przy takim ph, nazywanym punktem izoelektrycznym, tworzą się sole wewnętrzne, to znaczy cząsteczki, które mają jednocześnie ładunek dodatni i ujemny: R CH COO - NH 3 + Należy podkreślić, że w punkcie izoelektrycznym wypadkowy ładunek aminokwasu lub białka jest równy zero. Punkt izoelektryczny niektórych białek wynosi: Białko Punkt izoelektryczny (ph) Lecytyna 2.60 Albumina jaja kurzego 4.55 Żelatyna 4.85 Hemoglobina 7.00 Cytochrom C
8 Zastosowanie w elektroforezie odpowiedniego ph fazy rozpraszającej (dyspersyjnej) powoduje, że w środowisku zasadowym białka mają ładunek ujemny i wędrują do anody (anaforeza), w środowisku kwaśnym ładunek dodatni i wędrują do katody (kataforeza), natomiast w punkcie izoelektrycznym - zerowy i nie wykazują ruchliwości elektroforetycznej. Można sformułować regułę, która określa kolejność, w jakiej rozdzielane podczas elektroforezy cząstki lub cząsteczki docierają do katody. Pierwsze docierają do katody małe obdarzone dużym ładunkiem kationy, następnie większe kationy o mniejszym ładunku, potem cząsteczki obojętne. Kolejność wędrówki stref substancji obdarzonych ładunkiem ujemnym do anody jest analogiczna, małe aniony posiadające duży ładunek elektryczny migrują najszybciej, a duże aniony o małym ładunku najwolniej. Należy pamiętać, że procesowi elektroforezy praktycznie zawsze towarzyszy proces elektroosmozy. Zwykle ruchliwość elektroforetyczna przyjmuje mniejsze wartości od ruchliwości elektroosmotycznej w kapilarach z krzemionkowych. Dlatego podczas procesu elektroforezy w kapilarach krzemionkowych wszystkie składniki analizowanej próbki wędrują do katody. Najszybciej poruszają się strefy substancji o cząsteczkach najmniejszych i obdarzone największym ładunkiem dodatnim, a najwolniej pasma substancji o cząsteczkach najmniejszych i największym ładunku ujemnym. Schematycznie kolejność migracji substancji, różniących się ładunkiem i wielkością cząsteczek/cząstek, podczas procesu elektroforezy w kapilarze krzemionkowej jest przedstawiona na poniższym rysunku, rys. 6. Kierunek przepływu elektroosmotycznego i migracji stref substancji Rys. 6. Kolejność migracji cząstek/cząsteczek do katody podczas procesu elektroforezy w kapilarze krzemionkowej. Należy jednak pamiętać, że opisana kolejność migracji składników próbki w procesie kapilarnej elektroforezy jest regułą, która może mieć wyjątki. Elektroforezę bibułową prowadzi się w aparacie, którego schemat przedstawia rys.1. Przeprowadza się ją w sposób następujący: pasek bibuły nasyca się buforem o odpowiednim ph i nanosi roztwór białka np. w buforze mrówczanowym o ph = 2. Pasek bibuły z naniesionym białkiem umieszcza się w komorze zanurzając końce paska w buforze. Naczynie przykrywa się pokrywą i włącza prąd. Po upływie 1-2 godz. wyjmuje się pasek bibuły z rozdzie- 8
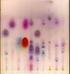
9 lonymi frakcjami białka, suszy i wywołuje barwnikiem np. błękitem bromotymolowym, który wiąże się ilościowo z albuminami. Podczas elektroforezy bibułowej zachodzą również inne zjawiska, które zakłócają prawidłowy przebieg rozdzielania np. adsorpcja białek na bibule, dyfuzja cząstek koloidu wzdłuż paska bibuły oraz wydzielania się ciepła w wyniku przepływu prądu przez elektrolit. Z tego powodu elektroforezę przeprowadza się na żelach: agarowym, skrobiowym lub poliakryloamidowym. Elektroforeza na żelach pozwala na uzyskanie lepszych wyników rozdzielania białek. Żele charakteryzują się większą zdolnością rozdzielczą, gdyż oprócz różnic w ruchliwości elektroforetycznej, cząstki koloidalne podlegają przesiewaniu molekularnemu. Rolę sita spełniają pory w sieci żelu, których średnica zależy od sposobu przygotowania żelu. Na rys.5 przedstawiono elektroforegram frakcji białkowych surowicy. albuminy próbki Rys. 5. Przykład elektroforegramu białek surowicy krwi. -globulina -globulina -globulina Podsumowanie informacji o wykorzystaniu elektroforezy w analizie farmaceutycznej i biomedycznej Metoda elektroforezy znalazła szerokie zastosowanie w farmacji i biomedycynie jako narzędzie do rozdzielania, izolowania i analizy ilościowej oraz jakościowej składników próbek szczególnie leków i pochodzenia biologicznego. Proces elektroforezy może być przeprowadzony różnymi technikami, jako elektroforeza na bibule, w żelu, kolumnie, kapilarze. Obecnie elektroforeza jako metoda analizy chemicznej jest najczęściej realizowana w żelu akrylamidowym lub agarze. Metodą tą poddaje się analizie materiał biologiczny (surowica, mocz, różne tkanki, a nawet pojedyncze komórki) pod względem poznania profilu frakcji białkowych czy DNA i RNA. W przypadku sekwencjonowania DNA (odczytywania kolejności par nukleotydów) elektroforeza jest kluczowym elementem tej analizy. Wyniki takiej analizy pomagają przy ustaleniu rodzaju schorzenia i postępów leczenia, cech genetycznych. Elektroforeza żelowa jest też wykorzystywana do analizy rozkładu chemicznego leków jako pojedynczych substancji chemicznych, złożonych mieszanek oraz ich zanieczyszczeń (np. 9
10 nieorganicznych takich jak ołów, cynk, miedź, żelazo oraz organicznych będących produktami rozkładu związku aktywnego, lub pozostałością po syntezie tego związku). Od przełomu lat siedemdziesiątych i osiemdziesiątych ubiegłego wieku obserwuje się stały rozwój elektroforezy prowadzonej w kapilarach (średnica wewnętrzna 0,05 0,15 mm, długość cm, napięcie polaryzujące 0 30 kv). Po okresie początkowej fascynacji tą metodą (dzięki uzyskiwanej bardzo wysokiej sprawności układów rozdzielczych), obecnie obserwuje się jej ustabilizowany rozwój. Bardzo duże możliwości separacyjne i analityczne pozwoliły na zastosowanie tej metody we współczesnej analizie farmaceutycznej, a szczególnie biomedycznej. Poza korzystną cechą tej metody związaną ze wspomnianą wysoką sprawnością, innymi jej zaletami są prosta procedura, bardzo mała objętość (nanolitry) próbki analizowanej, bardzo małe zużycie reagentów i rozpuszczalników, stosunkowo łatwe zastosowanie automatyzacji procesu separacji oraz krótki czas przygotowania próbki i prowadzenia separacji. Etapy te są żmudne i czasochłonne do wykonania w klasycznej metodzie elektroforezy żelowej. Przykłady prowadzenia analiz tą metoda można mnożyć. Znane są próby rozdzielania i analizowania praktycznie wszystkich grup substancji stosowanych w farmacji i biomedycynie. Dla porządku należy podać, że są to substancje małocząsteczkowe i o wielkich (makro-) cząsteczkach, jony nieorganiczne i organiczne, substancje o cząsteczkach obojętnych oraz enancjomery. Świadczą o tym niezmiernie liczne publikacje w czasopismach specjalistycznych i monografiach. Wiele instytucji (w tym wydawnictwa farmakopealne w różnych krajach) potwierdziły oficjalnie przydatność tej metody w analizie farmaceutycznej. Od 1990 roku obserwuje się wykorzystanie elektroforezy w układach miniaturowych tzw. mikroczipach. Rozwój tego rodzaju techniki elektroforetycznej jest stymulowany głownie zastosowaniami w analizie biomedycznej i farmaceutycznej, szczególnie do rozdzielania białek, peptydów, DNA oraz jego fragmentów (ustalanie sekwencji). 10
11 Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych. 2. Dokonać analizy otrzymanych wyników z uwzględnieniem właściwości strukturalnych badanych barwników i ph roztworów buforowych zastosowanych do elektroforezy. 3. Wskazać, które składniki znajdowały się w próbce stanowiącej mieszaninę barwników. Wykonanie ćwiczenia: Budowa zestawu do elektroforezy Doświadczenia wykonuje się w komorze do elektroforezy poziomej, której schematyczny wygląd w przekroju wzdłużnym jest przedstawiony na rys. 6. Na rysunku uwidoczniony jest również zasilacz prądu stałego. Pokrywa komory Żel agarozowy + Zasilacz Obudowa komory Elektroda Roztwór buforowy Elektroda Rys. 6. Schematyczny wygląd przekroju wzdłużnego komory do elektroforezy poziomej. Wygląd przestrzenny komory jest przedstawiony na rysunku 7. Na rysunku nie zostały uwidocznione elektrody, pokrywa komory i roztwory buforowe. Natomiast uwidocznione są warstwy żelu agarozowego w trzech segmentach komory. 1 segment Warstwa żelu 2 segment Wgłębienia elektrodowe 1 segmentu Wgłębienia elektrodowe 2 segmentu 3 segment Wgłębienia elektrodowe 3 segmentu Rys. 7. Widok przestrzenny komory do elektroforezy poziomej (bez pokrywy i elektrod). 11
12 Jak widać na rys. 6, zestaw do elektroforezy składa się z komory z przykrywą i zasilacza prądu stałego. W komorze, po obu jej stronach, są umieszczone elektrody. Aby przeprowadzić proces elektroforezy w komorze umieszcza się warstwę żelu agarozowego i nalewa roztwór buforowy do wgłębień z elektrodami, tak jak na rys. 6. Włączenie napięcia polaryzującego z zasilacza, w celu prowadzenia procesu elektroforezy, dokonuje się po uprzednim naniesieniu próbek rozdzielanych substancji na warstwę żelu agarozowego. Aparat do elektroforezy używany podczas doświadczeń w laboratorium chemii fizycznej został wyposażony w trzy-segmentową komorę, która pozwala na przeprowadzenie procesu elektroforezy w żelu agarozowym w trzech różnych roztworach buforowych, np. o różnych ph, jednocześnie. Na rys. 7, przedstawiającym widok przestrzenny komory, są widoczne te trzy segmenty z warstwami żelu w każdym z nich. Przygotowanie żelu agarozowego 1. Odważyć 1,11 g agarozy, wsypać do zlewki o pojemności 250 ml i dodać 110 cm 3 roztworu buforowego o ph = 3,6. Podobnie należy przygotować dwa roztwory buforowe agarozy w buforach o ph = 6,0 i ph = Każdy z otrzymanych trzech roztworów agarozy należy doprowadzić do zagotowania na płycie grzejnej i po lekkim ostudzeniu wlać kolejno do trzech segmentów komory. 3. Przed wlaniem roztworów agarozy do każdego segmentu komory należy po obu ich (segmentów) stronach przykleić taśmę samoprzylepną. Rys. 8 prezentuje sposób przyklejenia taśmy w segmentach komory. Należy zwrócić uwagę na to, by powierzchnie, do których będą przyklejane paski taśmy, były suche i czyste. Dzięki temu, po przyklejeniu taśmy samoprzylepnej, zostaną utworzone korytka w każdym z trzech segmentów komory. Z wprowadzonych roztworów agarozy do korytek, po ostygnięciu do temperatury pokojowej, utworzą się warstwy żelu agarozowego o grubości 5 6 mm. Taśma samoprzylepna 1 segment 2 segment 3 segment Rys. 8. Prezentacja sposobu przyklejenia taśmy samoprzylepnej w celu utworzenia korytek na roztwory agarozy. 12
13 Agaroza w roztw. buforowym o ph = 3,6 Agaroza w roztw. buforowym o ph = 6,0 1 segment 2 segment 3 segment Grzebień Agaroza w roztw. buforowym o ph = 10 Rys. 9. Widok komory z trzema roztworami agarozy w korytkach utworzonych z pasków taśmy samoprzylepnej i ścianek komory oraz grzebieniem plastikowym służącym do wykonania wgłębień na próbki badanych barwników w warstwie żelu. 4. Przed nalaniem roztworów agarozy do korytek należy w nich umieścić grzebień plastikowy, w celu utworzenia sześciu wgłębień w środkowej części warstwy żelu, rys. 9. Do wgłębień tych zostaną wprowadzone próbki badanych barwników w kolejnym etapie wykonywania doświadczenia. Po ostygnięciu roztworów agarozy należy usunąć taśmy samoprzylepne. Wypełnienie komory roztworami buforowymi 5. Po usunięciu taśm samoprzylepnych nalać ostrożnie do wgłębień komory z elektrodami odpowiednie roztwory buforowe, tak by poziom roztworu minimalnie przykrywał (ok. 1 mm) warstwę żelu w każdym segmencie wystarcza 380 ml roztworu buforowego do dwóch wgłębień elektrodowych jednego segmentu. Należy pamiętać aby do wgłębień elektrodowych 1 segmentu nalać roztwór buforowy o ph = 3,6, zgodnym (takim samym) z ph roztworu stosowanego do przygotowania warstwy żelu w tym segmencie ( ph = 3,6). Analogicznie należy wypełnić roztworami buforowymi o odpowiednim ph (6,0 i 10,0) wgłębienia elektrodowe 2 segmentu i 3 segmentu. 6. Usunąć grzebień. Nanoszenie próbek barwników na żel agarozowy 7. Do utworzonych sześciu wgłębień w środkowej części każdej warstwy żelu agarozowego wprowadzić kolejno, za pomocą strzykawki, niewielkie ilości sześciu roztworów barwników. Przy czym do pięciu wgłębień nanieść roztwory pojedynczych barwników, a do szóstego wgłębienia roztwór mieszaniny barwników wskazany przez asystenta. Podczas nanoszenia należy zwrócić uwagę na to, by roztwór barwnika przykrył całą powierzchnię dna wgłębienia na wysokość około 1 mm. Nanoszone roztwory barwników to: 1. Zieleń malachitowa 2. Rodamina 6G 3. PAR, 4-(2-pirydyloazo)rezorcynol 4. Czerwień Kongo 5. Azorubina Wzory strukturalne badanych barwników są umieszczone na końcu niniejszego opracowania. 13
14 Rys. 10 pokazuje przykładowe rozmieszczenie wgłębień w warstwie żelu. Można powiedzieć, że wgłębienia te stanowią linię startową dla badanych substancji. Roztwory pojedynczych barwników Roztwór mieszaniny barwników Rys. 10. Warstwa żelu agarozowego z jednego segmentu z sześcioma wgłębieniami na próbki pojedynczych barwników oraz ich mieszaniny. Zapoczątkowanie procesu elektroforezy i jego przebieg 8. Przykryć komorę pokrywą i podłączyć przewodami elektrycznymi komorę do zasilacza. Włączyć wtyczkę przewodu zasilającego do gniazda sieciowego. Włączyć napięcie polaryzujące o wartości 130 V i prowadzić proces elektroforezy w ciągu jednej godziny. W tym czasie obserwować zmiany zachodzące w komorze do elektroforezy i notować co 10 min wartości natężenia prądu. 9. Wyłączyć zasilacz po 1 godz. Wyjąć wtyczkę zasilacza z gniada sieciowego. Zdjąć pokrywę komory. Zmierzyć dystans migracji stref (plamek) poszczególnych barwników i dane te zamieścić w tabelach poniżej. 10. Po zakończeniu pomiarów przenieść za pomocą strzykawki o pojemności 100 ml roztwory buforowe z wgłębień elektrodowych do odpowiednich butelek. 11. Usunąć zużyty żel agarozowy z komory, a komorę umyć i wytrzeć do sucha ręcznikiem papierowym. 12. Uzyskane dane przedstawić w tabelach. Tabela 1. Dystanse migracji (S) stref (plamek) barwników podczas elektroforezy w żelu aga rozowym z roztworami buforowymi o różnych wartościach ph, napięcie polaryzu jące. V, czas trwania elektroforezy. min. Substancja Dystans migracji (S) w mm ph = 3,6 Dystans migracji (S) w mm ph = 6,0 Dystans migracji (S) w mm ph = 10 Zieleń malachitowa Rodamina 6G PAR Czerwień Kongo Azorubina 14
15 Mieszanina barwników Składnik 1 Składnik 2 Tabela 2. Wartości natężenia prądu i czasu prowadzenia procesu elektroforezy. Czas (t)/ min Natężenie prądu (I)/ ma 0 (start)
16 Wzory strukturalne barwników stosowanych jako substancje testowe w procesie elektroforezy: 16
17 8. ELEKTROFOREZA (schemat formularza do opracowania wyników ćwiczenia) Data wykonania ćwiczenia: Imię i nazwisko studenta: GS Imię i nazwisko asystenta: Zadania do wykonania: Tabela 1. Wykres 1. Zależność dystansu migracji poszczególnych stref barwników od ph roztworu buforowego: S = f (ph) Tabela 2. Wykres 2. Wykres natężenia prądu od czasu elektroforezy: I = f(t) Omówienie wyników i wnioski: - wyciągnąć wnioski dotyczące powiązania wartości dystansu migracji poszczególnych barwników z ich strukturą chemiczną i ph buforu. Odpowiedzieć na pytania: - które składniki znajdowały się w próbce stanowiącej mieszaninę barwników? - jakie efekty można zaobserwować podczas procesu elektroforezy? - jakie czynniki mogły wpłynąć na zmianę natężenia prądu podczas procesu elektroforezy? Podpis studenta: Podpis opiekuna: Data 17
ELEKTROFOREZA. Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM
 Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
8 ELEKTROFOREZA. Sprawdzono w roku 2017 przez A.Klimek-Turek. Właściwości elektryczne koloidów
 8 ELEKTROFOREZA Zagadnienia teoretyczne Układy koloidalne. Podział zoli. Budowa cząstki koloidalnej (miceli) koloidu fazowego, cząsteczkowego i asocjacyjnego. Właściwości elektryczne zoli, potencjał elektrokinetyczny,.
8 ELEKTROFOREZA Zagadnienia teoretyczne Układy koloidalne. Podział zoli. Budowa cząstki koloidalnej (miceli) koloidu fazowego, cząsteczkowego i asocjacyjnego. Właściwości elektryczne zoli, potencjał elektrokinetyczny,.
8 ELEKTROFOREZA. Sprawdzono w roku 2014 przez A.Klimek-Turek. Właściwości elektryczne koloidów
 8 ELEKTROFOREZA Zagadnienia teoretyczne Układy koloidalne. Podział zoli. Budowa cząstki koloidalnej (miceli) koloidu fazowego, cząsteczkowego i asocjacyjnego. Właściwości elektryczne zoli, potencjał elektrokinetyczny,.
8 ELEKTROFOREZA Zagadnienia teoretyczne Układy koloidalne. Podział zoli. Budowa cząstki koloidalnej (miceli) koloidu fazowego, cząsteczkowego i asocjacyjnego. Właściwości elektryczne zoli, potencjał elektrokinetyczny,.
Metody chromatograficzne w chemii i biotechnologii, wykład 6. Łukasz Berlicki
 Metody chromatograficzne w chemii i biotechnologii, wykład 6 Łukasz Berlicki Techniki elektromigracyjne Elektroforeza technika analityczna polegająca na rozdzielaniu mieszanin związków przez wymuszenie
Metody chromatograficzne w chemii i biotechnologii, wykład 6 Łukasz Berlicki Techniki elektromigracyjne Elektroforeza technika analityczna polegająca na rozdzielaniu mieszanin związków przez wymuszenie
WYSOKOSPRAWNA ELEKTROFOREZA KAPILARNA (HPCE) + +
 WYSOKOSPRAWNA ELEKTROFOREZA KAPILARNA (HPCE) WSTĘP Zjawisko elektroforezy polega na poruszaniu się lub migracji cząstek naładowanych w polu elektrycznym w wyniku przyciągania względnie odpychania. Najprostszy
WYSOKOSPRAWNA ELEKTROFOREZA KAPILARNA (HPCE) WSTĘP Zjawisko elektroforezy polega na poruszaniu się lub migracji cząstek naładowanych w polu elektrycznym w wyniku przyciągania względnie odpychania. Najprostszy
Wyścigi w polu elektrycznym
 Wyścigi w polu elektrycznym - czyli słów kilka o nowoczesnych technikach elektromigracyjnych Paweł Kubalczyk Katedra Chemii Środowiska Wydział Chemii UŁ Mieszaniny Mieszanina to układ dwóch lub więcej
Wyścigi w polu elektrycznym - czyli słów kilka o nowoczesnych technikach elektromigracyjnych Paweł Kubalczyk Katedra Chemii Środowiska Wydział Chemii UŁ Mieszaniny Mieszanina to układ dwóch lub więcej
ELEKTROFORETYCZNY ROZDZIAŁ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 2 ELEKTROFORETYCZNY ROZDZIAŁ BIAŁEK I. WSTĘP TEORETYCZNY Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 2 ELEKTROFORETYCZNY ROZDZIAŁ BIAŁEK I. WSTĘP TEORETYCZNY Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej,
Podstawy chromatografii i technik elektromigracyjnych / Zygfryd Witkiewicz, Joanna Kałużna-Czaplińska. wyd. 6-1 w PWN. Warszawa, cop.
 Podstawy chromatografii i technik elektromigracyjnych / Zygfryd Witkiewicz, Joanna Kałużna-Czaplińska. wyd. 6-1 w PWN. Warszawa, cop. 2017 Spis treści Przedmowa 11 1. Wprowadzenie 13 1.1. Krótka historia
Podstawy chromatografii i technik elektromigracyjnych / Zygfryd Witkiewicz, Joanna Kałużna-Czaplińska. wyd. 6-1 w PWN. Warszawa, cop. 2017 Spis treści Przedmowa 11 1. Wprowadzenie 13 1.1. Krótka historia
Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych + +
 Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Zjawisko elektroforezy polega na poruszaniu
Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Zjawisko elektroforezy polega na poruszaniu
Podstawy chromatografii i technik elektromigracyjnych / Zygfryd Witkiewicz, Joanna Kałużna-Czaplińska. wyd. 5, 4 dodr. Warszawa, 2015.
 Podstawy chromatografii i technik elektromigracyjnych / Zygfryd Witkiewicz, Joanna Kałużna-Czaplińska. wyd. 5, 4 dodr. Warszawa, 2015 Spis treści Przedmowa 11 1. Wprowadzenie 13 1.1. Krótka historia chromatografii
Podstawy chromatografii i technik elektromigracyjnych / Zygfryd Witkiewicz, Joanna Kałużna-Czaplińska. wyd. 5, 4 dodr. Warszawa, 2015 Spis treści Przedmowa 11 1. Wprowadzenie 13 1.1. Krótka historia chromatografii
K05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Ćwiczenie 5. Potencjał zeta, wyznaczanie punktu IEP. mgr Jacek Patkowski. Zakład Radiochemii i Chemii Koloidów UMCS
 Ćwiczenie 5 Potencjał zeta, wyznaczanie punktu IEP ćwiczenie opracowali: dr Małgorzata Paszkiewicz mgr Jacek Patkowski Zakład Radiochemii i Chemii Koloidów UMCS STRUKTURA PWE NA GRANICY FAZ TLENEK METALU/WODNY
Ćwiczenie 5 Potencjał zeta, wyznaczanie punktu IEP ćwiczenie opracowali: dr Małgorzata Paszkiewicz mgr Jacek Patkowski Zakład Radiochemii i Chemii Koloidów UMCS STRUKTURA PWE NA GRANICY FAZ TLENEK METALU/WODNY
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii ELEKTROFOREZA. Prowadzący: mgr inż. Marta Grec Miejsce ćwiczeń: sala 102
 Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii ELEKTROFOREZA Prowadzący: mgr inż. Marta Grec Miejsce ćwiczeń: sala 102 1. Wstęp teoretyczny Przyłożenie pola elektrycznego do wodnego roztworu
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii ELEKTROFOREZA Prowadzący: mgr inż. Marta Grec Miejsce ćwiczeń: sala 102 1. Wstęp teoretyczny Przyłożenie pola elektrycznego do wodnego roztworu
- oznaczenia naukowo-badawcze. - jedna z podstawowych technik. - oznaczenia laboratoryjnodiagnostyczne. Elektroforeza. badawczych.
 Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
CE1. Elektroforeza kapilarna dobór warunków rozdzielania CE2. Elektroforeza kapilarna oznaczanie homocysteiny w próbkach wodnych + +
 CE1. Elektroforeza kapilarna dobór warunków rozdzielania CE2. Elektroforeza kapilarna oznaczanie homocysteiny w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
CE1. Elektroforeza kapilarna dobór warunków rozdzielania CE2. Elektroforeza kapilarna oznaczanie homocysteiny w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
Układy zdyspergowane. Wykład 6
 Układy zdyspergowane Wykład 6 Treśd Podwójna warstwa elektryczna Zjawiska elektrokinetyczne Potencjał zeta Nowoczesne metody oznaczania Stabilnośd dyspersji Stabilnośd dyspersji koloidalnej jest wypadkową
Układy zdyspergowane Wykład 6 Treśd Podwójna warstwa elektryczna Zjawiska elektrokinetyczne Potencjał zeta Nowoczesne metody oznaczania Stabilnośd dyspersji Stabilnośd dyspersji koloidalnej jest wypadkową
CHROMATOGRAFIA BARWNIKÓW ROŚLINNYCH
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 1 CHROMATOGRAFIA BARWNIKÓW ROŚLINNYCH I. Wiadomości teoretyczne W wielu dziedzinach nauki i techniki spotykamy się z problemem
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 1 CHROMATOGRAFIA BARWNIKÓW ROŚLINNYCH I. Wiadomości teoretyczne W wielu dziedzinach nauki i techniki spotykamy się z problemem
Inżynieria Środowiska
 ROZTWORY BUFOROWE Roztworami buforowymi nazywamy takie roztwory, w których stężenie jonów wodorowych nie ulega większym zmianom ani pod wpływem rozcieńczania wodą, ani pod wpływem dodatku nieznacznych
ROZTWORY BUFOROWE Roztworami buforowymi nazywamy takie roztwory, w których stężenie jonów wodorowych nie ulega większym zmianom ani pod wpływem rozcieńczania wodą, ani pod wpływem dodatku nieznacznych
ELEKTROFOREZA KOLOIDÓW
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW ELEKTROFOREZA KOLOIDÓW Opiekun ćwiczenia: Sylwia Golba Miejsce ćwiczenia: Zakład Chemii Fizycznej ul. M. Strzody 9, p.
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW ELEKTROFOREZA KOLOIDÓW Opiekun ćwiczenia: Sylwia Golba Miejsce ćwiczenia: Zakład Chemii Fizycznej ul. M. Strzody 9, p.
LABORATORIUM Z PODSTAW BIOFIZYKI ĆWICZENIE NR 4 1. CEL ĆWICZENIA
 1. CEL ĆWICZENIA Pomiar potencjału dyfuzyjnego roztworów o różnych stężeniach jonów oddzielonych membranami: półprzepuszczalną i jonoselektywną w funkcji ich stężenia. Wykorzystanie równania Nernsta do
1. CEL ĆWICZENIA Pomiar potencjału dyfuzyjnego roztworów o różnych stężeniach jonów oddzielonych membranami: półprzepuszczalną i jonoselektywną w funkcji ich stężenia. Wykorzystanie równania Nernsta do
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph
 Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Temat 7. Równowagi jonowe w roztworach słabych elektrolitów, stała dysocjacji, ph Dysocjacja elektrolitów W drugiej połowie XIX wieku szwedzki chemik S.A. Arrhenius doświadczalnie udowodnił, że substancje
Podstawy fizyki wykład 8
 Podstawy fizyki wykład 8 Dr Piotr Sitarek Instytut Fizyki, Politechnika Wrocławska Ładunek elektryczny Grecy ok. 600 r p.n.e. odkryli, że bursztyn potarty o wełnę przyciąga inne (drobne) przedmioty. słowo
Podstawy fizyki wykład 8 Dr Piotr Sitarek Instytut Fizyki, Politechnika Wrocławska Ładunek elektryczny Grecy ok. 600 r p.n.e. odkryli, że bursztyn potarty o wełnę przyciąga inne (drobne) przedmioty. słowo
ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH. µ = ν / E ELEKTROFOREZA
 ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem przyłożonej zewnętrznie różnicy potencjałów
ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem przyłożonej zewnętrznie różnicy potencjałów
Pytania z Wysokosprawnej chromatografii cieczowej
 Pytania z Wysokosprawnej chromatografii cieczowej 1. Jak wpłynie 50% dodatek MeOH do wody na retencję kwasu propionowego w układzie faz odwróconych? 2. Jaka jest kolejność retencji kwasów mrówkowego, octowego
Pytania z Wysokosprawnej chromatografii cieczowej 1. Jak wpłynie 50% dodatek MeOH do wody na retencję kwasu propionowego w układzie faz odwróconych? 2. Jaka jest kolejność retencji kwasów mrówkowego, octowego
Techniki immunochemiczne. opierają się na specyficznych oddziaływaniach między antygenami a przeciwciałami
 Techniki immunochemiczne opierają się na specyficznych oddziaływaniach między antygenami a przeciwciałami Oznaczanie immunochemiczne RIA - ( ang. Radio Immuno Assay) techniki radioimmunologiczne EIA -
Techniki immunochemiczne opierają się na specyficznych oddziaływaniach między antygenami a przeciwciałami Oznaczanie immunochemiczne RIA - ( ang. Radio Immuno Assay) techniki radioimmunologiczne EIA -
ĆWICZENIE 3: CHROMATOGRAFIA PLANARNA
 ĆWICZENIE 3: CHROMATOGRAFIA PLANARNA Chromatografia jest to metoda chemicznej analizy instrumentalnej, w której dokonuje się podziału substancji (w przeciwprądzie) między fazę nieruchomą i fazę ruchomą.
ĆWICZENIE 3: CHROMATOGRAFIA PLANARNA Chromatografia jest to metoda chemicznej analizy instrumentalnej, w której dokonuje się podziału substancji (w przeciwprądzie) między fazę nieruchomą i fazę ruchomą.
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA. Wykład 2
 PODSTAWY CEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszczalnik Zjawisko dysocjacji Równowaga w roztworach elektrolitów i co z tego wynika Bufory ydroliza soli Roztwory (wodne)-
PODSTAWY CEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszczalnik Zjawisko dysocjacji Równowaga w roztworach elektrolitów i co z tego wynika Bufory ydroliza soli Roztwory (wodne)-
Akademickie Centrum Czystej Energii. Ogniwo paliwowe
 Ogniwo paliwowe 1. Zagadnienia elektroliza, prawo Faraday a, pierwiastki galwaniczne, ogniwo paliwowe 2. Opis Główną częścią ogniwa paliwowego PEM (Proton Exchange Membrane) jest membrana złożona z katody
Ogniwo paliwowe 1. Zagadnienia elektroliza, prawo Faraday a, pierwiastki galwaniczne, ogniwo paliwowe 2. Opis Główną częścią ogniwa paliwowego PEM (Proton Exchange Membrane) jest membrana złożona z katody
I BIOTECHNOLOGIA. 3-letnie studia stacjonarne I stopnia
 I BIOTECHNOLOGIA 3-letnie studia stacjonarne I stopnia PRZEDMIOT: CHEMIA OGÓLNA Z ELEMENTAMI CHEMII FIZYCZNEJ Ćwiczenia laboratoryjne semestr pierwszy 30 godz. Program ćwiczeń laboratoryjnych będzie realizowany
I BIOTECHNOLOGIA 3-letnie studia stacjonarne I stopnia PRZEDMIOT: CHEMIA OGÓLNA Z ELEMENTAMI CHEMII FIZYCZNEJ Ćwiczenia laboratoryjne semestr pierwszy 30 godz. Program ćwiczeń laboratoryjnych będzie realizowany
Mechanizm działania buforów *
 Mechanizm działania buforów * UNIWERSYTET PRZYRODNICZY Z doświadczenia nabytego w laboratorium wiemy, że dodanie kropli stężonego kwasu do 10 ml wody powoduje gwałtowny spadek ph o kilka jednostek. Tymczasem
Mechanizm działania buforów * UNIWERSYTET PRZYRODNICZY Z doświadczenia nabytego w laboratorium wiemy, że dodanie kropli stężonego kwasu do 10 ml wody powoduje gwałtowny spadek ph o kilka jednostek. Tymczasem
dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K
![dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K dla której jest spełniony warunek równowagi: [H + ] [X ] / [HX] = K](/thumbs/55/36391740.jpg) RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
RÓWNOWAGI W ROZTWORACH Szwedzki chemik Svante Arrhenius w 1887 roku jako pierwszy wykazał, że procesowi rozpuszczania wielu substancji towarzyszy dysocjacja, czyli rozpad cząsteczek na jony naładowane
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak)
 Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Roztwory buforowe (bufory) (opracowanie: dr Katarzyna Makyła-Juzak) 1. Właściwości roztworów buforowych Dodatek nieznacznej ilości mocnego kwasu lub mocnej zasady do czystej wody powoduje stosunkowo dużą
Badanie rozkładu pola elektrycznego
 Ćwiczenie 8 Badanie rozkładu pola elektrycznego 8.1. Zasada ćwiczenia W wannie elektrolitycznej umieszcza się dwie metalowe elektrody, połączone ze źródłem zmiennego napięcia. Kształt przekrojów powierzchni
Ćwiczenie 8 Badanie rozkładu pola elektrycznego 8.1. Zasada ćwiczenia W wannie elektrolitycznej umieszcza się dwie metalowe elektrody, połączone ze źródłem zmiennego napięcia. Kształt przekrojów powierzchni
Laboratorium z Konwersji Energii. Ogniwo Paliwowe PEM
 Laboratorium z Konwersji Energii Ogniwo Paliwowe PEM 1.0 WSTĘP Ogniwo paliwowe typu PEM (ang. PEM FC) Ogniwa paliwowe są urządzeniami elektro chemicznymi, stanowiącymi przełom w dziedzinie źródeł energii,
Laboratorium z Konwersji Energii Ogniwo Paliwowe PEM 1.0 WSTĘP Ogniwo paliwowe typu PEM (ang. PEM FC) Ogniwa paliwowe są urządzeniami elektro chemicznymi, stanowiącymi przełom w dziedzinie źródeł energii,
LABORATORIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE. Ćwiczenie nr 2 Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.
 LABOATOIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE Ćwiczenie nr Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.. Wprowadzenie Proces rozpadu drobin związków chemicznych
LABOATOIUM FIZYKI PAŃSTWOWEJ WYŻSZEJ SZKOŁY ZAWODOWEJ W NYSIE Ćwiczenie nr Temat: Wyznaczenie współczynnika elektrochemicznego i stałej Faradaya.. Wprowadzenie Proces rozpadu drobin związków chemicznych
Badanie rozkładu pola elektrycznego
 Ćwiczenie 8 Badanie rozkładu pola elektrycznego 8.1. Zasada ćwiczenia W wannie elektrolitycznej umieszcza się dwie metalowe elektrody, połączone ze źródłem zmiennego napięcia. Kształt przekrojów powierzchni
Ćwiczenie 8 Badanie rozkładu pola elektrycznego 8.1. Zasada ćwiczenia W wannie elektrolitycznej umieszcza się dwie metalowe elektrody, połączone ze źródłem zmiennego napięcia. Kształt przekrojów powierzchni
Badanie własności hallotronu, wyznaczenie stałej Halla (E2)
 Badanie własności hallotronu, wyznaczenie stałej Halla (E2) 1. Wymagane zagadnienia - ruch ładunku w polu magnetycznym, siła Lorentza, pole elektryczne - omówić zjawisko Halla, wyprowadzić wzór na napięcie
Badanie własności hallotronu, wyznaczenie stałej Halla (E2) 1. Wymagane zagadnienia - ruch ładunku w polu magnetycznym, siła Lorentza, pole elektryczne - omówić zjawisko Halla, wyprowadzić wzór na napięcie
Potencjometryczna metoda oznaczania chlorków w wodach i ściekach z zastosowaniem elektrody jonoselektywnej
 Potencjometryczna metoda oznaczania chlorków w wodach i ściekach z zastosowaniem elektrody jonoselektywnej opracowanie: dr Jadwiga Zawada Cel ćwiczenia: poznanie podstaw teoretycznych i praktycznych metody
Potencjometryczna metoda oznaczania chlorków w wodach i ściekach z zastosowaniem elektrody jonoselektywnej opracowanie: dr Jadwiga Zawada Cel ćwiczenia: poznanie podstaw teoretycznych i praktycznych metody
Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali
 Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali Wymagane wiadomości Podstawy korozji elektrochemicznej, wykresy E-pH. Wprowadzenie Główną przyczyną zniszczeń materiałów metalicznych
Ćwiczenie 1: Wyznaczanie warunków odporności, korozji i pasywności metali Wymagane wiadomości Podstawy korozji elektrochemicznej, wykresy E-pH. Wprowadzenie Główną przyczyną zniszczeń materiałów metalicznych
TWARDOŚĆ WODY. Ca(HCO 3 ) HCl = CaCl 2 + 2H 2 O + 2CO 2. Mg(HCO 3 ) 2 + 2HCl = MgCl 2 + 2H 2 O + 2CO 2
 TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
ANALIZA I OCZYSZCZANIE BIAŁEK
 Ćwiczenie 3 ANALIZA I CZYSZCZANIE BIAŁEK Część doświadczalna obejmuje: rozdział białek zawartych w surowicy krwi metodą elektroforezy w żelu agarozowym rozdział hemoglobiny od chromianu potasu metodą sączenia
Ćwiczenie 3 ANALIZA I CZYSZCZANIE BIAŁEK Część doświadczalna obejmuje: rozdział białek zawartych w surowicy krwi metodą elektroforezy w żelu agarozowym rozdział hemoglobiny od chromianu potasu metodą sączenia
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU ELEKTROFOREZA
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU ELEKTROFOREZA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU ELEKTROFOREZA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
WOJSKOWA AKADEMIA TECHNICZNA Wydział Mechaniczny Katedra Pojazdów Mechanicznych i Transportu LABORATORIUM TERMODYNAMIKI TECHNICZNEJ
 WOJSKOWA AKADEMIA TECHNICZNA Wydział Mechaniczny Katedra Pojazdów Mechanicznych i Transportu LABORATORIUM TERMODYNAMIKI TECHNICZNEJ Instrukcja do ćwiczenia T-06 Temat: Wyznaczanie zmiany entropii ciała
WOJSKOWA AKADEMIA TECHNICZNA Wydział Mechaniczny Katedra Pojazdów Mechanicznych i Transportu LABORATORIUM TERMODYNAMIKI TECHNICZNEJ Instrukcja do ćwiczenia T-06 Temat: Wyznaczanie zmiany entropii ciała
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
WYKAZ NAJWAŻNIEJSZYCH SYMBOLI
 SPIS TREŚCI WYKAZ NAJWAŻNIEJSZYCH SYMBOLI...7 PRZEDMOWA...8 1. WSTĘP...9 2. MATEMATYCZNE OPRACOWANIE WYNIKÓW POMIARÓW...10 3. LEPKOŚĆ CIECZY...15 3.1. Pomiar lepkości...16 3.2. Lepkość względna...18 3.3.
SPIS TREŚCI WYKAZ NAJWAŻNIEJSZYCH SYMBOLI...7 PRZEDMOWA...8 1. WSTĘP...9 2. MATEMATYCZNE OPRACOWANIE WYNIKÓW POMIARÓW...10 3. LEPKOŚĆ CIECZY...15 3.1. Pomiar lepkości...16 3.2. Lepkość względna...18 3.3.
Wrocław dn. 22 listopada 2005 roku. Temat lekcji: Elektroliza roztworów wodnych.
 Piotr Chojnacki IV rok, informatyka chemiczna Liceum Ogólnokształcące Nr I we Wrocławiu Wrocław dn. 22 listopada 2005 roku Temat lekcji: Elektroliza roztworów wodnych. Cel ogólny lekcji: Wprowadzenie pojęcia
Piotr Chojnacki IV rok, informatyka chemiczna Liceum Ogólnokształcące Nr I we Wrocławiu Wrocław dn. 22 listopada 2005 roku Temat lekcji: Elektroliza roztworów wodnych. Cel ogólny lekcji: Wprowadzenie pojęcia
Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu. (na prawach rękopisu)
 Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu (na prawach rękopisu) W analityce procesowej istotne jest określenie stężeń rozpuszczonych w cieczach gazów. Gazy rozpuszczają się w cieczach
Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu (na prawach rękopisu) W analityce procesowej istotne jest określenie stężeń rozpuszczonych w cieczach gazów. Gazy rozpuszczają się w cieczach
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
POLITECHNIKA WARSZAWSKA WYDZIAŁ ELEKTRYCZNY. PRACOWNIA MATERIAŁOZNAWSTWA ELEKTROTECHNICZNEGO KWNiAE
 POLITECHNIK WRSZWSK WYDZIŁ ELEKTRYCZNY PRCOWNI MTERIŁOZNWSTW ELEKTROTECHNICZNEGO KWNiE ĆWICZENIE 11 WYZNCZNIE ELEKTROCHEMICZNEGO RÓWNOWśNIK MIEDZI ORZ STŁEJ FRDY 1. Elektrolity i przewodnictwo jonowe Ogólnie
POLITECHNIK WRSZWSK WYDZIŁ ELEKTRYCZNY PRCOWNI MTERIŁOZNWSTW ELEKTROTECHNICZNEGO KWNiE ĆWICZENIE 11 WYZNCZNIE ELEKTROCHEMICZNEGO RÓWNOWśNIK MIEDZI ORZ STŁEJ FRDY 1. Elektrolity i przewodnictwo jonowe Ogólnie
ZAKŁAD CHEMII ANALITYCZNEJ
 ZAKŁAD CHEMII ANALITYCZNEJ Chemia analityczna I E 105 30 75 II 8 Chemia analityczna II E 105 30 75 III 7 Chromatografia II Zal/o 30 30 2 Elektroanaliza I Zal/o 45 15 30 285 105 180 Chemia analityczna I
ZAKŁAD CHEMII ANALITYCZNEJ Chemia analityczna I E 105 30 75 II 8 Chemia analityczna II E 105 30 75 III 7 Chromatografia II Zal/o 30 30 2 Elektroanaliza I Zal/o 45 15 30 285 105 180 Chemia analityczna I
Zestaw do doświadczeń z elektrochemii [ BAP_ doc ]
![Zestaw do doświadczeń z elektrochemii [ BAP_ doc ] Zestaw do doświadczeń z elektrochemii [ BAP_ doc ]](/thumbs/95/124630492.jpg) Zestaw do doświadczeń z elektrochemii [ BAP_1008057.doc ] [strona 1] Opis doświadczeń / instrukcja obsługi Zestaw Elektrochemia Strona 1 z 8 [strona 2] Zestaw Elektrochemia Nr artykułu: 51901 Spis treści
Zestaw do doświadczeń z elektrochemii [ BAP_1008057.doc ] [strona 1] Opis doświadczeń / instrukcja obsługi Zestaw Elektrochemia Strona 1 z 8 [strona 2] Zestaw Elektrochemia Nr artykułu: 51901 Spis treści
CHROMATOGRAFIA ADSORPCYJNA I PODZIAŁOWA. 1. Rozdział barwników roślinnych metodą chromatografii adsorpcyjnej (techniką kolumnową)
 Ćwiczenie nr 7 CHROMATOGRAFIA ADSORPCYJNA I PODZIAŁOWA 1. Rozdział barwników roślinnych metodą chromatografii adsorpcyjnej (techniką kolumnową) Zasada: Barwniki roślinne charakteryzują się różnym powinowactwem
Ćwiczenie nr 7 CHROMATOGRAFIA ADSORPCYJNA I PODZIAŁOWA 1. Rozdział barwników roślinnych metodą chromatografii adsorpcyjnej (techniką kolumnową) Zasada: Barwniki roślinne charakteryzują się różnym powinowactwem
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI Pracownia studencka Katedry Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 2 Oznaczanie benzoesanu denatonium w skażonym alkoholu etylowym metodą wysokosprawnej
UNIWERSYTET GDAŃSKI Pracownia studencka Katedry Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 2 Oznaczanie benzoesanu denatonium w skażonym alkoholu etylowym metodą wysokosprawnej
ĆWICZENIE 2 KONDUKTOMETRIA
 ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
TEST NA EGZAMIN POPRAWKOWY Z CHEMII DLA UCZNIA KLASY II GIMNAZJUM
 TEST NA EGZAMIN PPRAWKWY Z CHEMII DLA UCZNIA KLASY II GIMNAZJUM I. Część pisemna: 1. Które z poniższych stwierdzeń jest fałszywe? a.) Kwasy są to związki chemiczne zbudowane z wodoru i reszty kwasowej.
TEST NA EGZAMIN PPRAWKWY Z CHEMII DLA UCZNIA KLASY II GIMNAZJUM I. Część pisemna: 1. Które z poniższych stwierdzeń jest fałszywe? a.) Kwasy są to związki chemiczne zbudowane z wodoru i reszty kwasowej.
Wyznaczanie sił działających na przewodnik z prądem w polu magnetycznym
 Ćwiczenie 11A Wyznaczanie sił działających na przewodnik z prądem w polu magnetycznym 11A.1. Zasada ćwiczenia W ćwiczeniu mierzy się przy pomocy wagi siłę elektrodynamiczną, działającą na odcinek przewodnika
Ćwiczenie 11A Wyznaczanie sił działających na przewodnik z prądem w polu magnetycznym 11A.1. Zasada ćwiczenia W ćwiczeniu mierzy się przy pomocy wagi siłę elektrodynamiczną, działającą na odcinek przewodnika
Polarografia jest metodą elektroanalityczną, w której bada się zależność natężenia prądu płynącego przez badany roztwór w funkcji przyłożonego do
 Polarografia Polarografia jest metodą elektroanalityczną, w której bada się zależność natężenia prądu płynącego przez badany roztwór w funkcji przyłożonego do elektrod napięcia lub w funkcji potencjału
Polarografia Polarografia jest metodą elektroanalityczną, w której bada się zależność natężenia prądu płynącego przez badany roztwór w funkcji przyłożonego do elektrod napięcia lub w funkcji potencjału
Efekt Halla. Cel ćwiczenia. Wstęp. Celem ćwiczenia jest zbadanie efektu Halla. Siła Loretza
 Efekt Halla Cel ćwiczenia Celem ćwiczenia jest zbadanie efektu Halla. Wstęp Siła Loretza Na ładunek elektryczny poruszający się w polu magnetycznym w kierunku prostopadłym do linii pola magnetycznego działa
Efekt Halla Cel ćwiczenia Celem ćwiczenia jest zbadanie efektu Halla. Wstęp Siła Loretza Na ładunek elektryczny poruszający się w polu magnetycznym w kierunku prostopadłym do linii pola magnetycznego działa
ĆWICZENIA LABORATORYJNE Z CHEMII FIZYCZNEJ
 SKRYPTY DLA SZKÓŁ WYŻSZYCH POLITECHNIKA ŁÓDZKA Praca zbiorowa ĆWICZENIA LABORATORYJNE Z CHEMII FIZYCZNEJ DLA STUDENTÓW WYDZIAŁU INŻYNIERII CHEMICZNEJ I OCHRONY ŚRODOWISKA Wydanie II poprawione ŁÓDŹ 2006
SKRYPTY DLA SZKÓŁ WYŻSZYCH POLITECHNIKA ŁÓDZKA Praca zbiorowa ĆWICZENIA LABORATORYJNE Z CHEMII FIZYCZNEJ DLA STUDENTÓW WYDZIAŁU INŻYNIERII CHEMICZNEJ I OCHRONY ŚRODOWISKA Wydanie II poprawione ŁÓDŹ 2006
EFEKT SOLNY BRÖNSTEDA
 EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH
 ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH Instrukcja wykonana w Katedrze Chemii Środowiska ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem
ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH Instrukcja wykonana w Katedrze Chemii Środowiska ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem
PORÓWNANIE FAZ STACJONARNYCH STOSOWANYCH W HPLC
 PORÓWNANIE FAZ STACJONARNYCH STOSOWANYCH W HPLC Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego 1. Wstęp Chromatografia jest techniką umożliwiającą rozdzielanie składników
PORÓWNANIE FAZ STACJONARNYCH STOSOWANYCH W HPLC Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego 1. Wstęp Chromatografia jest techniką umożliwiającą rozdzielanie składników
HYDROLIZA SOLI. 1. Hydroliza soli mocnej zasady i słabego kwasu. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
n liczba moli elektronów E siła elektromotoryczna ogniwa F = en A stała Faradaya C/mol
 Zmiana entalpii swobodnej G podczas reakcji w której zachodzi przepływ elektronów jest pracą nieobjętościową i może być wyrażona jako iloczyn napięcie i ładunku. na przykład procesy oksydo-redukcyjne zachodzące
Zmiana entalpii swobodnej G podczas reakcji w której zachodzi przepływ elektronów jest pracą nieobjętościową i może być wyrażona jako iloczyn napięcie i ładunku. na przykład procesy oksydo-redukcyjne zachodzące
CHROMATOGRAFIA W UKŁADACH FAZ ODWRÓCONYCH RP-HPLC
 CHROMATOGRAFIA W UKŁADACH FAZ ODWRÓCONYCH RP-HPLC MK-EG-AS Wydział Chemiczny Politechniki Gdańskiej Gdańsk 2009 Chromatograficzne układy faz odwróconych (RP) Potocznie: Układy chromatograficzne, w których
CHROMATOGRAFIA W UKŁADACH FAZ ODWRÓCONYCH RP-HPLC MK-EG-AS Wydział Chemiczny Politechniki Gdańskiej Gdańsk 2009 Chromatograficzne układy faz odwróconych (RP) Potocznie: Układy chromatograficzne, w których
Laboratorium Podstaw Biofizyki Pomiar potencjału dyfuzyjnego i błonowego 4
 CEL ĆWICZENIA Pomiar potencjału dyfuzyjnego roztworów o różnych stężeniach jonów oddzielonych membranami: półprzepuszczalną i jonoselektywną w funkcji ich stężenia. Wykorzystanie równania Nernsta do wyznaczenia
CEL ĆWICZENIA Pomiar potencjału dyfuzyjnego roztworów o różnych stężeniach jonów oddzielonych membranami: półprzepuszczalną i jonoselektywną w funkcji ich stężenia. Wykorzystanie równania Nernsta do wyznaczenia
Badanie właściwości związków powierzchniowo czynnych
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ ORGANICZNEJ I PETROCHEMII INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH: Badanie właściwości związków powierzchniowo czynnych Laboratorium z
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ ORGANICZNEJ I PETROCHEMII INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH: Badanie właściwości związków powierzchniowo czynnych Laboratorium z
Spis treści. Wstęp... 9
 Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Spis treści Wstęp... 9 1. Szkło i sprzęt laboratoryjny 1.1. Szkła laboratoryjne własności, skład chemiczny, podział, zastosowanie.. 11 1.2. Wybrane szkło laboratoryjne... 13 1.3. Szkło miarowe... 14 1.4.
Ćwiczenie 25. Piotr Skołuda OGNIWA STĘŻENIOWE
 Ćwiczenie 25 Piotr Skołuda OGNIWA STĘŻENIOWE Zagadnienia: Ogniwa stężeniowe z przenoszeniem i bez przenoszenia jonów. Ogniwa chemiczne, ze szczególnym uwzględnieniem ogniw wykorzystywanych w praktyce jako
Ćwiczenie 25 Piotr Skołuda OGNIWA STĘŻENIOWE Zagadnienia: Ogniwa stężeniowe z przenoszeniem i bez przenoszenia jonów. Ogniwa chemiczne, ze szczególnym uwzględnieniem ogniw wykorzystywanych w praktyce jako
Ekstrakcja. Seminarium 7. 23/11/2015
 Ekstrakcja Seminarium 7. Prawo podziału Nernsta Jeżeli do układu złożonego z dwóch praktycznie niemieszających się cieczy wprowadzimy trzeci składnik, rozpuszczający się w obu cieczach, to w wyniku ustalenia
Ekstrakcja Seminarium 7. Prawo podziału Nernsta Jeżeli do układu złożonego z dwóch praktycznie niemieszających się cieczy wprowadzimy trzeci składnik, rozpuszczający się w obu cieczach, to w wyniku ustalenia
Ilościowa analiza mieszaniny alkoholi techniką GC/FID
 Ilościowa analiza mieszaniny alkoholi techniką GC/FID WPROWADZENIE Pojęcie chromatografii obejmuje grupę metod separacji substancji, w których występują diw siły: siła powodująca ruch cząsteczek w określonym
Ilościowa analiza mieszaniny alkoholi techniką GC/FID WPROWADZENIE Pojęcie chromatografii obejmuje grupę metod separacji substancji, w których występują diw siły: siła powodująca ruch cząsteczek w określonym
Zad: 5 Oblicz stężenie niezdysocjowanego kwasu octowego w wodnym roztworze o stężeniu 0,1 mol/dm 3, jeśli ph tego roztworu wynosi 3.
 Zad: 1 Oblicz wartość ph dla 0,001 molowego roztworu HCl Zad: 2 Oblicz stężenie jonów wodorowych jeżeli wartość ph wynosi 5 Zad: 3 Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H 2 SO
Zad: 1 Oblicz wartość ph dla 0,001 molowego roztworu HCl Zad: 2 Oblicz stężenie jonów wodorowych jeżeli wartość ph wynosi 5 Zad: 3 Oblicz stężenie jonów wodorotlenkowych w 0,05 molowym roztworze H 2 SO
Elektroliza - rozkład wody, wydzielanie innych gazów. i pokrycia galwaniczne.
 1 Elektroliza - rozkład wody, wydzielanie innych gazów i pokrycia galwaniczne. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - elektroliza, - elektrody, - katoda, - anoda, - potencjał ujemny, - potencjał
1 Elektroliza - rozkład wody, wydzielanie innych gazów i pokrycia galwaniczne. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - elektroliza, - elektrody, - katoda, - anoda, - potencjał ujemny, - potencjał
NAGRZEWANIE ELEKTRODOWE
 INSTYTUT INFORMATYKI STOSOWANEJ POLITECHNIKI ŁÓDZKIEJ Ćwiczenia Nr 7 NAGRZEWANIE ELEKTRODOWE 1.WPROWADZENIE. Nagrzewanie elektrodowe jest to nagrzewanie elektryczne oparte na wydzielaniu, ciepła przy przepływie
INSTYTUT INFORMATYKI STOSOWANEJ POLITECHNIKI ŁÓDZKIEJ Ćwiczenia Nr 7 NAGRZEWANIE ELEKTRODOWE 1.WPROWADZENIE. Nagrzewanie elektrodowe jest to nagrzewanie elektryczne oparte na wydzielaniu, ciepła przy przepływie
Scenariusz lekcji chemii w klasie III gimnazjum. Temat lekcji: Białka skład pierwiastkowy, budowa, właściwości i reakcje charakterystyczne
 Scenariusz lekcji chemii w klasie III gimnazjum Temat lekcji: Białka skład pierwiastkowy, budowa, właściwości i reakcje charakterystyczne Czas trwania lekcji: 2x 45 minut Cele lekcji: 1. Ogólny zapoznanie
Scenariusz lekcji chemii w klasie III gimnazjum Temat lekcji: Białka skład pierwiastkowy, budowa, właściwości i reakcje charakterystyczne Czas trwania lekcji: 2x 45 minut Cele lekcji: 1. Ogólny zapoznanie
Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej
 Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej WPROWADZENIE Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną techniką analityczną, stosowaną
Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej WPROWADZENIE Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną techniką analityczną, stosowaną
STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI
 Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Ćwiczenie 8 Semestr 2 STĘŻENIE JONÓW WODOROWYCH. DYSOCJACJA JONOWA. REAKTYWNOŚĆ METALI Obowiązujące zagadnienia: Stężenie jonów wodorowych: ph, poh, iloczyn jonowy wody, obliczenia rachunkowe, wskaźniki
Wyznaczanie parametrów równania Tafela w katodowym wydzielaniu metali na elektrodzie platynowej
 Ćwiczenie 2. Wyznaczanie parametrów równania Tafela w katodowym wydzielaniu metali na elektrodzie platynowej 1. Przygotowanie do wykonania ćwiczenia. 1.1. Włączyć zasilacz potencjostatu i nastawić go na
Ćwiczenie 2. Wyznaczanie parametrów równania Tafela w katodowym wydzielaniu metali na elektrodzie platynowej 1. Przygotowanie do wykonania ćwiczenia. 1.1. Włączyć zasilacz potencjostatu i nastawić go na
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 WARTOŚĆ ph ROZTWORÓW WODNYCH WSTĘP 1. Wartość ph wody i roztworów Woda dysocjuje na jon wodorowy i wodorotlenowy: H 2 O H + + OH (1) Stała równowagi tej reakcji, K D : wyraża się wzorem: K D = + [ Η ][
WARTOŚĆ ph ROZTWORÓW WODNYCH WSTĘP 1. Wartość ph wody i roztworów Woda dysocjuje na jon wodorowy i wodorotlenowy: H 2 O H + + OH (1) Stała równowagi tej reakcji, K D : wyraża się wzorem: K D = + [ Η ][
NA ŻELU POLIAKRYLAMIDOWYM
 Z48 ELEKTROFOREZA BIAŁEK NA ŻELU POLIAKRYLAMIDOWYM Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako
Z48 ELEKTROFOREZA BIAŁEK NA ŻELU POLIAKRYLAMIDOWYM Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Celem ćwiczenia jest wyznaczenie charakterystyki prądowo- napięciowej elektrolizera typu PEM,
 Ćw.2 Elektroliza wody za pomocą ogniwa paliwowego typu PEM Celem ćwiczenia jest wyznaczenie charakterystyki prądowo- napięciowej elektrolizera typu PEM, A także określenie wydajności tego urządzenia, jeśli
Ćw.2 Elektroliza wody za pomocą ogniwa paliwowego typu PEM Celem ćwiczenia jest wyznaczenie charakterystyki prądowo- napięciowej elektrolizera typu PEM, A także określenie wydajności tego urządzenia, jeśli
Chemia I Semestr I (1 )
 1/ 6 Inżyniera Materiałowa Chemia I Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr inż. Maciej Walewski. 2/ 6 Wykład Program 1. Atomy i cząsteczki: Materia, masa, energia. Cząstki elementarne. Atom,
1/ 6 Inżyniera Materiałowa Chemia I Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr inż. Maciej Walewski. 2/ 6 Wykład Program 1. Atomy i cząsteczki: Materia, masa, energia. Cząstki elementarne. Atom,
( L ) I. Zagadnienia. II. Zadania
 ( L ) I. Zagadnienia 1. Promieniowanie X w diagnostyce medycznej powstawanie, właściwości, prawo osłabienia. 2. Metody obrazowania naczyń krwionośnych. 3. Angiografia subtrakcyjna. II. Zadania 1. Wykonanie
( L ) I. Zagadnienia 1. Promieniowanie X w diagnostyce medycznej powstawanie, właściwości, prawo osłabienia. 2. Metody obrazowania naczyń krwionośnych. 3. Angiografia subtrakcyjna. II. Zadania 1. Wykonanie
Klasyfikacja procesów membranowych. Magdalena Bielecka Agnieszka Janus
 Klasyfikacja procesów membranowych Magdalena Bielecka Agnieszka Janus 1 Co to jest membrana Jest granica pozwalająca na kontrolowany transport jednego lub wielu składników z mieszanin ciał stałych, ciekłych
Klasyfikacja procesów membranowych Magdalena Bielecka Agnieszka Janus 1 Co to jest membrana Jest granica pozwalająca na kontrolowany transport jednego lub wielu składników z mieszanin ciał stałych, ciekłych
masy cząsteczkowej polimerów nisko i średnio polarnych, a także lipidów, fosfolipidów itp.. silanizowanyżel krzemionkowy
 CHROMATOGRAFIA WYKLUCZANIA (dawniej ŻELOWA PC/SEC) Układy chromatograficzne typu GPC / SEC 1. W warunkach nie-wodnych - eluenty: THF, dioksan, czerochloroetylen, chlorobenzen, ksylen; fazy stacjonarne:
CHROMATOGRAFIA WYKLUCZANIA (dawniej ŻELOWA PC/SEC) Układy chromatograficzne typu GPC / SEC 1. W warunkach nie-wodnych - eluenty: THF, dioksan, czerochloroetylen, chlorobenzen, ksylen; fazy stacjonarne:
Sporządzanie roztworów buforowych i badanie ich właściwości
 Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Jakościowa i ilościowa analiza mieszaniny alkoholi techniką chromatografii gazowej
 Jakościowa i ilościowa analiza mieszaniny alkoholi techniką chromatografii gazowej WPROWADZENIE Pojęcie chromatografii obejmuje grupę metod separacji substancji, w których występują diw siły: siła powodująca
Jakościowa i ilościowa analiza mieszaniny alkoholi techniką chromatografii gazowej WPROWADZENIE Pojęcie chromatografii obejmuje grupę metod separacji substancji, w których występują diw siły: siła powodująca
Roztwory elekreolitów
 Imię i nazwisko:... Roztwory elekreolitów Zadanie 1. (2pkt) W teorii Brönsteda sprzężoną parą kwas-zasada nazywa się układ złożony z kwasu oraz zasady, która powstaje z tego kwasu przez odłączenie protonu.
Imię i nazwisko:... Roztwory elekreolitów Zadanie 1. (2pkt) W teorii Brönsteda sprzężoną parą kwas-zasada nazywa się układ złożony z kwasu oraz zasady, która powstaje z tego kwasu przez odłączenie protonu.
RÓWNOWAGI KWASOWO-ZASADOWE W ROZTWORACH WODNYCH
 RÓWNOWAGI KWASOWO-ZASADOWE W ROZTWORACH WODNYCH Większość reakcji chemicznych (w tym również procesy zachodzące w środowisku naturalnym) przebiegają w roztworach wodnych. Jednym z ważnych typów reakcji
RÓWNOWAGI KWASOWO-ZASADOWE W ROZTWORACH WODNYCH Większość reakcji chemicznych (w tym również procesy zachodzące w środowisku naturalnym) przebiegają w roztworach wodnych. Jednym z ważnych typów reakcji
Dielektryki polaryzację dielektryka Dipole trwałe Dipole indukowane Polaryzacja kryształów jonowych
 Dielektryki Dielektryk- ciało gazowe, ciekłe lub stałe niebędące przewodnikiem prądu elektrycznego (ładunki elektryczne wchodzące w skład każdego ciała są w dielektryku związane ze sobą) Jeżeli do dielektryka
Dielektryki Dielektryk- ciało gazowe, ciekłe lub stałe niebędące przewodnikiem prądu elektrycznego (ładunki elektryczne wchodzące w skład każdego ciała są w dielektryku związane ze sobą) Jeżeli do dielektryka
Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Chemia - B udownictwo WS TiP
 Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Miareczkowanie kulometryczne
 KULOMETRIA Oznaczanie reduktorów metodą miareczkowania kulometrycznego amperostatycznego Dr Dorota Gugała-Fekner, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Wydział Chemii UMCS w Lublinie Materiały
KULOMETRIA Oznaczanie reduktorów metodą miareczkowania kulometrycznego amperostatycznego Dr Dorota Gugała-Fekner, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Wydział Chemii UMCS w Lublinie Materiały
ĆWICZENIE NR 4 PEHAMETRIA. Poznanie metod pomiaru odczynu roztworów wodnych kwasów, zasad i soli.
 ĆWICZENIE NR 4 PEHAMETRIA Cel ćwiczenia Poznanie metod pomiaru odczynu roztworów wodnych kwasów, zasad i soli. Zakres wymaganych wiadomości 1. Dysocjacja elektrolityczna.. Iloczyn jonowy wody.. Pojęcie
ĆWICZENIE NR 4 PEHAMETRIA Cel ćwiczenia Poznanie metod pomiaru odczynu roztworów wodnych kwasów, zasad i soli. Zakres wymaganych wiadomości 1. Dysocjacja elektrolityczna.. Iloczyn jonowy wody.. Pojęcie
Przewodnictwo elektryczne roztworów wodnych. - elektrolity i nieelektrolity.
 1 Przewodnictwo elektryczne roztworów wodnych - elektrolity i nieelektrolity. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - elektrolit, - nieelektrolit, - dysocjacja elektrolityczna, - prąd, - jony.
1 Przewodnictwo elektryczne roztworów wodnych - elektrolity i nieelektrolity. Czas trwania zajęć: 45 minut Pojęcia kluczowe: - elektrolit, - nieelektrolit, - dysocjacja elektrolityczna, - prąd, - jony.
Badanie rozkładu pola elektrycznego
 Ćwiczenie E1 Badanie rozkładu pola elektrycznego E1.1. Cel ćwiczenia Celem ćwiczenia jest zbadanie rozkładu pola elektrycznego dla różnych układów elektrod i ciał nieprzewodzących i przewodzących umieszczonych
Ćwiczenie E1 Badanie rozkładu pola elektrycznego E1.1. Cel ćwiczenia Celem ćwiczenia jest zbadanie rozkładu pola elektrycznego dla różnych układów elektrod i ciał nieprzewodzących i przewodzących umieszczonych
Próba kontrolna (PK) 1000 l 1000 l
 Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Chemia nieorganiczna Semestr I (1 )
 1/ 5 Chemia Budowlana Chemia nieorganiczna Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr hab. inż. Jarosław Chojnacki. 2/ 5 Wykład 1. Pochodzenie i rozpowszechnienie pierwiastków we wszechświecie
1/ 5 Chemia Budowlana Chemia nieorganiczna Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr hab. inż. Jarosław Chojnacki. 2/ 5 Wykład 1. Pochodzenie i rozpowszechnienie pierwiastków we wszechświecie
