Przemiany/Reakcje chemiczne
|
|
|
- Karolina Domańska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Przemiany/Reakcje chemiczne
2 Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych i chemicznych. Substancje wchodzące w reakcje chemiczne noszą nazwę substratów. Substancje, które powstają w czasie reakcji chemicznych noszą nazwę produktów. Równanie reakcji chemicznej - zapis przebiegu procesu chemicznego za pomocą symboli pierwiastków chemicznych i wzorów związków chemicznych. Równanie reakcji chemicznej jest bardzo podobne do zwykłego równania matematycznego.
3 REAKCJA CHEMICZNA Proces, w którym z cząsteczek, atomów lub jonów substancji wyjściowych (substratów) powstają cząsteczki, atomy lub jony produktów. A+ B = C+D substraty produkty
4 Typy reakcji chemicznych 1. Kierunek przemiany (syntezy, rozkładu,wymiany) 2. Efekt energetyczny ( egzo- oraz endotermiczne) 3. Liczba faz układu (homo- oraz heterogeniczne) 4. Przeniesienie elektronów (oksydacyjno-redukcyjne) 5. Charakter indywiduów chem. (jonowe, cząsteczkowe, rodnikowe) 6. Stan rownowagi (odwracalne oraz nieodwracalne) 7. Inne
5 Przemiany chemiczne rozpatruje się w dwóch aspektach: statycznym i kinetycznym Aspekt statyczny czyli zapis przemiany chemicznej w postaci równania z uwzględnieniem zależności molowych wynikających z podstawowych praw chemii, czyli prawa stałości składu i zachowania masy. Interpretacja kinetyczna dotyczy zagadnień związanych z przebiegiem reakcji, czyli jej szybkością, stanem równowagi reakcji i możliwością wpływania na przesunięcie równowagi reakcji. Równowaga statyczna to stan, w którym procesy chemiczne nie zachodzą, a stężenia reagentów nie zmieniają się w czasie. Równowaga dynamiczna to stan, w którym zachodzą przemiany chemiczne, jednak tyle samo substratów przechodzi w produkty, co produktów w substraty. W stanie równowagi dynamicznej szybkość reakcji danej oraz reakcji do niej przeciwnej są sobie równe, a stężenia reagentów ustalają się wówczas na stałym poziomie.
6 Reakcje odwracalne i nieodwracalne Teoretycznie prawie każda reakcja jest odwracalna jeśli zachodzi w odpowiednich warunkach. Reakcje w układach otwartych, w których jeden z produktów opuszcza środowisko reakcji są praktycznie nieodwracalne. Za reakcje nieodwracalne uważa się takie, w których co najmniej 99% substratów ulega przemianie. To, że reakcja jest nieodwracalna można przewidzieć za pomocą jej objawów, mianowicie: powstaje nierozpuszczalny produkt (wytrącenie osadu) wydziela się gaz powstaje słabo zdysocjowany produkt np. woda w reakcji zobojętniania Reakcje odwracalne - powstałe w reakcji produkty reagują z sobą odtwarzając substraty (reakcja odwrotna) W tego typu równaniach reakcji stosuje się strzałki dwustronne lub dwie strzałki o przeciwnych kierunkach. Reakcję biegnącą w prawo nazywa się prostą, zaś w lewo odwrotną.
7 Ta sama reakcja, w zależności od warunków jej prowadzenia może przebiegać w sposób odwracalny lub praktycznie nieodwracalny. W zwykłych warunkach iskra elektryczna inicjuje w mieszaninie wodoru i tlenu reakcję wybuchową syntezy wody: 2H2 O2 2H2O W temperaturze ok o C zachodzi reakcja odwrotna: 2H O 2H Przykłady reakcji praktycznie nieodwracalnych 2 2 O2 Reakcje jonowe przebiegające z wytrąceniem bardzo trudno rozpuszczalnego osadu np.; Ag Cl AgCl Niektóre reakcje syntezy: 2Mg O 2 2MgO Reakcje w których produktem jest gaz opuszczający środowisko reakcji: CaCO3 2HCl CaCl2 H2O CO2 Reakcje przebiegające z wytworzeniem produktu trudno dysocjującego: H2SO4 2NaOH Na 2SO4 2H2O
8 Ogólny zapis równania reakcji chemicznej Najczęściej substraty zapisujemy po lewej, a produkty po prawej stronie równania. Jeśli produkty reagują ze sobą, tworząc z powrotem substraty, to mówimy że reakcja jest odwracalna. Substraty i produkty to reagenty.
9 Zasady pisania reakcji chemicznych Lewa strona równania reakcji musi się równać stronie prawej - pod względem liczby poszczególnych pierwiastków -pod względem wypadkowego ładunku elektrycznego Fe OH - = Fe(OH) 3 Ładunek elektryczny strony lewej: +3 + (-3) = 0 Ładunek elektryczny strony prawej: 0 = 0 Ładunek elektryczny strony lewej = ładunkowi strony prawej 0=0 Strona lewa strona prawa Fe = 1 Fe = 1 O = 3 O = 3 H = 3 H = 3 L = P
10 W czasie reakcji spalania magnezu (rys.1), z dwóch substancji : tlenu, który jest bezbarwnym gazem i występuje w postaci cząsteczek dwuatomowych, magnezu, który jest metalem, barwy srebrzystoszarej, o stałym stanie skupienia i występuje w postaci atomowej, powstaje tlenek magnezu ciało stałe, barwy białej, zupełnie nie przypominające substancji wziętych do reakcji chemicznej. O 2 MgO Mg Rys. 1 Spalanie magnezu
11 Typy reakcji chemicznych: 1.Reakcja syntezy jest reakcją, w której z dwu lub kilku substancji prostszych powstaje jedna substancja bardziej złożona według schematu: Słowny opis przebiegu reakcji: azot + wodór amoniak Modelowe przedstawienie przemiany + H H H N N H H H H H N H H H H H H H N H Równanie reakcji chemicznej N H 2 2 NH 3
12 2. Reakcja analizy jest przemianą, w której z jednej substancji złożonej powstaje dwie lub kilka substancji prostszych. Analiza jest odwrotnością reakcji syntezy. Słowny opis przebiegu reakcji: tlenek magnezu Modelowe przedstawienie reakcji: magnez + tlen Mg O Mg + O O Mg O Mg Równanie reakcji chemicznej 2 MgO 2 Mg + O 2
13 3. Reakcja wymiany jest najczęściej spotykanym typem reakcji. W procesie tym następuje wymiana składników pomiędzy substancjami reagującymi. Wyróżnia się reakcje wymiany: pojedynczej, podwójnej. Wymiana pojedyncza A + BC Kierunek reakcji AC + B Zn + 2HCl ---> ZnCl 2 + H 2 Wymiana podwójna 2K + 2H 2 O ---> 2KOH + H 2 AB + CD Kierunek reakcji AC + BD MgSO 4 + Na 2 CO 3 ---> MgCO 3 + Na 2 SO 4 H 2 SO 4 + Ca(OH) 2 ---> CaSO 4 + 2H 2 O
14 Modelowe przedstawienie przebiegu reakcji wymiany pojedynczej Mg + H H Cl Cl Mg Cl Cl + H H Słowny zapis reakcji wymiany pojedynczej: magnez + chlorowodór chlorek magnezu + wodór Równanie chemiczne Mg + 2HCl MgCl 2 + H 2
15 Modelowe przedstawienie przebiegu reakcji wymiany podwójnej O H Mg + H O H H Cl Cl M g Cl Cl + O H H O H H Słowny zapis reakcji wymiany podwójnej: wodorotlenek magnezu + chlorowodór chlorek magnezu + woda Równanie chemiczne Mg(OH) 2 + 2HCl MgCl H 2 O
16 REAKCJE UTLENIANIA I REDUKCJI Szczególnym przypadkiem reakcji wymiany są reakcje utleniania i redukcji. Reakcja tlenku miedzi (II) z wodorem przebiega zgodnie ze schematem:
17 Schemat 1 W reakcji (schemat 1) wodór odebrał tlen z tlenku miedzi (II) i połączył się z nim tworząc tlenek wodoru, czyli wodę. Taka reakcja nosi nazwę reakcji utleniania- redukcji. Utlenianie to przyłączanie tlenu do pierwiastka chemicznego (wodór się utlenił). Proces odwrotny to redukcja, czyli odłączanie tlenu. Tlen został odłączony od miedzi, czyli miedź uległa redukcji.
18 Inne przykłady reakcji utleniania- redukcji Schemat 2 Podział reakcji chemicznych ze względu na zachowanie wobec tlenu Utlenianie reduktor nie zawiera tlenu i może go przyjąć Redukcja utleniacz ma tlen i może go oddać
19 Reakcje syntezy, analizy i wymiany krótkie podsumowanie Syntezy (łączenia) Wymiany pojedynczej A + B AB AB + C A + BC na przykład 2 Mg + O 2 2 MgO 2 substraty 1 produkt Mg + H 2 O MgO + H 2 2 substraty 2 produkty Analizy (rozkładu) AB A + B 2 Ag 2 O 4 Ag + O 2 1 substrat 2 produkty Wymiany podwójnej AB + CD AD + BC 2 NaOH + CusO 4 Na 2 SO 4 + Cu(OH) 2 2 substraty 2 produkty
20 W czasie reakcji chemicznych obserwujemy; powstawanie nowych cząstek (atomów, jonów lub cząsteczek) o innej strukturze niż cząstki wyjściowe, przebudowę wiązań chemicznych, przemianę jednych substancji w inne, o nowych właściwościach, efekty cieplne związane ze zmianą stanu energetycznego
21 Cechy reakcji chemicznych Prawo zachowania masy Przebieg w określonych stosunkach ilościowych i prawo stałości składu Określony efekt energetyczny Określona szybkość
22 A. Prawo zachowania masy W układzie zamkniętym masa substratów wchodzących w reakcję chemiczną równa jest masie jej produktów, czyli masa substancji biorących udział w reakcji chemicznej nie zmienia się. Jeżeli masy substratów A i B oznaczymy jako m A i m B, zaś masy produktów C i D jako m C i m D, to zachodzi równość: A B C D m A m Z prawem zachowania masy wiąże się konieczność bilansowania równań reakcji chemicznych, czyli dobierania współczynników stechiometrycznych w taki sposób, aby liczba (ilość moli) atomów danego pierwiastka po obu stronach równania była taka sama. B m C m D W świetle prawa równoważności masy i energii (E = mc 2 ) prawo zachowania masy nie jest ściśle spełnione. Jednakże podczas reakcji chemicznych wymieniane ilości energii są na tyle małe, że zmiana masy układu nie jest wykrywalna standardowymi metodami, stąd przyjmuje się stałość masy układu reakcyjnego.
23 B1. Stosunek ilościowy reagentów Substancje reagują ze sobą w ściśle określonym stosunku ilościowym zwanym stosunkiem stechiometrycznym Zasada stechiometrii: w reakcji chemicznej ilość jednego reagenta określa ilości wszytskich pozostałych reagentów
24 B2. Prawo stałości składu (prawo stałych stosunków wagowych) Stosunek ilości wagowych (mas) pierwiastków wchodzących w skład danego związku chemicznego jest zawsze stały i charakterystyczny dla tego związku. Wynika z niego że: - każdy związek chemiczny ma ściśle określony i zawsze stały skład chemiczny. -pierwiastki reagują ze sobą w ściśle określonych stosunkach mas ( stosunku wagowym). W przeciwieństwie do mieszanin fizycznych, które można sporządzić z różnych składników w dowolnych stosunkach wagowych, reakcje chemiczne przebiegają jedynie przy zachowaniu ściśle określonej proporcji substratów, a w związku chemicznym, który powstaje stosunki masowe składników są stałe. np. woda H 2 O H : O = 2 1u : 1 16u = 1 : 8, wodór i tlen występują w każdej próbce wody w stosunku wagowym 1 : 8, a to oznacza, że 1 gram wodoru i 8 gram tlenu łączą się z wytworzeniem 9 gramów wody.
25 Prosty przykład Równanie: NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O Kluczem do rozwiązania każdego równania jest następująca reguła: Liczba atomów pierwiastka X po prawej stronie równania jest taka sama jak liczba atomów pierwiastka X po stronie lewej.
26 Skorzystajmy ze znanego już nam równania: NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O Z poznanej przed chwilą reguły wynika, że: Liczba atomów sodu (Na) po prawej i po lewej stronie równania musi być taka sama Liczba atomów tlenu (O) po prawej i po lewej stronie równania musi być taka sama Liczba atomów wodoru (H) po prawej i po lewej stronie równania musi być taka sama Liczba atomów siarki (S) po prawej i po lewej stronie równania musi być taka sama Zauważmy, że powyższa reguła musi być spełniona przez wszystkie atomy biorące udział w reakcji!
27 Rozwiązanie krok po kroku NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O Lewa: 1 atom Na 5 atomów O 3 atomy H 1 atom S Prawa: 2 atomy Na 5 atomów O 2 atomy H 1 atom S 1. Rozpisujemy jakie i ile atomów znajduje się po każdej stronie równania. 2. Patrzymy liczba których atomów jest inna po prawej i lewej stronie równania sodu oraz wodoru
28 Rozwiązanie krok po kroku 2NaOH + H 2 SO 4 Na 2 SO 4 + H 2 O 3. Uzgadnianie stron rozpoczynamy od pierwiastków innych niż wodór i tlen w naszym przypadku jest to sód. Skoro po prawej stronie mamy 2 Na, a po lewej tylko 1, to przed NaOH dopisujemy 2. W efekcie po lewej stronie równania zmienia się nam także liczba atomów tlenu i wodoru: Lewa: 1 atom Na 5 atomów O 3 atomy H 1 atom S Lewa: 2 atomy Na 6 atomów O 4 atomy H 1 atom S Prawa: 2 atomy Na 5 atomów O 2 atomy H 1 atom S
29 Rozwiązanie krok po kroku 2NaOH + H 2 SO 4 Na 2 SO H 2 O Lewa: 2 atomy Na 6 atomów O 4 atomy H 1 atom S Prawa: 2 atomy Na 5 atomów O 2 atomy H 1 atom S 4. Uzgadniamy tleny. Po prawej mamy 5 atomów tlenu, po lewej 6, z czego wynika, że gdzieś po prawej stronie równania musimy dopisać 2. Pytanie brzmi gdzie? Postawienie 2 przed Na 2 SO 4 nie miałoby żadnego sensu, ponieważ zniszczylibyśmy przed chwileczką uzgodnioną liczbę atomów sodu. Z czego wynika, że 2 musimy postawić przed H 2 O i tak właśnie robimy.
30 Rozwiązanie krok po kroku 2NaOH + H 2 SO 4 Na 2 SO 4 + 2H 2 O Postawienie 2 przed cząsteczką H 2 O powoduje, że po prawej stronie równania zmienia się także liczba atomów wodoru: Lewa: 2 atomy Na 6 atomów O 4 atomy H 1 atom S Prawa: 2 atomy Na 5 atomów O 2 atomy H 1 atom S Prawa: 2 atomy Na 6 atomów O 4 atomy H 1 atom S 5. Uzgadniamy wodory w tym przypadku po uzgodnieniu liczby atomów tlenu automatycznie uzupełniliśmy także liczbę atomów wodoru. W EFEKCIE LEWA = PRAWA
31 Sprawdzenie W ten prosty sposób rozwiązaliśmy pierwsze równanie stechiometryczne 2NaOH + H 2 SO 4 Na 2 SO 4 + 2H 2 O Lewa: 2 atomy Na 6 atomów O 4 atomy H 1 atom S lewa = prawa Prawa: 2 atomy Na 6 atomów O 4 atomy H 1 atom S
32 C. Energia w reakcjach chemicznych Spalanie na przykład magnezu czy siarki w tlenie wymaga dostarczenia energii do zapoczątkowania reakcji. Potem proces spalania zachodzi gwałtownie z wydzieleniem energii cieplnej i świetlnej. Niektórym reakcjom mogą towarzyszyć również efekty akustyczne (wybuch). Takie reakcje przebiegające z wydzieleniem energii do otoczenia noszą nazwę reakcji egzoenergetycznych. Otrzymywanie tlenu z manganianu (VII) potasu zachodzi tylko wtedy, gdy dostarczamy przez cały czas energii. Reakcja chemiczna do której przebiegu konieczne jest ciągłe dostarczanie energii nosi nazwę reakcji endoenergetycznej W życiu codziennym przykładem reakcji egzoenergetycznych jest spalanie drewna lub węgla kamiennego.
33 Podział reakcji ze względu na efekty energetyczne Egzoenergetyczne (wydziela się energia do otoczenia) substraty produkty + energia reakcje samorzutne Endoenergetyczne (energia jest dostarczana) substraty + energia produkty reakcje wymuszone Zn + 2HCl ZnCl 2 + H 2 + energia temperatura 2HgO 2Hg + O 2 Przykłady: spalanie gazu ziemnego w kuchence gazowej, spalanie drewna w kominku Przykłady: smażenie mięsa na patelni, reakcja rozkładu tlenku rtęci (II)
34 D. Szybkość reakcji chemicznej Reakcje przebiegają z bardzo różną szybkością jedne są momentalne (reakcje jonowe), inne powolne (polimeryzacji), wreszcie znane są reakcje powolne o szybkościach znikomo małych np. niektóre reakcje rozpadu promieniotwórczego. Szybkość reakcji opisywana jest przez zmianę liczby moli (stężenia substratów) lub zmianę liczby moli (stężenia produktów) w jednostce czasu. Szybkość reakcji wyrażamy więc jako przyrost stężenia molowego produktu C pr lub ubytek stężenia molowego substratu Csub w jednostce czasu t v C produktu t lub v C t substratu W stałej temperaturze szybkość reakcji chemicznej jest w danej chwili proporcjonalna do iloczynu stężeń substratów. A v B k[a] [B] produkty k stała szybkości reakcji, charakterystyczna dla danej reakcji w danej temperaturze.
35 Równanie kinetyczne aa bb cc dd Równanie kinetyczne jest matematycznym zapisem wiążącym szybkość reakcji ze stężeniami reagentów. v k b c a A c B lub v k [A] a [B] b k - stała szybkości reakcji, c A, c B / [A], [B]- stężenia substratów A i B, a, b - zazwyczaj współczynniki stechiometryczne z reakcji a+b = rząd reakcji.
36 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego dla danej reakcji wymaga danych eksperymentalnych dotyczących głównie zależności między stężeniem reagentów a szybkością reakcji. Wpływem różnych zmiennych na szybkość reakcji, takich jak temperatura czy obecność katalizatorów. Zebrane dane eksperymentalne, poddawane są analizie teoretycznej w celu ustalenia mechanizmu, stechiometrii reakcji oraz dopasowania odpowiedniego równania kinetycznego.
37 Opis reakcji chemicznej mechanizm reakcji opisuje jak cząsteczki reagują z sobą, które wiązania kolejno ulegają zerwaniu lub tworzeniu. Jest to często zbiór elementarnych reakcji, które składają się na całość przemiany definiując jej mechanizm. stechiometria reakcji określa ilościowe zależności reagentów; jaka ilość moli danego substratu potrzebna jest do otrzymania określonej ilości moli produktu. rzędowość reakcji opisuje zależność szybkości reakcji od stężenia substratu.
38 Czynniki wpływające na kinetykę reakcji Każda reakcja chemiczna w określonych warunkach ma swoją ściśle określona szybkość reakcji wyrażaną poprzez stałą kinetyczną. szybkość reakcji zależna jest od natury reagentów. Czynniki wpływające na szybkość reakcji kontrolowane podczas jej przebiegu: - Stężenie molekuły reagujących substancji muszą się ze sobą zderzać. - Stan skupienia molekuły muszą być ze sobą zmieszane by doszło do zderzeń. - Temperatura molekuły muszą się zderzać z odpowiednią energią by doszło do rekcji. - Użycie katalizatora.
39 Wpływ zmian stężenia na stan równowagi A B C D K [C][D] [A][B] 1. Wprowadzenie substratów do roztworu Następuje zwiększenie wartości mianownika, ponieważ stała K w danej temperaturze nie ulega zmianie musi zwiększyć się wartość licznika. Wniosek: Przy zwiększeniu stężenia substratów w roztworze następuje przesunięcie równowagi w kierunku powstawania produktów ( w prawo). 2. Wprowadzenie produktów do roztworu ( lub usuwanie substratów) Następuje zwiększenie wartości licznika, ponieważ stała K nie ulega zmianie musi nastąpić zwiększenie wartości mianownika. Wniosek: przy zwiększeniu stężenia produktów w roztworze następuje przesunięcie równowagi w kierunku substratów( w lewo).
40 Wpływ zmian temperatury na stan równowagi Wzrost temperatury przesuwa położenie równowagi chemicznej, w myśl reguły przekory i równocześnie zmienia wartość stałej równowagi K, w odróżnieniu od zmian stężenia, które przesuwają równowagę przy zachowaniu tej samej wartości K. Jeżeli reakcja jest endotermiczna tzn. towarzyszy jej pochłanianie ciepła to wzrost temperatury w myśl reguły przekory przesuwa równowagę w kierunku kompensacji tej zmiany, czyli w kierunku pochłaniania ciepła ( tj. z lewej strony na prawą). Wzrost temperatury w przypadku reakcji egzotermicznej egzoenergetycznej (takiej której towarzyszy wydzielanie ciepła) przesuwa ją w kierunku odwrotnym (z prawej strony na lewą). Katalizator a równowaga Katalizator nie wpływa na położenie stanu równowagi. Katalizator w jednakowym stopniu zmienia szybkości reakcji w lewo i w prawo. Działanie katalizatora polega na skróceniu czasu potrzebnego do osiągnięcia stanu równowagi.
41 Wpływ zmian ciśnienia na stan równowagi Zmiana ciśnienia wywołuje zmiany w układzie jedynie wtedy, gdy liczba moli produktów reakcji jest różna od liczby substratów (zmienia się objętość produktów w stosunku do objętości zajmowanej przez substraty). 3H NH 2 N2 2 3 Z 4 moli substratów powstaje 2 mole produktów. Reakcji przebiegającej z lewa na prawo, towarzyszy zmniejszenie ilości moli. Wzrost ciśnienia w układzie, w którym zachodzi reakcja syntezy amoniaku, spowoduje przesunięcie równowagi w kierunku kompensacji ciśnienia, czyli w kierunku zmniejszenia ilości moli (tzn. w kierunku syntezy) N 2O4 2NO2 Wzrost ciśnienia powoduje przesunięcie równowagi w lewo w kierunku tworzenia N 2 O 4 tj. w kierunku zmniejszenia ilości moli. N O 2NO 2 2 Zmiana ciśnienia nie wywołuje żadnych zmian w układzie znajdującym się w stanie równowagi.
42 Jak wpłynie podwyższenie ciśnienia, przy stałej temperaturze, na równowagę następujących reakcji: 2CO O CO Odpowiedź: równowaga przesunie się w prawo Reakcja pomiędzy stałym węglem a dwutlenkiem węgla jest reakcją endotermiczną: C CO 2CO 2 W którą stronę przesunie się równowaga pod wpływem wzrostu temperatury? Odpowiedź: Równowaga przesunie się w prawo.
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Wykład z Chemii Ogólnej i Nieorganicznej
 Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Kinetyka reakcji chemicznych. Dr Mariola Samsonowicz
 Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Przemiany substancji
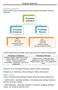 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych
 Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu
 Podstawy obliczeń chemicznych podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu prawo zachowania masy mówi, że w reakcji chemicznej
Podstawy obliczeń chemicznych podstawami stechiometrii, czyli działu chemii zajmującymi są obliczeniami jest prawo zachowania masy oraz prawo stałości składu prawo zachowania masy mówi, że w reakcji chemicznej
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego:
 1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 01/1 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia Grudzień Styczeń
 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1 Kinetyka reakcji chemicznych
 Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
TYPY REAKCJI CHEMICZNYCH
 TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
TYPY REAKCJI CHEMICZNYCH Opracowanie: dr inż Krystyna Moskwa, dr hab. Barbara Stypuła, mgr Agnieszka Tąta Reakcje chemiczne to procesy, w czasie których substancje ulegają przemianom, prowadzącym do powstawania
Tematy i zakres treści z chemii - zakres rozszerzony, dla klas 2 LO2 i 3 TZA/archt. kraj.
 Tematy i zakres treści z chemii - zakres rozszerzony, dla klas 2 LO2 i 3 TZA/archt. kraj. Tytuł i numer rozdziału w podręczniku Nr lekcji Temat lekcji Szkło i sprzęt laboratoryjny 1. Pracownia chemiczna.
Tematy i zakres treści z chemii - zakres rozszerzony, dla klas 2 LO2 i 3 TZA/archt. kraj. Tytuł i numer rozdziału w podręczniku Nr lekcji Temat lekcji Szkło i sprzęt laboratoryjny 1. Pracownia chemiczna.
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
-wszystkie substancje (pierwiastki lub zw chem) które biorą udział w reakcji chemicznej nazywamy reagentami
 Zapis reakcji chemicznej co to są przemiany chemiczne oraz w jaki sposób możemy opisać zachodzące reakcje? wokół nas bezustannie zachodzą rozmaite przemiany przemiany podczas których powstaje nowa substancja,
Zapis reakcji chemicznej co to są przemiany chemiczne oraz w jaki sposób możemy opisać zachodzące reakcje? wokół nas bezustannie zachodzą rozmaite przemiany przemiany podczas których powstaje nowa substancja,
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II
 Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks
 Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
Obliczenia stechiometryczne, bilansowanie równań reakcji redoks Materiały pomocnicze do zajęć wspomagających z chemii opracował: dr Błażej Gierczyk Wydział Chemii UAM Obliczenia stechiometryczne Podstawą
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020
 Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
Wymagania edukacyjne na poszczególne roczne oceny klasyfikacyjne z przedmiotu chemia dla klasy 7 w r. szk. 2019/2020 Ocenę niedostateczną otrzymuje uczeń, który nie opanował wymagań na ocenę dopuszczającą.
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
Przykładowy zestaw zadań z chemii Odpowiedzi i schemat punktowania poziom podstawowy
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów
 Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Obliczenia chemiczne. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
W tej reakcji stopień utleniania żelaza wzrasta od 0 do III. Odwrotnie tlen zmniejszył stopień utlenienia z 0 na II.
 8 Utlenianie i redukcja Początkowo termin utlenianie odnosił się do reakcji pierwiastków lub związków chemicznych z tlenem, a termin redukcja stosowano do określenia usunięcia tlenu ze związku. Później,
8 Utlenianie i redukcja Początkowo termin utlenianie odnosił się do reakcji pierwiastków lub związków chemicznych z tlenem, a termin redukcja stosowano do określenia usunięcia tlenu ze związku. Później,
a) jeżeli przedstawiona reakcja jest reakcją egzotermiczną, to jej prawidłowy przebieg jest przedstawiony na wykresie za pomocą linii...
 1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych
 Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Podstawowe pojęcia i prawa chemiczne, Obliczenia na podstawie wzorów chemicznych 1. Wielkości i jednostki stosowane do wyrażania ilości materii 1.1 Masa atomowa, cząsteczkowa, mol Masa atomowa Atomy mają
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu
 Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Projekt Era inżyniera pewna lokata na przyszłość jest współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
a) 1 mol b) 0,5 mola c) 1,7 mola d) potrzebna jest znajomość objętości zbiornika, aby można było przeprowadzić obliczenia
 1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
analogicznie: P g, K g, N g i Mg g.
 Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Zadanie 1 Obliczamy zawartość poszczególnych składników w 10 m 3 koncentratu: Ca: 46 g Ca - 1 dm 3 roztworu x g Ca - 10000 dm 3 roztworu x = 460000 g Ca analogicznie: P 170000 g, K 10000 g, N 110000 g
Kinetyka i równowaga reakcji chemicznej
 Kinetyka i równowaga reakcji chemicznej W przebiegu reakcji chemicznych interesujące są dwa aspekty zachodzących przemian: 1. rodzaj substratów i otrzymanych z nich produktów, 2. szybkość, z jaką substraty
Kinetyka i równowaga reakcji chemicznej W przebiegu reakcji chemicznych interesujące są dwa aspekty zachodzących przemian: 1. rodzaj substratów i otrzymanych z nich produktów, 2. szybkość, z jaką substraty
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
SUBSTANCJE CHEMICZNE I ICH PRZEMIANY
 DOPUSZCZAJĄCĄ DZIAŁ SUBSTANCJE CHEMICZNE I ICH PRZEMIANY -zna zasady bhp obowiązujące w pracowni chemicznej -nazywa sprzęt i szkło laboratoryjne używane w pracowni chemicznej -wie, że substancje charakteryzują
DOPUSZCZAJĄCĄ DZIAŁ SUBSTANCJE CHEMICZNE I ICH PRZEMIANY -zna zasady bhp obowiązujące w pracowni chemicznej -nazywa sprzęt i szkło laboratoryjne używane w pracowni chemicznej -wie, że substancje charakteryzują
Powstawanie żelazianu(vi) sodu przebiega zgodnie z równaniem: Ponieważ termiczny rozkład kwasu borowego(iii) zachodzi zgodnie z równaniem:
 Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
Zad. 1 Ponieważ reakcja jest egzoenergetyczna (ujemne ciepło reakcji) to wzrost temperatury spowoduje przesunięcie równowagi w lewo, zatem mieszanina przyjmie intensywniejszą barwę. Układ będzie przeciwdziałał
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Termochemia efekty energetyczne reakcji
 Termochemia efekty energetyczne reakcji 1. Podstawowe pojęcia termodynamiki chemicznej a) Układ i otoczenie Układ, to wyodrębniony obszar materii, oddzielony od otoczenia wyraźnymi granicami (np. reagenty
Termochemia efekty energetyczne reakcji 1. Podstawowe pojęcia termodynamiki chemicznej a) Układ i otoczenie Układ, to wyodrębniony obszar materii, oddzielony od otoczenia wyraźnymi granicami (np. reagenty
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
REAKCJE CHEMICZNE I ICH PRZEBIEG
 REAKCJE CHEMICZNE I ICH PRZEBIEG WSTĘP TEORETYCZNY Reakcja chemiczna proces, w którym jedna lub kilka substancji chemicznych ulega przemianie tworząc nową lub nowe substancje, w wyniku zerwania jednych,
REAKCJE CHEMICZNE I ICH PRZEBIEG WSTĘP TEORETYCZNY Reakcja chemiczna proces, w którym jedna lub kilka substancji chemicznych ulega przemianie tworząc nową lub nowe substancje, w wyniku zerwania jednych,
Wzory sumaryczne i strukturalne związków
 Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI
 Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU.
 CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU. Projekt zrealizowany w ramach Mazowieckiego programu stypendialnego dla uczniów szczególnie uzdolnionych
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU. Projekt zrealizowany w ramach Mazowieckiego programu stypendialnego dla uczniów szczególnie uzdolnionych
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
Obliczenia chemiczne
 strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH
 1 OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH Np.: WYZNACZANIE ILOŚCI SUBSTRATÓW KONIECZNYCH DLA OTRZYMANIA OKREŚLONYCH ILOŚCI PRODUKTU PODSTAWY OBLICZEŃ CHEMICZNYCH
1 OBLICZENIA STECHIOMETRIA STECHIOMETRIA: INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH Np.: WYZNACZANIE ILOŚCI SUBSTRATÓW KONIECZNYCH DLA OTRZYMANIA OKREŚLONYCH ILOŚCI PRODUKTU PODSTAWY OBLICZEŃ CHEMICZNYCH
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019
 Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Pierwiastek, który się utlenia jest reduktorem, natomiast pierwiastek, który się redukuje jest utleniaczem.
 Równania redox - reakcje chemiczne, w których zachodzi jednocześnie utlenienie i redukcja pierwiastków chemicznych. Utlenienie proces, podczas którego pierwiastek ze stopnia niższego przechodzi na stopień
Równania redox - reakcje chemiczne, w których zachodzi jednocześnie utlenienie i redukcja pierwiastków chemicznych. Utlenienie proces, podczas którego pierwiastek ze stopnia niższego przechodzi na stopień
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
IX Podkarpacki Konkurs Chemiczny 2016/2017. ETAP I r. Godz Zadanie 1 (11 pkt)
 IX Podkarpacki Konkurs Chemiczny 016/017 ETAP I 10.11.016 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh Zadanie 1 (1) 1. Liczba elektronów walencyjnych w atomach bromu
IX Podkarpacki Konkurs Chemiczny 016/017 ETAP I 10.11.016 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh Zadanie 1 (1) 1. Liczba elektronów walencyjnych w atomach bromu
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2015/2016 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Za poprawną metodę Za poprawne obliczenia wraz z podaniem zmiany ph
 Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia
 Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia Osiągnięcia podstawowe Rodzaje i przemiany materii wymienia powtarzające się elementy podręcznika i wskazuje rolę, jaką odgrywają;
Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia Osiągnięcia podstawowe Rodzaje i przemiany materii wymienia powtarzające się elementy podręcznika i wskazuje rolę, jaką odgrywają;
Zadanie 2. (1 pkt) Uzupełnij tabelę, wpisując wzory sumaryczne tlenków w odpowiednie kolumny. CrO CO 2 Fe 2 O 3 BaO SO 3 NO Cu 2 O
 Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Test maturalny Chemia ogólna i nieorganiczna Zadanie 1. (1 pkt) Uzupełnij zdania. Pierwiastek chemiczny o liczbie atomowej 16 znajduje się w.... grupie i. okresie układu okresowego pierwiastków chemicznych,
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH
 WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
WŁAŚCIWOŚCI NIEKTÓRYCH PIERWIASTKÓW I ICH ZWIĄZKÓW NIEORGANICZNYCH PODZIAŁ ZWIĄZKÓW NIEORGANICZNYCH Tlenki (kwasowe, zasadowe, amfoteryczne, obojętne) Związki niemetali Kwasy (tlenowe, beztlenowe) Wodorotlenki
Przedmiotowy system oceniania z chemii w klasie 7. Ocena dopuszczająca [1] Ocena dostateczna [1+2] Ocena dobra [1+2+3] Ocena bardzo dobra [ ]
![Przedmiotowy system oceniania z chemii w klasie 7. Ocena dopuszczająca [1] Ocena dostateczna [1+2] Ocena dobra [1+2+3] Ocena bardzo dobra [ ] Przedmiotowy system oceniania z chemii w klasie 7. Ocena dopuszczająca [1] Ocena dostateczna [1+2] Ocena dobra [1+2+3] Ocena bardzo dobra [ ]](/thumbs/73/68989892.jpg) Przedmiotowy system oceniania z chemii w klasie 7 Ocena dopuszczająca [1] Ocena dostateczna [1+2] Ocena dobra [1+2+3] Ocena bardzo dobra [1+2+3+4] Uczeń większość poleceń wykonuje z pomocą nauczyciela:
Przedmiotowy system oceniania z chemii w klasie 7 Ocena dopuszczająca [1] Ocena dostateczna [1+2] Ocena dobra [1+2+3] Ocena bardzo dobra [1+2+3+4] Uczeń większość poleceń wykonuje z pomocą nauczyciela:
To jest. Ocena bardzo dobra [ ] energetycznych. s p d f. Ocena dobra [ ] izotopowym. atomowych Z. ,, d oraz f.
![To jest. Ocena bardzo dobra [ ] energetycznych. s p d f. Ocena dobra [ ] izotopowym. atomowych Z. ,, d oraz f. To jest. Ocena bardzo dobra [ ] energetycznych. s p d f. Ocena dobra [ ] izotopowym. atomowych Z. ,, d oraz f.](/thumbs/96/129580154.jpg) 34 Wymagania programowe To jest przyrodniczych,,,,, chemicznego na podstawie zapisu A Z E,,,, podaje masy atomowe pierwiastków chemicznych,, n,,,,, s, p, d oraz f przyrodniczych,,,,, oraz Z,,, d oraz f,,
34 Wymagania programowe To jest przyrodniczych,,,,, chemicznego na podstawie zapisu A Z E,,,, podaje masy atomowe pierwiastków chemicznych,, n,,,,, s, p, d oraz f przyrodniczych,,,,, oraz Z,,, d oraz f,,
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania programowe na poszczególne oceny chemia kl. I
 I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
3. OBLICZENIA STECHIOMETRYCZNE.
 3. OBLICZENIA STECHIOMETRYCZNE. A1 POZIOM PODSTAWOWY OBLICZENIA DOTYCZĄCE MOLA DROBIN SUBSTANCJI CHEMICZNEJ Mol stanowi porcję drobin (atomów, jonów, cząsteczek, cząstek elementarnych) każdej substancji
3. OBLICZENIA STECHIOMETRYCZNE. A1 POZIOM PODSTAWOWY OBLICZENIA DOTYCZĄCE MOLA DROBIN SUBSTANCJI CHEMICZNEJ Mol stanowi porcję drobin (atomów, jonów, cząsteczek, cząstek elementarnych) każdej substancji
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Propozycja planu wynikowego Chemia Nowej Ery - klasa 1 gimnazjum
 Propozycja planu wynikowego Chemia Nowej Ery - klasa 1 gimnazjum Tytuł rozdziału w podręczniku Temat lekcji Wstęp 1. Wprowadzenie chemia jako nauka przyrodnicza Szkło laboratoryjne Sprzęt laboratoryjny
Propozycja planu wynikowego Chemia Nowej Ery - klasa 1 gimnazjum Tytuł rozdziału w podręczniku Temat lekcji Wstęp 1. Wprowadzenie chemia jako nauka przyrodnicza Szkło laboratoryjne Sprzęt laboratoryjny
KONKURS CHEMICZNY DLA UCZNIÓW SZKOŁY PODSTAWOWEJ ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
nazywa wybrane elementy szkła i sprzętu laboratoryjnego oraz określa ich przeznaczenie (4)
 Wymagania na poszczególne oceny z chemii w klasie I Uczeń: I. Substancje i ich właściwości stosuje zasady bezpieczeństwa obowiązujące w pracowni chemicznej (2) zalicza chemię do nauk przyrodniczych (2)
Wymagania na poszczególne oceny z chemii w klasie I Uczeń: I. Substancje i ich właściwości stosuje zasady bezpieczeństwa obowiązujące w pracowni chemicznej (2) zalicza chemię do nauk przyrodniczych (2)
MAŁOPOLSKI KONKURS CHEMICZNY. dla uczniów szkół podstawowych. 25 października 2019 r. Etap I (szkolny)
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Wewnętrzna budowa materii
 Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
