Aptima Specimen Transfer Kit
|
|
|
- Wacława Rudnicka
- 7 lat temu
- Przeglądów:
Transkrypt
1 Aptima Aptima Specimen Transfer Kit Zastosowanie Do użytku diagnostycznego in vitro. Tylko do sprzedaży poza USA. Aptima Specimen Transfer kit (Zestaw do przenoszenia próbek Aptima) jest przeznaczony do stosowania wyłącznie z testami Aptima. Aptima Specimen Transfer kit umożliwia badanie za pomocą testu Aptima próbek ginekologicznych, pobranych do fiolek ThinPrep Pap Test, zawierających roztwór PreservCyt. Ponadto, Aptima Specimen Transfer kit umożliwia przeprowadzenie za pomocą testu Aptima HPV i testu genotypu Aptima HPV 16 18/45 badania próbek ginekologicznych pobranych do płynu konserwującego SurePath. Aptima Specimen Transfer kit może być także używany do przenoszenia próbek wymazu z miejsca zmiany w podłożu do transportu wirusów (VTM). Odczynniki Uwaga: Informacje na temat wszelkich zwrotów wskazujących środki ostrożności i zwrotów wskazujących rodzaj zagrożenia, które można wiązać z odczynnikami, można znaleźć w Bibliotece Kart Charakterystyki Substancji Niebezpiecznych pod adresem Dostarczone materiały Aptima Specimen Transfer Kit (Nr kat C) Element Liczba Opis Probówki do przenoszenia próbek Aptima 100 probówek 1 probówka x 2,9 ml. Materiały wymagane, ale oferowane oddzielnie Uwaga: Materiały dostarczane Hologic są zaopatrzone w numery katalogowe, chyba że podano inne dane. Pipetor i końcówki, którymi można pipetować 1000 µl Wybielacz, 5% do 7% (0,7 M do 1,0 M) roztwór podchlorynu sodu Statyw na probówki testowe Chłonne przykrycia stołów, z plastikowym podkładem Chusteczki pochłaniające Fisherbrand BloodBloc (dostarczane przez Fischer Scientific) Niepylące chusteczki jednorazowe Zestaw roztworów do przenoszenia Aptima (Nr kat ), do stosowania z próbkami SurePath Pipetor i końcówki, którymi można pipetować 300 µl Pipetor i końcówki, którymi można pipetować 25 ml Łaźnia wodna, mogąca utrzymać temperaturę 90 C Kulki polipropylenowe o średnicy 20 mm do łaźni wodnej Materiały opcjonalne Filtry Gyn TransCyt (przezroczyste), do stosowania z systemem ThinPrep 2000 Aptima Specimen Transfer Kit 1 AW Rev. 001
2 Wymagania dotyczące przechowywania zestawów Wymagania dotyczące przechowywania zestawów Aptima Przed użyciem probówki do przenoszenia próbek należy przechowywać w temperaturze pokojowej (15 C do 30 C). Po odebraniu, roztwór transportowy Aptima należy przechowywać w temperaturze 2 C do 8 C (schłodzony). Nie używać odczynników po upływie terminu ich ważności, podanym na fiolkach. Ostrzeżenia i środki ostrożności A. Informacje dotyczące postępowania z wymazami pobranymi do badań cytologicznych na podłożu płynnym zamieszczono w instrukcjach obsługi systemów ThinPrep 2000, ThinPrep 3000* oraz aparatów ThinPrep 5000 i ThinPrep 5000 z podajnikiem Autoloader (systemy ThinPrep 5000). B. Jeśli będzie stosowana procedura usuwania alikwotów, należy zapoznać się ze wskazówkami ich usuwania, zamieszczonymi w instrukcjach do systemu ThinPrep 2000, systemu ThinPrep 3000 lub systemów ThinPrep C. Aptima Specimen Transfer Kit należy stosować wyłącznie z testami Aptima. Nie oceniano rezultatu stosowania z innymi produktami. D. Nie dopuszczać do bezpośredniego kontaktu podłoża do przenoszenia próbek Aptima ze skórą lub błonami śluzowymi, nie przyjmować wewnętrznie. E. Stosować wyłącznie dostarczone lub podane jednorazowe materiały laboratoryjne. F. Stosować rutynowe laboratoryjne środki ostrożności. W wyznaczonych miejscach do pracy nie jeść, nie pić i nie palić. W czasie pracy z próbkami i odczynnikami, należy nosić jednorazowe, bezproszkowe rękawice, okulary ochronne oraz fartuchy laboratoryjne. Po zakończeniu pracy z próbkami i odczynnikami należy umyć ręce. G. Pobrane próbki mogą być zakaźne. W czasie pracy z próbkami należy stosować powszechnie obowiązujące środki ostrożności. Procedury opisane w ulotce dołączonej do opakowania powinien przeprowadzać wyłącznie odpowiednio przeszkolony personel laboratoryjny. H. Na kolejnych etapach postępowania z próbkami należy unikać skażenia krzyżowego. W próbkach może być wysokie stężenie mikroorganizmów. Rękawice należy zmieniać często i zawsze po ich zetknięciu się z próbką. Zużyte materiały należy wyrzucać, nie przenosząc ich nad otwartymi pojemnikami. Nie należy dopuszczać, aby pojemniki z próbkami stykały się ze sobą. I. Powierzchnie robocze, pipety i inny sprzęt należy regularnie odkażać 0,5% roztworem podchlorynu sodowego, przygotowanego przy użyciu wody dejonizowanej (DI). Jeśli do sporządzenia 0,5% roztworu podchlorynu sodu nie zostanie użyta woda dejonizowana, roztwór może działać nieprawidłowo. Wartość ph wody wodociągowej różni się w zależności od laboratorium. Woda o odczynie zasadowym może spowodować zmniejszenie ilości dostępnego chloru, a tym samym spowodować, że podchloryn sodu będzie mniej skutecznie odkażać sprzęt. Należy zapoznać się z informacjami w części Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej ThinPrep i Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej SurePath oraz Instrukcja odkażania. Nie oceniano wpływu procedury odkażania systemu ThinPrep 2000 na wyniki badania cytologicznego. Przed wprowadzeniem procedury odkażania, laboratoria powinny sprawdzić, czy nie ma ona wpływu na wyniki badań cytologicznych. J. Do przenoszenia pobranego materiału do probówek do przenoszenia należy używać wyłącznie końcówek pipet z zatyczkami hydrofobowymi. K. Nie należy używać zestawu po upływie terminu ważności. L. W czasie transportu i przechowywania próbek należy utrzymywać odpowiednią temperaturę, pozwoli to zapewnić ich dobry stan. Prawidłowe warunki transportu i przechowywania próbek opisano w odpowiedniej ulotce dołączonej do odpowiedniego opakowania testów Aptima. M. Pozostałości próbek klinicznych, niezużyte odczynniki i odpady należy utylizować zgodnie z lokalnymi przepisami. *Do stosowania wyłącznie w badaniu Aptima HPV oraz badaniu genotypowym Aptima HPV 16 18/45 Aptima Specimen Transfer Kit 2 AW Rev. 001
3 Aptima Charakterystyka wyników badania próbek ginekologicznych N. W przypadku badania materiału ginekologicznego poddanego obróbce przy zastosowaniu systemu ThinPrep 2000, istnieje zatwierdzona odpowiednia procedura, która zmniejsza możliwość zakażenia krzyżowego w czasie pracy z materiałem do badań cytologicznych. Dwoma ważnymi etapami procedury są: (1) nasączanie pokrywki filtra 0,5% roztworem podchlorynu sodu przez 1 minutę między próbkami oraz (2) polecenie, aby osoba pracująca z próbką zmieniała rękawice między próbkami. Szczegółowy protokół przedstawiono w części Informacja dotycząca procedur postępowania z próbkami do badania cytologicznego na podłożu płynnym ThinPrep C. O. Nie przenosić i nie używać próbki pobranej do badania cytologicznego SurePath na podłożu ciekłym do testu Aptima HPV lub badania genotypowego Aptima HPV 16 18/45, jeśli w fiolce nie ma przyrządu do pobierania. P. Pracując z roztworem do przenoszenia Aptima należy zachować ostrożność (roztwór do rekonstytucji Pro K oraz rekonstytuowany roztwór do przenoszenia Pro K), unikać bezpośredniego kontaktu ze skórą i błonami śluzowymi, nie połykać. W przypadku kontaktu skóry z tymi odczynnikami lub dostania się ich do oka, spłukać wodą. Jeśli płyn się rozleje, należy rozcieńczyć go wodą i wytrzeć do sucha. Charakterystyka wyników badania próbek ginekologicznych Charakterystykę wyników badań próbek ginekologicznych pobranych do fiolek do cytologii płynnej ThinPrep i SurePath przedstawiono w odpowiednich ulotkach dołączonych do opakowania testu Aptima. Z ulotkami dołączonymi do opakowań testów Aptima można zapoznać się na stronie W tabeli poniżej przedstawiono zaakceptowaną procedurę postępowania z alikwotami dla każdego z testów Aptima. Test Aptima do Chlamydia trachomatis i Neisseria gonorrhoeae (test Aptima Combo 2 ) Chlamydia trachomatis (test Aptima CT) Neisseria gonorrhoeae (test Aptima GC) Mycoplasma genitalium (Test Aptima Mycoplasma genitalium) Trichomonas vaginalis (Test Aptima Trichomonas vaginalis) Ludzki wirus brodawczaka (Papillomavirus) (test Aptima HPV) Ludzki wirus brodawczaka (Papillomavirus) (test genetyczny Aptima HPV 16 18/45) Alikwota przed przetwarzaniem Tak System ThinPrep 2000 Alikwota po przetwarzaniu System ThinPrep 3000 Systemy ThinPrep 5000 Próbki do badania cytologicznego na podłożu płynnym SurePath Tak Nie Nie Nie Nie Nie Nie Nie Tak Tak Tak Tak Transport i przechowywanie próbek Uwaga: Pełne informacje na temat przechowywania i transportu próbek zamieszczono w odpowiedniej wkładce dołączonej do odpowiedniego opakowania testów Aptima. Próbki do badania cytologicznego na podłożu płynnym ThinPrep Przed przeniesieniem do probówek do przenoszenia próbek Aptima, próbki ginekologiczne można przechowywać w fiolkach do cytologii płynnej ThinPrep w temperaturze 2 C do 30 C co najmniej 30 dni. Dodatkowe informacje na temat przechowywania i transportu próbek zamieszczono w odpowiedniej ulotce dołączonej do opakowania testów Aptima. Próbki do cytologii płynnej ThinPrep przeniesione do probówek do przenoszenia próbek Aptima Aptima Specimen Transfer Kit 3 AW Rev. 001
4 Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej Aptima mogą być przechowywane w temperaturze od 2 C do 30 C przez co najmniej 14 dni przed testem. Dodatkowe informacje na temat przechowywania i transportu próbek zamieszczono w odpowiedniej ulotce dołączonej do opakowania testów Aptima. Próbki do badania cytologicznego na podłożu płynnym SurePath Przed przeniesieniem do probówek do przenoszenia Aptima, próbki ginekologiczne w fiolkach do cytologii płynnej SurePath można przechowywać w temperaturze od 2 C do 25 C przez 7 dni. Po przeniesieniu próbki do badania cytologicznego na podłożu płynnym SurePath do probówki do przenoszenia próbek Aptima, przed zastosowaniem roztworu transportowego Aptima, można ją przechowywać w temperaturze od 2 C do 25 C przez 7 dni. Przed przeprowadzeniem testu Aptima HPV i testu genotypowego Aptima HPV 16 18/45 próbki SurePath należy przygotować. Dodatkowe informacje na temat przechowywania testu Aptima HPV i testu genotypowego Aptima HPV 16 18/45 i postępowania z tymi testami zamieszczono w ulotkach dołączonych do opakowania. Wymazy z miejsca zmian VTM Przed przeniesieniem do probówek transportowych Aptima wymazy z miejsca zmian VTM w probówce VTM można przechowywać w temperaturze od 2 C do 8 C przez 3 dni. Dodatkowe informacje na temat przechowywania i transportu próbek zamieszczono w odpowiedniej ulotce dołączonej do opakowania testów Aptima. Wymazy z miejsca zmian VTM przeniesione do próbek transportowych Aptima mogą być przechowywane w temperaturze od 2 C do 30 C przez co najmniej 30 dni przed testem. Jeśli konieczne jest przechowywanie przez dłuższy okres, wymazy z miejsca zmiany VTM należy zamrozić w próbce transportowej Aptima w temperaturze 20 C, można je wtedy przechowywać do 90 dni. Uwaga: Próbki należy wysłać zgodnie z obowiązującymi krajowymi i międzynarodowymi przepisami transportowymi. Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej ThinPrep A. Przygotowanie strefy przenoszenia próbek 1. Założyć czyste rękawice. 2. Przetrzeć powierzchnie robocze i pipetory 0,5% roztworem podchlorynu sodu. (użyć wody dejonizowanej do rozcieńczenia 5% do 7% (0,7 M do 1,0 M) roztworu podchlorynu sodu. W przypadku prawidłowego przechowywania, przygotowana partia 0,5% roztworu podchlorynu sodu zachowa właściwości odkażające przez 1 tydzień). 3. Roztwór podchlorynu sodu powinien oddziaływać na powierzchnie robocze i pipetory przez co najmniej 1 minutę, potem należy spłukać go wodą. Osuszyć powierzchnie ręcznikami papierowymi. 4. Nakryć blaty robocze czystymi, chłonnymi i zaopatrzonymi w plastikowy podkład osłonami stołu laboratoryjnego. 5. W strefie przenoszenia próbek należy umieścić statyw z dostateczną liczbą probówek transportowych Aptima, odpowiadającą liczbie poddawanych testom próbek do badania cytologicznego na podłożu płynnym ThinPrep. Jeśli będzie stosowana procedura usuwania alikwotów, należy zapoznać się w instrukcji obsługi systemu ThinPrep 2000, systemu ThinPrep 3000 lub systemu ThinPrep 5000 ze wskazówkami na temat usuwania alikwoty i postępować zgodnie z procedurą przenoszenia próbek Hologic, opisaną w części Uwaga dot. procedury B. Jeśli próbki do badania cytologicznego na podłożu płynnym ThinPrep będą po obróbce przy użyciu systemu ThinPrep 2000 przenoszone do probówek transportowych Aptima, należy użyć systemu ThinPrep 2000 zgodnie z instrukcjami zamieszczonymi w części Uwaga dot. procedury C oraz Uwaga dot. procedury D. Jeśli próbki do badania cytologicznego na podłożu płynnym ThinPrep będą po obróbce przy użyciu systemu ThinPrep 3000 przenoszone do probówek do przenoszenia próbek Aptima, należy użyć systemu ThinPrep 3000 zgodnie z instrukcją stosowania systemu ThinPrep Jeśli próbki do badania cytologicznego na podłożu płynnym ThinPrep będą po obróbce przy użyciu któregokolwiek systemu ThinPrep 5000 przenoszone do probówek transportowych Aptima, należy użyć systemów ThinPrep 5000 zgodnie z instrukcjami do tych systemów ThinPrep Aptima Specimen Transfer Kit 4 AW Rev. 001
5 Aptima Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej B. Procedura przenoszenia próbek dotycząca usuwanych przed obróbką alikwotów próbek do badania cytologicznego na ciekłym podłożu przy użyciu systemu ThinPrep 2000, systemu ThinPrep 3000 lub systemów ThinPrep Założyć czyste rękawice i przenieść próbki, które mają być badane do strefy przenoszenia próbek. 2. Odkręcić nakrętkę probówki do przenoszenia próbek Aptima i położyć na blacie nakrętkę gwintem do góry. 3. Worteksować przez 3 do 10 sekund zawarty w probówce alikwot próbki do badania cytologicznego na podłożu płynnym ThinPrep. Odkręcić nakrętkę probówki i położyć na blacie nakrętkę gwintem do góry. 4. W ciągu 1 minuty od worteksowania przenieść 1 ml próbki do badania cytologicznego na podłożu płynnym do próbówki do przenoszenia próbek Aptima. 5. Wyrzucić końcówkę pipety do odpowiedniego pojemnika na materiały stwarzające zagrożenie biologiczne. 6. Mocno zakręcić probówkę do przenoszenia próbek Aptima. Delikatnie odwrócić probówkę 2 do 3 razy, aby zapewnić dokładne wymieszanie próbki. 7. Zakręcić probówkę zawierającą usuniętą część próbki do badania cytologicznego na podłożu płynnym Thinrep i, jeśli trzeba, przechowywać w temperaturze od 2 C do 30 C przez maks. 30 dni. 8. Założyć czyste rękawice i kolejno powtórzyć opisane powyżej etapy 1-7 przenoszenia próbek. Aby zmniejszyć ryzyko skażenia innych próbek, w danym momencie należy pracować z jedną próbką do badania cytologicznego na ciekłym podłożu. 9. Przejść do części Procedura testowa. C. Przetwarzanie próbek do badania cytologicznego na podłożu płynnym przy zastosowaniu systemu ThinPrep 2000 Należy zapoznać się z instrukcją stosowania systemu ThinPrep 2000, w której opisano etapy przetwarzania próbki w standardowym badaniu cytologicznym i konserwacje pierścieni O-ring u podstawy pokrywki filtra. Uwaga: Poniższe procedury czyszczenia systemu ThinPrep 2000 nie są wymagane w przypadku testów Aptima HPV. Więcej informacji zamieszczono w części Badanie skażenia próbek do badania cytologicznego na płynnym podłożu ThinPrep w odniesieniu do testu Aptima HPV poniżej. 1. Założyć czyste rękawice. 2. Oczyścić 2 pokrywki filtra przez zanurzenie ich na co najmniej 1 minutę w 0,5% roztworze podchlorynu sodu, przepłukać w wodzie dejonizowanej i starannie osuszyć niepylacą chusteczką jednorazową. Wyrzucić chusteczkę. Uwaga: Użycie dwóch pokrywek filtra umożliwia kontynuowanie pracy, gdy jedna pokrywka filtra jest w trakcie nasiąkania. 3. Umieścić czystą pokrywkę filtra na chusteczce BloodBloc Super Absorbency. 4. Umieścić łaźnię utrwalającą w systemie ThinPrep Utworzyć zespół filtra, umieszczając nowy fitr Gyn TransCyt w czystej pokrywce filtra i włożyć zespół filtra do systemu ThinPrep (szczegółowe informacje na temat przeprowadzania tego etapu procedury zamieszczono w Instrukcji stosowania systemu ThinPrep 2000). 6. Włożyć szkiełko do uchwytu. (szczegółowe informacje na temat przeprowadzania tego etapu procedury zamieszczono w Instrukcji stosowania systemu ThinPrep 2000). 7. Odkręcić nakrętkę fiolki testu ThinPrep Pap i położyć nakrętkę na blacie gwintem do góry. Sprawdzić, czy blat jest czysty, nie ma na nim pozostałości wybielacza lub ciał obcych. 8. Włożyć fiolkę testu ThinPrep Pap do systemu ThinPrep W menu głównym systemu ThinPrep wybrać 4-GYN, naciskając 4 na klawiaturze. 9. Założyć czyste rękawice. 10. Gdy preparat szkiełkowy jest gotowy, należy otworzyć drzwiczki, wyjąć fiolkę testową ThinPrep Pap i ponownie ją zakręcić. 11. Wyjąć łaźnię utrwalającą i umieścić preparat w łaźni zawierającej 95% etanol. 12. Ponownie włożyć łaźnię utrwalającą do systemu. Aptima Specimen Transfer Kit 5 AW Rev. 001
6 Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej Aptima 13. Wyjąć zespół filtra z systemu, chwytając jedną ręką pokrywkę filtra i, używając niepylącej chusteczki jednorazowej jako bariery, oddzielić filtr od jego pokrywki. Wyrzucić filtr, rękawice i chusteczkę jednorazową. Nie wyrzucać pokrywki filtra. 14. Umieścić pokrywkę filtra na co najmniej 1 minutę w pojemniku z 0,5% roztworem podchlorynu sodu. 15. Mając założone czyste rękawice, wypłukać pokrywkę filtra w wodzie dejonizowanej, następnie osuszyć starannie pokrywkę niepylącą chusteczką jednorazową. Wyrzucić chusteczkę. 16. Powtórzyć procedurę dla każdej próbki, zaczynając od 3. etapu tej procedury, zmieniać rękawice po każdej próbce i kontynuować pracę do czasu przetworzenia wszystkich próbek. D. Procedura przenoszenia próbek po przetwarzaniu w systemie ThinPrep 2000, systemie ThinPrep 3000 lub systemie ThinPrep Założyć czyste rękawice i przenieść próbki, które mają być badane do strefy przenoszenia próbek. 2. Odkręcić nakrętkę probówki do przenoszenia próbek Aptima i położyć nakrętkę na blacie gwintem do góry. 3. Worteksować fiolkę testu ThinPrep Pap przez 3 do 10 sekund. Otworzyć fiolkę i położyć zakrętkę gwintem do góry na blacie. 4. W ciągu 1 minuty od worteksowania przenieść 1 ml próbki do badania cytologicznego na podłożu płynnym ThinPrep do próbówki do przenoszenia próbek Aptima. 5. Wyrzucić końcówkę pipety do odpowiedniego pojemnika na materiały stwarzające zagrożenie biologiczne. 6. Mocno zakręcić probówkę do przenoszenia próbek Aptima. Delikatnie odwrócić probówkę 2 do 3 razy, aby zapewnić dokładne wymieszanie próbki. 7. W razie konieczności przechowywania, ponownie zakręcić fiolkę z testem ThinPrep Pap. 8. Założyć czyste rękawice i kolejno powtórzyć opisane powyżej etapy 1-7 przenoszenia próbek. Aby zmniejszyć ryzyko skażenia innych próbek, w danym momencie należy pracować z jedną przetwarzaną próbką do badania cytologicznego na ciekłym podłożu. 9. Przejść do części Procedura testowa. Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej SurePath A. Przygotowanie strefy przenoszenia próbek 1. Założyć czyste rękawice. 2. Przetrzeć powierzchnie robocze i pipetory 0,5% roztworem podchlorynu sodu. (użyć wody dejonizowanej do rozcieńczenia 5% do 7% (0,7 M do 1,0 M) roztworu podchlorynu sodu. W przypadku prawidłowego przechowywania, przygotowana partia 0,5% roztworu podchlorynu sodu zachowa właściwości odkażające przez 1 tydzień). 3. Roztwór podchlorynu sodu powinien oddziaływać na powierzchnie robocze i pipetory przez co najmniej 1 minutę, potem należy spłukać go wodą. Osuszyć powierzchnie ręcznikami papierowymi. 4. Nakryć blaty robocze czystymi, chłonnymi i zaopatrzonymi w plastikowy podkład osłonami stołu laboratoryjnego. 5. W strefie przenoszenia próbek należy umieścić statyw z dostateczną liczbą probówek do przenoszenia próbek Aptima, odpowiadającą liczbie poddawanych testom próbek do badania cytologicznego na podłożu płynnym SurePath. 6. Opatrzeć każdą probówkę do przenoszenia próbek Aptima numerem kolejnym badania lub numerem identyfikacyjnym ID. B. Procedura przenoszenia próbek dotycząca próbek do badania cytologicznego na podłożu płynnym SurePath 1. Założyć czyste rękawice i przenieść próbki, które mają być badane do strefy przenoszenia próbek. 2. Odkręcić nakrętkę probówki do przenoszenia próbek Aptima i położyć na blacie nakrętkę gwintem do góry. 3. Wortkesowa fiolkę do badania cytologicznego na podłożu płynnym przez 3 do 10 sekund. Otworzyć fiolkę i położyć zakrętkę gwintem do góry na blacie. Aptima Specimen Transfer Kit 6 AW Rev. 001
7 Aptima Informacje dotyczące procedur postępowania z próbkami do cytologii płynnej 4. W ciągu 1 minuty od worteksowania przenieść 0,5 ml próbki do badania cytologicznego na podłożu płynnym SurePath do próbówki do przenoszenia próbek Aptima. Więcej informacji zamieszczono w Procedura postępowania z próbkami, dotycząca próbek do badania cytologicznego na podłożu płynnym SurePath. 5. Wyrzucić końcówkę pipety do odpowiedniego pojemnika na materiały stwarzające zagrożenie biologiczne. 6. Mocno zakręcić probówkę do przenoszenia próbek Aptima. Delikatnie odwrócić probówkę 2 do 3 razy, aby zapewnić dokładne wymieszanie próbki. 7. W razie konieczności przechowywania, ponownie zakręcić fiolkę SurePath. 8. Założyć czyste rękawice i kolejno powtórzyć opisane powyżej etapy 1 7 przenoszenia próbek. Aby zmniejszyć ryzyko skażenia innych próbek, w danym momencie należy pracować z jedną próbką do badania cytologicznego na ciekłym podłożu SurePath. 9. Przejść do części Procedura testowa. C. Procedura postępowania z próbkami, dotycząca próbek do badania cytologicznego na podłożu płynnym SurePath 1. Przygotować powierzchnie robocze a. Założyć czyste rękawice. b. Wytrzeć blat roboczy lub powierzchnie w strefie roboczej 0,5% roztworem podchlorynu sodu (do rozcieńczenia 5% do 7% roztworu podchlorynu sodu. W przypadku prawidłowego przechowywania, przygotowana partia 0,5% roztworu podchlorynu sodu zachowa właściwości odkażające przez 1 tydzień). c. Roztwór powinien mieć styczność z powierzchniami przez 1 minutę, następnie należy spłukać go wodą. Osuszyć powierzchnie ręcznikami papierowymi. d. Nakryć blaty robocze czystymi, chłonnymi i zaopatrzonymi w plastikowy podkład osłonami stołu laboratoryjnego. 2. Przygotowanie odczynników roztworu do przenoszenia Aptima nowego zestawu odczynników a. Otworzyć liofilizowaną fiolkę Pro K (szklaną). b. Mocno wcisnąć ząbkowaną końcówkę kołnierza rekonstytucyjnego w ujście szklanej fiolki (Rysunek 1 Etap 1). c. Otworzyć buteleczkę z roztworem do rekonstytucji Pro K (plastikową) i położyć nakrętkę na czystej, przykrytej powierzchni roboczej. d. Trzymając plastikowa buteleczkę na blacie, mocno wcisnąć drugi koniec kołnierza rekonstytucyjnego w ujście buteleczki (Rysunek 1 Etap 2). e. Odwrócić połączone buteleczkę i fiolkę. Poczekać, aż roztwór spłynie do szklanej fiolki (Rysunek 1 Etap 3). Ilość płynu powinna być większa niż pojemność szklanej fiolki i część płynu powinna pozostać w kołnierzu rekonstytucyjnym. f. Delikatnie zataczać fiolką koła w powietrzu, aby wymieszać jej zawartość. (Rysunek 1 etap 4). g. Poczekać dopóki liofilizowany odczynnik nie przejdzie do roztworu (około 3 minut). h. Odwrócić połączone buteleczkę i fiolkę (Rysunek 1 etap 5). Poczekać, aż płyn ponownie spłynie do buteleczki. i. Powtórzyć etap h. j. Usunąć kołnierz rekonstytucyjny i szklaną fiolkę (Rysunek 1 etap 6). k. Ponownie zakręcić plastikową buteleczkę (Rysunek 1 etap 7). l. Wymieszać, odwracając buteleczkę 5 lub 6 razy. m. Na buteleczce zapisać inicjały operatora i datę rekonstytucji. n. Wyrzucić kołnierz rekonstytucyjny oraz szklaną fiolkę (Rysunek 1 etap 8). o. Przechowywać roztwór do przenoszenia Pro K w temperaturze od 2 C do 8 C przez maksimum 30 dni. Nie zamrażać. p. Po 30 dniach lub po upływie terminu ważności zestawu, w zależności od tego, co nastąpi wcześniej, rekonstytuowany roztwór do przenoszenia Pro K należy wyrzucić. Aptima Specimen Transfer Kit 7 AW Rev. 001
8 Uwagi dotyczące procedury postępowania z próbkami wymazów z miejsca Aptima 3. Przygotowanie odczynników roztworu do przenoszenia Aptima wcześniej rekonstytuowanego zestawu odczynników a. Poczekać, aż rekonstytuowany roztwór do przenoszenia Pro K osiągnie temperaturę pokojową. b. Przed użyciem dokładnie wymieszać, odwracając buteleczkę. 4. Dodawanie odczynnika a. Umieścić statyw z probówkami Aptima, zawierającymi próbki do badania cytologicznego na podłożu płynnym, na przykrytej powierzchni roboczej. b. Z jednej z probówek z próbką odkręcić nakrętkę i położyć ją gwintem do góry na czystej, przykrytej powierzchni roboczej. c. Do probówki z próbką dodać 300 µl rekonstytuowanego roztworu do przenoszenia Pro K. d. Ponownie zakręcić probówkę z próbką i delikatnie odwrócić probówkę 5 6 razy w celu wymieszania zawartości. e. Powtórzyć etapy od b do d dla pozostałych probówek z próbkami. 5. Postępowanie z próbkami a. Poczekać, aż łaźnia wodna osiągnie temperaturę 90 C. Wstępnie podgrzewając wodę można użyć pokrywy łaźni wodnej, ale na czas inkubacji należy ją zdjąć. Pokryć powierzchnię łaźni wodnej przeznaczonymi do tego kulkami, aby w czasie inkubacji zapewnić izolację powierzchni. Uwaga: Jeśli na etapie inkubacji pokrywa nie zostanie zdjęta, mogą ulec uszkodzeniu zakrętki probówek do przenoszenia próbek Aptima. b. Umieścić statyw z probówkami na próbki, zawierającymi rekonstytuowany roztwór do przenoszenia Pro K w łaźni wodnej. Poziom wody w łaźni wodnej powinien być taki sam, jak poziom płynu w probówkach z próbkami. c. Inkubować probówki z próbkami przez 15 minut. d. Wyjąć probówki z próbkami z łaźni wodnej i poczekać, dopóki nie ostygną do temperatury pokojowej. e. Przed przeprowadzeniem testu Aptima HPV i testu genotypowego Aptima HPV 16 18/45 przetwarzane próbki można przechowywać w temperaturze 2 C do 8 C przez maksimum 17 dni. Uwagi dotyczące procedury postępowania z próbkami wymazów z miejsca zmiany VTM A. Przygotowanie strefy przenoszenia próbek 1. Założyć czyste rękawice bezpudrowe. 2. Przetrzeć powierzchnie robocze i pipetory 2,5% do 3,5% (0,35 M to 0,5 M) roztworem podchlorynu sodu. 3. Roztwór podchlorynu sodu powinien oddziaływać na powierzchnie robocze i pipetory przez co najmniej 1 minutę, potem należy spłukać go wodą dejonizowaną. Osuszyć powierzchnie czystymi ręcznikami papierowymi. Aptima Specimen Transfer Kit 8 AW Rev. 001
9 Aptima Procedura testowa 4. Nakryć blaty robocze czystymi, chłonnymi i zaopatrzonymi w plastikowy podkład osłonami stołu laboratoryjnego. 5. W strefie przenoszenia próbek należy umieścić statyw z dostateczną liczbą probówek transportowych Aptima, odpowiadającą liczbie poddawanych testom próbek do badania VTM. 6. Opatrzeć każdą probówkę do przenoszenia próbek Aptima numerem kolejnym badania lub numerem identyfikacyjnym ID. B. Procedura przenoszenie próbek 1. Aby zmniejszyć ryzyko skażenia innych próbek, w danym momencie należy pracować z jedną próbką VTM. 2. Założyć czyste, bezpudrowe rękawice i przenieść próbki, które mają być badane do strefy przenoszenia próbek. 3. Pobrać jedną próbkę VTM. Odkręcić nakrętkę probówki transportowej Aptima i położyć nakrętkę na blacie gwintem do góry. 4. Worteksować próbkę VTM przez 3 do 10 sekund. Odkręcić nakrętkę probówki i położyć nakrętkę gwintem do góry na blacie. 5. W ciągu 1 minuty od worteksowania odpipetować 0,5 ml próbki VTM do probówki do przenoszenia Aptima zawierającej 2,9 ml STM. 6. Wyrzucić końcówkę pipety do odpowiedniego pojemnika na materiały stwarzające zagrożenie biologiczne. 7. Mocno zakręcić probówkę do przenoszenia próbek Aptima. Delikatnie odwrócić probówkę 2 do 3 razy, aby zapewnić dokładne wymieszanie próbki. 8. Zakręcić probówkę zawierającą pozostałą część próbki VTM, aby przygotować ją do przechowywania w temperaturze 70 C, jeśli będzie taka potrzeba. 9. Przenosząc kolejne próbki, powtarzać etapy 3 do 8. Zmieniać często rękawice bezpudrowe, a zwłaszcza, jeśli dojdzie do ich kontaktu z próbką. Procedura testowa Wykonać badania cytologiczne na podłożu płynnym ThinPrep lub SurePath, albo badanie wymazów z miejsca zmiany VTM z probówki do przenoszenia próbek Aptima, zgodnie z instrukcjami zamieszczonymi w odpowiedniej ulotce dołączonej do opakowania testu Aptima. Uwaga: Przed przeprowadzeniem testu Aptima HPV i testu genotypowego Aptima HPV 16 18/45 próbki do testu cytologicznego na podłożu płynnym przenoszone do probówki Aptima należy wstępnie przygotować. Dodatkowe informacje na temat testu Aptima HPV i testu genotypowego Aptima HPV 16 18/45 zamieszczono w ulotkach dołączonych do opakowania. Instrukcja odkażania Uwaga: Jeśli próbki do badania cytologicznego na podłożu płynnym ThinPrep będą po obróbce przy użyciu systemu ThinPrep 2000 przenoszone do probówek do przenoszenia Aptima, należy 8 godzin po użyciu przeprowadzić odkażanie systemu ThinPrep Ważne jest, aby czyścić system od góry urządzenia do dołu i aby zmieniać rękawice zgodnie z instrukcjami, aby zapobiec ponownemu skażeniu powierzchni roboczych. W czasie tej procedury unikać dotykania przewodów wewnętrznego oprzyrządowania. W celu odkażenia systemu ThinPrep 2000 należy używać wyłącznie 0,5% roztworu podchlorynu sodu. A. Odkażanie systemu ThinPrep Nałożyć czyste rękawice. 2. Zwilżyć bezpyłową chusteczkę jednorazową 0,5% roztworem podchlorynu sodu. 3. Otworzyć drzwiczki na próbki, przetrzeć uchwyt szkiełek chusteczką jednorazową i wyrzucić ją. 4. Zamknąć drzwiczki na próbki. 5. Przestawić wewnętrzne mechanizmy systemu do położenia konserwacji, naciskając na klawiaturze 7, potem 2 i Enter. Aptima Specimen Transfer Kit 9 AW Rev. 001
10 Procedura testowa Aptima 6. Otworzyć drzwiczki na próbki. 7. Założyć czyste rękawice. 8. Zwilżyć bezpyłową chusteczkę jednorazową 0,5% roztworem podchlorynu sodu i przetrzeć nią od góry do dołu wszystkie powierzchnie. Należy pamiętać, aby starannie oczyścić powierzchnie używane w czasie przetwarzania próbek, takie jak uchwyt szkiełek, uchwyt wanienki utrwalającej oraz uchwyt fiolek na próbki. Należy także pamiętać o oczyszczeniu uszczelki nakrętki i wnętrza drzwiczek systemu. Wyrzucić chusteczkę. 9. Zmienić rękawiczki. Bezpyłową chusteczką jednorazową zwilżoną 0,5% roztworem podchlorynu sodu oczyścić zewnętrzne powierzchnie systemu od góry do dołu, zwracając szczególną uwagę na klamkę drzwiczek i klawiaturę. Wyrzucić chusteczkę. 10. Pozostawić 0,5% roztwór podchlorynu sodu w kontakcie z urządzeniem na 5 minut. 11. Przywrócić system do położenia roboczego, zamykając drzwiczki na próbki i naciskając na klawiaturze Enter. 12. Zmienić rękawice i przetrzeć uchwyt szkiełek bezpyłową chusteczką jednorazową, nasączoną wodą dejonizowaną. Wyrzucić chusteczkę. 13. Zamknąć drzwiczki na próbki i nacisnąć na klawiaturze 7, potem 2 i Enter, aby ponownie przestawić system w położenie konserwacji. 14. Otworzyć drzwiczki na próbki i, pracując od góry do dołu, przetrzeć wnętrze urządzenia bezpyłową chusteczką jednorazową, nasączoną wodą dejonizowaną, aby dokładnie i usunąć z uszczelki nakrętki 0,5% roztwór podchlorynu sodu. Wyrzucić chusteczkę. 15. Powtórzyć etapy 1 do 14, aby mieć pewność, że odkażanie zostało doprowadzone do końca. B. Protokół monitoringu skażenia laboratorium Istnieje wiele zależnych od laboratorium czynników, które mogą przyczyniać się do skażenia, w tym liczba badanych próbówek, przepływ pracy, rozpowszechnienie chorób i różne inne działania laboratorium. Należy uwzględnić te czynniki przy ustalaniu częstości monitoringu. Należy ustalić odstępy między kontrolami skażenia na podstawie praktyk i procedur obowiązujących w danym laboratorium. Każde laboratorium cytologiczne musi skoordynować swoją pracę z ośrodkiem Aptima w celu badania pobranego materiału pod kątem skażenia i uzyskania wyników badania. W celu monitorowania skażenia laboratorium, można stosować następującą procedurę przy zastosowaniu zestawu do pobierania wymazów Aptima Unisex do próbek wewnątrzszyjkowych oraz próbek z cewki moczowej mężczyzn: 1. Oznakować próbówki transportowe z wymazami numerami odpowiadającymi obszarowi laboratorium, które będzie sprawdzane. 2. Wyjąć próbkę wymazu (niebieska wymazówka z zielonym nadrukiem) z opakowania, zwilżyć wymazówkę w podłożu transportowym i kolistym ruchem nanieść wymaz na numerowany obszar. 3. Natychmiast włożyć wymazówkę do odpowiedniej probówki transportowej. 4. Ostrożnie odłamać trzonek wymazówki w linii nacięcia. Unikać rozchlapania zawartości. 5. Mocno zakręcić probówkę transportową do wymazów. 6. Powtórzyć etapy 2 do 5 dla wszystkich obszarów, z których ma być pobrany wymaz. 7. Sprawdzić wymaz stosując właściwy test Aptima, zgodnie z punktem Procedura testowa w ulotce dołączonej do opakowania odpowiedniego testu. Jeśli wyniki są dodatnie lub niejednoznaczne (zob. punkt Interpretacja wyników testu w odpowiedniej ulotce dołączonej do opakowania testu), powierzchni może być skażona i można ją odkazić, stosując 0,5% roztwór podchlorynu sodu, tak jak zalecono w odpowiedniej Instrukcji dla operatora i/lub w ulotce dołączonej do opakowania testu. Badanie skażenia próbek do badania cytologicznego na płynnym podłożu ThinPrep w odniesieniu do testu Aptima Combo 2 Aby wykazać, że nasączenie pokrywki filtra 0,5% roztworem podchlorynu sodu ( wybielanie ) skutecznie zmniejsza skażenie, badano na zmianę 200 ujemnych i 200 dodatnich próbek GC o wysokim mianie (>1x10 6 CFU/ml), najpierw bez etapów wybielania, a potem przy zastosowaniu tej procedury. Dodatnie próbki GC Aptima Specimen Transfer Kit 10 AW Rev. 001
11 Aptima zostały przygotowane przez dodanie do próbki do badania cytologicznego na podłożu płynnym komórkowego fg GC rrna >5x10 6. Operator powinien pamiętać o zmianie rękawic, zarówno przed pierwszym, jak i drugim etapem procedury obróbki każdej z próbek. Przy analizie wszystkich 400 próbek używano tej samej pokrywki filtra. Po obróbce w systemie ThinPrep 2000, 1 ml pozostałej próbki ThinPrep przeniesiono do probówki do przenoszenia próbek Aptima (teraz jest ona określana jako przetworzona próbka do badania cytologicznego na podłożu płynnym), a następnie poddana testowi Aptima Combo 2. Warunki te symulują procedury, które, jak się oczekuje, będą przeprowadzane w typowym środowisku klinicznym. Ponadto, z każdej próbki przed poddaniem jej obróbce w systemie ThinPrep 2000, pobierano pewną ilość, służącą za próbkę kontrolną. Jeśli próbka dawała fałszywie dodatni wynik, alikwotę tę poddawano testowi, aby stwierdzić, czy do zanieczyszczenia doszło przed rozpoczęciem przetwarzania próbki. Poza tym, pod koniec drugiego etapu, dodano dodatkowych 20 ujemnych próbek do badania cytologicznego na podłożu płynnym ThinPrep, aby stwierdzić, czy nagromadzenie się komórek w systemie (potencjalnie z powodu tworzenia się aerozoli), mogło spowodować skażenie próbek ujemnych. Bez etapu wybielania, wśród próbek ThinPrep były 24 fałszywie dodatnie wyniki i 17 wyników niejednoznacznych wyników, co oznacza 20,5% wyników fałszywie dodatnich. Gdy stosowano wybielanie pokrywki filtra między kolejnymi próbkami, częstość fałszywie dodatnich wyników wyniosła 1,4% (3 fałszywie dodatnie z 220 próbek ujemnych). Żadna z alikwot sprzed przetwarzania próbek dających fałszywe wyniki nie była GC-dodatnia. Jest to zgodne z obserwacją, że do skażenia nie doszło przed przetwarzaniem próbki w systemie ThinPrep 2000; nastąpiło ono najprawdopodobniej w czasie obróbki próbki cytologicznej. Badania te pokazują, że wprowadzenie protokołu ograniczającego skażenie zmniejsza możliwość zakażenia krzyżowego na poszczególnych etapach przetwarzania w systemie ThinPrep 2000 > 14 razy. Badanie skażenia próbek do badania cytologicznego na płynnym podłożu ThinPrep w odniesieniu do testu Aptima HPV Badanie systemu ThinPrep 2000 Przeprowadzono badanie mające na celu określenie częstości fałszywie dodatnich wyników rejestrowanych przy stosowaniu testu Aptima HPV, gdy próbki do badania cytologicznego na podłożu płynnym ThinPrep zawierające znaczne stężenie komórek HPV-dodatnich z dodatkiem analitu, były przetwarzane w systemie ThinPrep 2000 na zmianę z próbkami HPV-negatywnymi. Próbki ujemne były otrzymywane przez dodanie do 20 ml roztworu PreservCyt 3 x 10 5 wyhodowanych komórek HPV-ujemnych. Przed przetworzeniem w systemie ThinPrep 2000, 1 ml każdej próbki ujemnej przeniesiono do probówki do przenoszenia próbek Aptima, ta część próbki stanowiła kontrolę ujemną przed przetworzeniem. Próbki HPV-dodatnie o wysokim mianie, zostały utworzone przez dodanie do 20 ml roztworu PreservCyt 7,5 x 10 4 dodatnich pod względem HPV 16, wyhodowanych komórek i 2,25 x 10 5 wyhodowanych komórek HPV-ujemnych. Próbki HPV-dodatnie i HPV-ujemne były na zmianę przetwarzane w systemie ThinPrep 2000 zgodnie z instrukcją obsługi tego urządzenia. Jeden zestaw próbek HPV-dodatnich i HPV-ujemnych przetwarzano po przeprowadzeniu procedury oczyszczania pokrywki filtra (opis zamieszczono w części Uwaga dot. procedury C), a jeden bez zastosowania tej procedury. Z każdej próbki po przetworzeniu w systemie ThinPrep 2000 pobrano pewna ilość materiału ( próbki po przetworzeniu ) i przeniesiono ją do probówki do przenoszenia próbek Aptima. Próbki przed przetworzeniem i po przetworzeniu zostały zbadane za pomocą testu Aptima HPV. Obliczono częstość fałszywie dodatnich wyników w przypadku próbek kontroli ujemnej przed przetworzeniem, a także obu zestawów próbek ujemnych przed przetworzeniem (przy stosowaniu procedury oczyszczania i bez niej) oraz zastosowano dwustronny test mnożnika Lagrange a przy poziomie ufności 95%. Wśród próbek ujemnych po przetworzeniu, gdy zastosowano procedurę czyszczenia, zaobserwowano jedną próbkę fałszywie dodatnią na 120 badanych, co daje częstość fałszywie dodatnich wyników 0,8% (99,2% swoistość). Z próbek ujemnych po przetworzeniu, gdy nie zastosowano procedury czyszczenia, zaobserwowano łącznie 2 wyniki fałszywie dodatnie wśród 119 testowanych próbek ujemnych, co daje częstość fałszywie dodatnich wyników 1,7% (98,3% swoistość). Wszystkie trzy próbki dające fałszywe wyniki były ujemne w badaniu próbki kontroli ujemnej przed przetworzeniem. Różnica częstości fałszywie dodatnich wyników była nieistotna statystycznie; różnica -0,85% (95% przedział ufności: -5,16% do 3,00%). Aptima Specimen Transfer Kit 11 AW Rev. 001
12 Ograniczenia Badanie systemu ThinPrep 3000 Aptima Przeprowadzono badanie mające na celu określenie częstości fałszywie dodatnich wyników rejestrowanych przy stosowaniu testu Aptima HPV, gdy próbki do badania cytologicznego na podłożu płynnym ThinPrep zawierające znaczne stężenie komórek HPV-dodatnich z dodatkiem analitu, były przetwarzane w systemie ThinPrep 3000 na zmianę z próbkami HPV-negatywnymi. Próbki ujemne były otrzymywane przez dodanie do 20 ml roztworu PreservCyt 3 x 10 5 wyhodowanych komórek HPV-ujemnych. Przed przetworzeniem w systemie ThinPrep 3000, 1 ml każdej próbki ujemnej przeniesiono do probówki do przenoszenia próbek Aptima, ta część próbki stanowiła kontrolę ujemną przed przetworzeniem. Próbki HPV-dodatnie o wysokim mianie zostały utworzone przez dodanie do 20 ml roztworu PreservCyt 2 x 10 5 dodatnich pod względem HPV 16, wyhodowanych komórek i 1 x 10 5 komórek HPV-ujemnych. Próbki HPVdodatnie i HPV-ujemne były na zmianę przetwarzane w systemie ThinPrep 3000 zgodnie z instrukcją obsługi ThinPrep Z każdej próbki po przetworzeniu w systemie ThinPrep 3000 pobrano pewną ilość materiału ( próbki po przetworzeniu ) i przeniesiono ją do probówki do przenoszenia próbek Aptima. Próbki przed przetworzeniem i po przetworzeniu zostały zbadane za pomocą testu Aptima HPV. Obliczono częstość fałszywie dodatnich wyników w przypadku próbek kontroli ujemnej przed przetworzeniem i po przetworzeniu, oraz zastosowano dwustronny test mnożnika Lagrange a przy poziomie ufności 95%. Próbki ujemne po przetworzeniu dały jeden wynik fałszywie dodatni (1/120, 0,8%), natomiast w przypadku próbek ujemnych przed przetworzeniem nie zaobserwowano ani jednego fałszywie dodatniego wyniku (0/120, 0%). Badanie Aparatu ThinPrep 5000 z podajnikiem Autoloader (System ThinPrep 5000) Przeprowadzono badanie mające na celu określenie częstości fałszywie dodatnich wyników rejestrowanych przy stosowaniu testu Aptima HPV, gdy próbki do badania cytologicznego na podłożu płynnym ThinPrep zawierające znaczne stężenie komórek HPV-dodatnich z dodatkiem analitu były przetwarzane w systemie ThinPrep 5000 na zmianę z próbkami HPV-negatywnymi. Resztkowe, HPV-ujemne próbki do badania cytologicznego na podłożu płynnym zostały połączone i utworzyły próbki HPV-ujemne. Próbki HPV-dodatnie zostały przygotowane przez połączenie pozostałości próbek do badania cytologicznego na podłożu płynnym ThinPrep w pięć dużych pul ujemnych. Próbki dodatnie pod względem HPV typu 16 (SiHa) i próbki dodatnie pod względem HPV typu 18 (HeLa) zostały połączone w pule, dając stężenie 1 x 10 4 komórek/ml dla każdej linii komórek. Próbki HPV-dodatnie i HPV-ujemne były na zmianę przetwarzane w systemie ThinPrep 5000 zgodnie z instrukcją obsługi ThinPrep Z każdej próbki po przetworzeniu w systemie ThinPrep 5000 pobrano pewną ilość materiału ( próbki po przetworzeniu ) i przeniesiono ją do probówki do przenoszenia próbek Aptima. Próbki przed przetworzeniem i po przetworzeniu zostały zbadane za pomocą testu Aptima HPV. Obliczono częstość fałszywie dodatnich wyników dla próbek ujemnych przed przetworzeniem i po przetworzeniu. Próbki ujemne przed przetworzeniem i po przetworzeniu dały po jednym fałszywie dodatnim wyniku (1/250, 0,4%). Ograniczenia A. Wyniki testu Aptima nie były oceniane w badaniach tych samych próbek do cytologii, na podłożu płynnym ThinPrep, zarówno przed, jak i po przetworzeniu w systemie ThinPrep 2000, systemie ThinPrep 3000 System, ani w systemach ThinPrep B. Próbki do badania cytologicznego na podłożu płynnym przetwarzane w systemie ThinPrep 3000 ani w systemach ThinPrep 5000 nie były oceniane pod kątem stosowania z testami Aptima Combo 2, Aptima GC i Aptima CT. C. Próbki do badań cytologicznych na podłożu płynnym po przetworzeniu nie były badane pod kątem stosowania z testem Aptima Trichomonas vaginalis, ani testem Aptima Mycoplasma genitalium. D. Aptima Specimen Transfer kit oceniono przy użyciu próbek do badania cytologicznego na podłożu płynnym, pobranych albo za pomocą urządzenia typu miotełki lub typu wewnątrzszyjkowa szczoteczka/szpatułka. Możliwość zastosowania innych urządzeń do pobierania próbek nie była oceniana w testach Aptima. E. Nie oceniano wpływu procedury odkażania systemu ThinPrep 2000 na wyniki badania cytologicznego. Przed wprowadzeniem procedury odkażania, laboratoria powinny sprawdzić, czy nie ma ona wpływu na wyniki badań cytologicznych. Aptima Specimen Transfer Kit 12 AW Rev. 001
13 Aptima Ograniczenia F. Produktów tych może używać wyłącznie personel, który został przeszkolony w zakresie stosowania zestawu do przenoszenia próbek Aptima Specimen Transfer Kit oraz/lub zestawu roztworu do przenoszenia Aptima. G. Wzmacniacz wybielacza Aptima nie był oceniany pod kątem procedury odkażania systemu ThinPrep H. Nie przeprowadzono oceny wpływu usunięcia przed analizą cytologiczną 1 ml próbki do badania cytologicznego na podłożu płynnym SurePath na wynik badania. I. Jeśli w badaniu cytologicznym na podłożu płynnym są niewielkie ilości materiału komórkowego, może dojść do nierównomiernego rozkładu materiału, co może mieć z kolei wpływ na możliwość wykrycia organizmów docelowych w zebranym materiale. Jeśli ujemne wyniki badania próbki nie są zgodne z oceną kliniczną, może być konieczne pobranie nowej próbki. W porównaniu z bezpośrednim pobieraniem próbek przy użyciu podłoża transportowego do wymazów Aptima, dodatkowa objętość roztworu PreservCyt może być przyczyną większego rozcieńczenia materiału próbki. J. Na wyniki badania mogą mieć wpływ niewłaściwy sposób pobrania, przechowywania lub obróbki. Aptima Specimen Transfer Kit 13 AW Rev. 001
14 Ograniczenia Aptima Hologic, Inc Genetic Center Drive San Diego, CA USA Dział obsługi klientów: Hologic ( ) Dział pomocy technicznej: Więcej informacji zamieszczono na stronie EMERGO EUROPE Molenstraat BH The Hague Holandia Hologic, Aptima, Aptima Combo 2, PreservCyt, ThinPrep, i TransCyt i powiązane logo są znakami towarowymi lub zastrzeżonymi znakami towarowymi firmy Hologic, Inc. i/lub spółek zależnych w Stanach Zjednoczonych i/lub innych państwach. FISHERBRAND i BLOODBLOC są znakami handlowymi Fisher Scientific. RAININ jest znakiem handlowym Rainin Instrument, LLC. SUREPATH jest znakiem handlowym TriPath Imaging, Inc. Wszystkie inne znaki towarowe, które mogą pojawić się we wkładce do opakowania należą do ich odpowiednich właścicieli Hologic, Inc. All rights reserved. AW Rev Aptima Specimen Transfer Kit 14 AW Rev. 001
QMS Quality in Microbiology Scheme Wydanie 14 Data wydania: czerwiec 2018
 Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
Poniższe wytyczne dotyczą wszystkich rodzajów materiału klinicznego.
 Strona 1 z 5 Wytyczne dotyczące zlecania, pobierania, oznakowania, przechowywania, transportowania i rejestrowania próbek materiału klinicznego do badań w Pracowni PCR Niżej przedstawione wytyczne dotyczące
Strona 1 z 5 Wytyczne dotyczące zlecania, pobierania, oznakowania, przechowywania, transportowania i rejestrowania próbek materiału klinicznego do badań w Pracowni PCR Niżej przedstawione wytyczne dotyczące
Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów
 Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
HEMATOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
 HEMATOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi. Zdezynfekować
HEMATOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi. Zdezynfekować
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA. Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2019 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2019 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
THAMNOTOXKIT F Procedura testu
 THAMNOTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 LITR) - 5 FIOLEK ZE SKONCENTROWANYMI ROZTWORAMI SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 WLAĆ ZAWARTOŚĆ 5 FIOLEK
THAMNOTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 LITR) - 5 FIOLEK ZE SKONCENTROWANYMI ROZTWORAMI SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 WLAĆ ZAWARTOŚĆ 5 FIOLEK
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
OSTRACODTOXKIT F Procedura testu
 OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
Instrukcja postępowania z materiałem skażonym szkodliwymi czynnikami biologicznymi
 Instrukcja postępowania z materiałem skażonym szkodliwymi czynnikami biologicznymi Instrukcja postępowania z materiałem skażonym szkodliwymi czynnikami biologicznymi UWAGI OGÓLNE Materiały skażone szkodliwymi
Instrukcja postępowania z materiałem skażonym szkodliwymi czynnikami biologicznymi Instrukcja postępowania z materiałem skażonym szkodliwymi czynnikami biologicznymi UWAGI OGÓLNE Materiały skażone szkodliwymi
INSTRUKCJA UŻYTKOWANIA
 INSTRUKCJA UŻYTKOWANIA n Parasite Suspensions w formalinie PRZEZNACZENIE Preparaty Parasite Suspensions firmy Microbiologics są wykorzystywane w programach zapewniania jakości jako materiały porównawcze
INSTRUKCJA UŻYTKOWANIA n Parasite Suspensions w formalinie PRZEZNACZENIE Preparaty Parasite Suspensions firmy Microbiologics są wykorzystywane w programach zapewniania jakości jako materiały porównawcze
KOAGULOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
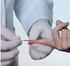 KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ
 MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Genomic Mini AX Bacteria+ Spin
 Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
Preparaty do sporządzania mieszaniny żywieniowej przechowujemy w suchym, czystym pomieszczeniu, w temperaturze pokojowej, chronimy od światła.
 Preparaty do sporządzania mieszaniny żywieniowej przechowujemy w suchym, czystym pomieszczeniu, w temperaturze pokojowej, chronimy od światła. Sporządzenie mieszaniny żywieniowej (worka) Przygotowujemy:
Preparaty do sporządzania mieszaniny żywieniowej przechowujemy w suchym, czystym pomieszczeniu, w temperaturze pokojowej, chronimy od światła. Sporządzenie mieszaniny żywieniowej (worka) Przygotowujemy:
AmpliTest Chlamydia/Chlamydophila (Real Time PCR)
 AmpliTest Chlamydia/Chlamydophila (Real Time PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla bakterii z rodzajów Chlamydia i Chlamydophila techniką Real Time PCR Nr kat.: BAC18-50 BAC18-100 Wielkość
AmpliTest Chlamydia/Chlamydophila (Real Time PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla bakterii z rodzajów Chlamydia i Chlamydophila techniką Real Time PCR Nr kat.: BAC18-50 BAC18-100 Wielkość
Zestaw do wykrywania Babesia spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych
 Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Zestaw do oczyszczania DNA po reakcjach enzymatycznych
 Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
AmpliTest Salmonella spp. (Real Time PCR)
 AmpliTest Salmonella spp. (Real Time PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla bakterii z rodzaju Salmonella techniką Real Time PCR Nr kat.: BAC01-50 Wielkość zestawu: 50 oznaczeń Objętość
AmpliTest Salmonella spp. (Real Time PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla bakterii z rodzaju Salmonella techniką Real Time PCR Nr kat.: BAC01-50 Wielkość zestawu: 50 oznaczeń Objętość
Genomic Maxi AX Direct
 Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
INSTRUKCJA STOSOWANIA
 Strona 1 z 6 INSTRUKCJA STOSOWANIA Zawiesiny pasożytów w formalinie PRZEZNACZENIE Zawiesiny pasożytów oferowane przez Microbiologics przeznaczone są do programów zapewnienia jakości tam, gdzie do przeprowadzenia
Strona 1 z 6 INSTRUKCJA STOSOWANIA Zawiesiny pasożytów w formalinie PRZEZNACZENIE Zawiesiny pasożytów oferowane przez Microbiologics przeznaczone są do programów zapewnienia jakości tam, gdzie do przeprowadzenia
SNAP* BVD. Bovine Virus Diarrhea Antigen Test Kit. Zestaw diagnostyczny do wykrywania antygenu wirusa biegunki i choroby błon śluzowych bydła (BVD-MD)
 SNAP* BVD Bovine Virus Diarrhea Antigen Test Kit Zestaw diagnostyczny do wykrywania antygenu wirusa biegunki i choroby błon śluzowych bydła (BVD-MD) 06-20814-01 Bovine Virus Diarrhea Antigen Test Kit
SNAP* BVD Bovine Virus Diarrhea Antigen Test Kit Zestaw diagnostyczny do wykrywania antygenu wirusa biegunki i choroby błon śluzowych bydła (BVD-MD) 06-20814-01 Bovine Virus Diarrhea Antigen Test Kit
SPIRODELA DUCKWEED TOXKIT Procedura testu
 SPIRODELA DUCKWEED TOXKIT Procedura testu 1 PRZYGOTOWANIE POŻYWKI WZROSTOWEJ I DO ROZCIEŃCZEŃ - KOLBKA MIAROWA (500 ml) - FIOLKI ZE STĘŻONYMI ROZTWORAMI POŻYWKI STEINBERG - CZYSTA WODA (dejonizowana lub
SPIRODELA DUCKWEED TOXKIT Procedura testu 1 PRZYGOTOWANIE POŻYWKI WZROSTOWEJ I DO ROZCIEŃCZEŃ - KOLBKA MIAROWA (500 ml) - FIOLKI ZE STĘŻONYMI ROZTWORAMI POŻYWKI STEINBERG - CZYSTA WODA (dejonizowana lub
Czyszczenie i dezynfekcja Głowica pomiarowa tonometru, szkła kontaktowe oraz zestaw dezynfekcyjny Desinset
 ČESKY БЪЛГАРСКИ MAGYAR POLSKI HRVATSKI ΕΛΛΗΝΙΚΗ DANSK NORSK INSTRUKCJA UŻYTKOWANIA Czyszczenie i dezynfekcja Głowica pomiarowa tonometru, szkła kontaktowe oraz zestaw dezynfekcyjny Desinset 2. Edycja /
ČESKY БЪЛГАРСКИ MAGYAR POLSKI HRVATSKI ΕΛΛΗΝΙΚΗ DANSK NORSK INSTRUKCJA UŻYTKOWANIA Czyszczenie i dezynfekcja Głowica pomiarowa tonometru, szkła kontaktowe oraz zestaw dezynfekcyjny Desinset 2. Edycja /
INSTRUKCJA UŻYTKOWANIA STRZYKAWEK I IGIEŁ
 INSTRUKCJA UŻYTKOWANIA STRZYKAWEK I IGIEŁ TELINJECT VARIO Ostrzeżenie: Firma TELINJECT GMBH nie ponosi odpowiedzialności za szkody powstałe w wyniku niewłaściwego użytkowania. Wymagania przepisów prawnych
INSTRUKCJA UŻYTKOWANIA STRZYKAWEK I IGIEŁ TELINJECT VARIO Ostrzeżenie: Firma TELINJECT GMBH nie ponosi odpowiedzialności za szkody powstałe w wyniku niewłaściwego użytkowania. Wymagania przepisów prawnych
AmpliTest GMO screening-nos (Real Time PCR)
 AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
Elektryczny otwieracz do wina
 Elektryczny otwieracz do wina Numer artykułu: 350 980 pl Instrukcja obsługi Tchibo GmbH D-22290 Hamburg 92230FV05X07VII 2017-05 Drodzy Klienci! Państwa nowy elektryczny otwieracz do wina umożliwia bardzo
Elektryczny otwieracz do wina Numer artykułu: 350 980 pl Instrukcja obsługi Tchibo GmbH D-22290 Hamburg 92230FV05X07VII 2017-05 Drodzy Klienci! Państwa nowy elektryczny otwieracz do wina umożliwia bardzo
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH
 Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Łódź pontonowa dla dzieci 180 x 90 cm
 Łódź pontonowa dla dzieci 180 x 90 cm Szanowny Kliencie, dziękujemy za zakup łodzi pontonowej dla dzieci. Prosimy o przeczytanie instrukcji i przestrzeganie podanych wskazówek i porad, aby mogli Państwo
Łódź pontonowa dla dzieci 180 x 90 cm Szanowny Kliencie, dziękujemy za zakup łodzi pontonowej dla dzieci. Prosimy o przeczytanie instrukcji i przestrzeganie podanych wskazówek i porad, aby mogli Państwo
Zestaw przeznaczony jest do całkowitej izolacji RNA z bakterii, drożdży, hodowli komórkowych, tkanek oraz krwi świeżej (nie mrożonej).
 Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Allergen FlowThrough ALERGENY. Do oceny skuteczności procesu mycia (Zaakceptowane/odrzucone)
 Allergen FlowThrough Do oceny skuteczności procesu mycia (Zaakceptowane/odrzucone) ALERGENY Badanie jakościowe Wymaz: min. Ekstrakcja: min. Test: 0 min. Czas łączny: 2 min. Testy jakościowe do wykrywania
Allergen FlowThrough Do oceny skuteczności procesu mycia (Zaakceptowane/odrzucone) ALERGENY Badanie jakościowe Wymaz: min. Ekstrakcja: min. Test: 0 min. Czas łączny: 2 min. Testy jakościowe do wykrywania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
ROTA-ADENO Virus Combo Test Device
 Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 29 kwietnia 2016 r. Poz. 600 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 11 kwietnia 2016 r. w sprawie szczegółowych rodzajów środków bezpieczeństwa
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 29 kwietnia 2016 r. Poz. 600 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 11 kwietnia 2016 r. w sprawie szczegółowych rodzajów środków bezpieczeństwa
fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 Sierpień 2018
 Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Zestaw do izolacji genomowego DNA z drożdży
 Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Zestaw do wykrywania Anaplasma phagocytophilum w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Cyfrowa waga bagażowa z wyświetlaczem LCD (do 40 kg)
 Cyfrowa waga bagażowa z wyświetlaczem LCD (do 40 kg) Szanowny Kliencie, dziękujemy za zakup praktycznej cyfrowej wagi bagażowej z wyświetlaczem LCD. Prosimy o przeczytanie instrukcji i przestrzeganie podanych
Cyfrowa waga bagażowa z wyświetlaczem LCD (do 40 kg) Szanowny Kliencie, dziękujemy za zakup praktycznej cyfrowej wagi bagażowej z wyświetlaczem LCD. Prosimy o przeczytanie instrukcji i przestrzeganie podanych
K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE
 K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE Postępowanie analityczne, znane pod nazwą miareczkowania konduktometrycznego, polega na wyznaczeniu punktu końcowego miareczkowania
K1. KONDUKTOMETRYCZNE MIARECZKOWANIE STRĄCENIOWE I KOMPLEKSOMETRYCZNE Postępowanie analityczne, znane pod nazwą miareczkowania konduktometrycznego, polega na wyznaczeniu punktu końcowego miareczkowania
Wydanie 3 EGZ. NADZOROWANY
 Strona 1 z 6 Opracował Asystent Elżbieta Półtorak 04.03.2011r. Stanowisko, imię i nazwisko: Data: Podpis Sprawdził Szef ZDL Andrzej Białek 08.03.2011r. Stanowisko, imię i nazwisko: Data: Podpis Zatwierdził
Strona 1 z 6 Opracował Asystent Elżbieta Półtorak 04.03.2011r. Stanowisko, imię i nazwisko: Data: Podpis Sprawdził Szef ZDL Andrzej Białek 08.03.2011r. Stanowisko, imię i nazwisko: Data: Podpis Zatwierdził
PROCEDURA SYSTEMU ZARZĄDZANIA JAKOŚCIĄ WSPRiTS MEDITRANS SP ZOZ w Warszawie ISO 9001:2008 PROCEDURA DEZYNFEKCJI I MYCIA AMBULANSU
 ISO 9001:008 Nr wersji - Nr egz. 1 1 z 6 DATA PODPIS Główny Specjalista ds. OPRACOWAŁ Pielęgniarstwa oraz Średniego i Niższego Personelu Medycznego 0.04.009r. Ewa Ślązak Ewa Ślązak ZATWIERDZIŁ Dyrektor
ISO 9001:008 Nr wersji - Nr egz. 1 1 z 6 DATA PODPIS Główny Specjalista ds. OPRACOWAŁ Pielęgniarstwa oraz Średniego i Niższego Personelu Medycznego 0.04.009r. Ewa Ślązak Ewa Ślązak ZATWIERDZIŁ Dyrektor
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
1. Zamawiający: 2. Opis przedmiotu zamówienia:
 Zapytanie ofertowe na dostawę analizatora wraz z oprogramowaniem do automatycznej izolacji, amplifikacji i detekcji sekwencji DNA wirusów brodawczaka ludzkiego typu wysokiego ryzyka (hr-hpv) metodą PCR
Zapytanie ofertowe na dostawę analizatora wraz z oprogramowaniem do automatycznej izolacji, amplifikacji i detekcji sekwencji DNA wirusów brodawczaka ludzkiego typu wysokiego ryzyka (hr-hpv) metodą PCR
Zakład Patologii i Diagnostyki Laboratoryjnej
 1. Zasady transportu materiału do badań patomorfologicznych z jednostki zewnętrznej. 1.1. może być przeprowadzany jedynie przez przeszkolone, wyznaczone do tego celu osoby lub samego pacjenta w przypadku
1. Zasady transportu materiału do badań patomorfologicznych z jednostki zewnętrznej. 1.1. może być przeprowadzany jedynie przez przeszkolone, wyznaczone do tego celu osoby lub samego pacjenta w przypadku
Końcówka do odkurzacza przeciw roztoczom ze sterylizacją UV
 Końcówka do odkurzacza przeciw roztoczom ze sterylizacją UV Szanowny Kliencie, dziękujemy za zakup końcówki do odkurzacza z funkcją sterylizacji UV. Prosimy o przeczytanie instrukcji i przestrzeganie podanych
Końcówka do odkurzacza przeciw roztoczom ze sterylizacją UV Szanowny Kliencie, dziękujemy za zakup końcówki do odkurzacza z funkcją sterylizacji UV. Prosimy o przeczytanie instrukcji i przestrzeganie podanych
ELEKTROFOREZA. Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM
 Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
INSTRUKCJE POBIERANIA MATERIAŁU DO BADANIA
 ul. Zaliwskiego 9a, 04-145 Warszawa NIP: 1131047646, REGON 01314486400045 INSTRUKCJE POBIERANIA MATERIAŁU DO BADANIA I. Pobieranie wymazów z jamy ustnej Przygotowanie osób biorących udział w badaniu: -
ul. Zaliwskiego 9a, 04-145 Warszawa NIP: 1131047646, REGON 01314486400045 INSTRUKCJE POBIERANIA MATERIAŁU DO BADANIA I. Pobieranie wymazów z jamy ustnej Przygotowanie osób biorących udział w badaniu: -
Badania mikrobiologiczne wg PN-EN ISO 11737
 Badania mikrobiologiczne wg PN-EN ISO 11737 mgr Agnieszka Wąsowska Specjalistyczne Laboratorium Badawcze ITA-TEST Z-ca Dyrektora ds. Badań Kierownik Zespołu Badań Mikrobiologicznych i Chemicznych Tel.022
Badania mikrobiologiczne wg PN-EN ISO 11737 mgr Agnieszka Wąsowska Specjalistyczne Laboratorium Badawcze ITA-TEST Z-ca Dyrektora ds. Badań Kierownik Zespołu Badań Mikrobiologicznych i Chemicznych Tel.022
Genomic Micro AX Swab Gravity Plus
 Genomic Micro AX Swab Gravity Plus Zestaw do izolacji genomowego DNA z wymazów metodą grawitacyjną. W skład zestawu wchodzą wymazówki. wersja 0517 100 izolacji Nr kat. 105-100P Pojemność kolumny do oczyszczania
Genomic Micro AX Swab Gravity Plus Zestaw do izolacji genomowego DNA z wymazów metodą grawitacyjną. W skład zestawu wchodzą wymazówki. wersja 0517 100 izolacji Nr kat. 105-100P Pojemność kolumny do oczyszczania
Total RNA Zol-Out. 25 izolacji, 100 izolacji
 Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
ZALECENIE POBIERANIE, TRANSPORT I PRZECHOWYWANIE PRÓBKI KRWI DO BADANIA WIRUSOLOGICZNEGO/ BAKTERIOLOGICZNEGO
 PRÓBKI KRWI / BAKTERIOLOGICZNEGO 1. Do jałowej probówki pobrać jałowo krew NA SKRZEP 3 4 ml krwi żylnej. Uwaga: W trakcie pobierania krwi nie trzeba być na czczo 5. Próbkę krwi dostarczyć do badania w
PRÓBKI KRWI / BAKTERIOLOGICZNEGO 1. Do jałowej probówki pobrać jałowo krew NA SKRZEP 3 4 ml krwi żylnej. Uwaga: W trakcie pobierania krwi nie trzeba być na czczo 5. Próbkę krwi dostarczyć do badania w
Miernik chloru Extech CL200
 INSTRUKCJA OBSŁUGI Miernik chloru Extech CL200 Nr produktu 121628 Strona 1 z 8 Opis miernika CL 200 Opis przedniego panelu Funkcje przycisków ExStik s zmieniają się w zależności od podpiętej elektrody
INSTRUKCJA OBSŁUGI Miernik chloru Extech CL200 Nr produktu 121628 Strona 1 z 8 Opis miernika CL 200 Opis przedniego panelu Funkcje przycisków ExStik s zmieniają się w zależności od podpiętej elektrody
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.0 Numer zadania: 01 Wypełnia
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.0 Numer zadania: 01 Wypełnia
EZ-Accu Shot TM Microorganisms
 EZ-Accu Shot TM Microorganisms OPIS PRODUKTU EZ-Accu Shot TM Microorganisms są to preparaty liofilizowanych mikroorganizmów dające
EZ-Accu Shot TM Microorganisms OPIS PRODUKTU EZ-Accu Shot TM Microorganisms są to preparaty liofilizowanych mikroorganizmów dające
Wojewódzka Stacja Sanitarno-Epidemiologiczna w Poznaniu
 Wojewódzka Stacja Sanitarno-Epidemiologiczna w Poznaniu PROGRAM WHO ELIMINACJI ODRY/RÓŻYCZKI Program eliminacji odry i różyczki został uchwalony przez Światowe Zgromadzenie Zdrowia 28 maja 2003 roku. Realizacja
Wojewódzka Stacja Sanitarno-Epidemiologiczna w Poznaniu PROGRAM WHO ELIMINACJI ODRY/RÓŻYCZKI Program eliminacji odry i różyczki został uchwalony przez Światowe Zgromadzenie Zdrowia 28 maja 2003 roku. Realizacja
4. Składowanie. Preparatu nie należy składować razem z produktami spożywczymi, napojami oraz paszami.
 Cillit -Neutra Cillit-Neutra przeznaczony jest do neutralizacji zużytych roztworów Cillit (patrz: karta katalogowa L 06), szczególnie przed ich odprowadzeniem do kanalizacji, jak również do podwyższania
Cillit -Neutra Cillit-Neutra przeznaczony jest do neutralizacji zużytych roztworów Cillit (patrz: karta katalogowa L 06), szczególnie przed ich odprowadzeniem do kanalizacji, jak również do podwyższania
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Preparat podawać zewnętrznie, bezpośrednio na skórę. Nie kąpać zwierząt 2 dni przed i 2 dni po zastosowaniu produktu.
 Strona 1 z 5 Strona 2 z 5 0,5 g/100 ml Roztwór na skórę dla psów i kotów. SKŁAD: Fipronil 0,5 g/100 ml DAWKOWANIE I DROGA PODANIA: Preparat podawać zewnętrznie, bezpośrednio na skórę. Nie kąpać zwierząt
Strona 1 z 5 Strona 2 z 5 0,5 g/100 ml Roztwór na skórę dla psów i kotów. SKŁAD: Fipronil 0,5 g/100 ml DAWKOWANIE I DROGA PODANIA: Preparat podawać zewnętrznie, bezpośrednio na skórę. Nie kąpać zwierząt
JAK PRAWIDŁOWO, BEZPIECZNIE I KOMFORTOWO KORZYSTAĆ Z GLUKOMETRU.
 JAK PRAWIDŁOWO, BEZPIECZNIE I KOMFORTOWO KORZYSTAĆ Z GLUKOMETRU. Niniejszy materiał ma wyłącznie cel informacyjny. Przed rozpoczęciem użytkowania należy zapoznać się z instrukcjami użycia glukometru, pasków
JAK PRAWIDŁOWO, BEZPIECZNIE I KOMFORTOWO KORZYSTAĆ Z GLUKOMETRU. Niniejszy materiał ma wyłącznie cel informacyjny. Przed rozpoczęciem użytkowania należy zapoznać się z instrukcjami użycia glukometru, pasków
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
gdzie m w określa masę węglowodoru, a m r masę całego roztworu. Wyniki zanotować w tabeli. cpods
 Oznaczanie węglowodorów ropopochodnych w wodach i ściekach z zastosowanie techniki analizy fazy nadpowierzchniowej i chroatografii gazowej (Headspace-CG-MS) Wykonanie ćwiczenia Materiały, przyrządy i odczynniki:
Oznaczanie węglowodorów ropopochodnych w wodach i ściekach z zastosowanie techniki analizy fazy nadpowierzchniowej i chroatografii gazowej (Headspace-CG-MS) Wykonanie ćwiczenia Materiały, przyrządy i odczynniki:
ELEKTRYCZNY GARNEK DO GOTOWANIA RYŻU RC-12
 Instrukcja obsługi ELEKTRYCZNY GARNEK DO GOTOWANIA RYŻU RC-12 Przed użyciem urządzenia należy zapoznać się z jego instrukcją. Urządzenie należy używać tylko w sposób opisany w niniejszej instrukcji obsługi.
Instrukcja obsługi ELEKTRYCZNY GARNEK DO GOTOWANIA RYŻU RC-12 Przed użyciem urządzenia należy zapoznać się z jego instrukcją. Urządzenie należy używać tylko w sposób opisany w niniejszej instrukcji obsługi.
Co ma wspólnego ludzka dwunastnica z proszkiem do. prania?
 1 Co ma wspólnego ludzka dwunastnica z proszkiem do prania? Czas trwania zajęć: 45 minut Potencjalne pytania badawcze: 1. Czy lipazy zawarte w proszku do prania rozkładają tłuszcze roślinne? 2. Jaka jest
1 Co ma wspólnego ludzka dwunastnica z proszkiem do prania? Czas trwania zajęć: 45 minut Potencjalne pytania badawcze: 1. Czy lipazy zawarte w proszku do prania rozkładają tłuszcze roślinne? 2. Jaka jest
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 ZASADY OCENIANIA
 Układ graficzny CKE 2017 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Prowadzenie
Układ graficzny CKE 2017 EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 ZASADY OCENIANIA Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Nazwa kwalifikacji: Prowadzenie
Stosowanie w skali laboratoryjnej
 Stosowanie w skali laboratoryjnej Spis treści Velcorin Stosowanie w skali laboratoryjnej str. 3 5 Wprowadzenie str. 3 Środki ostrożności str. 3 Metoda pracy (sensorycznie) str. 4 Metoda pracy (mikrobiologicznie)
Stosowanie w skali laboratoryjnej Spis treści Velcorin Stosowanie w skali laboratoryjnej str. 3 5 Wprowadzenie str. 3 Środki ostrożności str. 3 Metoda pracy (sensorycznie) str. 4 Metoda pracy (mikrobiologicznie)
Grupa SuperTaniaApteka.pl Utworzono : 30 wrzesień 2016
 TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Mikser recepturowy. sylaba. serii MR. instrukcja obsługi FARMAS, 2013. sylaba MR instrukcja obsługi 1
 Mikser recepturowy sylaba serii MR instrukcja obsługi FARMAS, 2013 sylaba MR instrukcja obsługi 1 Wstęp Gratulujemy nabycia miksera recepturowego sylaba serii MR. Jest to urządzenie, które znacząco ułatwi
Mikser recepturowy sylaba serii MR instrukcja obsługi FARMAS, 2013 sylaba MR instrukcja obsługi 1 Wstęp Gratulujemy nabycia miksera recepturowego sylaba serii MR. Jest to urządzenie, które znacząco ułatwi
10) istotne kliniczne dane pacjenta, w szczególności: rozpoznanie, występujące czynniki ryzyka zakażenia, w tym wcześniejsza antybiotykoterapia,
 Załącznik nr 2 Standardy jakości w zakresie mikrobiologicznych badań laboratoryjnych, w tym badań technikami biologii molekularnej, oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji
Załącznik nr 2 Standardy jakości w zakresie mikrobiologicznych badań laboratoryjnych, w tym badań technikami biologii molekularnej, oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji
Elcometer 134A. Zestaw do wykrywania chlorków soli w ścierniwie. Instrukcja obsługi
 Elcometer 134A Zestaw do wykrywania chlorków soli w ścierniwie Instrukcja obsługi Zawartość 1.0. Ważne uwagi 2.0. Zakres dostawy 3.0. Obsługa 4.0. Specyfikacja rurki miareczkującej 4.1. Właściwości 4.2.
Elcometer 134A Zestaw do wykrywania chlorków soli w ścierniwie Instrukcja obsługi Zawartość 1.0. Ważne uwagi 2.0. Zakres dostawy 3.0. Obsługa 4.0. Specyfikacja rurki miareczkującej 4.1. Właściwości 4.2.
Instrukcja dla kleju TL-T70 TRI-FREE Bez Trichloroetenu
 Instrukcja dla kleju TL-T70 TRI-FREE Bez Trichloroetenu Nilos Polska Ul. Kosynierów 38 41-219 Sosnowiec 32 266 80 15 biuro@nilospolska.pl www.nilospolska.pl Strona 1 Instrukcja dla TOPGUM TL-T70 Wymagania
Instrukcja dla kleju TL-T70 TRI-FREE Bez Trichloroetenu Nilos Polska Ul. Kosynierów 38 41-219 Sosnowiec 32 266 80 15 biuro@nilospolska.pl www.nilospolska.pl Strona 1 Instrukcja dla TOPGUM TL-T70 Wymagania
EZ-CFU TM One Step Microorganisms
 EZ-CFU TM One Step Microorganisms OPIS PRODUKTU EZ-CFU TM One Step są liofilizowanymi preparatami szczepów referencyjnych przeznaczonymi do przeprowadzania kontroli w laboratoriach mikrobiologicznych.
EZ-CFU TM One Step Microorganisms OPIS PRODUKTU EZ-CFU TM One Step są liofilizowanymi preparatami szczepów referencyjnych przeznaczonymi do przeprowadzania kontroli w laboratoriach mikrobiologicznych.
Genomic Micro AX Blood Gravity 96-well
 Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Zestaw do izolacji DNA z wymazów oraz nasienia
 Nr kat. EM06 Wersja: 1.2018 Zestaw do izolacji DNA z wymazów oraz nasienia EXTRACTME is a registered trademark of BLIRT S.A. www.blirt.eu Nr kat. EM06 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA SWAB
Nr kat. EM06 Wersja: 1.2018 Zestaw do izolacji DNA z wymazów oraz nasienia EXTRACTME is a registered trademark of BLIRT S.A. www.blirt.eu Nr kat. EM06 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA SWAB
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
Lampka stołowa LED. Instrukcja obsługi. Tchibo GmbH D Hamburg 85677FV04X00VI
 Lampka stołowa LED pl Instrukcja obsługi Tchibo GmbH D-22290 Hamburg 85677FV04X00VI 2016-01 328 108 Drodzy Klienci! Państwa nowa lampka stołowa LED emituje przyjemnie miękkie światło. Jest odporna na wpływy
Lampka stołowa LED pl Instrukcja obsługi Tchibo GmbH D-22290 Hamburg 85677FV04X00VI 2016-01 328 108 Drodzy Klienci! Państwa nowa lampka stołowa LED emituje przyjemnie miękkie światło. Jest odporna na wpływy
Karta charakterystyki mieszaniny
 Strona 1 z 5 1. łuidentyfikacja substancji / i identyfikacja przedsiębiorstwa a. Nazwa chemiczna produktu biodegradowalny poliester b. Zastosowanie tworzywo drukujące w technologii FDM c. Typ chemiczny
Strona 1 z 5 1. łuidentyfikacja substancji / i identyfikacja przedsiębiorstwa a. Nazwa chemiczna produktu biodegradowalny poliester b. Zastosowanie tworzywo drukujące w technologii FDM c. Typ chemiczny
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX. 20 izolacji
 Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE ZASADY INSTRUKCJE
 NARODOWY INSTYTUT ZDROWIA PUBLICZNEGO - PAŃSTWOWY ZAKŁAD HIGIENY ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE ZASADY INSTRUKCJE ZAKŁAD WIRUSOLOGII NIZP-PZH UL. CHOCIMSKA 24 00-791 WARSZAWA
NARODOWY INSTYTUT ZDROWIA PUBLICZNEGO - PAŃSTWOWY ZAKŁAD HIGIENY ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE ZASADY INSTRUKCJE ZAKŁAD WIRUSOLOGII NIZP-PZH UL. CHOCIMSKA 24 00-791 WARSZAWA
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
Blender z nasadką ze stali nierdzewnej z akcesoriami
 Blender z nasadką ze stali nierdzewnej z akcesoriami Szanowny Kliencie, dziękujemy za zakup blendera ze stali nierdzewnej z akcesoriami. Prosimy o przeczytanie instrukcji i przestrzeganie podanych wskazówek
Blender z nasadką ze stali nierdzewnej z akcesoriami Szanowny Kliencie, dziękujemy za zakup blendera ze stali nierdzewnej z akcesoriami. Prosimy o przeczytanie instrukcji i przestrzeganie podanych wskazówek
Warszawa, dnia 5 sierpnia 2014 r. Poz. 1035
 Warszawa, dnia 5 sierpnia 2014 r. Poz. 1035 OBWIESZCZENIE ministra gospodarki z dnia 4 czerwca 2014 r. w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra Gospodarki w sprawie sposobu pobierania
Warszawa, dnia 5 sierpnia 2014 r. Poz. 1035 OBWIESZCZENIE ministra gospodarki z dnia 4 czerwca 2014 r. w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra Gospodarki w sprawie sposobu pobierania
CERTYFIKAT TESTÓW 13Y-JET0078
 13Y-JET0078 CERTYFIKAT TESTÓW Niniejszym potwierdzamy, że poniższe urządzenie elektryczne przekazane do testów w naszym laboratorium w dniu 19 czerwca 2013 r. (nr odbioru D13Y0181) jest zgodne z wymaganiami
13Y-JET0078 CERTYFIKAT TESTÓW Niniejszym potwierdzamy, że poniższe urządzenie elektryczne przekazane do testów w naszym laboratorium w dniu 19 czerwca 2013 r. (nr odbioru D13Y0181) jest zgodne z wymaganiami
Instrukcja dla klejów TL-PVC oraz TL-W
 Instrukcja dla klejów TL-PVC oraz TL-W Nilos Polska Ul. Kosynierów 38 41-219 Sosnowiec 32 266 80 15 biuro@nilospolska.pl www.nilospolska.pl Strona 1 Instrukcja dla TOPGUM TL-PVC oraz TL-W Wymagania materiałowe
Instrukcja dla klejów TL-PVC oraz TL-W Nilos Polska Ul. Kosynierów 38 41-219 Sosnowiec 32 266 80 15 biuro@nilospolska.pl www.nilospolska.pl Strona 1 Instrukcja dla TOPGUM TL-PVC oraz TL-W Wymagania materiałowe
D10. Suma Bac D10. Preparat myjąco - dezynfekcyjny. Opis. Cechy. Właściwości. Sposób użycia
 Preparat myjąco - dezynfekcyjny Opis Suma Bac D10 jest skoncentrowanym preparatem myjąco-dezynfekcyjnym, przeznaczonym do mycia i dezynfekcji powierzchni i urządzeń w przemyśle spożywczym i gastronomii,
Preparat myjąco - dezynfekcyjny Opis Suma Bac D10 jest skoncentrowanym preparatem myjąco-dezynfekcyjnym, przeznaczonym do mycia i dezynfekcji powierzchni i urządzeń w przemyśle spożywczym i gastronomii,
Techniki molekularne ćw. 1 1 z 6
 Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
Informacje o producencie / dostawcy
 data druku: 01.06.2010 1 strona 1. NAZWA SUBSTANCJI LUB PREPARATU i NAZWA FIRMY Informacje o produkcie Nazwa handlowa: Hüppe Top Plus Informacje o producencie / dostawcy Producent / dostawca: Ulica/skrytka
data druku: 01.06.2010 1 strona 1. NAZWA SUBSTANCJI LUB PREPARATU i NAZWA FIRMY Informacje o produkcie Nazwa handlowa: Hüppe Top Plus Informacje o producencie / dostawcy Producent / dostawca: Ulica/skrytka
Karta charakterystyki Według Dz.U.11 poz.84 z 2001r./ dyrektywy UE 91/155/EEC Data wydania: Zastępuje wydanie z
 Karta charakterystyki Data wydania: 20.02.2004 Zastępuje wydanie z 17.02.2003 Producent: Merck KGaA * D-64271 Darmstadt * Tel: +49 6151 72-2440 Dystrybutor: Merck Sp. z o.o. * Al. Jerozolimskie 178 * 02-486
Karta charakterystyki Data wydania: 20.02.2004 Zastępuje wydanie z 17.02.2003 Producent: Merck KGaA * D-64271 Darmstadt * Tel: +49 6151 72-2440 Dystrybutor: Merck Sp. z o.o. * Al. Jerozolimskie 178 * 02-486
MASZYNA DO CZYSZCZENIA BUTÓW
 Instrukcja instalowania, obsługi i konserwacji MASZYNA DO CZYSZCZENIA BUTÓW Szanowny Kliencie Przed podłączeniem urządzenia dokładnie przeczytaj całą instrukcję obsługi, aby niewłaściwym użytkowaniem nie
Instrukcja instalowania, obsługi i konserwacji MASZYNA DO CZYSZCZENIA BUTÓW Szanowny Kliencie Przed podłączeniem urządzenia dokładnie przeczytaj całą instrukcję obsługi, aby niewłaściwym użytkowaniem nie
