Planowanie badań stabilności i minimalizacja liczby badań
|
|
|
- Mikołaj Kowalewski
- 8 lat temu
- Przeglądów:
Transkrypt
1 NARZĘDZIA STATYSTYCZNE W BADANIACH TRWAŁOŚCI PRODUKTU LECZNICZEGO Dorota Osiecka, Gedeon Richter Polska Sp. z o.o. Wstęp Obowiązek prowadzenia badań stabilności jest jednym z wielu wymagań nałożonych na firmy farmaceutyczne, zarówno przez organy państwowe, jak i międzynarodowe. Badania stabilności są prowadzone jednak nie tylko ze względu na wymagania prawne, ale także dlatego, że stabilność zarówno substancji aktywnych API, jak i produktów leczniczych jest jednym z krytycznych parametrów procesu wytwarzania i dystrybucji gotowych wyrobów. Wiedza o trwałości własnego produktu pozwala firmie budować jakość projektowanych produktów leczniczych, potwierdzić termin ważności nowo zarejestrowanych produktów oraz kontrolować jakość (a tym samym dbać o zdrowie pacjenta i bezpieczne stosowanie) produktów leczniczych będących na rynku oraz dbać o własny wizerunek i budować zaufanie pacjentów. Badania stabilności wykonywane są w celu określenia: zmienności produktu w czasie, w krytycznych warunkach środowiskowych (temperatury, wilgotności i oświetlenia), odpowiednich warunków przechowywania, określenia lub potwierdzania specyfikacji wyrobu gotowego (zarówno w czasie zwalniania, jak i w ciągu całego okresu ważności), uzasadnienia zaproponowanego okresu ważności. Aby odpowiednio zaprojektować, dobrze prowadzić oraz prawidłowo zinterpretować wyniki tych długotrwałych i czasochłonnych badań, coraz częściej posługujemy się różnorodnymi zdobyczami technicznymi i naukowymi. Zaliczenie tu wnioskowań opartych na metodach statystycznych wydaje się w pełni uzasadnione. Planowanie badań stabilności i minimalizacja liczby badań Badania stabilności, szczególnie te prowadzone przed wprowadzeniem produktu leczniczego na rynek, aby dostarczać pełnej informacji o naszym produkcie, powinny uwzględniać wpływ różnorodnych czynników przez długi okres czasu. Dodatkowo należy wykonać Copyright StatSoft Polska
2 badania w wielu kolejnych punktach czasowych. Powyższe czynniki sprawiają, że pełne badania stabilności wymagają długiego kilkuletniego okresu czasu, a dodatkowo są bardzo rozbudowane. Aby ograniczać te kosztowne i długotrwałe badania, coraz częściej stosuje się programy redukcji testów. Dwa najpopularniejsze, rekomendowane przez ICH, metody redukcji liczby badań to: bracketing i matrixing 1. Te opierające się na statystyce metody projektowania doświadczeń (badań stabilności) można stosować, z pewnymi ograniczeniami, na wszystkich etapach życia produktu (tabela 1). Tabela 1. Zastosowanie planów redukcji testów. Faza rozwoju Przedrozwojowe badania stabilności Fazy kliniczne I - III Przyspieszone i długoterminowe badania serii rejestracyjnych Badania stabilności on going Badania stabilności follow - up Preferowana procedura redukcji bracketing bracketing bracketing / matrixing matrixing matrixing Bracketing jest metodą, w której redukcja opiera się na testowaniu we wszystkich zalecanych punktach czasowych tylko skrajnych obiektów doświadczalnych. Czynnikami, które możemy uwzględnić w planie redukcji testów z wykorzystaniem tej metody, i które generują nam plan badań stabilności, są: różne dawki tego samego produktu i różne wielkości/różne ilości wypełniania opakowań. Stabilność na wszystkich pośrednich poziomach jest reprezentowana przez najmniej stabilną skrajny obiekt doświadczalny. Przy wyborze obiektów eksperymentalnych należy wziąć pod uwagę także liczbę badanych dawek i rodzajów opakowań; czasami badanie tylko skrajnych obiektów może okazać się zbyt małym zbiorem. Ponieważ ten plan redukcji przewiduje wykonywanie badań we wszystkich punktach czasowych dla wybranych obiektów, powinien być stosowany w przypadkach konieczności wykrywania i śledzenia trendów. Matrixing jest metodą tworzenia zredukowanego planu badań poprzez wybór podzbiorów ze wszystkich możliwych prób (ze wszystkimi możliwymi kombinacjami czynników wpływających na stabilność), które są sekwencyjnie badane w kolejnych punktach czasowych. Stosując tę metodę redukcji, zakładamy, że każdy podzbiór reprezentuje stabilność wszystkich prób w danym punkcie czasowym. Czynniki projektowania: redukcję badań należy wypośrodkować tak, aby mieć możliwość obserwowania wpływu wszystkich czynników podobnie jak w pełnych badaniach stabilności (wszystkie plany powinny zachowywać dostateczną zdolność wykrywania zmienności w obrębie jednego czynnika, jak i pomiędzy czynnikami), 1 International Conference on Harmonization. Q1D: Bracketing and Matrixing Designs for Stability Testing of New Drug Substances and Products CPMP/ICH/4104/00-ICH February Copyright StatSoft Polska 2014
3 w ciągu pierwszych 12 miesięcy trzy punkty powinny być przebadane w każdym przypadku, wszystkie przypadki powinny być przebadane na początku i na końcu oraz po każdych 12 miesiącach, dla badań przyspieszonych i pośrednich każdy przypadek powinien być przebadany w co najmniej trzech punktach czasowych. Stosowanie tej metody niesie pewne ograniczenia podczas ustalania terminu ważności z wykorzystaniem danych uzyskanych dzięki matrixingowi. Badania stabilności prowadzone zgodnie z tym planem redukcji nie stanowią dostatecznej podstawy do wykrycia wpływu niektórych czynników lub interakcji czynników na stabilność produktu (powodując błędne wnioskowanie o równoważności serii). Oszacowany na podstawie tych danych termin ważności jest krótszy, a szacowanie przebiega z mniejszą precyzją. Powyższe ograniczenia powodują, że metoda ta jest częściej wykorzystywana w badaniach potwierdzających proponowany/przewidywany okres trwałości dla produktów wykazujących niewielką zmienność. Zastosowanie planów redukcji testów w badaniach stabilności ułatwia i przyspiesza proces uzyskania wyników, danych koniecznych do oszacowania terminu ważności lub wpływu różnorodnych warunków na badany produkt. Zastosowanie ich ma jednak swoje wady, wpływ pewnych czynników lub kombinacji tych czynników nie jest dobrze widoczny, dlatego zawsze zastosowanie planów redukcji powinno być działaniem dobrze przemyślanym i naukowo uzasadnionym. Przewidywania trwałości na podstawie badań stresowych Pierwsze zalecenia dotyczące badania trwałości zostały opracowane przez Federalny Urząd do spraw Żywności i Leków (FDA) w 1987 r. Europejska Agencja do spraw Oceny Środków Leczniczych (EMEA) wydała pierwsze wytyczne odnoszące się do kontroli parametrów trwałości w 1995 r., a w roku 2003 ukazały się wytyczne łączące zalecenia FDA i EMEA. Trwałość jest to przede wszystkim odporność na działanie czynników fizycznych i chemicznych. Metodyka oceny trwałości opiera się na badaniu kinetyki reakcji rozkładu substancji czynnej produktów rozkładu. Reakcje rozkładu często przebiegają bardzo wolno, z tego powodu badania trwałości nowego produktu leczniczego w warunkach normalnych są długotrwałe i nieekonomiczne. Za pomocą statystyki jest możliwe, na podstawie uzyskanych w ten sposób danych, przewidywanie wyników z badań długookresowych oraz ustalenie możliwego zakresu terminu ważności. Dotyczy to szczególnie danych uzyskanych z badań przyspieszonego starzenia i stresowych, prowadzonych w różnych temperaturach, które można ze sobą porównywać dzięki zastosowaniu równania Arrheniusa. Analizując kinetykę reakcji, można w krótkim czasie oszacować wielkość zmian zachodzących w postaci leku po dłuższym okresie przechowywania w określonych dla produktu leczniczego warunkach. Znalezienie najbardziej stabilnej postaci leku dla nowego produktu leczniczego jest sprawą bardzo istną dla powodzenia całego procesu wdrożenia. Dodatkowym wyzwaniem na tym Copyright StatSoft Polska
4 etapie jest czas badania powinny być zakończone tak szybko, jak tylko to jest możliwe. Dlatego więc, zgodnie z wytyczną ICH 2, przeprowadza się badania przyspieszone uwzględniające efekt wzrostu temperatury co 10. Przy ocenie wyników stosuje się dobrze poznaną teorię Arrheniusa, która pozwala poprzez ekstrapolację przewidzieć trwałość produktu (w warunkach normalnych w 25 C). Pierwszym krokiem w ustalaniu najbardziej trwałej formy farmaceutycznej jest ustalenie, czy pomiędzy zmiennymi (zawartość substancji czynnej i warunki przechowywania, np. temperatura) istnieje statystycznie istotna korelacja poprzez wyznaczanie współczynnika korelacji. Jeśli stwierdzi się taką korelację, oznaczającą rozkład substancji czynnej pod wpływem temperatury w czasie, należy dopasować kinetyczny model reakcji rozkładu, wykonując następujące kroki: dane uzyskane z różnych temperatur należy dopasować do kinetycznego modelu reakcji rozkładu: zerowego lub pierwszego rzędu, przez analizę regresji, odpowiednio liniową lub nieliniową, uzasadnienie statystyczne obu modeli (potwierdzenie następuje z wykorzystaniem metody ANOVA dla modelu zerowego rzędu lub test χ 2 dla modelu pierwszego rzędu); jeśli oba są uzasadnione należy porównać wariancje obu modeli za pomocą testu F-Snedecora: jeśli istotna różnica jest wykryta, należy wybrać kinetyczny model z mniejszą wariancją, jeśli nie wykryto istotnej różnicy, zgodnie z założeniami teorii Arrheniusa, należy wybrać jeden model dla wszystkich temperatur biorąc pod uwagę wiedzę na temat reakcji rozkładu 3,4,5. Po wybraniu kinetycznego modelu rozkładu z równania Arrheniusa wyliczana jest stała rozpadu (k T ) dla każdej temperatury: k Ea / RT T Ae lub lnkt ln A Ea /( RT) gdzie: k T jest stałą reakcji rozkładu w różnych temperaturach, A faktor częstotliwości, E a energia aktywacji, R stała gazowa, T temperatura przechowywani prób w stopniach Kelvina. 2 International Conference on Harmonization. Q1A: Stability Testing of New Drug Substances and Drug Products CPMP/ICH/ 2736/99 September J.T. Carstensen, Solution kinetics, in J.T. Carstensen, C.T. Rhodes, Drug Stability. Principles and Practices, 3 rd ed., Marcel Dekker, New York, 2000, W.R. Young, Accelerated temperature pharmaceutical product stability determinations, Drug Dev. Ind. Pharm.: 1990; 16: J.T. Carstensen, Interaction of moisture with solids, in J.T. Carstensen, C.T. Rhodes, Drug Stability. Principles and Practices, 3 rd ed., Marcel Dekker, New York, 2000, Copyright StatSoft Polska 2014
5 Po wyznaczeniu stałych rozpadu dla wszystkich sprawdzanych temperatur sprawdzane jest, czy istnieje statystyczne istotna korelacja pomiędzy: stałą rozpadu a odwrotnością temperatury przechowywania. Istnienie takiej korelacji warunkuje możliwość zastosowania równania Arrheniusa do wyliczenia, przez ekstrapolację, k 25 C stałej reakcji rozkładu w temperaturze 25 C. Jeśli stwierdzono statystycznie istotną korelację, należy, wykorzystując nieliniową regresję, dopasować model opisujący tę zależność, a następnie sprawdzić, czy jest on uzasadniony statystycznie (test χ 2 ). Wyznaczona stała rozpadu dla temperatury 25 C pozwala wyliczyć parametr t 90 (czas, po którym następuje redukcja zawartości substancji czynnej do 90% wartości początkowej) dla wszystkich porównywanych form farmaceutycznych. Wybór najbardziej trwałej formy farmaceutycznej dla danej substancji czynnej następuje również z wykorzystaniem metod statystycznych, np. testu t-studenta. Podejście takie nie zawsze daje się zastosować z sukcesem. Powodem tego są różnorodne fluktuacje zachodzące w czasie reakcji rozkładu. Zaliczamy do nich: przejścia fazowe, zmiany ph, niekontrolowanie wpływu wilgotności względnej, występowanie złożonych mechanizmów reakcji 6. Również forma, w jakiej występuje substancja czynna w produkcie leczniczym i interakcje z substancjami pomocniczymi, mają istotny wpływ na różnice w reakcjach rozkładu zachodzących dla czystej substancji czynnej i produktu leczniczego zawierającego tę substancję czynną 9. Metoda ta przedstawia nam zmiany zachodzące w produkcie tylko z pewnym przybliżeniem, ponieważ nie uwzględnia wszystkich czynników wpływających na produkt w czasie jego przebywania na rynku. Dlatego jest zalecana przez ICH 2 raczej do badania trwałości substancji czynnych. Zastosowanie warunków stresowych pozwala znacznie skrócić czas potrzebny do odpowiedzi na istotne w czasie tworzenia produktu problemy: porównać trwałości serii produktów, przewidywać zmiany cech produktu w długim okresie jego użytkowania w normalnych warunkach, poznawać mechanizmy degradacji, testować metody zabezpieczania produktów przed rozkładem. Aby umożliwić rzetelną ocenę trwałości produktu, co zapewnia bezpieczeństwo stosowania produktu leczniczego, organy dopuszczają różnorodne podejścia. Federalny Urząd do spraw Żywności i Leków (FDA), jeśli dane literaturowe odnośnie trwałości nie są wystarczające, daje możliwość włączenia do programu badań stabilności określających trwałość, obok przechowywania prób w normalnych warunkach, warunków stresowych. 7 Proponowane przez FDA warunki stresowe powinny uwzględniać: temperaturę (np. 5ºC, 50ºC; 75ºC), wilgotności (np. 75%RH lub wyższe), 6 K.C. Waterman; R.C. Adami Accelerated aging: Prediction of chemical stability of pharmaceuticals International Journal of Pharmaceutics 2005; 293; Food and Drug Administration (1987) Guideline for Submitting Documentation for Stability Studies of Human Drugs and Biologics Maryland: Center for Drugs and Biologica. Copyright StatSoft Polska
6 promieniowanie elektromagnetyczne o różnej długości fali (np nm, ultrafioletowe, z zakresu widzialnego), zasadowe lub kwasowe ph. Europejska Agencja do spraw Oceny Środków Leczniczych (EMEA) wydała wytyczną 8 odnośnie testowania fotostabilności dla substancji czynnej i pośrednich produktów leczniczych. Ostatnie doniesienia naukowe 9 pozwalają mieć nadzieję, że możliwe będzie skrócenie badań trwałości z jednoczesnym uzyskaniem bardzo wiarygodnych wyników poprzez zastosowanie metody ASPA (Accelerated Stability Assessment Program) przyspieszonego programu oceny stabilności. Na podstawie badań przeprowadzonych na stałych postaciach leku zawierających małocząsteczkowe substancje czynne (np. aspiryna, witamina C) zaproponowano 14-dniowy przyspieszony program badań stabilności. Dzięki połączeniu metody isoconversion paradigm (określenie czasu potrzebnego do osiągnięcia poziomu produktów rozkładu równych limitowi specyfikacji) z zastosowaniem do ekstrapolacji danych, poprawionego względem wilgotności, równania Arrheniusa. Metoda ASAP wydaje się bardzo kusząca ze względu na ilość uzyskiwanych informacji, a także szybkość, z jaką te informacje uzyskujemy. Jednakże w procesie zbierania danych w celu określenia trwałości produktu leczniczego nie można jej zastosować z jednoczesną eliminacją przyspieszonych badań stabilności (40 C ± 2 C/75% RH ± 5% RH) prowadzonych przez 6 miesięcy, oczywiście poszerzonych o badania w warunkach stresowych zalecanych przez wytyczne FDA i ICH. Szacowanie terminu ważności Dzięki statystyce możemy, z użyciem danych historycznych, prognozować wartość parametrów jakościowych i na tej podstawie oszacować, jak długo dany parametr będzie spełniał wymagania specyfikacji, a tym samym, jaki będzie okres trwałości produktu leczniczego. Okresem ważności produktu leczniczego nazywamy przedział czasu, w którym produkt przechowywany w zalecanych warunkach spełnia wymagania specyfikacji jakościowej. Znamy różne metody oszacowania tego przedziału czasu. Metoda oparta na wytycznych FDA 10 każe wyznaczać termin ważności jako punkt czasowy, w którym dolny limit przedziału ufności (wyznaczony z 95% prawdopodobieństwem) dla najlepiej dopasowanej 8 International Conference on Harmonization. Q1B: Photostability Testing of New Active Substances and Medicinal Products- CPMP/ICH/279/95 January K. C. Waterman, A. J. Carella, M. J. Gumkowski, P. Lukulay, B. C. MacDonald, M. C. Roy, and S.L. Shamblin1 Improved Protocol and Data Analysis for Accelerated Shelf-Life Estimation of Solid Dosage Forms Pharmaceutical Research, 2007; Vol. 24, No Food and Drug Administration (1987) Guideline for Submitting Documentation for Stability Studies of Human Drugs and Biologics Maryland: Center for Drugs and Biologica Copyright StatSoft Polska 2014
7 prostej regresji przecina najniższy akceptowany limit badanego parametru jakościowego (często jest to 90% deklarowanej ilości). Zastosowanie ekstrapolacji jest uzależnione od uzyskanych danych nie tylko z warunków długoterminowych, ale również przyspieszonych. Należy wziąć pod uwagę, czy dane wskazują na istnienie zmienności badanego parametru w czasie, a także występujące zmienności. W podjęciu decyzji o zastosowaniu ekstrapolacji i maksymalnym oszacowanym terminie ważności pomocne jest, załączone w wytycznej 13 w załączniku A, drzewo decyzyjne. Dodatkowo wspominana wytyczna ICH 13 opisuje podejścia do wyznaczania terminu ważności w zależności od zastosowanych danych wejściowych: analiza dla pojedynczej serii, analiza z uwzględnieniem jednego czynnika (jednej zmiennej), wyniki z pełnych badań stabilności: ocena uzyskanych danych osobno dla każdej serii i wybranie najkrótszego oszacowanego terminu ważności pierwsze przecięcie z limitem specyfikacji, łączna ocena danych uzyskanych dla wszystkich badanych serii po wcześniejszym potwierdzeniu równoważności danych z poszczególnych zbiorów (czyli potwierdzeniu hipotezy o braku statystycznie istotnych różnic pomiędzy współczynnikami kierunkowymi i wyrazami wolnymi wyznaczonych prostych) poprzez zastosowanie testów statystycznych porównujących grupy (analiza wariancji ANOVA, test t-studenta,). analiza z uwzględnieniem wielu czynników, wyniki z pełnych badań stabilności: ocena, czy oszacowany termin ważności na podstawie badań z zastosowaniem kombinacji wszystkich czynników jest dłuższy niż jeden proponowany ocena z wykorzystaniem testów równoważności danych, czy dane z różnych faktorów i kombinacji faktorów można połączyć w celu całkowitego oszacowania pojedynczego terminu ważności. analiza z badań stabilności zaprojektowanych za pomocą bracketingu. Dane pochodzące z badań stabilności projektowanych zgodnie z zasadami backetingu mogą być traktowane jak analiza danych z uwzględnieniem wielu czynników z pełnych badań stabilności. Należy jednak pamiętać, że termin ważności dla produktów o pośrednich dawkach lub wielkościach pojemników (nietestowanych) są ustalane na podstawie najmniej stabilnego produktu granicznego (badanego). analiza z badań stabilności zaprojektowanych za pomocą matrixingu. Badania projektowane zgodnie z zasadami matrixingu dostarczają tylko części danych, dlatego ważne jest, aby ustalić, czy wszystkie czynniki i kombinacje czynników, które mają wpływ na termin ważności, są testowane właściwie, a wszystkie założenia redukcji badań odpowiednio uzasadnione. Opierając się na wytycznych, zarówno FDA jak i ICH. przyjmujemy, że termin ważności jest to okres, w którym produkt leczniczy spełnia wymagania specyfikacji. Szacując ten Copyright StatSoft Polska
8 termin powinniśmy mieć pewność, że będzie on prawdziwy dla wszystkich, wyprodukowanych w tych samych warunkach, przyszłych serii tego produktu. Uzasadnionym więc wydaje się być stosowanie ekstrapolacji z prostej wyznaczonej za pomocą analizy regresji jako metody o ugruntowanym znaczeniu i opierającej się na definicji terminu ważności zaaprobowanej przez urzędy rejestracyjne. Ocena równoważności danych Badania stabilności prowadzone są dla wielu serii tego samego produktu. Dane uzyskane z tych badań możemy rozważać osobno dla każdej serii lub łącznie dla danego produktu. Plusem łącznej oceny danych (z wielu serii lub z wielu kombinacji czynników, których wpływ jest badany: opakowanie, dawka itp.) jest korzystanie z większej liczby danych, co znacznie zmniejsza przedział ufności i poprawia jakość oraz prawdopodobieństwo wnioskowania statystycznego. Aby można było łączyć dane z różnych grup (różnych serii, dla których prowadzone są badania stabilności lub grup wyników uzyskanych podczas testowania wpływu poszczególnych czynników/kombinacji czynników na stabilność produktu), należy potwierdzić badania potwierdzające równoważności danych z poszczególnych zbiorów, a dokładnie mówiąc, porównywalne muszą być zależności pomiędzy badanym parametrem a czasem dla poszczególnych serii. Federalny Urząd do spraw Żywności i Leków (FDA) we wspomnianej wcześnie wytycznej 7 jako metodę określania równoważności danych dla poszczególnych serii zaleca testowanie hipotez zerowych o równości współczynników nachylenia i wyrazów wolnych wyznaczonych dla poszczególnych (dla badanych parametrów ilościowych) prostych. Na podstawie prac T.A. Bankrofta wytyczna FDA zaleca dla tych testów poziom istotności 0,25. Jeśli wyniki testu porównującego równość współczynników prostych jest wyższy niż 0,25, dane mogą być połączone i rozpatrywane łącznie. Wytyczna ICH 11, identycznie jak FDA, zaleca zastosowanie analizy wariancji (ANCOVA) z ustalonym poziomem istotności (poziomem odrzucenia) 0,25 dla warunków powiązanych z serią i 0,05 dla warunków nie związanych z serią. O ile powodem wprowadzenia takiego dużego współczynnika, podczas analizy danych z warunków powiązanych z serią, jest relatywnie ograniczona liczba prób w typowych badaniach stabilności, to wytyczna nie uściśla, dlaczego dla innych danych powinien być stosowanych współczynnik 0,05. Tak duży współczynnik powoduje zwiększenie mocy testu 12, co daje dużą pewność, że połączone dane należą do jednego zbioru. Zalecana przez wytyczną metoda opiera się na pośrednich obliczeniach współczynników nachylenia i wyrazów wolnych dla wyznaczonych i najlepiej dopasowanych modeli regresji. W metodzie tej w centrum zainteresowania jest niepowodzenie wykrycia znaczącej różnicy pomiędzy danymi, czyli błąd II rodzaju. Aby 11 International Conference on Harmonization. Q1E: Evaluation for stability data; CPMP/ICH/420/02-ICH Aug Ruberg, S.J., Stegeman, J.W. Pooling data for stability studies: Testing the equality of batch degradation slopes. Biometrics 1991; 3: Copyright StatSoft Polska 2014
9 potwierdzić równoważność danych w zbiorach, dla których założyliśmy liniową zależność pomiędzy badanym parametrem a czasem, musimy przeprowadzić testy statystyczne badające, czy współczynniki kierunkowe wyznaczonych prostych oraz wyrazy wolne wyznaczonych prostych nie różnią się od siebie w sensie statystycznym (testujemy hipotezę zerową o równości stopnia degradacji w porównywanych seriach). Zyskiem z łącznego traktowania danych jest uzyskanie większej ilości danych, a tym samym poprawienie mocy analizy i zawężenie obszaru ufności, co zazwyczaj powoduje wydłużenie szacowanego terminu ważności. Metoda ta obarczona jest oczywiście wadami: brak wyraźnie ustalonego kryterium statystycznie istotnej różnicy dla współczynnika nachylenia prostej, szansa połączenia danych jest większa dla źle zaprojektowanych badań stabilności (mała liczba punktów pomiarowych skutkuje większym błędem wariancji) wzrasta prawdopodobieństwo odrzucenia hipotezy zerowej. Problem możliwości łączenia danych uzyskanych w badaniach stabilności dla różnych serii (lub w wyniku testowania wpływu różnych czynników) ma istotne znaczenie w opracowywaniu danych, czyli podczas szacowania terminu ważności. Decyzja, że dane mogą być rozpatrywane łącznie, automatycznie poprawia nam jakość wnioskowania i najczęściej wydłuża oszacowany termin ważności. Podobnie jak w przypadku metod szacowania terminu ważności, zalecane metody (badania różności współczynników wyznaczonych prostych) powinny być stosowana nie tylko ze względu na obowiązujące wytyczne, ale także dlatego, że nie wymagają stosowania dodatkowych przybliżeń. Zastosowanie zalecanej przez ICH metody ANCOVA wydaje się logicznym wyborem, gdyż dzięki temu jesteśmy w stanie przeprowadzić porównanie dla wielu grup danych jednocześnie. Program ciągłego monitorowania stabilności Badania te rozpoczynane są po wprowadzeniu produktu leczniczego na rynek. Stabilność produktu leczniczego powinna być monitorowana ciągle, zgodnie z odpowiednio zaprojektowanym programem, który pozwoli na wykrycie każdego czynnika wpływającego na stabilności (zmiana poziomu zanieczyszczeń lub profilu uwalniania) związanego z postacią leku w opakowaniu handlowym. Celem programu ciągłego monitorowania stabilności jest monitorowanie produktu w ciągu jego okresu ważności oraz określenie, że produkt pozostaje, i można oczekiwać, że będzie pozostawał w zgodzie ze specyfikacją, jeżeli jest przechowywany w warunkach określonych na etykiecie. Liczba serii i częstotliwość badań powinna dostarczać wystarczających danych do przeprowadzenia analizy trendów. Przynajmniej jedna seria, każdej dawki i każdego rodzaju opakowania bezpośredniego wytwarzanego produktu leczniczego, powinna zostać włączona do programu raz do roku, chyba że istnieje inne uzasadnienie (chyba że nie wyprodukowano w danym roku żadnej serii). Dodatkowo należy uwzględniać w tych badaniach wszystkie serie wyprodukowane Copyright StatSoft Polska
10 I StatSoft Polska, tel , , z wprowadzonymi zmianami. Jeżeli potrafimy przeprowadzić naukowe uzasadnienie, można stosować zasady określania grup i macierzy (bracketing and matrixing). 13 Szczególnie rygorystyczne wymagania, jakim podlega przemysł farmaceutyczny, powoduje, że istnieje koniczność ciągłej kontroli parametrów jakościowych naszych produktów. Aby mieć pewność, że są one ciągle pod kontrolą, możemy na podstawie wyników z badań stabilności (zawartości substancji czynnej, zawartości wody, poziomu zanieczyszczeń, parametrów fizycznych) przeprowadzać analizę trendów, która pozwoli odpowiednio wcześnie wykryć zmiany zachodzące w naszych produktach 14 i być może ograniczyć ich wpływ na kolejne serie produktów. Wykrycie prawidłowości pojawiających się w zebranych wynikach wstępnie możemy określić na podstawie analizy wykresów: prosty liniowy wykres danych lub skategoryzowany wykres ramka-wąsy (rys. 1) Średnia Średnia±Odch.std Średnia±1,96*Odch.std 15 II III IV V VI VII Rys. 1. Wykres ramka-wąsy. Zależności zawartości środka konserwującego od czasu (tygodnie). Występowanie trendu badamy, analizując korelację pomiędzy badanym parametrem a zmienną określającą czas. W tym celu korzystamy z testów współczynnika korelacji: parametrycznego testu współczynnika korelacji Pearsona lub nieparametrycznego testu korelacji rang Spearmana. Współczynnik korelacji przyjmuje wartości z przedziału <-1; 1>. Ujemne lub dodatnie wartości współczynnika wskazują na występowanie trendu odpowiednio rosnącego lub malejącego. Współczynnik pozwala również określić siłę 13 Stability Testing of New Drug Substances and Drug Products (ICH Q1A (R2)) - CPMP/ICH/ 2736/99 Aug Świat przemysłu farmaceutycznego 2/2009, Czy mój proces jest trendy? Czyli analiza trendów. M. Kusy, M. Popieluch Copyright StatSoft Polska 2014
11 występującego trendu im wartości są bliższe -1 lub 1, tym związek badanego parametru ze zmienną określającą czas silniejszy. Inne, stosunkowo łatwe rozwiązanie wykorzystuje analizę regresji prostej, gdzie zmienną zależną jest badany parametr, a zmienną niezależną czas. Wykrycie trendu sprowadza się w tym przypadku do sprawdzenia, czy współczynnik nachylenia prostej regresji jest różny od zera. Na podstawie wyliczonych współczynników regresji wyznaczane jest prawdopodobieństwo testowe, które porównujemy z przyjętym poziomem istotności α. Wyznaczone prawdopodobieństwo testowe mniejsze niż przyjęty poziom istotności wymusza odrzucenie hipotezy zerowej o braku trendów w badanych danych. Etapy analizy trendu: Sprawdzenie hipotezy o braku trendów i określenie jego charakteru. W przypadku wykrycia trendu analiza regresji i naniesienie linii trendu na wykres danych. Ekstrapolacja linii trendu w celu określenia przecięcia linii trendu z granicami specyfikacji. Analiza danych z badań on going jest jedynym elementem badań stabilności, dla których nie istnieje wyraźna sugestia w postaci wytycznych co do zastosowania określonych testów. Oczywisty wydaje się wybór metod prostych, przyjaznych w stosowaniu i jednoznacznych w interpretacji. Jak sobie pomóc? Jak widzimy, prowadząc badania stabilności gromadzimy ogromne ilości danych: wyników dla różnorodnych serii, różnych warunków, odmiennych opakowań, zawierających API od dwóch, czasami trzech wytwórców, zbieranych w różnych punktach czasowych. Naszym podstawowym zadaniem nie jest jednak produkowanie danych, a zarządzanie nimi. Oprócz wprowadzania danych, przechowywania i docierania do nich, dodatkowo dochodzi konieczność analizowania ich oraz wyciągania prawidłowych wniosków na temat zmian zachodzących w produkcie oraz pojawiających się trendach. W przypadku konieczności przeprowadzenia analizy lub przygotowania raportu konieczna jest zazwyczaj integracja informacji oraz wykonanie analiz statystycznych (mozolnych wyliczeń), a na koniec przeniesienie ich wyników wraz z odpowiednimi komentarzami do postaci raportu. Proces ten przede wszystkim był niezwykle pracochłonny. Systemy komputerowe stają się nieodzowne. Nasza firma zdecydowała się na wykorzystanie w tym celu programu STATISTICA. Wdrożono kompleksowy system gromadzenia i analizy danych. Dzięki temu: usystematyzowano sposób wprowadzania i przechowywania danych, dzięki zastosowaniu Kompleksowej Platformy Badań Stabilności, która jest bazą danych analitycznych, Copyright StatSoft Polska
12 zapewniono bezpieczeństwo danych poprzez zastosowanie odpowiedniej architektury informatycznej, zarządzenie uprawnieniami i konieczność logowania oraz wdrożenie funkcjonalności śledzenia wszystkich zmian, zapewniono szybki dostęp do danych, udostępniono możliwość szybszego przygotowania m.in. raportu z wszystkimi wynikami dla wybranej serii lub raportu zestawiającego wyniki badań dla wybranego produktu, udostępniono rozwiązanie STATISTICA Zestaw Farmaceutyczny Ocena Stabilności, który automatyzuje wykonanie analiz i przygotowanie finalnego raportu. Podstawą systemu jest baza danych umożliwiająca zbieranie wyników w jednym miejscu, nawet jeśli badania są wykonywane w różnych laboratoriach. Baza danych jest prosta, intuicyjna i zawiera wszystkie informacje niezbędne podczas tworzenia nowego badania. Zakres informacji można w każdej chwili w prosty sposób zmienić lub uzupełnić. Aktualnie więc praca z gromadzeniem danych ogranicza się do wprowadzenia przez uprawnione osoby danych za pośrednictwem dedykowanego interfejsu, a następnie osoba, która wykonuje analizy lub raporty, definiuje tylko zakres danych, które są przenoszone do 72 Copyright StatSoft Polska 2014
13 środowiska analitycznego, gdzie można je przeglądać i dowolnie analizować lub automatycznie wykonać ich analizę oraz wygenerować jeden z wielu raportów. Dzięki zastosowaniu zautomatyzowanych obliczeń statystycznych czas przygotowania raportów został skrócony, a dodatkowo zyskano analityczną bazę danych, w której przechowywane są wszystkie, także historyczne informacje dotyczące parametrów i produktów. Literatura 1. International Conference on Harmonization. Q1D: Bracketing and Matrixing Designs for Stability Testing of New Drug Substances and Products CPMP/ICH/4104/00-ICH February International Conference on Harmonization. Q1A: Stability Testing of New Drug Substances and Drug Products CPMP/ICH/ 2736/99 September J.T. Carstensen, Solution kinetics, in J.T. Carstensen, C.T. Rhodes, Drug Stability. Principles and Practices, 3rd ed., Marcel Dekker, New York, 2000, W.R. Young, Accelerated temperature pharmaceutical product stability determinations, Drug Dev. Ind. Pharm.: 1990; 16: Copyright StatSoft Polska
14 5. J.T. Carstensen, Interaction of moisture with solids, in J.T. Carstensen, C.T. Rhodes, Drug Stability. Principles and Practices, 3rd ed., Marcel Dekker, New York, 2000, K.C. Waterman; R.C. Adami Accelerated aging: Prediction of chemical stability of pharmaceuticals International Journal of Pharmaceutics 2005; 293; Food and Drug Administration (1987) Guideline for Submitting Documentation for Stability Studies of Human Drugs and Biologics Maryland: Center for Drugs and Biologica. 8. International Conference on Harmonization. Q1B: Photostability Testing of New Active Substances and Medicinal Products- CPMP/ICH/279/95 January K. C. Waterman, A. J. Carella, M. J. Gumkowski, P. Lukulay, B. C. MacDonald, M. C. Roy, and S.L. Shamblin1 Improved Protocol and Data Analysis for Accelerated Shelf- Life Estimation of Solid Dosage Forms Pharmaceutical Research, 2007; Vol. 24, No Food and Drug Administration (1987) Guideline for Submitting Documentation for Stability Studies of Human Drugs and Biologics Maryland: Center for Drugs and Biologica. 11. International Conference on Harmonization. Q1E: Evaluation for stability data; CPMP/ICH/420/02-ICH Aug Ruberg, S.J., Stegeman, J.W. Pooling data for stability studies: Testing the equality of batch degradation slopes. Biometrics 1991; 3: Stability Testing of New Drug Substances and Drug Products (ICH Q1A (R2)) CPMP/ICH/ 2736/99 Aug Świat przemysłu farmaceutycznego 2/2009, Czy mój proces jest trendy? Czyli analiza trendów. M. Kusy, M. Popieluch Copyright StatSoft Polska 2014
Michał Kusy, StatSoft Polska Sp. z o.o.
 CZY MÓJ PROCES JEST TRENDY, CZYLI ANALIZA TRENDÓW Michał Kusy, StatSoft Polska Sp. z o.o. Wprowadzenie Analiza danych w kontroli środowiska produkcji i magazynowania opiera się między innymi na szeregu
CZY MÓJ PROCES JEST TRENDY, CZYLI ANALIZA TRENDÓW Michał Kusy, StatSoft Polska Sp. z o.o. Wprowadzenie Analiza danych w kontroli środowiska produkcji i magazynowania opiera się między innymi na szeregu
Wprowadzenie do analizy korelacji i regresji
 Statystyka dla jakości produktów i usług Six sigma i inne strategie Wprowadzenie do analizy korelacji i regresji StatSoft Polska Wybrane zagadnienia analizy korelacji Przy analizie zjawisk i procesów stanowiących
Statystyka dla jakości produktów i usług Six sigma i inne strategie Wprowadzenie do analizy korelacji i regresji StatSoft Polska Wybrane zagadnienia analizy korelacji Przy analizie zjawisk i procesów stanowiących
Testowanie hipotez statystycznych. Wnioskowanie statystyczne
 Testowanie hipotez statystycznych Wnioskowanie statystyczne Hipoteza statystyczna to dowolne przypuszczenie co do rozkładu populacji generalnej (jego postaci funkcyjnej lub wartości parametrów). Hipotezy
Testowanie hipotez statystycznych Wnioskowanie statystyczne Hipoteza statystyczna to dowolne przypuszczenie co do rozkładu populacji generalnej (jego postaci funkcyjnej lub wartości parametrów). Hipotezy
WSPIERANIE ZADAŃ ANALITYCZNYCH Z ZASTOSOWANIEM STATISTICA NA PRZYKŁADZIE BIOTON S.A.
 WSPIERANIE ZADAŃ ANALITYCZNYCH Z ZASTOSOWANIEM STATISTICA NA PRZYKŁADZIE BIOTON S.A. Jan Grzesik, Zespół Specjalistów ds. Zapewnienia Jakości w BIOTON S.A. Wymagania statystycznego opracowania wyników
WSPIERANIE ZADAŃ ANALITYCZNYCH Z ZASTOSOWANIEM STATISTICA NA PRZYKŁADZIE BIOTON S.A. Jan Grzesik, Zespół Specjalistów ds. Zapewnienia Jakości w BIOTON S.A. Wymagania statystycznego opracowania wyników
USPRAWNIENIE WYKONYWANIA ANALIZ I TWORZENIA RAPORTÓW STATISTICA ZESTAW FARMACEUTYCZNY
 USPRAWNIENIE WYKONYWANIA ANALIZ I TWORZENIA RAPORTÓW STATISTICA ZESTAW FARMACEUTYCZNY Michał Iwaniec, StatSoft Polska Sp. z o.o. Wprowadzenie Od kilkunastu lat stale rośnie ilość gromadzonych i analizowanych
USPRAWNIENIE WYKONYWANIA ANALIZ I TWORZENIA RAPORTÓW STATISTICA ZESTAW FARMACEUTYCZNY Michał Iwaniec, StatSoft Polska Sp. z o.o. Wprowadzenie Od kilkunastu lat stale rośnie ilość gromadzonych i analizowanych
Szkice rozwiązań z R:
 Szkice rozwiązań z R: Zadanie 1. Założono doświadczenie farmakologiczne. Obserwowano przyrost wagi ciała (przyrost [gram]) przy zadanych dawkach trzech preparatów (dawka.a, dawka.b, dawka.c). Obiektami
Szkice rozwiązań z R: Zadanie 1. Założono doświadczenie farmakologiczne. Obserwowano przyrost wagi ciała (przyrost [gram]) przy zadanych dawkach trzech preparatów (dawka.a, dawka.b, dawka.c). Obiektami
PDF created with FinePrint pdffactory Pro trial version http://www.fineprint.com
 Analiza korelacji i regresji KORELACJA zależność liniowa Obserwujemy parę cech ilościowych (X,Y). Doświadczenie jest tak pomyślane, aby obserwowane pary cech X i Y (tzn i ta para x i i y i dla różnych
Analiza korelacji i regresji KORELACJA zależność liniowa Obserwujemy parę cech ilościowych (X,Y). Doświadczenie jest tak pomyślane, aby obserwowane pary cech X i Y (tzn i ta para x i i y i dla różnych
Statystyka matematyczna dla leśników
 Statystyka matematyczna dla leśników Wydział Leśny Kierunek leśnictwo Studia Stacjonarne I Stopnia Rok akademicki 03/04 Wykład 5 Testy statystyczne Ogólne zasady testowania hipotez statystycznych, rodzaje
Statystyka matematyczna dla leśników Wydział Leśny Kierunek leśnictwo Studia Stacjonarne I Stopnia Rok akademicki 03/04 Wykład 5 Testy statystyczne Ogólne zasady testowania hipotez statystycznych, rodzaje
Analiza Danych Sprawozdanie regresja Marek Lewandowski Inf 59817
 Analiza Danych Sprawozdanie regresja Marek Lewandowski Inf 59817 Zadanie 1: wiek 7 8 9 1 11 11,5 12 13 14 14 15 16 17 18 18,5 19 wzrost 12 122 125 131 135 14 142 145 15 1 154 159 162 164 168 17 Wykres
Analiza Danych Sprawozdanie regresja Marek Lewandowski Inf 59817 Zadanie 1: wiek 7 8 9 1 11 11,5 12 13 14 14 15 16 17 18 18,5 19 wzrost 12 122 125 131 135 14 142 145 15 1 154 159 162 164 168 17 Wykres
Testy nieparametryczne
 Testy nieparametryczne Testy nieparametryczne możemy stosować, gdy nie są spełnione założenia wymagane dla testów parametrycznych. Stosujemy je również, gdy dane można uporządkować według określonych kryteriów
Testy nieparametryczne Testy nieparametryczne możemy stosować, gdy nie są spełnione założenia wymagane dla testów parametrycznych. Stosujemy je również, gdy dane można uporządkować według określonych kryteriów
KORELACJE I REGRESJA LINIOWA
 KORELACJE I REGRESJA LINIOWA Korelacje i regresja liniowa Analiza korelacji: Badanie, czy pomiędzy dwoma zmiennymi istnieje zależność Obie analizy się wzajemnie przeplatają Analiza regresji: Opisanie modelem
KORELACJE I REGRESJA LINIOWA Korelacje i regresja liniowa Analiza korelacji: Badanie, czy pomiędzy dwoma zmiennymi istnieje zależność Obie analizy się wzajemnie przeplatają Analiza regresji: Opisanie modelem
LINIOWOŚĆ METODY OZNACZANIA ZAWARTOŚCI SUBSTANCJI NA PRZYKŁADZIE CHROMATOGRAFU
 LINIOWOŚĆ METODY OZNACZANIA ZAWARTOŚCI SUBSTANCJI NA PRZYKŁADZIE CHROMATOGRAFU Tomasz Demski, StatSoft Polska Sp. z o.o. Wprowadzenie Jednym z elementów walidacji metod pomiarowych jest sprawdzenie liniowości
LINIOWOŚĆ METODY OZNACZANIA ZAWARTOŚCI SUBSTANCJI NA PRZYKŁADZIE CHROMATOGRAFU Tomasz Demski, StatSoft Polska Sp. z o.o. Wprowadzenie Jednym z elementów walidacji metod pomiarowych jest sprawdzenie liniowości
ALGORYTMICZNA I STATYSTYCZNA ANALIZA DANYCH
 1 ALGORYTMICZNA I STATYSTYCZNA ANALIZA DANYCH WFAiS UJ, Informatyka Stosowana II stopień studiów 2 Wnioskowanie statystyczne dla zmiennych numerycznych Porównywanie dwóch średnich Boot-strapping Analiza
1 ALGORYTMICZNA I STATYSTYCZNA ANALIZA DANYCH WFAiS UJ, Informatyka Stosowana II stopień studiów 2 Wnioskowanie statystyczne dla zmiennych numerycznych Porównywanie dwóch średnich Boot-strapping Analiza
Weryfikacja hipotez statystycznych
 Weryfikacja hipotez statystycznych Hipoteza Test statystyczny Poziom istotności Testy jednostronne i dwustronne Testowanie równości wariancji test F-Fishera Testowanie równości wartości średnich test t-studenta
Weryfikacja hipotez statystycznych Hipoteza Test statystyczny Poziom istotności Testy jednostronne i dwustronne Testowanie równości wariancji test F-Fishera Testowanie równości wartości średnich test t-studenta
Prawdopodobieństwo i rozkład normalny cd.
 # # Prawdopodobieństwo i rozkład normalny cd. Michał Daszykowski, Ivana Stanimirova Instytut Chemii Uniwersytet Śląski w Katowicach Ul. Szkolna 9 40-006 Katowice E-mail: www: mdaszyk@us.edu.pl istanimi@us.edu.pl
# # Prawdopodobieństwo i rozkład normalny cd. Michał Daszykowski, Ivana Stanimirova Instytut Chemii Uniwersytet Śląski w Katowicach Ul. Szkolna 9 40-006 Katowice E-mail: www: mdaszyk@us.edu.pl istanimi@us.edu.pl
Statystyczna analiza danych w programie STATISTICA 7.1 PL (wykład 3) Dariusz Gozdowski
 Statystyczna analiza danych w programie STATISTICA 7.1 PL (wykład 3) Dariusz Gozdowski Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW Dwuczynnikowa analiza wariancji (2-way
Statystyczna analiza danych w programie STATISTICA 7.1 PL (wykład 3) Dariusz Gozdowski Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW Dwuczynnikowa analiza wariancji (2-way
166 Wstęp do statystyki matematycznej
 166 Wstęp do statystyki matematycznej Etap trzeci realizacji procesu analizy danych statystycznych w zasadzie powinien rozwiązać nasz zasadniczy problem związany z identyfikacją cechy populacji generalnej
166 Wstęp do statystyki matematycznej Etap trzeci realizacji procesu analizy danych statystycznych w zasadzie powinien rozwiązać nasz zasadniczy problem związany z identyfikacją cechy populacji generalnej
Korelacja oznacza współwystępowanie, nie oznacza związku przyczynowo-skutkowego
 Korelacja oznacza współwystępowanie, nie oznacza związku przyczynowo-skutkowego Współczynnik korelacji opisuje siłę i kierunek związku. Jest miarą symetryczną. Im wyższa korelacja tym lepiej potrafimy
Korelacja oznacza współwystępowanie, nie oznacza związku przyczynowo-skutkowego Współczynnik korelacji opisuje siłę i kierunek związku. Jest miarą symetryczną. Im wyższa korelacja tym lepiej potrafimy
RÓWNOWAŻNOŚĆ METOD BADAWCZYCH
 RÓWNOWAŻNOŚĆ METOD BADAWCZYCH Piotr Konieczka Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska Równoważność metod??? 2 Zgodność wyników analitycznych otrzymanych z wykorzystaniem porównywanych
RÓWNOWAŻNOŚĆ METOD BADAWCZYCH Piotr Konieczka Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska Równoważność metod??? 2 Zgodność wyników analitycznych otrzymanych z wykorzystaniem porównywanych
ZJAZD 4. gdzie E(x) jest wartością oczekiwaną x
 ZJAZD 4 KORELACJA, BADANIE NIEZALEŻNOŚCI, ANALIZA REGRESJI Analiza korelacji i regresji jest działem statystyki zajmującym się badaniem zależności i związków pomiędzy rozkładami dwu lub więcej badanych
ZJAZD 4 KORELACJA, BADANIE NIEZALEŻNOŚCI, ANALIZA REGRESJI Analiza korelacji i regresji jest działem statystyki zajmującym się badaniem zależności i związków pomiędzy rozkładami dwu lub więcej badanych
Weryfikacja hipotez statystycznych. KG (CC) Statystyka 26 V / 1
 Weryfikacja hipotez statystycznych KG (CC) Statystyka 26 V 2009 1 / 1 Sformułowanie problemu Weryfikacja hipotez statystycznych jest drugą (po estymacji) metodą uogólniania wyników uzyskanych w próbie
Weryfikacja hipotez statystycznych KG (CC) Statystyka 26 V 2009 1 / 1 Sformułowanie problemu Weryfikacja hipotez statystycznych jest drugą (po estymacji) metodą uogólniania wyników uzyskanych w próbie
Rozdział 8. Regresja. Definiowanie modelu
 Rozdział 8 Regresja Definiowanie modelu Analizę korelacji można traktować jako wstęp do analizy regresji. Jeżeli wykresy rozrzutu oraz wartości współczynników korelacji wskazują na istniejąca współzmienność
Rozdział 8 Regresja Definiowanie modelu Analizę korelacji można traktować jako wstęp do analizy regresji. Jeżeli wykresy rozrzutu oraz wartości współczynników korelacji wskazują na istniejąca współzmienność
( x) Równanie regresji liniowej ma postać. By obliczyć współczynniki a i b należy posłużyć się następującymi wzorami 1 : Gdzie:
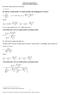 ma postać y = ax + b Równanie regresji liniowej By obliczyć współczynniki a i b należy posłużyć się następującymi wzorami 1 : xy b = a = b lub x Gdzie: xy = też a = x = ( b ) i to dane empiryczne, a ilość
ma postać y = ax + b Równanie regresji liniowej By obliczyć współczynniki a i b należy posłużyć się następującymi wzorami 1 : xy b = a = b lub x Gdzie: xy = też a = x = ( b ) i to dane empiryczne, a ilość
Statystyka matematyczna Testowanie hipotez i estymacja parametrów. Wrocław, r
 Statystyka matematyczna Testowanie hipotez i estymacja parametrów Wrocław, 18.03.2016r Plan wykładu: 1. Testowanie hipotez 2. Etapy testowania hipotez 3. Błędy 4. Testowanie wielokrotne 5. Estymacja parametrów
Statystyka matematyczna Testowanie hipotez i estymacja parametrów Wrocław, 18.03.2016r Plan wykładu: 1. Testowanie hipotez 2. Etapy testowania hipotez 3. Błędy 4. Testowanie wielokrotne 5. Estymacja parametrów
TESTY NIEPARAMETRYCZNE. 1. Testy równości średnich bez założenia normalności rozkładu zmiennych: Manna-Whitney a i Kruskala-Wallisa.
 TESTY NIEPARAMETRYCZNE 1. Testy równości średnich bez założenia normalności rozkładu zmiennych: Manna-Whitney a i Kruskala-Wallisa. Standardowe testy równości średnich wymagają aby badane zmienne losowe
TESTY NIEPARAMETRYCZNE 1. Testy równości średnich bez założenia normalności rozkładu zmiennych: Manna-Whitney a i Kruskala-Wallisa. Standardowe testy równości średnich wymagają aby badane zmienne losowe
Statystyka w pracy badawczej nauczyciela Wykład 4: Analiza współzależności. dr inż. Walery Susłow walery.suslow@ie.tu.koszalin.pl
 Statystyka w pracy badawczej nauczyciela Wykład 4: Analiza współzależności dr inż. Walery Susłow walery.suslow@ie.tu.koszalin.pl Statystyczna teoria korelacji i regresji (1) Jest to dział statystyki zajmujący
Statystyka w pracy badawczej nauczyciela Wykład 4: Analiza współzależności dr inż. Walery Susłow walery.suslow@ie.tu.koszalin.pl Statystyczna teoria korelacji i regresji (1) Jest to dział statystyki zajmujący
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 4
 STATYSTYKA I DOŚWIADCZALNICTWO Wykład 4 Inne układy doświadczalne 1) Układ losowanych bloków Stosujemy, gdy podejrzewamy, że może występować systematyczna zmienność między powtórzeniami np. - zmienność
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 4 Inne układy doświadczalne 1) Układ losowanych bloków Stosujemy, gdy podejrzewamy, że może występować systematyczna zmienność między powtórzeniami np. - zmienność
Testowanie hipotez statystycznych.
 Statystyka Wykład 10 Wrocław, 22 grudnia 2011 Testowanie hipotez statystycznych Definicja. Hipotezą statystyczną nazywamy stwierdzenie dotyczące parametrów populacji. Definicja. Dwie komplementarne w problemie
Statystyka Wykład 10 Wrocław, 22 grudnia 2011 Testowanie hipotez statystycznych Definicja. Hipotezą statystyczną nazywamy stwierdzenie dotyczące parametrów populacji. Definicja. Dwie komplementarne w problemie
P: Czy studiujący i niestudiujący preferują inne sklepy internetowe?
 2 Test niezależności chi-kwadrat stosuje się (między innymi) w celu sprawdzenia czy pomiędzy zmiennymi istnieje związek/zależność. Stosujemy go w sytuacji, kiedy zmienna zależna mierzona jest na skali
2 Test niezależności chi-kwadrat stosuje się (między innymi) w celu sprawdzenia czy pomiędzy zmiennymi istnieje związek/zależność. Stosujemy go w sytuacji, kiedy zmienna zależna mierzona jest na skali
Testowanie hipotez. Marcin Zajenkowski. Marcin Zajenkowski () Testowanie hipotez 1 / 25
 Testowanie hipotez Marcin Zajenkowski Marcin Zajenkowski () Testowanie hipotez 1 / 25 Testowanie hipotez Aby porównać ze sobą dwie statystyki z próby stosuje się testy istotności. Mówią one o tym czy uzyskane
Testowanie hipotez Marcin Zajenkowski Marcin Zajenkowski () Testowanie hipotez 1 / 25 Testowanie hipotez Aby porównać ze sobą dwie statystyki z próby stosuje się testy istotności. Mówią one o tym czy uzyskane
Wprowadzenie do statystyki dla. chemików testowanie hipotez
 chemików testowanie hipotez Michał Daszykowski, Ivana Stanimirova Instytut Chemii Uniwersytet Śląski w Katowicach Ul. Szkolna 9 40-006 Katowice E-mail: www: mdaszyk@us.edu.pl istanimi@us.edu.pl http://www.sites.google.com/site/chemomlab/
chemików testowanie hipotez Michał Daszykowski, Ivana Stanimirova Instytut Chemii Uniwersytet Śląski w Katowicach Ul. Szkolna 9 40-006 Katowice E-mail: www: mdaszyk@us.edu.pl istanimi@us.edu.pl http://www.sites.google.com/site/chemomlab/
OBLICZENIE PRZEPŁYWÓW MAKSYMALNYCH ROCZNYCH O OKREŚLONYM PRAWDOPODOBIEŃSTWIE PRZEWYŻSZENIA. z wykorzystaniem programu obliczeniowego Q maxp
 tel.: +48 662 635 712 Liczba stron: 15 Data: 20.07.2010r OBLICZENIE PRZEPŁYWÓW MAKSYMALNYCH ROCZNYCH O OKREŚLONYM PRAWDOPODOBIEŃSTWIE PRZEWYŻSZENIA z wykorzystaniem programu obliczeniowego Q maxp DŁUGIE
tel.: +48 662 635 712 Liczba stron: 15 Data: 20.07.2010r OBLICZENIE PRZEPŁYWÓW MAKSYMALNYCH ROCZNYCH O OKREŚLONYM PRAWDOPODOBIEŃSTWIE PRZEWYŻSZENIA z wykorzystaniem programu obliczeniowego Q maxp DŁUGIE
Jak sprawdzić normalność rozkładu w teście dla prób zależnych?
 Jak sprawdzić normalność rozkładu w teście dla prób zależnych? W pliku zalezne_10.sta znajdują się dwie zmienne: czasu biegu przed rozpoczęciem cyklu treningowego (zmienna 1) oraz czasu biegu po zakończeniu
Jak sprawdzić normalność rozkładu w teście dla prób zależnych? W pliku zalezne_10.sta znajdują się dwie zmienne: czasu biegu przed rozpoczęciem cyklu treningowego (zmienna 1) oraz czasu biegu po zakończeniu
MODELE LINIOWE. Dr Wioleta Drobik
 MODELE LINIOWE Dr Wioleta Drobik MODELE LINIOWE Jedna z najstarszych i najpopularniejszych metod modelowania Zależność między zbiorem zmiennych objaśniających, a zmienną ilościową nazywaną zmienną objaśnianą
MODELE LINIOWE Dr Wioleta Drobik MODELE LINIOWE Jedna z najstarszych i najpopularniejszych metod modelowania Zależność między zbiorem zmiennych objaśniających, a zmienną ilościową nazywaną zmienną objaśnianą
Zadanie 1 Zakładając liniową relację między wydatkami na obuwie a dochodem oszacować MNK parametry modelu: y t. X 1 t. Tabela 1.
 tel. 44 683 1 55 tel. kom. 64 566 811 e-mail: biuro@wszechwiedza.pl Zadanie 1 Zakładając liniową relację między wydatkami na obuwie a dochodem oszacować MNK parametry modelu: gdzie: y t X t y t = 1 X 1
tel. 44 683 1 55 tel. kom. 64 566 811 e-mail: biuro@wszechwiedza.pl Zadanie 1 Zakładając liniową relację między wydatkami na obuwie a dochodem oszacować MNK parametry modelu: gdzie: y t X t y t = 1 X 1
Zintegrowany system zarządzania wiedzą w wytwarzaniu produktów leczniczych
 Zintegrowany system zarządzania wiedzą w wytwarzaniu produktów leczniczych Model Zarządzania Jakością wg ICH Q10 Cykl Życia Produktu System Monitorowania Działania Procesu i Jakości Produktu System Działań
Zintegrowany system zarządzania wiedzą w wytwarzaniu produktów leczniczych Model Zarządzania Jakością wg ICH Q10 Cykl Życia Produktu System Monitorowania Działania Procesu i Jakości Produktu System Działań
TEST STATYSTYCZNY. Jeżeli hipotezę zerową odrzucimy na danym poziomie istotności, to odrzucimy ją na każdym większym poziomie istotności.
 TEST STATYSTYCZNY Testem statystycznym nazywamy regułę postępowania rozstrzygająca, przy jakich wynikach z próby hipotezę sprawdzaną H 0 należy odrzucić, a przy jakich nie ma podstaw do jej odrzucenia.
TEST STATYSTYCZNY Testem statystycznym nazywamy regułę postępowania rozstrzygająca, przy jakich wynikach z próby hipotezę sprawdzaną H 0 należy odrzucić, a przy jakich nie ma podstaw do jej odrzucenia.
Testowanie hipotez dla dwóch zmiennych zależnych. Moc testu. Minimalna liczność próby; Regresja prosta; Korelacja Pearsona;
 LABORATORIUM 4 Testowanie hipotez dla dwóch zmiennych zależnych. Moc testu. Minimalna liczność próby; Regresja prosta; Korelacja Pearsona; dwie zmienne zależne mierzalne małe próby duże próby rozkład normalny
LABORATORIUM 4 Testowanie hipotez dla dwóch zmiennych zależnych. Moc testu. Minimalna liczność próby; Regresja prosta; Korelacja Pearsona; dwie zmienne zależne mierzalne małe próby duże próby rozkład normalny
12/30/2018. Biostatystyka, 2018/2019 dla Fizyki Medycznej, studia magisterskie. Estymacja Testowanie hipotez
 Biostatystyka, 2018/2019 dla Fizyki Medycznej, studia magisterskie Wyznaczanie przedziału 95%CI oznaczającego, że dla 95% prób losowych następujące nierówności są prawdziwe: X t s 0.025 n < μ < X + t s
Biostatystyka, 2018/2019 dla Fizyki Medycznej, studia magisterskie Wyznaczanie przedziału 95%CI oznaczającego, że dla 95% prób losowych następujące nierówności są prawdziwe: X t s 0.025 n < μ < X + t s
Regresja wielokrotna. PDF created with FinePrint pdffactory Pro trial version http://www.fineprint.com
 Regresja wielokrotna Model dla zależności liniowej: Y=a+b 1 X 1 +b 2 X 2 +...+b n X n Cząstkowe współczynniki regresji wielokrotnej: b 1,..., b n Zmienne niezależne (przyczynowe): X 1,..., X n Zmienna
Regresja wielokrotna Model dla zależności liniowej: Y=a+b 1 X 1 +b 2 X 2 +...+b n X n Cząstkowe współczynniki regresji wielokrotnej: b 1,..., b n Zmienne niezależne (przyczynowe): X 1,..., X n Zmienna
WSTĘP DO REGRESJI LOGISTYCZNEJ. Dr Wioleta Drobik-Czwarno
 WSTĘP DO REGRESJI LOGISTYCZNEJ Dr Wioleta Drobik-Czwarno REGRESJA LOGISTYCZNA Zmienna zależna jest zmienną dychotomiczną (dwustanową) przyjmuje dwie wartości, najczęściej 0 i 1 Zmienną zależną może być:
WSTĘP DO REGRESJI LOGISTYCZNEJ Dr Wioleta Drobik-Czwarno REGRESJA LOGISTYCZNA Zmienna zależna jest zmienną dychotomiczną (dwustanową) przyjmuje dwie wartości, najczęściej 0 i 1 Zmienną zależną może być:
Idea. θ = θ 0, Hipoteza statystyczna Obszary krytyczne Błąd pierwszego i drugiego rodzaju p-wartość
 Idea Niech θ oznacza parametr modelu statystycznego. Dotychczasowe rozważania dotyczyły metod estymacji tego parametru. Teraz zamiast szacować nieznaną wartość parametru będziemy weryfikowali hipotezę
Idea Niech θ oznacza parametr modelu statystycznego. Dotychczasowe rozważania dotyczyły metod estymacji tego parametru. Teraz zamiast szacować nieznaną wartość parametru będziemy weryfikowali hipotezę
Analiza wariancji - ANOVA
 Analiza wariancji - ANOVA Analiza wariancji jest metodą pozwalającą na podział zmienności zaobserwowanej wśród wyników eksperymentalnych na oddzielne części. Każdą z tych części możemy przypisać oddzielnemu
Analiza wariancji - ANOVA Analiza wariancji jest metodą pozwalającą na podział zmienności zaobserwowanej wśród wyników eksperymentalnych na oddzielne części. Każdą z tych części możemy przypisać oddzielnemu
Analiza korespondencji
 Analiza korespondencji Kiedy stosujemy? 2 W wielu badaniach mamy do czynienia ze zmiennymi jakościowymi (nominalne i porządkowe) typu np.: płeć, wykształcenie, status palenia. Punktem wyjścia do analizy
Analiza korespondencji Kiedy stosujemy? 2 W wielu badaniach mamy do czynienia ze zmiennymi jakościowymi (nominalne i porządkowe) typu np.: płeć, wykształcenie, status palenia. Punktem wyjścia do analizy
ODRZUCANIE WYNIKÓW POJEDYNCZYCH POMIARÓW
 ODRZUCANIE WYNIKÓW OJEDYNCZYCH OMIARÓW W praktyce pomiarowej zdarzają się sytuacje gdy jeden z pomiarów odstaje od pozostałych. Jeżeli wykorzystamy fakt, że wyniki pomiarów są zmienną losową opisywaną
ODRZUCANIE WYNIKÓW OJEDYNCZYCH OMIARÓW W praktyce pomiarowej zdarzają się sytuacje gdy jeden z pomiarów odstaje od pozostałych. Jeżeli wykorzystamy fakt, że wyniki pomiarów są zmienną losową opisywaną
Weryfikacja hipotez statystycznych, parametryczne testy istotności w populacji
 Weryfikacja hipotez statystycznych, parametryczne testy istotności w populacji Dr Joanna Banaś Zakład Badań Systemowych Instytut Sztucznej Inteligencji i Metod Matematycznych Wydział Informatyki Politechniki
Weryfikacja hipotez statystycznych, parametryczne testy istotności w populacji Dr Joanna Banaś Zakład Badań Systemowych Instytut Sztucznej Inteligencji i Metod Matematycznych Wydział Informatyki Politechniki
METODY CHEMOMETRYCZNE W IDENTYFIKACJI ŹRÓDEŁ POCHODZENIA
 METODY CHEMOMETRYCZNE W IDENTYFIKACJI ŹRÓDEŁ POCHODZENIA AMFETAMINY Waldemar S. Krawczyk Centralne Laboratorium Kryminalistyczne Komendy Głównej Policji, Warszawa (praca obroniona na Wydziale Chemii Uniwersytetu
METODY CHEMOMETRYCZNE W IDENTYFIKACJI ŹRÓDEŁ POCHODZENIA AMFETAMINY Waldemar S. Krawczyk Centralne Laboratorium Kryminalistyczne Komendy Głównej Policji, Warszawa (praca obroniona na Wydziale Chemii Uniwersytetu
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 5
 STATYSTYKA I DOŚWIADCZALNICTWO Wykład 5 Analiza korelacji - współczynnik korelacji Pearsona Cel: ocena współzależności między dwiema zmiennymi ilościowymi Ocenia jedynie zależność liniową. r = cov(x,y
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 5 Analiza korelacji - współczynnik korelacji Pearsona Cel: ocena współzależności między dwiema zmiennymi ilościowymi Ocenia jedynie zależność liniową. r = cov(x,y
Maciej Oleksy Zenon Matuszyk
 Maciej Oleksy Zenon Matuszyk Jest to proces związany z wytwarzaniem oprogramowania. Jest on jednym z procesów kontroli jakości oprogramowania. Weryfikacja oprogramowania - testowanie zgodności systemu
Maciej Oleksy Zenon Matuszyk Jest to proces związany z wytwarzaniem oprogramowania. Jest on jednym z procesów kontroli jakości oprogramowania. Weryfikacja oprogramowania - testowanie zgodności systemu
STATYSTYKA MATEMATYCZNA WYKŁAD 4. Testowanie hipotez Estymacja parametrów
 STATYSTYKA MATEMATYCZNA WYKŁAD 4 Testowanie hipotez Estymacja parametrów WSTĘP 1. Testowanie hipotez Błędy związane z testowaniem hipotez Etapy testowana hipotez Testowanie wielokrotne 2. Estymacja parametrów
STATYSTYKA MATEMATYCZNA WYKŁAD 4 Testowanie hipotez Estymacja parametrów WSTĘP 1. Testowanie hipotez Błędy związane z testowaniem hipotez Etapy testowana hipotez Testowanie wielokrotne 2. Estymacja parametrów
Spis treści. Przedmowa... XI. Rozdział 1. Pomiar: jednostki miar... 1. Rozdział 2. Pomiar: liczby i obliczenia liczbowe... 16
 Spis treści Przedmowa.......................... XI Rozdział 1. Pomiar: jednostki miar................. 1 1.1. Wielkości fizyczne i pozafizyczne.................. 1 1.2. Spójne układy miar. Układ SI i jego
Spis treści Przedmowa.......................... XI Rozdział 1. Pomiar: jednostki miar................. 1 1.1. Wielkości fizyczne i pozafizyczne.................. 1 1.2. Spójne układy miar. Układ SI i jego
Walidacja metod analitycznych Raport z walidacji
 Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Zmienne zależne i niezależne
 Analiza kanoniczna Motywacja (1) 2 Często w badaniach spotykamy problemy badawcze, w których szukamy zakresu i kierunku zależności pomiędzy zbiorami zmiennych: { X i Jak oceniać takie 1, X 2,..., X p }
Analiza kanoniczna Motywacja (1) 2 Często w badaniach spotykamy problemy badawcze, w których szukamy zakresu i kierunku zależności pomiędzy zbiorami zmiennych: { X i Jak oceniać takie 1, X 2,..., X p }
Stanisław Cichocki. Natalia Nehrebecka. Wykład 9
 Stanisław Cichocki Natalia Nehrebecka Wykład 9 1 1. Dodatkowe założenie KMRL 2. Testowanie hipotez prostych Rozkład estymatora b Testowanie hipotez prostych przy użyciu statystyki t 3. Przedziały ufności
Stanisław Cichocki Natalia Nehrebecka Wykład 9 1 1. Dodatkowe założenie KMRL 2. Testowanie hipotez prostych Rozkład estymatora b Testowanie hipotez prostych przy użyciu statystyki t 3. Przedziały ufności
VI WYKŁAD STATYSTYKA. 9/04/2014 B8 sala 0.10B Godz. 15:15
 VI WYKŁAD STATYSTYKA 9/04/2014 B8 sala 0.10B Godz. 15:15 WYKŁAD 6 WERYFIKACJA HIPOTEZ STATYSTYCZNYCH PARAMETRYCZNE TESTY ISTOTNOŚCI Weryfikacja hipotez ( błędy I i II rodzaju, poziom istotności, zasady
VI WYKŁAD STATYSTYKA 9/04/2014 B8 sala 0.10B Godz. 15:15 WYKŁAD 6 WERYFIKACJA HIPOTEZ STATYSTYCZNYCH PARAMETRYCZNE TESTY ISTOTNOŚCI Weryfikacja hipotez ( błędy I i II rodzaju, poziom istotności, zasady
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 7
 STATYSTYKA I DOŚWIADCZALNICTWO Wykład 7 Analiza korelacji - współczynnik korelacji Pearsona Cel: ocena współzależności między dwiema zmiennymi ilościowymi Ocenia jedynie zależność liniową. r = cov(x,y
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 7 Analiza korelacji - współczynnik korelacji Pearsona Cel: ocena współzależności między dwiema zmiennymi ilościowymi Ocenia jedynie zależność liniową. r = cov(x,y
), którą będziemy uważać za prawdziwą jeżeli okaże się, że hipoteza H 0
 Testowanie hipotez Każde przypuszczenie dotyczące nieznanego rozkładu badanej cechy nazywamy hipotezą statystyczną. Hipoteza określająca jedynie wartości nieznanych parametrów liczbowych badanej cechy
Testowanie hipotez Każde przypuszczenie dotyczące nieznanego rozkładu badanej cechy nazywamy hipotezą statystyczną. Hipoteza określająca jedynie wartości nieznanych parametrów liczbowych badanej cechy
Sposób wykorzystywania świadectw wzorcowania do ustalania okresów między wzorcowaniami
 EuroLab 2010 Warszawa 3.03.2010 r. Sposób wykorzystywania świadectw wzorcowania do ustalania okresów między wzorcowaniami Ryszard Malesa Polskie Centrum Akredytacji Kierownik Działu Akredytacji Laboratoriów
EuroLab 2010 Warszawa 3.03.2010 r. Sposób wykorzystywania świadectw wzorcowania do ustalania okresów między wzorcowaniami Ryszard Malesa Polskie Centrum Akredytacji Kierownik Działu Akredytacji Laboratoriów
5. WNIOSKOWANIE PSYCHOMETRYCZNE
 5. WNIOSKOWANIE PSYCHOMETRYCZNE Model klasyczny Gulliksena Wynik otrzymany i prawdziwy Błąd pomiaru Rzetelność pomiaru testem Standardowy błąd pomiaru Błąd estymacji wyniku prawdziwego Teoria Odpowiadania
5. WNIOSKOWANIE PSYCHOMETRYCZNE Model klasyczny Gulliksena Wynik otrzymany i prawdziwy Błąd pomiaru Rzetelność pomiaru testem Standardowy błąd pomiaru Błąd estymacji wyniku prawdziwego Teoria Odpowiadania
Testowanie hipotez statystycznych
 9 października 2008 ...czyli definicje na rozgrzewkę n-elementowa próba losowa - wektor n zmiennych losowych (X 1,..., X n ); intuicyjnie: wynik n eksperymentów realizacja próby (X 1,..., X n ) w ω Ω :
9 października 2008 ...czyli definicje na rozgrzewkę n-elementowa próba losowa - wektor n zmiennych losowych (X 1,..., X n ); intuicyjnie: wynik n eksperymentów realizacja próby (X 1,..., X n ) w ω Ω :
Wykład 9 Testy rangowe w problemie dwóch prób
 Wykład 9 Testy rangowe w problemie dwóch prób Wrocław, 18 kwietnia 2018 Test rangowy Testem rangowym nazywamy test, w którym statystyka testowa jest konstruowana w oparciu o rangi współrzędnych wektora
Wykład 9 Testy rangowe w problemie dwóch prób Wrocław, 18 kwietnia 2018 Test rangowy Testem rangowym nazywamy test, w którym statystyka testowa jest konstruowana w oparciu o rangi współrzędnych wektora
MONITOROWANIE DZIAŁAŃ NIEPOŻĄDANYCH
 MONITOROWANIE DZIAŁAŃ NIEPOŻĄDANYCH Michał Kusy, StatSoft Polska Sp. z o.o. Wprowadzenie Wyniki badań klinicznych leku przeprowadzanych przed wprowadzeniem go na rynek nie są w stanie dostarczyć w pełni
MONITOROWANIE DZIAŁAŃ NIEPOŻĄDANYCH Michał Kusy, StatSoft Polska Sp. z o.o. Wprowadzenie Wyniki badań klinicznych leku przeprowadzanych przed wprowadzeniem go na rynek nie są w stanie dostarczyć w pełni
Narzędzia statystyczne i ekonometryczne. Wykład 1. dr Paweł Baranowski
 Narzędzia statystyczne i ekonometryczne Wykład 1 dr Paweł Baranowski Informacje organizacyjne Wydział Ek-Soc, pok. B-109 pawel@baranowski.edu.pl Strona: baranowski.edu.pl (w tym materiały) Konsultacje:
Narzędzia statystyczne i ekonometryczne Wykład 1 dr Paweł Baranowski Informacje organizacyjne Wydział Ek-Soc, pok. B-109 pawel@baranowski.edu.pl Strona: baranowski.edu.pl (w tym materiały) Konsultacje:
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 6
 STATYSTYKA I DOŚWIADCZALNICTWO Wykład 6 Metody sprawdzania założeń w analizie wariancji: -Sprawdzanie równości (jednorodności) wariancji testy: - Cochrana - Hartleya - Bartletta -Sprawdzanie zgodności
STATYSTYKA I DOŚWIADCZALNICTWO Wykład 6 Metody sprawdzania założeń w analizie wariancji: -Sprawdzanie równości (jednorodności) wariancji testy: - Cochrana - Hartleya - Bartletta -Sprawdzanie zgodności
ZASTOSOWANIE TECHNIK CHEMOMETRYCZNYCH W BADANIACH ŚRODOWISKA. dr inż. Aleksander Astel
 ZASTOSOWANIE TECHNIK CHEMOMETRYCZNYCH W BADANIACH ŚRODOWISKA dr inż. Aleksander Astel Gdańsk, 22.12.2004 CHEMOMETRIA dziedzina nauki i techniki zajmująca się wydobywaniem użytecznej informacji z wielowymiarowych
ZASTOSOWANIE TECHNIK CHEMOMETRYCZNYCH W BADANIACH ŚRODOWISKA dr inż. Aleksander Astel Gdańsk, 22.12.2004 CHEMOMETRIA dziedzina nauki i techniki zajmująca się wydobywaniem użytecznej informacji z wielowymiarowych
Sterowanie jakością badań i analiza statystyczna w laboratorium
 Sterowanie jakością badań i analiza statystyczna w laboratorium CS-17 SJ CS-17 SJ to program wspomagający sterowanie jakością badań i walidację metod badawczych. Może działać niezależnie od innych składników
Sterowanie jakością badań i analiza statystyczna w laboratorium CS-17 SJ CS-17 SJ to program wspomagający sterowanie jakością badań i walidację metod badawczych. Może działać niezależnie od innych składników
Statystyka i Analiza Danych
 Warsztaty Statystyka i Analiza Danych Gdańsk, 20-22 lutego 2014 Zastosowania wybranych technik regresyjnych do modelowania współzależności zjawisk Janusz Wątroba StatSoft Polska Centrum Zastosowań Matematyki
Warsztaty Statystyka i Analiza Danych Gdańsk, 20-22 lutego 2014 Zastosowania wybranych technik regresyjnych do modelowania współzależności zjawisk Janusz Wątroba StatSoft Polska Centrum Zastosowań Matematyki
PODSTAWOWE ANALIZY I WIZUALIZACJA Z WYKORZYSTANIEM MAP W STATISTICA
 PODSTAWOWE ANALIZY I WIZUALIZACJA Z WYKORZYSTANIEM MAP W STATISTICA Krzysztof Suwada, StatSoft Polska Sp. z o.o. Wstęp Wiele różnych analiz dotyczy danych opisujących wielkości charakterystyczne bądź silnie
PODSTAWOWE ANALIZY I WIZUALIZACJA Z WYKORZYSTANIEM MAP W STATISTICA Krzysztof Suwada, StatSoft Polska Sp. z o.o. Wstęp Wiele różnych analiz dotyczy danych opisujących wielkości charakterystyczne bądź silnie
Opis zakładanych efektów kształcenia na studiach podyplomowych WIEDZA
 Opis zakładanych efektów kształcenia na studiach podyplomowych Nazwa studiów: BIOSTATYSTYKA PRAKTYCZNE ASPEKTY STATYSTYKI W BADANIACH MEDYCZNYCH Typ studiów: doskonalące Symbol Efekty kształcenia dla studiów
Opis zakładanych efektów kształcenia na studiach podyplomowych Nazwa studiów: BIOSTATYSTYKA PRAKTYCZNE ASPEKTY STATYSTYKI W BADANIACH MEDYCZNYCH Typ studiów: doskonalące Symbol Efekty kształcenia dla studiów
Kontekstowe wskaźniki efektywności nauczania - warsztaty
 Kontekstowe wskaźniki efektywności nauczania - warsztaty Przygotowała: Aleksandra Jasińska (a.jasinska@ibe.edu.pl) wykorzystując materiały Zespołu EWD Czy dobrze uczymy? Metody oceny efektywności nauczania
Kontekstowe wskaźniki efektywności nauczania - warsztaty Przygotowała: Aleksandra Jasińska (a.jasinska@ibe.edu.pl) wykorzystując materiały Zespołu EWD Czy dobrze uczymy? Metody oceny efektywności nauczania
Statystyka i opracowanie danych Podstawy wnioskowania statystycznego. Prawo wielkich liczb. Centralne twierdzenie graniczne. Estymacja i estymatory
 Statystyka i opracowanie danych Podstawy wnioskowania statystycznego. Prawo wielkich liczb. Centralne twierdzenie graniczne. Estymacja i estymatory Dr Anna ADRIAN Paw B5, pok 407 adrian@tempus.metal.agh.edu.pl
Statystyka i opracowanie danych Podstawy wnioskowania statystycznego. Prawo wielkich liczb. Centralne twierdzenie graniczne. Estymacja i estymatory Dr Anna ADRIAN Paw B5, pok 407 adrian@tempus.metal.agh.edu.pl
Metodologia badań psychologicznych. Wykład 12. Korelacje
 Metodologia badań psychologicznych Lucyna Golińska SPOŁECZNA AKADEMIA NAUK Wykład 12. Korelacje Korelacja Korelacja występuje wtedy gdy dwie różne miary dotyczące tych samych osób, zdarzeń lub obiektów
Metodologia badań psychologicznych Lucyna Golińska SPOŁECZNA AKADEMIA NAUK Wykład 12. Korelacje Korelacja Korelacja występuje wtedy gdy dwie różne miary dotyczące tych samych osób, zdarzeń lub obiektów
Analiza autokorelacji
 Analiza autokorelacji Oblicza się wartości współczynników korelacji między y t oraz y t-i (dla i=1,2,...,k), czyli współczynniki autokorelacji różnych rzędów. Bada się statystyczną istotność tych współczynników.
Analiza autokorelacji Oblicza się wartości współczynników korelacji między y t oraz y t-i (dla i=1,2,...,k), czyli współczynniki autokorelacji różnych rzędów. Bada się statystyczną istotność tych współczynników.
Uwaga. Decyzje brzmią różnie! Testy parametryczne dotyczące nieznanej wartości
 TESTOWANIE HIPOTEZ Przez hipotezę statystyczną rozumiemy, najogólniej mówiąc, pewną wypowiedź na temat rozkładu, z którego pochodzi próbka. Hipotezy dzielimy na parametryczne i nieparametryczne. Parametrycznymi
TESTOWANIE HIPOTEZ Przez hipotezę statystyczną rozumiemy, najogólniej mówiąc, pewną wypowiedź na temat rozkładu, z którego pochodzi próbka. Hipotezy dzielimy na parametryczne i nieparametryczne. Parametrycznymi
Kwalifikacja wykonawców różnych etapów wytwarzania
 Kwalifikacja wykonawców różnych etapów wytwarzania Dorota Prokopczyk Warszawskie Zakłady Farmaceutyczne Polfa S.A. wytwarzaniem produktów leczniczych -jest każde działanie prowadzące do powstania produktu
Kwalifikacja wykonawców różnych etapów wytwarzania Dorota Prokopczyk Warszawskie Zakłady Farmaceutyczne Polfa S.A. wytwarzaniem produktów leczniczych -jest każde działanie prowadzące do powstania produktu
b) Niech: - wśród trzech wylosowanych opakowań jest co najwyżej jedno o dawce 15 mg. Wówczas:
 ROZWIĄZANIA I ODPOWIEDZI Zadanie A1. Można założyć, że przy losowaniu trzech kul jednocześnie kolejność ich wylosowania nie jest istotna. A więc: Ω = 20 3. a) Niech: - wśród trzech wylosowanych opakowań
ROZWIĄZANIA I ODPOWIEDZI Zadanie A1. Można założyć, że przy losowaniu trzech kul jednocześnie kolejność ich wylosowania nie jest istotna. A więc: Ω = 20 3. a) Niech: - wśród trzech wylosowanych opakowań
Projekt zarządzania jakością wykorzystujący STATISTICA Data Miner przynosi w voestalpine roczne oszczędności w wysokości 800 000 EUR
 Projekt zarządzania jakością wykorzystujący STATISTICA Data Miner przynosi w voestalpine roczne oszczędności w wysokości 800 000 EUR Przemysł samochodowy stawia najwyższe wymagania jakościowe w stosunku
Projekt zarządzania jakością wykorzystujący STATISTICA Data Miner przynosi w voestalpine roczne oszczędności w wysokości 800 000 EUR Przemysł samochodowy stawia najwyższe wymagania jakościowe w stosunku
Wykład 9 Wnioskowanie o średnich
 Wykład 9 Wnioskowanie o średnich Rozkład t (Studenta) Wnioskowanie dla jednej populacji: Test i przedziały ufności dla jednej próby Test i przedziały ufności dla par Porównanie dwóch populacji: Test i
Wykład 9 Wnioskowanie o średnich Rozkład t (Studenta) Wnioskowanie dla jednej populacji: Test i przedziały ufności dla jednej próby Test i przedziały ufności dla par Porównanie dwóch populacji: Test i
Teoria błędów. Wszystkie wartości wielkości fizycznych obarczone są pewnym błędem.
 Teoria błędów Wskutek niedoskonałości przyrządów, jak również niedoskonałości organów zmysłów wszystkie pomiary są dokonywane z określonym stopniem dokładności. Nie otrzymujemy prawidłowych wartości mierzonej
Teoria błędów Wskutek niedoskonałości przyrządów, jak również niedoskonałości organów zmysłów wszystkie pomiary są dokonywane z określonym stopniem dokładności. Nie otrzymujemy prawidłowych wartości mierzonej
Analiza składowych głównych. Wprowadzenie
 Wprowadzenie jest techniką redukcji wymiaru. Składowe główne zostały po raz pierwszy zaproponowane przez Pearsona(1901), a następnie rozwinięte przez Hotellinga (1933). jest zaliczana do systemów uczących
Wprowadzenie jest techniką redukcji wymiaru. Składowe główne zostały po raz pierwszy zaproponowane przez Pearsona(1901), a następnie rozwinięte przez Hotellinga (1933). jest zaliczana do systemów uczących
Elementy statystyki wielowymiarowej
 Wnioskowanie_Statystyczne_-_wykład Spis treści 1 Elementy statystyki wielowymiarowej 1.1 Kowariancja i współczynnik korelacji 1.2 Macierz kowariancji 1.3 Dwumianowy rozkład normalny 1.4 Analiza składowych
Wnioskowanie_Statystyczne_-_wykład Spis treści 1 Elementy statystyki wielowymiarowej 1.1 Kowariancja i współczynnik korelacji 1.2 Macierz kowariancji 1.3 Dwumianowy rozkład normalny 1.4 Analiza składowych
STATYSTYKA I DOŚWIADCZALNICTWO. Wykład 2
 STATYSTYKA I DOŚWIADCZALNICTWO Wykład Parametry przedziałowe rozkładów ciągłych określane na podstawie próby (przedziały ufności) Przedział ufności dla średniej s X t( α;n 1),X + t( α;n 1) n s n t (α;
STATYSTYKA I DOŚWIADCZALNICTWO Wykład Parametry przedziałowe rozkładów ciągłych określane na podstawie próby (przedziały ufności) Przedział ufności dla średniej s X t( α;n 1),X + t( α;n 1) n s n t (α;
Zadania ze statystyki, cz.7 - hipotezy statystyczne, błąd standardowy, testowanie hipotez statystycznych
 Zadania ze statystyki, cz.7 - hipotezy statystyczne, błąd standardowy, testowanie hipotez statystycznych Zad. 1 Średnia ocen z semestru letniego w populacji studentów socjologii w roku akademickim 2011/2012
Zadania ze statystyki, cz.7 - hipotezy statystyczne, błąd standardowy, testowanie hipotez statystycznych Zad. 1 Średnia ocen z semestru letniego w populacji studentów socjologii w roku akademickim 2011/2012
Statystyczna analiza danych w programie STATISTICA (wykład 2) Dariusz Gozdowski
 Statystyczna analiza danych w programie STATISTICA (wykład ) Dariusz Gozdowski Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW Weryfikacja (testowanie) hipotez statystycznych
Statystyczna analiza danych w programie STATISTICA (wykład ) Dariusz Gozdowski Katedra Doświadczalnictwa i Bioinformatyki Wydział Rolnictwa i Biologii SGGW Weryfikacja (testowanie) hipotez statystycznych
Współczynnik korelacji. Współczynnik korelacji jest miernikiem zależności między dwiema cechami Oznaczenie: ϱ
 Współczynnik korelacji Współczynnik korelacji jest miernikiem zależności między dwiema cechami Oznaczenie: ϱ Własności współczynnika korelacji 1. Współczynnik korelacji jest liczbą niemianowaną 2. ϱ 1,
Współczynnik korelacji Współczynnik korelacji jest miernikiem zależności między dwiema cechami Oznaczenie: ϱ Własności współczynnika korelacji 1. Współczynnik korelacji jest liczbą niemianowaną 2. ϱ 1,
Zadania ze statystyki cz. 8 I rok socjologii. Zadanie 1.
 Zadania ze statystyki cz. 8 I rok socjologii Zadanie 1. W potocznej opinii pokutuje przekonanie, że lepsi z matematyki są chłopcy niż dziewczęta. Chcąc zweryfikować tę opinię, przeprowadzono badanie w
Zadania ze statystyki cz. 8 I rok socjologii Zadanie 1. W potocznej opinii pokutuje przekonanie, że lepsi z matematyki są chłopcy niż dziewczęta. Chcąc zweryfikować tę opinię, przeprowadzono badanie w
Statystyka od podstaw Janina Jóźwiak, Jarosław Podgórski
 Statystyka od podstaw Janina Jóźwiak, Jarosław Podgórski Książka jest nowoczesnym podręcznikiem przeznaczonym dla studentów uczelni i wydziałów ekonomicznych. Wykład podzielono na cztery części. W pierwszej
Statystyka od podstaw Janina Jóźwiak, Jarosław Podgórski Książka jest nowoczesnym podręcznikiem przeznaczonym dla studentów uczelni i wydziałów ekonomicznych. Wykład podzielono na cztery części. W pierwszej
STATYSTYKA MATEMATYCZNA WYKŁAD 4. WERYFIKACJA HIPOTEZ PARAMETRYCZNYCH X - cecha populacji, θ parametr rozkładu cechy X.
 STATYSTYKA MATEMATYCZNA WYKŁAD 4 WERYFIKACJA HIPOTEZ PARAMETRYCZNYCH X - cecha populacji, θ parametr rozkładu cechy X. Wysuwamy hipotezy: zerową (podstawową H ( θ = θ i alternatywną H, która ma jedną z
STATYSTYKA MATEMATYCZNA WYKŁAD 4 WERYFIKACJA HIPOTEZ PARAMETRYCZNYCH X - cecha populacji, θ parametr rozkładu cechy X. Wysuwamy hipotezy: zerową (podstawową H ( θ = θ i alternatywną H, która ma jedną z
Porównanie generatorów liczb losowych wykorzystywanych w arkuszach kalkulacyjnych
 dr Piotr Sulewski POMORSKA AKADEMIA PEDAGOGICZNA W SŁUPSKU KATEDRA INFORMATYKI I STATYSTYKI Porównanie generatorów liczb losowych wykorzystywanych w arkuszach kalkulacyjnych Wprowadzenie Obecnie bardzo
dr Piotr Sulewski POMORSKA AKADEMIA PEDAGOGICZNA W SŁUPSKU KATEDRA INFORMATYKI I STATYSTYKI Porównanie generatorów liczb losowych wykorzystywanych w arkuszach kalkulacyjnych Wprowadzenie Obecnie bardzo
Metody Ilościowe w Socjologii
 Metody Ilościowe w Socjologii wykład 2 i 3 EKONOMETRIA dr inż. Maciej Wolny AGENDA I. Ekonometria podstawowe definicje II. Etapy budowy modelu ekonometrycznego III. Wybrane metody doboru zmiennych do modelu
Metody Ilościowe w Socjologii wykład 2 i 3 EKONOMETRIA dr inż. Maciej Wolny AGENDA I. Ekonometria podstawowe definicje II. Etapy budowy modelu ekonometrycznego III. Wybrane metody doboru zmiennych do modelu
Analiza regresji - weryfikacja założeń
 Medycyna Praktyczna - portal dla lekarzy Analiza regresji - weryfikacja założeń mgr Andrzej Stanisz z Zakładu Biostatystyki i Informatyki Medycznej Collegium Medicum UJ w Krakowie (Kierownik Zakładu: prof.
Medycyna Praktyczna - portal dla lekarzy Analiza regresji - weryfikacja założeń mgr Andrzej Stanisz z Zakładu Biostatystyki i Informatyki Medycznej Collegium Medicum UJ w Krakowie (Kierownik Zakładu: prof.
Testowanie hipotez statystycznych
 Agenda Instytut Matematyki Politechniki Łódzkiej 2 stycznia 2012 Agenda Agenda 1 Wprowadzenie Agenda 2 Hipoteza oraz błędy I i II rodzaju Hipoteza alternatywna Statystyka testowa Zbiór krytyczny Poziom
Agenda Instytut Matematyki Politechniki Łódzkiej 2 stycznia 2012 Agenda Agenda 1 Wprowadzenie Agenda 2 Hipoteza oraz błędy I i II rodzaju Hipoteza alternatywna Statystyka testowa Zbiór krytyczny Poziom
ANALIZA WYNIKÓW NAUCZANIA W GIMNAZJUM NR 3 Z ZASTOSOWANIEM KALKULATORA EWD 100 ROK 2012
 ANALIZA WYNIKÓW NAUCZANIA W GIMNAZJUM NR 3 Z ZASTOSOWANIEM KALKULATORA EWD 100 ROK 2012 OPRACOWAŁY: ANNA ANWAJLER MARZENA KACZOR DOROTA LIS 1 WSTĘP W analizie wykorzystywany będzie model szacowania EWD.
ANALIZA WYNIKÓW NAUCZANIA W GIMNAZJUM NR 3 Z ZASTOSOWANIEM KALKULATORA EWD 100 ROK 2012 OPRACOWAŁY: ANNA ANWAJLER MARZENA KACZOR DOROTA LIS 1 WSTĘP W analizie wykorzystywany będzie model szacowania EWD.
Analizy wariancji ANOVA (analysis of variance)
 ANOVA Analizy wariancji ANOVA (analysis of variance) jest to metoda równoczesnego badania istotności różnic między wieloma średnimi z prób pochodzących z wielu populacji (grup). Model jednoczynnikowy analiza
ANOVA Analizy wariancji ANOVA (analysis of variance) jest to metoda równoczesnego badania istotności różnic między wieloma średnimi z prób pochodzących z wielu populacji (grup). Model jednoczynnikowy analiza
STATYSTYKA - PRZYKŁADOWE ZADANIA EGZAMINACYJNE
 STATYSTYKA - PRZYKŁADOWE ZADANIA EGZAMINACYJNE 1 W trakcie badania obliczono wartości średniej (15,4), mediany (13,6) oraz dominanty (10,0). Określ typ asymetrii rozkładu. 2 Wymień 3 cechy rozkładu Gauss
STATYSTYKA - PRZYKŁADOWE ZADANIA EGZAMINACYJNE 1 W trakcie badania obliczono wartości średniej (15,4), mediany (13,6) oraz dominanty (10,0). Określ typ asymetrii rozkładu. 2 Wymień 3 cechy rozkładu Gauss
Testowanie hipotez statystycznych
 Testowanie hipotez statystycznych Hipotezą statystyczną jest dowolne przypuszczenie co do rozkładu populacji generalnej (jego postaci funkcyjnej lub wartości parametrów). Prawdziwość tego przypuszczenia
Testowanie hipotez statystycznych Hipotezą statystyczną jest dowolne przypuszczenie co do rozkładu populacji generalnej (jego postaci funkcyjnej lub wartości parametrów). Prawdziwość tego przypuszczenia
weryfikacja hipotez dotyczących parametrów populacji (średnia, wariancja)
 PODSTAWY STATYSTYKI. Teoria prawdopodobieństwa i elementy kombinatoryki. Zmienne losowe i ich rozkłady 3. Populacje i próby danych, estymacja parametrów 4. Testowanie hipotez 5. Testy parametryczne (na
PODSTAWY STATYSTYKI. Teoria prawdopodobieństwa i elementy kombinatoryki. Zmienne losowe i ich rozkłady 3. Populacje i próby danych, estymacja parametrów 4. Testowanie hipotez 5. Testy parametryczne (na
parametrów strukturalnych modelu = Y zmienna objaśniana, X 1,X 2,,X k zmienne objaśniające, k zmiennych objaśniających,
 诲 瞴瞶 瞶 ƭ0 ƭ 瞰 parametrów strukturalnych modelu Y zmienna objaśniana, = + + + + + X 1,X 2,,X k zmienne objaśniające, k zmiennych objaśniających, α 0, α 1, α 2,,α k parametry strukturalne modelu, k+1 parametrów
诲 瞴瞶 瞶 ƭ0 ƭ 瞰 parametrów strukturalnych modelu Y zmienna objaśniana, = + + + + + X 1,X 2,,X k zmienne objaśniające, k zmiennych objaśniających, α 0, α 1, α 2,,α k parametry strukturalne modelu, k+1 parametrów
Spis treści. Laboratorium III: Testy statystyczne. Inżynieria biomedyczna, I rok, semestr letni 2013/2014 Analiza danych pomiarowych
 1 Laboratorium III: Testy statystyczne Spis treści Laboratorium III: Testy statystyczne... 1 Wiadomości ogólne... 2 1. Krótkie przypomnienie wiadomości na temat testów statystycznych... 2 1.1. Weryfikacja
1 Laboratorium III: Testy statystyczne Spis treści Laboratorium III: Testy statystyczne... 1 Wiadomości ogólne... 2 1. Krótkie przypomnienie wiadomości na temat testów statystycznych... 2 1.1. Weryfikacja
Karta (sylabus) modułu/przedmiotu Inżynieria Materiałowa Studia II stopnia Specjalność: Inżynieria Powierzchni
 Karta (sylabus) modułu/przedmiotu Inżynieria Materiałowa Studia II stopnia Specjalność: Inżynieria Powierzchni Przedmiot: Statystyczne Sterowanie Procesami Rodzaj przedmiotu: Obowiązkowy Kod przedmiotu:
Karta (sylabus) modułu/przedmiotu Inżynieria Materiałowa Studia II stopnia Specjalność: Inżynieria Powierzchni Przedmiot: Statystyczne Sterowanie Procesami Rodzaj przedmiotu: Obowiązkowy Kod przedmiotu:
