CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Pediaven G15 jest dostępny w dwukomorowych workach. Każdy worek zawiera: Roztwór aminokwasów 500 ml
|
|
|
- Ludwika Pietrzyk
- 7 lat temu
- Przeglądów:
Transkrypt
1 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Pediaven G15, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Pediaven G15 jest dostępny w dwukomorowych workach. Każdy worek zawiera: Substancje czynne Roztwór aminokwasów 500 ml Roztwór glukozy 500 ml Roztwór po zmieszaniu, gotowy do użycia 1000 ml alanina 1,45 g 1,45 g arginina 0,94 g 0,94 g kwas asparaginowy 0,94 g 0,94 g acetylocysteina (co odpowiada cysteinie) 0,31 g (0,23 g) 0,31 g (0,23 g) kwas glutaminowy 1,63 g 1,63 g glicyna 0,48 g 0,48 g histydyna 0,48 g 0,48 g izoleucyna 0,71 g 0,71 g leucyna 1,61 g 1,61 g lizyna jednowodna (co odpowiada lizynie bezwodnej) 1,45 g (1,29 g) 1,45 g (1,29 g) metionina 0,30 g 0,30 g fenyloalanina 0,62 g 0,62 g prolina 1,29 g 1,29 g seryna 0,87 g 0,87 g tauryna 0,07 g 0,07 g treonina 0,83 g 0,83 g tryptofan 0,32 g 0,32 g tyrozyna 0,11 g 0,11 g walina 0,83 g 0,83 g dipotasu fosforan 1,39 g 1,39 g glukoza jednowodna (co odpowiada glukozie bezwodnej) 165,0 g (150,0 g) 165,0 g (150,0 g) wapnia glukonian 2,69 g 2,69 g magnezu mleczan dwuwodny 0,95 g 0,95 g sodu chlorek 1,75 g 1,75 g potasu chlorek 0,67 g 0,67 g cynku octan dwuwodny 6,72 mg 6,72 mg miedzi siarczan pięciowodny 1,18 mg 1,18 mg sodu fluorek 1,11 mg 1,11 mg selenu dwutlenek 0,07 mg 0,07 mg manganu chlorek czterowodny 0,36 mg 0,36 mg potasu jodek 0,07 mg 0,07 mg chromu chlorek sześciowodny 0,10 mg 0,10 mg żelaza siarczan siedmiowodny 2,49 mg 2,49 mg kobaltu chlorek sześciowodny 0,61 mg 0,61 mg molibdenian amonu czterowodny 0,09 mg 0,09 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
2 Wartość odżywcza glukoza aminokwasy azot całkowity energia całkowita energia pozabiałkowa sód potas wapń magnez chlorki fosforany chrom kobalt miedź żelazo fluor jod mangan molibden selen cynk w 1000 ml 150 g 15 g 2,14 g 660 kcal 600 kcal 30 mmol 25 mmol 6 mmol 4 mmol 39 mmol 8 mmol 20 µg 150 µg 300 µg 500 µg 500 µg 50 µg 100 µg 50 µg 50 µg 2000 µg 3. POSTAĆ FARMACEUTYCZNA Roztwór do infuzji Roztwory glukozy i aminokwasów są przezroczyste, bezbarwne do lekko żółtawych, wolne od cząstek stałych. Produkt leczniczy, po zmieszaniu zawartości dwóch komór, jest przezroczystym roztworem, bezbarwnym do lekko żółtego, wolnym od cząstek stałych. Osmolarność: około 1091 mosm/l ph: 4,8 5,5 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Żywienie pozajelitowe pacjentów, u których żywienie doustne lub dojelitowe jest niemożliwe, niewystarczające lub przeciwwskazane. Pediaven G15 jest wskazany do zapewnienia dziennego zapotrzebowania na azot (aminokwasy lewoskrętne), glukozę, elektrolity, pierwiastki śladowe a także płyny u niemowląt, dzieci i młodzieży, w stanie stabilnym, szczególnie bez nadmiernych strat przez przewód pokarmowy i bez ciężkiego niedożywienia. 4.2 Dawkowanie i sposób podawania Pediaven G15 może być stosowany jako składnik krótkotrwałego, całkowitego lub częściowego żywienia pozajelitowego (z wyjątkiem specjalnych przypadków). Po dwóch tygodniach, lekarz dokona ponownej oceny czy Pediaven G15 jest odpowiednim produktem leczniczym w stosunku do potrzeb pacjenta i podejmie decyzję co do konieczności kontynuowania żywienia pozajelitowego. Dawkowanie Zalecenia dotyczące dawkowania u dzieci i młodzieży są wytycznymi ogólnymi, opartymi na wartościach średnich. Dawkę należy ustalić indywidualnie, w zależności od wieku pacjenta, masy ciała, zapotrzebowania FR/H/0554/003/DC 2
3 metabolicznego i energetycznego, stanu klinicznego pacjenta i zdolności do metabolizowania składników odżywczych, jak również żywienia doustnego lub dojelitowego. Lekarz dokona regularnej, klinicznej i biologicznej, oceny stanu odżywienia i sytuacji metabolicznej pacjenta, szczególnie w przypadku gdy żywienie pozajelitowe trwa dłużej niż 14 dni. Kontrola parametrów klinicznych i laboratoryjnych, patrz punkt 4.4. Zalecenia ogólne dotyczące dawki: poniższe tabele przedstawiają ogólne wytyczne dotyczące średniego zapotrzebowania* żywieniowego u dzieci i młodzieży Dzienne zapotrzebowanie w zależności od wieku Energia pozabiałkowa (kcal/kg mc./dobę) Aminokwasy (g/kg mc./dobę) Glukoza (g/kg mc./dobę) Niemowlęta 1. miesiąc życia do 2 lat Dzieci od 2 do 11 lat Młodzież od 11 do 18 lat (nie przekraczając dawki 400 g/dobę) Dawka maksymalna na godzinę Niemowlęta 1. miesiąc życia do 2 lat Dzieci od 2 do 11 lat Młodzież od 11 do 18 lat Glukoza (g/kg mc./godz.) 1,4 1,2 0,5 Pediaven G15 (ml/kg mc./godz.) 9 * zalecane wartości wg wytycznych ESPEN-ASPEN 8 3 Szybkość infuzji produktu leczniczego Pediaven G15 należy dostosować do zaleconej przez lekarza dawki, dobowej objętości produktu leczniczego do podania i czasu trwania infuzji. W zależności od stanu klinicznego i tolerancji pacjenta, Pediaven G15 może być uzupełniany o substancje dodatkowe (witaminy i elektrolity); maksymalna dawka, której nie należy przekraczać, podana jest w punkcie 6.6. Jeśli do produktu leczniczego dodawane są tłuszcze (tylko poprzez łącznik Y, nie bezpośrednio do worka, patrz punkt 6.6), należy uwzględnić zmianę współczynnika kalorii niebiałkowych do azotu. Sposób podawania Podanie do żyły centralnej. W infuzji ciągłej (podanie w czasie krótszym niż 24 godziny), szybkość infuzji w ciągu pierwszej godziny należy stopniowo zwiększać, aby zapobiec wystąpieniu hiperglikemii a następnie, na godzinę przed zakończeniem infuzji, stopniowo zmniejszać, aby zapobiec wystąpieniu hipoglikemii. 4.3 Przeciwwskazania Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Wrodzone zaburzenia metabolizmu aminokwasów. Ciężka niewydolność nerek bez możliwości przeprowadzenia dializy. Ciężka, niekontrolowana hiperglikemia. Patologicznie zwiększone stężenie w osoczu jednego z elektrolitów zawartych w produkcie leczniczym. FR/H/0554/003/DC 3
4 Niestabilny stan ogólny [taki jak, lecz nie ograniczający się do: ciężki stany pourazowy, niewyrównana cukrzyca, ostra faza wstrząsu krążeniowego, ciężka kwasica metaboliczna, ciężki zespół ogólnoustrojowej reakcji zapalnej (ciężka posocznica) oraz śpiączka hiperosmolarna]. Pacjent jest w stanie ciężkiego niedożywienia. Ponadto, należy uwzględnić ogólne przeciwwskazania do podawania infuzji dożylnej, w szczególności są to: ostry obrzęk płuc, przewodnienie, nieleczona niewydolność serca lub odwodnienie hipotoniczne. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Pediaven G15, roztwór do infuzji jest roztworem hipertonicznym. Pediaven G15, roztwór do infuzji należy podawać jedynie do żyły centralnej. Nie należy go podawać do żyły obwodowej z powodu wysokiej osmolarności. Ponieważ wykorzystanie cewnika dożylnego wiąże się z ryzykiem zakażenia, podczas zakładania i obsługi cewnika zalecane jest dokładne przestrzeganie zasad postępowania aseptycznego, aby uniknąć jakiegokolwiek zakażenia. W przypadku wystąpienia jakichkolwiek oznak lub jakiegokolwiek objawu reakcji anafilaktycznej (szczególnie gorączki, dreszczy, pocenia się, wysypki lub duszności) należy natychmiast przerwać infuzję. W celu uniknięcia ryzyka wystąpienia hiperglikemii, należy obserwować maksymalną szybkość infuzji glukozy na godzinę, w zależności od wieku i sytuacji metabolicznej pacjenta (patrz punkt 4.2). W celu uniknięcia ryzyka związanego z podaniem infuzji z szybkością większą niż zalecana, ważne jest przeprowadzenie infuzji z regularną i kontrolowaną szybkością, z użyciem elektronicznego urządzenia regulującego szybkość przepływu (pompa, np. pompa strzykawkowa). Hipermagnezemia Odnotowano wystąpienie hipermagnezemii po podaniu innych pozajelitowych leków pediatrycznych, ale nie odnotowano przypadków wystąpienia hipermagnezemii po podaniu produktu leczniczego Pediaven G15. Jednakże, ze względu na wysokość stężenia magnezu w produkcie leczniczym Pediaven G15, istnieje możliwość wystąpienia hipermagnezemii, szczególnie po podaniu dużych dawek (patrz punkt 4.2). Objawy hipermagnezemii obejmują ogólne osłabienie organizmu pacjenta, obniżenie aktywności ruchowej, nudności, wymioty, hipokalcemię, niewydolność oddechową, niedociśnienie tętnicze i zaburzenia rytmu serca. Zaleca się kontrolowanie stężenia magnezu na początku leczenia, a następnie w odpowiednich odstępach czasu, zgodnie ze standardową praktyką kliniczną i potrzebami pacjenta. Jest to szczególnie ważne u pacjentów ze zwiększonym ryzykiem wystąpienia hipermagnezemii, w tym u pacjentów z zaburzeniami czynności nerek, u pacjentów otrzymujących inne produkty lecznicze, które powodują ryzyko wystąpienia hipermagnezemii lub u pacjentów otrzymujących magnez z innych źródeł. Jeśli stężenia magnezu w surowicy są podwyższone (powyżej prawidłowych wartości) infuzję należy przerwać lub zmniejszyć szybkość infuzji do poziomu klinicznie właściwego i bezpiecznego. W celu zapewnienia całkowitego żywienia pozajelitowego, zalecane jest jednoczesne podawanie witamin rozpuszczalnych w wodzie i tłuszczach, jak również tłuszczów, chyba że jest to przeciwwskazane. W przypadku dodania emulsji tłuszczowej, należy uwzględnić zmianę współczynnika kalorii niebiałkowych do azotu. Pediaven G15 zawiera pierwiastki śladowe. Podczas infuzji niezbędna jest obserwacja kliniczna i laboratoryjna, szczególnie na jej początku. Należy kontrolować osmolarność i stężenie glukozy w surowicy, jak również równowagę wodno-elektrolitową, równowagę kwasowo-zasadową i czynność wątroby. Podczas pierwszego tygodnia leczenia, należy kilkukrotnie przeprowadzić ocenę stężenia elektrolitów. Po tym czasie, w zależności od stanu pacjenta, można uwzględnić dłuższe odstępy między kolejnymi ocenami. We wszystkich przypadkach, częstość obserwacji klinicznej i laboratoryjnej należy dostosować do każdego pacjenta oraz w przypadku wydłużonego leczenia. FR/H/0554/003/DC 4
5 Obserwacja kliniczna i laboratoryjna powinna zostać wzmożona w następujących przypadkach: ciężka niewydolność wątroby: istnieje ryzyko wystąpienia lub nasilenia zaburzeń neurologicznych związanych z hiperamonemią. ciężka niewydolność nerek: istnieje ryzyko wystąpienia lub nasilenia kwasicy metabolicznej oraz hiperazotemii. W przypadku niewydolności nerek, należy dostosować przyjęcie azotu do czynności nerek pacjenta. kwasica metaboliczna: w kwasicy mleczanowej nie zaleca się podawania glukozy dożylnie. cukrzyca lub nietolerancja glukozy: należy kontrolować glikemię, cukromocz, ketonurię oraz, o ile to konieczne, dostosować dawkę insuliny. Pediaven G15, roztwór do infuzji należy stosować ostrożnie, gdy wymagane jest ograniczenie przyjmowania płynów, szczególnie w niektórych chorobach serca, płuc, wątroby lub nerek. U pacjentów niedożywionych rozpoczęcie żywienia pozajelitowego, które jest podawane w infuzji z szybkością większą niż zalecana lub niewłaściwie kontrolowaną, może prowadzić do zespołu ponownego odżywienia z ryzykiem wystąpienia przeciążenia płynami (obrzęk, obrzęk płuc, niewydolność serca), skąpomoczu oraz zaburzeń metabolicznych (hipokaliemia, hipofosfatemia, hiperglikemia). Do zmian tych może dojść w ciągu 24 do 48 godzin, w związku z tym w tej grupie pacjentów zaleca się ostrożne i powolne rozpoczynanie żywienia pozajelitowego. Należy także ściśle monitorować i odpowiednio dostosowywać podawanie płynów, elektrolitów, pierwiastków śladowych i witamin. Należy kontrolować stężenia elektrolitów, wapnia, fosforu i magnezu u pacjentów niedożywionych otrzymujących w infuzji Pediaven G15, nawet jeśli infuzja podawana jest przez krótki okres czasu. Jeśli żywienie pozajelitowe z zastosowaniem produktu leczniczego Pediaven G15 trwa dłużej niż dwa tygodnie, należy skontrolować stężenia wapnia i fosforu u każdego pacjenta. Zaburzenia czynności nerek Produkt leczniczy należy stosować ostrożnie u pacjentów z zaburzeniami czynności nerek. Należy ściśle kontrolować bilans płynowy i elektrolitowy, włączając stężenie magnezu (patrz: hipermagnezemia) u tych pacjentów. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Należy szczególnie uważnie kontrolować glikemię w przypadku jednoczesnego podawania z roztworami glukozy lub produktami leczniczymi, które mogą spowodować wzrost stężenia glukozy we krwi. Nie należy podawać ceftriaksonu jednocześnie z roztworami dożylnymi zawierającymi wapń, w tym z produktem leczniczym Pediaven G15, przez tę samą linię infuzyjną (np. łącznik Y) z powodu ryzyka wytrącenia się soli wapniowych ceftriaksonu. Jeśli ta sama linia infuzyjna jest używana do podawania sekwencyjnego, linię należy dokładnie przepłukać zgodnym roztworem (np. fizjologicznym roztworem soli), aby uniknąć wytrącenia osadu. W niektórych przypadkach, w zależności od potrzeb pacjenta, roztwory farmakologiczne oraz przeznaczone do żywienia pozajelitowego mogą zostać dodane do worka, ale tylko po sprawdzeniu zgodności sporządzonej mieszaniny (patrz punkt 6.6). Nie należy dodawać innych produktów leczniczych do worka zawierającego Pediaven G15 ani jednocześnie podawać inne produkty lecznicze przez ten sam zestaw infuzyjny bez wcześniejszego sprawdzenia zgodności sporządzonej mieszaniny. Istnieje ryzyko wytrącenia się soli wapniowych. 4.6 Wpływ na płodność, ciążę i laktację Płodność Brak danych dotyczących toksycznego wpływu na reprodukcję u zwierząt. FR/H/0554/003/DC 5
6 Ciąża Brak danych dotyczących stosowania produktu leczniczego Pediaven G15 u kobiet w okresie ciąży. Lekarz powinien dokładnie ocenić stosunek korzyści do ryzyka u każdej pacjentki przed podaniem produktu leczniczego Pediaven G15. Karmienie piersią Nie przeprowadzono badań do oceny bezpieczeństwa stosowania produktu leczniczego Pediaven G15 u kobiet podczas karmienia piersią. Lekarz powinien dokładnie ocenić stosunek korzyści do ryzyka przed podaniem produktu leczniczego Pediaven G15 kobiecie podczas karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie dotyczy. 4.8 Działania niepożądane Mogą wystąpić działania niepożądane związane z żywieniem pozajelitowym, zwłaszcza na początku leczenia. Klasyfikacja układów i narządów MedDRA Zaburzenia układu immunologicznego Zaburzenia metabolizmu i odżywiania Zaburzenia żołądka i jelit Zaburzenia wątroby i dróg żółciowych Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) Nadwrażliwość lub reakcje alergiczne na określone aminokwasy Hiperglikemia, kwasica metaboliczna, hiperazotemia, hiperkalcemia, hiperwolemia Nudności, wymioty Przemijające zaburzenia czynności wątroby Objawy, które mogą wystąpić po przedawkowaniu produktu leczniczego (patrz punkt 4.9) są zwykle odwracalne i ustępują po przerwaniu leczenia. Zaburzenia układu immunologicznego W przypadku wystąpienia nietypowych oznak lub objawów reakcji alergicznej, takich jak pocenie się, gorączka, dreszcze, bóle głowy, wysypka lub trudności w oddychaniu, należy natychmiast przerwać infuzję. Metabolizm i zaburzenia odżywiania Jeśli szybkość infuzji glukozy na godzinę przekracza zdolność pacjenta do metabolizowania glukozy może wystąpić hiperglikemia (zdolność ta jest różna w zależności od wieku, występujących zaburzeń i równocześnie stosowanych metod leczenia). Nadmierne przyjęcie aminokwasów może prowadzić do wystąpienia kwasicy metabolicznej. Może wystąpić hiperazotemia, szczególnie przy jednocześnie występującej niewydolności nerek, wątroby lub układu oddechowego. Niewłaściwe warunki stosowania produktu leczniczego (nadmierne lub nieodpowiednie podanie produktu leczniczego w stosunku do zapotrzebowania pacjenta lub infuzja z szybkością większą niż zalecana) mogą spowodować wystąpienie objawów hiperglikemii, hiperkalcemii lub hiperwolemii. Zaburzenia czynności nerek i dróg moczowych W przypadku nadmiernego przyjęcia azotu, może wystąpić hiperazotemia, szczególnie przy jednocześnie występującej niewydolności nerek. Zaburzenia ogólne i stany w miejscu podania Miejscowe stany zapalne lub reakcje martwicze były obserwowane w następstwie wynaczynienia. Zgłaszanie podejrzewanych działań niepożądanych Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie FR/H/0554/003/DC 6
7 podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C Warszawa tel.: fax.: ndl@urpl.gov.pl. 4.9 Przedawkowanie Nadmierne lub nieodpowiednie podanie produktu leczniczego w stosunku do zapotrzebowania pacjenta może spowodować przeciążenie płynami, zaburzenia równowagi wodno-elektrolitowej, hiperosmolarność, hiperglikemię lub hiperazotemię. Informacje dotyczące maksymalnej szybkości infuzji na godzinę, w zależności od wieku pacjenta, patrz punkt 4.2. Brak specyficznego leczenia w przypadku przeciążenia płynami. Należy zastosować standardowe procedury ratunkowe oraz szczególnie dokładnie kontrolować czynności układu oddechowego, nerek i układu sercowonaczyniowego. Dokładne monitorowanie parametrów biochemicznych krwi i moczu jest niezbędne, a wszelkie występujące nieprawidłowości powinny być odpowiednio leczone. W rzadkich, ciężkich przypadkach, może być niezbędna dializa. W przypadku wystąpienia hiperglikemii, należy ją leczyć odpowiednio do stanu pacjenta poprzez podawanie odpowiednich dawek insuliny lub poprzez dostosowanie szybkości infuzji. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: roztwory do żywienia pozajelitowego, kod ATC: B05BA10. Pediaven G15 jest dwuskładnikowym roztworem do podawania pozajelitowego, dostarczającym mieszaninę węglowodanów, aminokwasów, elektrolitów i pierwiastków śladowych. Jego skład jest szczególnie dostosowany do potrzeb dzieci i młodzieży. Pediaven G15 zawiera niezbędne i warunkowo niezbędne aminokwasy, dostosowane głównie do potrzeb dzieci i młodzieży, w szczególności tyrozynę, histydynę oraz acetylocysteinę prekursor cysteiny. Glukoza jest jedynym węglowodanem wykorzystywanym jako substrat energetyczny w żywieniu pozajelitowym dzieci i młodzieży; może być wykorzystywana przez organizm w sposób szybki i bezpośredni, bez wcześniejszej konwersji enzymatycznej. 5.2 Właściwości farmakokinetyczne Nie odnotowano szczególnych różnic w odniesieniu do metabolizmu i wydalania składników odżywczych podawanych drogą dożylną w porównaniu do podania dojelitowego. Poszczególne etapy metabolizowania pierwiastków śladowych można podzielić następująco: transport we krwi przez białka transportujące: albuminy (Mn, Cu, Zn, Se), transferynę (Fe, Cr), ceruloplazminę (Cu), witaminę B 12 (Co) selenometioninę (Se) lub przez niebiałkowe przenośniki (F, I, Mo). magazynowanie, które wymaga specyficznych białek: ferrytynę (Fe), hormony tarczycy (I), selenoproteiny (Se) lub niespecyficzne białka: metalotioneiny (Cu, Zn, Mn, Mo) lub fluoroapatyty (F). FR/H/0554/003/DC 7
8 wydalanie: pierwiastki śladowe kationowe (Fe, Cu, Mn, Zn) są głównie wydalane z żółcią. Pierwiastki śladowe anionowe (I, F) i określone minerały utlenione (takie jak Mo, Co, Se, Cr) są głównie wydalane z moczem. 5.3 Przedkliniczne dane o bezpieczeństwie Nie przeprowadzono nieklinicznych badań toksyczności produktu leczniczego Pediaven G15. Dane literaturowe dotyczące aminokwasów oraz roztworów glukozy w różnych mieszaninach i stężeniach nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Biorąc pod uwagę to, że składniki żywieniowe znajdujące się w produkcie leczniczym Pediaven G15, roztwór do infuzji są stosowane jako terapia zastępcza na poziomie fizjologicznym, ryzyko wystąpienia działania toksycznego podczas normalnego stosowania klinicznego jest uważane za niewielkie. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Kwas octowy lodowaty (do ustalenia ph) Kwas solny (do ustalenia ph) Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne W związku z dużą ilością składników zawartych w roztworze, ryzyko wystąpienia fizyko-chemicznej niezgodności jest znaczne. Produktu leczniczego Pediaven G15 nie należy mieszać lub jednocześnie podawać przez ten sam zestaw infuzyjny z innymi elektrolitami lub produktami leczniczymi bez wcześniejszego sprawdzenia zgodności i stabilności sporządzonej mieszaniny. Na życzenie można uzyskać informacje dotyczące zgodności produktu leczniczego z innymi dodatkami (np. elektrolity, pierwiastki śladowe, witaminy) oraz odpowiednich okresów ważności sporządzonych mieszanin (patrz punkt 6.6). Nie należy podawać ceftriaksonu jednocześnie z roztworami dożylnymi zawierającymi wapń, w tym z produktem leczniczym Pediaven G15, przez tę samą linię infuzyjną (np. przez łącznik Y) z powodu ryzyka wytrącenia się soli wapniowych ceftriaksonu (patrz punkt 4.5). 6.3 Okres ważności Okres ważności produktu leczniczego w opakowaniu do sprzedaży 18 miesięcy Okres ważności po zmieszaniu Wykazano chemiczną i fizyczną stabilność roztworu po zmieszaniu dwóch komór przez 24 godziny w temperaturze 25 C. Z mikrobiologicznego punktu widzenia, produkt leczniczy należy zużyć natychmiast. Okres ważności po zmieszaniu z dodatkowymi substancjami Fizyko-chemiczna stabilność po zmieszaniu z dodatkowymi substancjami: patrz punkt 6.6. Z mikrobiologicznego punktu widzenia produkt leczniczy należy zużyć natychmiast po dodaniu innych składników. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w temperaturze poniżej 25 C. Nie zamrażać. Przechowywać w worku zewnętrznym. Nie otwierać worka zewnętrznego aż do momentu użycia. Zużyć bezpośrednio po wymieszaniu zawartości dwóch komór. FR/H/0554/003/DC 8
9 6.5 Rodzaj i zawartość opakowania Worek dwukomorowy zbudowany z wielowarstwowej folii polimerowej (Biofine), umieszczony w worku zewnętrznym. Worek wewnętrzny wyposażony w system portów, każdy z portów zamknięty korkiem z gumy poliizoprenowej i polipropylenową zatyczką (niezawierające lateksu). Worek wewnętrzny podzielony na dwie komory zgrzewem pękającym podczas przygotowywania worka. W przestrzeni między workiem wewnętrznym a zewnętrznym umieszczony pochłaniacz tlenu. Wielkość opakowania: 4 worki dwukomorowe 1000 ml 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Nie stosować jeśli opakowanie jest uszkodzone. Stosować wyłącznie wtedy, gdy roztwory aminokwasów i glukozy są przezroczyste, bezbarwne do lekko żółtawych. Zawartość dwóch oddzielnych komór należy zmieszać przed użyciem, a także przed ewentualnym dodaniem innych substancji przez przeznaczony do tego celu port. Do jednorazowego użycia. Mieszanie dwóch komór przed użyciem: 1. Usunąć worek zewnętrzny i położyć worek na twardej powierzchni. 2. Delikatnie zrolować worek zaczynając od góry (od strony uchwytu), uciskając aż do momentu pęknięcia zgrzewu pionowego. Odwrócić worek kilkukrotnie, co powinno zapewnić dokładne wymieszanie składników mieszaniny. Substancje dodatkowe i zgodność Do produktu leczniczego Pediaven G15 można dodawać wyłącznie roztwory farmakologiczne lub przeznaczone do żywienia pozajelitowego, których zgodność została ustalona. Mieszaninę należy zużyć natychmiast. Jeśli niezbędne jest podanie całkowitego żywienia pozajelitowego, po zmieszaniu dwóch komór, do worka można dodać inne składniki przez port przeznaczony do podawania dodatkowych substancji. Wszelkie dodatki należy łączyć z produktem leczniczym w warunkach aseptycznych w celu uniknięcia zakażenia. Sporządzoną mieszaninę należy dobrze wymieszać. Należy zwrócić szczególną uwagę na zgodność sporządzonej mieszaniny. Dodawanie emulsji tłuszczowych bezpośrednio do worka jest przeciwwskazane z powodu ryzyka destabilizacji emulsji tłuszczowej przez kationy dwuwartościowe zawarte w roztworze. Niemniej jednak, emulsje tłuszczowe mogą być podawane poprzez łącznik Y. Usuwanie pozostałości produktu leczniczego Niezużytą pozostałość mieszaniny należy usunąć. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Fresenius Kabi Polska Sp. z o.o. ul. Hrubieszowska Warszawa 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU Pozwolenie nr FR/H/0554/003/DC 9
10 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO FR/H/0554/003/DC 10
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vaminolact, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Substancje czynne: L-alanina L-arginina L-asparaginowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Vaminolact, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Substancje czynne: L-alanina L-arginina L-asparaginowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Pediaven NN2 jest dostępny w dwukomorowych workach. Każdy worek zawiera:
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Pediaven NN2, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Pediaven NN2 jest dostępny w dwukomorowych workach. Każdy worek zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Pediaven NN2, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Pediaven NN2 jest dostępny w dwukomorowych workach. Każdy worek zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Supliven, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Supliven zawiera: 1 ml 1 ampułka (10 ml) chromu(iii)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Supliven, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Supliven zawiera: 1 ml 1 ampułka (10 ml) chromu(iii)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADDAMEL N, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml koncentratu zawiera: Substancje czynne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 12,00 g 8,51 g) 5,176 g 4,20 g) 0,70 g 0,52 g)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminoven Infant 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera: L-izoleucyna L-leucyna L-lizyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminoven Infant 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera: L-izoleucyna L-leucyna L-lizyny
Ulotka dołączona do opakowania: informacja dla użytkownika. Aminoven Infant 10%, roztwór do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Aminoven Infant 10%, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika Aminoven Infant 10%, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal B. Braun 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: Aminokwasy: w 1 ml w 250 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal B. Braun 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: Aminokwasy: w 1 ml w 250 ml
Aminomel 10E 12,5E Substancje czynne: L-izoleucyna 5,85 g 7,31 g L-leucyna 6,24 g 7,80 g L-lizyny octan (w przeliczeniu na L-lizynę)
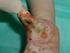 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMINOMEL 10E roztwór do infuzji. AMINOMEL 12,5E roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AMINOMEL 10E roztwór do infuzji. AMINOMEL 12,5E roztwór do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu do infuzji zawiera:
Ulotka dla pacjenta: informacja dla użytkownika. Aminomix 1 Novum, roztwór do infuzji. Roztwór aminokwasów i węglowodanów wraz z elektrolitami
 Ulotka dla pacjenta: informacja dla użytkownika, roztwór do infuzji Roztwór aminokwasów i węglowodanów wraz z elektrolitami Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dla pacjenta: informacja dla użytkownika, roztwór do infuzji Roztwór aminokwasów i węglowodanów wraz z elektrolitami Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 1. NAZWA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Aminoplasmal B.Braun 10% E roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Aminokwasy: Izoleucyna 5,00 g
1. NAZWA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Aminoplasmal B.Braun 10% E roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: Aminokwasy: Izoleucyna 5,00 g
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal 15%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera Izoleucyna Leucyna Lizyna jednowodna (zawartość
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal 15%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera Izoleucyna Leucyna Lizyna jednowodna (zawartość
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Skład produktu leczniczego NUTRYELT wyrażony w ilości soli na ampułkę (10 ml) i na litr.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości soli na ampułkę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości soli na ampułkę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Skład produktu leczniczego NUTRYELT wyrażony w ilości soli na ampułkę (10 ml) i na litr.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości soli na ampułkę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład produktu leczniczego wyrażony w ilości soli na ampułkę
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
6,00 g 6,40 g 10,27 g. 4,59 g 5,53 g 5,13 g 2,05 g 5,13 g 3,02 g 3,88 g 2,59 g 2,16 g 1,29 g 1,66 g 2,59 0,54 g. 0,37 g
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminomel Nephro roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: L-izoleucyna L-leucyna L-lizyny octan (odpowiada
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminomel Nephro roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1000 ml roztworu zawiera: L-izoleucyna L-leucyna L-lizyny octan (odpowiada
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Chlorek sodu Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO 0,9% Sodium Chloride Braun, 9 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera Chlorek sodu Stężenia elektrolitów:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
Ulotka dołączona do opakowania: informacja dla użytkownika. PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS roztwór do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
ŻYWIENIE POZAJELITOWE 3 WORKI TRÓJKOMOROWE
 ŻYWIENIE POZAJELITOWE 3 WORKI TRÓJKOMOROWE WORKI TRÓJKOMOROWE 4 ŻYWIENIE POZAJELITOWE ŻYWIENIE POZAJELITOWE 5 6 ŻYWIENIE POZAJELITOWE ŻYWIENIE POZAJELITOWE 7 WORKI DWUKOMOROWE 8 ŻYWIENIE POZAJELITOWE ŻYWIENIE
ŻYWIENIE POZAJELITOWE 3 WORKI TRÓJKOMOROWE WORKI TRÓJKOMOROWE 4 ŻYWIENIE POZAJELITOWE ŻYWIENIE POZAJELITOWE 5 6 ŻYWIENIE POZAJELITOWE ŻYWIENIE POZAJELITOWE 7 WORKI DWUKOMOROWE 8 ŻYWIENIE POZAJELITOWE ŻYWIENIE
Ulotka dołączona do opakowania: informacja dla użytkownika. SmofKabiven Peripheral, emulsja do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven Peripheral, emulsja do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven Peripheral, emulsja do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
miedzi glukonian manganu glukonian kobaltu(ii) glukonian amonu heptamolibdenian Gęstość 1,00 g/cm 3 DECAVEN Skład molarny/ 40ml
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO DECAVEN, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1000 ml zawiera żelaza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO DECAVEN, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1000 ml zawiera żelaza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika Aminoplasmal B. Braun 10% E roztwór do infuzji Aminokwasy i elektrolity Należy uważnie zapoznać się z treścią ulotki przed
ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika Aminoplasmal B. Braun 10% E roztwór do infuzji Aminokwasy i elektrolity Należy uważnie zapoznać się z treścią ulotki przed
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
Nadający się do wstrzyknięcia roztwór aminokwasów zawiera 15 L-aminokwasów (8 aminokwasów niezbędnych) potrzebnych do syntezy białka.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CLINIMIX N14G30E 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ CLINIMIX N14G30E jest pakowany w dwukomorowych workach; jedna komora
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CLINIMIX N14G30E 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ CLINIMIX N14G30E jest pakowany w dwukomorowych workach; jedna komora
Ulotka dołączona do opakowania: informacja dla użytkownika. SmofKabiven Peripheral, emulsja do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven Peripheral, emulsja do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven Peripheral, emulsja do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CLINIMIX N12G20E zestaw dwóch roztworów do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CLINIMIX N12G20E zestaw dwóch roztworów do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY CLINIMIX N12G20E jest pakowany
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CLINIMIX N12G20E zestaw dwóch roztworów do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY CLINIMIX N12G20E jest pakowany
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
Fresenius Kabi Polska Sp. z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY mg/1000 ml jony mmol/1000
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN FIZJOLOGICZNY WIELOELEKTROLITOWY IZOTONICZNY FRESENIUS, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY mg/1000 ml jony mmol/1000
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dipeptiven, 200 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera: Substancja czynna
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Dipeptiven, 200 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera: Substancja czynna
Ulotka dołączona do opakowania: informacja dla użytkownika. SmofKabiven extra Nitrogen EF, emulsja do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven extra Nitrogen EF, emulsja do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven extra Nitrogen EF, emulsja do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
1g tłuszczów = 5 ml = 100 kropli preparatu IVELIP 20% Dorośli Dawka: 1 do 3,0 g tłuszczów/kg masy ciała/dobę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IVELIP 20% 200 mg/ml, emulsja do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml emulsji zawiera: olej sojowy oczyszczony (Soiae oleum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IVELIP 20% 200 mg/ml, emulsja do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml emulsji zawiera: olej sojowy oczyszczony (Soiae oleum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 0,99 g (0,88 g) 0,13 g (0,11 g) 0,070 g (0,052 g)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal Paed 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: Aminokwasy: w 1 ml w 100 ml w 250
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aminoplasmal Paed 10%, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Roztwór do infuzji zawiera: Aminokwasy: w 1 ml w 100 ml w 250
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO MULTIMEL N4-550 E 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO MULTIMEL N4-550 E 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Multimel N4-550 E pakowany jest w trójkomorowe worki. Dostępne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO MULTIMEL N4-550 E 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Multimel N4-550 E pakowany jest w trójkomorowe worki. Dostępne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO RUMIANEK FIX, 1,5 g/saszetkę, zioła do zaparzania w saszetkach 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda saszetka zawiera 1,5 g Matricaria
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Olimel N7, emulsja do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Olimel ma postać trójkomorowego worka. Każdy worek zawiera roztwór glukozy,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Olimel N7, emulsja do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Olimel ma postać trójkomorowego worka. Każdy worek zawiera roztwór glukozy,
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
ULOTKA DLA PACJENTA. Ulotka dołączona do opakowania: informacja dla pacjenta. Glukoza 5 Braun, 50 mg/ml, roztwór do infuzji (Glucosum)
 ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Glukoza 5 Braun, 50 mg/ml, roztwór do infuzji (Glucosum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Glukoza 5 Braun, 50 mg/ml, roztwór do infuzji (Glucosum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Nazwa produktu leczniczego: OLIMEL PERI N4E, OLIMEL N5E, OLIMEL N7E, OLIMEL N9, OLIMEL N9E, OLIMEL N12E, preparat złożony, emulsja do infuzji
 INFORMACJA O LEKU Nazwa produktu leczniczego: OLIMEL PERI N4E, OLIMEL N5E, OLIMEL N7E, OLIMEL N9, OLIMEL N9E, OLIMEL N12E, preparat złożony, emulsja do infuzji SKŁAD JAKOŚCIOWY I ILOŚCIOWY OLIMEL PERI,
INFORMACJA O LEKU Nazwa produktu leczniczego: OLIMEL PERI N4E, OLIMEL N5E, OLIMEL N7E, OLIMEL N9, OLIMEL N9E, OLIMEL N12E, preparat złożony, emulsja do infuzji SKŁAD JAKOŚCIOWY I ILOŚCIOWY OLIMEL PERI,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Accusol 35. Accusol 35
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Accusol 35 Potassium 4 mmol/l Roztwór do hemofiltracji, hemodializy i hemodiafiltracji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład Komora duża
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Accusol 35 Potassium 4 mmol/l Roztwór do hemofiltracji, hemodializy i hemodiafiltracji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Skład Komora duża
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Benelyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu do infuzji zawiera: sodu chlorek potasu chlorek wapnia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Benelyte, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu do infuzji zawiera: sodu chlorek potasu chlorek wapnia
Duosol zawierający 4 mmol/l potasu
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Duosol zawierający 4 mmol/l potasu 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Mniejsza komora Roztwór elektrolitów 555 ml na Większa komora Roztwór
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Duosol zawierający 4 mmol/l potasu 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Mniejsza komora Roztwór elektrolitów 555 ml na Większa komora Roztwór
Ulotka dołączona do opakowania: informacja dla użytkownika. Aminoplasmal Paed 10%, roztwór do infuzji. Do stosowania u dzieci (w wieku 0-11 lat)
 Ulotka dołączona do opakowania: informacja dla użytkownika Aminoplasmal Paed 10%, roztwór do infuzji Do stosowania u dzieci (w wieku 0-11 lat) Aminokwasy Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla użytkownika Aminoplasmal Paed 10%, roztwór do infuzji Do stosowania u dzieci (w wieku 0-11 lat) Aminokwasy Należy uważnie zapoznać się z treścią ulotki przed
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nutrineal PD4 (z 1,1% roztworem aminokwasów), Zestaw do dializy otrzewnowej. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 litr roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Nutrineal PD4 (z 1,1% roztworem aminokwasów), Zestaw do dializy otrzewnowej. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 litr roztworu zawiera:
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
Fresenius Kabi Polska Sp. z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM 5% ET NATRIUM CHLORATUM 0,9% 2:1 FRESENIUS, (33,3 mg + 3,0 mg)/ml, roztwór do infuzji 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY 1 ml roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM 5% ET NATRIUM CHLORATUM 0,9% 2:1 FRESENIUS, (33,3 mg + 3,0 mg)/ml, roztwór do infuzji 2. SKŁAD ILOŚCIOWY I JAKOŚCIOWY 1 ml roztworu
Ulotka dołączona do opakowania: informacja dla użytkownika. Benelyte, roztwór do infuzji Produkt złożony
 Ulotka dołączona do opakowania: informacja dla użytkownika, roztwór do infuzji Produkt złożony Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla użytkownika, roztwór do infuzji Produkt złożony Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM TEVA, 200 mg/ml, roztwór do wstrzykiwań GLUCOSUM TEVA, 400 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY GLUCOSUM
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM TEVA, 200 mg/ml, roztwór do wstrzykiwań GLUCOSUM TEVA, 400 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY GLUCOSUM
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Nutriflex special zestaw dwóch roztworów do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nutriflex special zestaw dwóch roztworów do sporządzania roztworu do infuzji 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Ilości substancji czynnych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Nutriflex special zestaw dwóch roztworów do sporządzania roztworu do infuzji 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Ilości substancji czynnych
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Septofar Miód i Cytryna, 0,6 mg + 1,2 mg, pastylki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda pastylka twarda zawiera: Amylometakrezol
Produkt stosowany pomocniczo w dolegliwościach związanych ze stanami zapalnymi stawów oraz w stanach bólowych po stłuczeniach.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa produktu leczniczego Pasta borowinowa lecznicza 2. Skład jakościowy i ilościowy Borowina 3. Postać farmaceutyczna Pasta na skórę 4. Szczegółowe dane kliniczne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN RINGERA FRESENIUS, (8,6 mg + 0,3 mg + 0,33 mg)/ml, roztwór do infuzji (Natrii chloridum + Kalii chloridum + Calcii chloridum dihydricum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PŁYN RINGERA FRESENIUS, (8,6 mg + 0,3 mg + 0,33 mg)/ml, roztwór do infuzji (Natrii chloridum + Kalii chloridum + Calcii chloridum dihydricum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
1. Nazwa własna produktu leczniczego Physioneal 40 z glukozą 3,86% w/v 38,6 mg/ml roztwór do dializy otrzewnowej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa własna produktu leczniczego Physioneal 40 z glukozą 3,86% w/v 38,6 mg/ml roztwór do dializy otrzewnowej 2. Skład jakościowy i ilościowy Przed zmieszaniem 1000
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. Nazwa własna produktu leczniczego Physioneal 40 z glukozą 3,86% w/v 38,6 mg/ml roztwór do dializy otrzewnowej 2. Skład jakościowy i ilościowy Przed zmieszaniem 1000
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM 10% FRESENIUS, 100 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 100 mg glukozy (Glucosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLUCOSUM 10% FRESENIUS, 100 mg/ml, roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 100 mg glukozy (Glucosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Bocheńska Lecznicza Sól Jodowo-Bromowa 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Produkt leczniczy zawiera sól jodowo-bromową, w tym jodki nie mniej
DEKARCENAL 2:1 O SMAKU KAWY Z MLEKIEM
 DEKARCENAL 2:1 O SMAKU KAWY Z MLEKIEM żywność specjalnego przeznaczenia medycznego do postępowania dietetycznego w niedożywieniu i w ryzyku jego powstania DEKARCENAL 2:1 o smaku kawy z mlekiem to kompletny
DEKARCENAL 2:1 O SMAKU KAWY Z MLEKIEM żywność specjalnego przeznaczenia medycznego do postępowania dietetycznego w niedożywieniu i w ryzyku jego powstania DEKARCENAL 2:1 o smaku kawy z mlekiem to kompletny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cynk Aguettant, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cynk Aguettant, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cynk Aguettant, 1 mg/ml, koncentrat do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 1 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon Advance, (1000 mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Accusol 35 Potassium 4 mmol/l Roztwór do hemofiltracji, hemodializy i hemodiafiltracji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Accusol 35 Potassium 4 mmol/l Roztwór do hemofiltracji, hemodializy i hemodiafiltracji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. NuTRIflex Omega plus Emulsja do infuzji
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Emulsja do infuzji Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Emulsja do infuzji Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
Ulotka dołączona do opakowania: informacja dla pacjenta. Aminoplasmal Paed 10%, roztwór do infuzji
 Ulotka dołączona do opakowania: informacja dla pacjenta Aminoplasmal Paed 10%, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Aminoplasmal Paed 10%, roztwór do infuzji Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Syrop z bluszczu Labima 5,4 mg/ml, syrup 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Suchy wyciąg z liści bluszczu (Hedera helix L., folium). 1 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Syrop z bluszczu Labima 5,4 mg/ml, syrup 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Suchy wyciąg z liści bluszczu (Hedera helix L., folium). 1 ml
ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas
 Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
PLANOWANIE INTERWENCJI ŻYWIENIOWEJ (2)
 Kurs Zespołów Żywieniowych PLANOWANIE INTERWENCJI ŻYWIENIOWEJ (2) Stanisław Kłęk Polskie Towarzystwo Żywienia Pozajelitowego i Dojelitowego Szpital Specjalistyczny im. Stanley Dudrick a, Skawina Planowanie:
Kurs Zespołów Żywieniowych PLANOWANIE INTERWENCJI ŻYWIENIOWEJ (2) Stanisław Kłęk Polskie Towarzystwo Żywienia Pozajelitowego i Dojelitowego Szpital Specjalistyczny im. Stanley Dudrick a, Skawina Planowanie:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rehydron, proszek do przygotowywania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 saszetka zawiera: Glukoza bezwodna 6,75 g Chlorek sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Rehydron, proszek do przygotowywania roztworu 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 saszetka zawiera: Glukoza bezwodna 6,75 g Chlorek sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOXIUM 500, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg wapnia dobesylanu (Calcii dobesilas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DOXIUM 500, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg wapnia dobesylanu (Calcii dobesilas).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
