Agencja Oceny Technologii Medycznych
|
|
|
- Rafał Lipiński
- 7 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 42/2014 z dnia 28 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie bendamustyny w rozpoznaniu zakwalifikowanym do kodu ICD-10: C81 z rozszerzeniami realizowanego w ramach Programu leczenia w ramach świadczenia chemioterapii niestandardowej Rada Przejrzystości uznaje za niezasadne usunięcie świadczenia obejmującego podawanie bendamustyny w rozpoznaniu zakwalifikowanym do kodu ICD-10: C81 z rozszerzeniami, realizowanego w ramach Programu leczenia w ramach świadczenia chemioterapii niestandardowej, z jego ograniczeniem do uzasadnionych klinicznie przypadków, np. terapii pomostowej do planowanego przeszczepu komórek macierzystych u pacjentów, u których stwierdzono pierwotną lub wtórną oporność na wcześniej zastosowane schematy leczenia o potwierdzonej skuteczności. Zasadne wydaje się, aby cena opakowania leku zawierającego bendamustynę, stosowanego w ramach chemioterapii niestandardowej, nie była wyższa od limitu finansowania opublikowanego w aktualnym Obwieszczeniu Ministra Zdrowia, z uwzględnieniem instrumentów podziału ryzyka. Uzasadnienie Nie odnaleziono rekomendacji ani mocnych dowodów naukowych potwierdzających zasadność stosowania bendamustyny we wskazaniu C81 (choroba Hodgkina) wraz z rozszerzeniami. Znanych jest szereg komparatorów dla wymienionej technologii o potwierdzonej skuteczności. Przesłanki do stosowania tej technologii wynikające z dowodów o słabej jakości naukowej odnaleziono jedynie w odniesieniu do nielicznych przypadków pierwotnie lub wtórnie opornych na wcześniej zastosowane schematy leczenia, wymagających wprowadzenia terapii pomostowej do planowanego przeszczepu komórek macierzystych, co podkreśla w swojej opinii także jeden z ekspertów. Liczba dotychczas wydawanych zgód na leczenie bendamustyną w ramach świadczenia chemioterapii niestandardowej w przedmiotowych rozpoznaniach jest znikoma i nie przekracza 5 rocznie. Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa, tel fax sekretariat@aotm.gov.pl
2 Przedmiot wniosku Stanowisko Rady Przejrzystości AOTM nr 42/2014 z dnia 28 stycznia 2014 r. Zlecenie dotyczy wydania rekomendacji Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia ze świadczeń gwarantowanych obejmujących podanie produktów leczniczych bendamustyny w rozpoznaniu zakwalifikowanym do kodu C81 - Choroba Hodgkina wraz z rozszerzeniami w Programie leczenia w ramach świadczenia chemioterapii niestandardowej. Problem zdrowotny Choroba Hodgkina, zwana też ziarnicą złośliwą, jest chorobą nowotworową węzłów chłonnych. U ponad 80% pacjentów umiejscawia się powyżej przepony. Objawy ogólne występują u około 30% chorych. Mogą to być: gorączka (powyżej 38 C), nocne poty oraz ubytek masy ciała. Od kilku lat obowiązuje nowe podejście do klasyfikacji chłoniaka Hodgkina. Anglojęzyczne klasyfikacje histopatologiczne obecnie używają określenia Hodgkin lymphoma. Zgodnie z klasyfikacją WHO/REAL wprowadzoną w 1999 roku, choroba ta została podzielona na dwie jednostki podkliniczne: postać guzkową z przewagą limfocytów i postać klasyczną, obejmującą typ włóknienia guzkowy, mieszanokomórkowy, z dużą ilością limfocytów bądź ich zanikiem. Podstawę rozpoznania stanowi ocena histopatologiczna węzła chłonnego lub innej nacieczonej tkanki. Natomiast podstawę klasyfikacji stanowią różnice w morfologii komórek nowotworowych oraz w otaczających je środowiskach. Rozpoznanie histopatologiczne chłoniaka Hodgkina musi być zawsze uzupełnione oceną stopnia zaawansowania klinicznego Ann Arbor z modyfikacją Cotswolds. Według tej klasyfikacji stopień zaawansowania obejmuje liczbę i lokalizację zajętych węzłów chłonnych lub narządów pozalimfatycznych, oraz obecność objawów ogólnych. Zgodnie z otrzymaną opinią konsultanta wojewódzkiego ds. hematologii w praktyce klinicznej rozpoznanie chłoniaka Hodgkina opiera się na histologicznym badaniu pobranego węzła chłonnego i mieści się w zakresie C81.0 do C81.3. W dostępnej literaturze medycznej nie odnaleziono danych objaśniających znaczenie następujących klasyfikacji: C81.7 inna choroba Hodgkina; C81.9 choroba Hodgkina nie określona. Przypadki takie wynikają zdaniem eksperta raczej z trudności w ocenie przez patomorfologa i w codziennej praktyce występują sporadycznie lub wcale. Występują dwa szczyty zachorowań: pierwszy około 25 r.ż. i drugi po 50 r.ż. Mężczyźni chorują nieco częściej niż kobiety. Dzieci poniżej 10 r.ż. chorują natomiast bardzo rzadko. Chłoniak Hodgkina stanowi około 5 7% chorób nowotworowych u dzieci, a roczna częstość zachorowań wynosi 5/ osób poniżej 15 lat. Chłoniak ten częściej występuje również u osób z niedoborami odporności, zarówno wrodzonymi (m.in. ataksja-teleangiektazja, zespół Wiskotta-Aldricha i agammaglobulinemia typu szwajcarskiego), jak i nabytymi. W Polsce zgłasza się do rejestrów około 800 nowych zachorowań rocznie, co stanowi 0,8% wszystkich nowotworów i ok. 25% chłoniaków. Dotychczas nie poznano przyczyn tej choroby. Pod uwagę brane są predyspozycje genetyczne i wpływ czynników środowiskowych lub infekcyjnych, szczególnie w dzieciństwie i młodym wieku. Coraz liczniejsze dowody wskazują na to, że patogenetycznie z rozwojem tej choroby wiąże się zakażenie wirusem Epsteina-Barr. Choroba ta, zwana też ziarnicą złośliwą, jest chorobą nowotworową węzłów chłonnych. U ponad 80% pacjentów umiejscawia się powyżej przepony. Objawy ogólne występują u około 30% chorych. Mogą to być: gorączka (powyżej 38 C), nocne poty oraz ubytek masy ciała. Podstawę rozpoznania stanowi ocena histopatologiczna węzła chłonnego lub innej nacieczonej tkanki. Natomiast podstawę klasyfikacji stanowią różnice w morfologii komórek nowotworowych oraz w otaczających je środowiskach. Rozpoznanie histopatologiczne chłoniaka Hodgkina musi być zawsze uzupełnione oceną stopnia zaawansowania klinicznego Ann Arbor z modyfikacją Cotswolds. Według tej klasyfikacji stopień zaawansowania obejmuje liczbę i lokalizację zajętych węzłów chłonnych lub narządów pozalimfatycznych, oraz obecność objawów ogólnych. Ziarnica złośliwa jest rozrostem o dużej chemio- i promieniowrażliwości, stąd leczenie opiera się połączeniu wybranego schematu chemioterapeutycznego wraz z zastosowaniem radioterapii. W zależności od stopnia zaawansowania choroby wyleczalność ziarnicy złośliwej wynosi od 50 do 95%. 2/5
3 Opis wnioskowanej technologii medycznej Stanowisko Rady Przejrzystości AOTM nr 42/2014 z dnia 28 stycznia 2014 r. Bendamustyna jest lekiem o działaniu przeciwnowotworowym, o właściwościach alkilujących, analogiem purynowym, pochodną chlormetyny. Jego działanie polega na uszkodzeniu DNA komórek nowotworowych prowadząc do ich apoptozy i hamuje ich podział. Stosuje się ją w leczeniu następujących nowotworów: - przewlekła białaczka limfocytowa (nowotwór złośliwy limfocytów, rodzaju krwinek białych) u pacjentów, u których leczenie fludarabiną jest niewskazane; - chłoniak nieziarniczy (non-hodgkin) (nowotwór złośliwy tkanki limfatycznej, części układu odpornościowego) u pacjentów, u których doszło do pogorszenia w przebiegu choroby nowotworowej w czasie lub po leczeniu z zastosowaniem rituksymabu; - szpiczak mnogi (nowotwór złośliwy szpiku kostnego) w skojarzeniu z prednizonem u pacjentów w wieku powyżej 65 lat, którzy nie kwalifikują się do przeszczepu komórek macierzystych ani do leczenia talidomidem lub bortezomibem. Alternatywne technologie medyczne Na podstawie odnalezionych dowodów naukowych, a także nadesłanych opinii eksperckich stwierdza się, że obecnie opcjami alternatywnymi najczęściej stosowanymi w wskazaniu C 81 są schematy chemioterapii linii BEACOPP (bleomycyna, etopozyd, adriamycyna, cyklofosfamid, winkrystyna, prokarbazyna, prednizon), ABVD (adriamycyna, bleomycyna, winblastyna, dakarbazyna), a także schematy DHAP (fosfodihydroksyaceton, fosforan dihydroksyacetonu)/igev (ifosfamid, gemcytabina, winorelbina)/ice (ifosfamid, karboplatyna, etopozyd) stosowane u tzw. populacji obciążonej (vulnerable). Dodatkowo eksperci wskazują na możliwe zastosowanie substancji brentuksymab vedotin. Ponadto, w leczeniu chłoniaka Hodgkina stosuje się radioterapię miejsc pierwotnie zmienionych (IFRT) jako monoterapię bądź terapię wspomagającą leczenie chemioterapeutykami. Skuteczność kliniczna, praktyczna W wyniku przeprowadzonej strategii wyszukiwania nie odnaleziono żadnych przeglądów systematycznych i/lub metaanaliz dotyczących przedmiotowej sprawy. Odnalezione badania wtórne były badaniami o nieokreślonej metodologii i z tego względu nie zostały włączone do niniejszej analizy. Odnalezione i omówione w raporcie badania pierwotne były albo badaniami retrospektywnymi albo badaniami 1-2 fazy klinicznej. Brak jest obecnie wystarczających dowodów naukowych potwierdzających w sposób jednoznaczny efektywność bendamustyny zarówno jako monoterapii, jak również części schematu terapeutycznego we wskazaniu C 81 wraz z ew. rozszerzeniami. Odnalezione badania sugerują potencjalnie korzystny wpływ bendamustyny podawanej w schemacie terapeutycznym BeEAM (a więc łącznie z etopozydem, cytarabina i mefalanem) w leczeniu opornego/nawrotowego chłoniaka Hodgkina. Terapia ta służy wówczas jako terapia pomostowa do planowanego przeszczepu komórek macierzystych. Najczęściej planuje się przeszczep allogeniczny (allosct, NMT), gdyż wcześniej zastosowany przeszczep autogeniczny (ASCT) nie był możliwy bądź nie przyniósł oczekiwanych rezultatów. Bezpieczeństwo stosowania W 2010 r. Europejska Agencja Leków zakończyła procedurę arbitrażu w wyniku braku porozumienia między państwami członkowskimi Unii Europejskiej (UE) w kwestii dopuszczenia do obrotu preparatu bendamustyny Levact i produktów z nim związanych. Działający przy Agencji Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) uznał, że korzyści ze stosowania preparatu Levact przewyższają ryzyko oraz że pozwolenie na dopuszczenie do obrotu można przyznać w Niemczech i w następujących państwach członkowskich: w Austrii, Belgii, Danii, Finlandii, Francji, Hiszpanii, Irlandii, Luksemburgu, Norwegii, Polsce, Wielkiej Brytanii i we Włoszech. CHMP ocenił dwa badania kliniczne przedstawione przez firmę na poparcie wskazań do stosowania w szpiczaku mnogim i chłoniaku nieziarniczym. Na podstawie oceny tych danych i w wyniku dyskusji naukowej przeprowadzonej wewnątrz Komitetu CHMP uznał, że korzyści ze stosowania preparatu Levact przewyższają ryzyko w tych dwóch wskazaniach, w odniesieniu do których wniesiono sprzeciw. 3/5
4 Stanowisko Rady Przejrzystości AOTM nr 42/2014 z dnia 28 stycznia 2014 r. Komitet zalecił więc przyznanie pozwolenia na dopuszczenie preparatu Levact do obrotu w Niemczech i wszystkich zainteresowanych państwach członkowskich w odniesieniu do wszystkich proponowanych we wniosku wskazań. Większość odnalezionych informacji dotyczących bezpieczeństwa substancji bendamustyny dotyczyła jej stosowania we wskazaniach zarejestrowanych. Niemniej jednak, bendamustyna uznana jest za lek wywołujący wiele poważnych i zagrażających życiu działań niepożądanych, w tym zahamowanie czynności szpiku kostnego, infekcje oraz wtórne nowotwory. Bendamustyna zostało określona jako lek przeciwnowotworowy o umiarkowanym potencjale emetycznym u osób leczonych chemioterapią lub radioterapią. Nie zaleca się stosowania bendamustyny w ciąży ani podczas karmienie piersią. Co więcej, bezpieczeństwo jak i skuteczność stosowania tej substancji u dzieci nie zostały dotychczas określone na podstawie badań naukowych. W leczeniu chłoniaka Hodgkina do głównych zdarzeń niepożądanych zaobserwowanych podczas badań klinicznych I i II fazy należały: silna neutropenia i trombocytopenia, jak również zakażenia/zapalenia oraz anemia. Niejednokrotnie stwierdzano przypadki śmiertelne podczas prowadzonych badan klinicznych, które mogły być jednak związane z samą progresją chorobą, a nie z zastosowanym leczeniem bendamustyną. Wpływ na budżet płatnika publicznego Zgodnie z załącznikiem do obwieszczenia Ministra Zdrowia z dnia 23 grudnia 2013 r. (poz. 52): wykaz refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych na dzień 1 stycznia 2014, bendamustyna jest obecnie finansowana ze środków publicznych w Polsce w ramach następujących programów lekowych: Bendamustyna (załącznik programu B 51): Leczenie bendamustyną chłoniaków nieziarniczych o powolnym przebiegu opornych na rutyksymab (ICD-10: C82, C83, C85, C88.0) Zgodnie z informacją przekazaną wraz ze zleceniem MZ oraz w korespondencji Prezesa NFZ bendamustyna w rozpoznaniu C81 wraz z rozszerzeniami jest finansowana ze środków publicznych w Polsce w ramach świadczenia chemioterapii niestandardowej. Dane przekazane przez NFZ wskazują, że w latach wydano łącznie 10 zgód na leczenie bendamustyną w ramach świadczenia chemioterapii niestandardowej w przedmiotowych rozpoznaniach. Liczba wniosków na leczenie bendamustyną w 2012 r. 5 wniosków, oraz w 2013 r. 4 wnioski. Rekomendacje innych instytucji dotyczące ocenianej technologii medycznej Łącznie odnaleziono 11 rekomendacji dotyczących leczenia choroby Hodgkina. Żadna z odnalezionych rekomendacji poza jedną nie uwzględniła stosowania bendamustyny w chorobie Hodgkina. Najważniejszym czynnikiem w planowaniu leczenia jest stadium zaawansowania choroby, z uwzględnieniem czynników prognostycznych. Należy podkreślić, że wszyscy pacjenci, niezależnie od stadium i rokowania, powinni być poddani terapii z intencją wyleczenia. Odnalezione zalecenia dotyczące chorych w stadium wczesnym i pośrednim chłoniaka Hodgkina wskazują, że leczeniem z wyboru jest chemioterapia skojarzona z radioterapią. U chorych z grupy tzw. niskiego ryzyka wystarczające jest dwukrotne zastosowanie schematu chemioterapeutycznego ABVD (adriamycyna, bleomycyna, winblastyna, dakarbazyna) oraz radioterapii miejsc pierwotnie zmienionych (IFRT) w dawce 20 Gy. U chorych z tzw. grupy niekorzystnego ryzyka powinno się stosować ten sam schemat chemioterapeutyczny, ale czterokrotnie oraz IFRT w dawce 30 Gy. Alternatywę w tej grupie pacjentów stanowią dwa cykle eskalowanych dawek schematu BEACOPP (bleomycyna, etopozyd, adriamycyna, cyklofosfamid, winkrystyna, prokarbazyna, prednizon) oraz 2 cykle ABVD, a następnie IFRT w dawce 30 Gy. Odnalezione zalecenia dotyczące chorych w stadiach zaawansowanych chłoniaka Hodgkina wskazują z kolei, że leczeniem z wyboru jest zastosowanie chemioterapii według protokołu ABVD, podając 6 cykli u chorych z całkowitą remisją choroby lub 8 cykli u tych, którzy osiągają jedynie częściową remisję choroby. Alternatywnie można zastosować 4 cykle eskalowanych dawek schematu BEACOPP, a po uzyskaniu całkowitej remisji choroby kolejne 4 cykle BEACOPP w dawkach standardowych. 4/5
5 Stanowisko Rady Przejrzystości AOTM nr 42/2014 z dnia 28 stycznia 2014 r. Warto zauważyć, że schemat BEACOPP nie powinien być stosowany u chorych powyżej 60. roku życia ze względu na dużą toksyczność hematologiczną tego schematu. W przypadku nawrotu lub opornej postaci chłoniaka Hodgkina standardem postępowania jest zastosowanie alternatywnej chemioterapii. To właśnie tych przypadków najczęściej dotyczyło ewentualne leczenie bendamustyną lub lenalidomidem, oceniane w odnalezionych przez analityka badaniach pierwotnych. Obecnie, optymalny protokół chemioterapii w tych wskazaniach powinien cechować się skutecznością przeciwnowotworową i niską toksycznością, szczególnie wobec krwiotwórczych komórek macierzystych, umożliwiając tym samym ich mobilizację i późniejsze przeszczepienie. Wobec braku badań randomizowanych trudno wskazać protokół chemioterapii, który miałby zdecydowaną przewagę nad pozostałymi. Do najczęściej stosowanych w praktyce klinicznej zalicza się jednak schematy oparte na cisplatynie, takie jak DHAP (cisplatyna, cytarabina, deksametazon) oraz inne, jak np. IGEV (ifosfamid, gemcytabina, winorelbina). Allogeniczne przeszczepienie krwiotwórczych komórek macierzystych u chorych z HL pozostaje przedmiotem kontrowersji, głównie ze względu na wysoką śmiertelność okołoprzeszczepową. Inną opcją jest także użycie nowych leków, najlepiej w ramach kontrolowanych badań klinicznych, takich jak brentuksymab vedotin. Odnaleziona rekomendacja Brytyjskiego Komitetu ds. Hematologii, wydana w 2013 r., a dotycząca schematów chemioterapii stosowanych jako terapia ratunkowa u pacjentów z chłoniakiem Hodgkina, kwalifikujących się do przeszczepu komórek macierzystych, wskazała że wybór schematu chemioterapeutycznego powinien zostać oparty o rozpoznane u pacjenta czynniki ryzyka oraz od prowadzonych w danym ośrodku metod leczenia. Między innymi wskazała na możliwe zastosowanie bendamustyny, która w odnalezionym badaniu klinicznym Moskowitz et al. wykazała ogólną odpowiedź kliniczną badanych na poziomie 53%, a uzyskaną całkowitą remisję choroby u 33% chorych z nawrotowym/opornym chłoniakiem Hodgkina. W wyniku przeprowadzonego wyszukiwania nie odnaleziono żadnych rekomendacji dotyczących finansowania ze środków publicznych omawianych substancji w wskazaniach pozarejestracyjnych. Należy mieć na uwadze, że w większości krajów europejskich brak jest pozytywnych list leków refundowanych we wskazaniach pozarejestracyjnych. Za zastosowanie leku w takim przypadku odpowiada lekarz, leki stosowane są w ramach badań klinicznych lub refundowane na zasadach indywidulanej zgody, po wykazaniu, że w danym stanie klinicznym nie jest możliwe zastosowanie innego leku, który jest refundowany oraz wskazaniu dowodów na skuteczność kliniczną. Ponadto, rekomendacje refundacyjne możliwe do odnalezienia na stronach agencji HTA rzadko, jeśli w ogóle, dotyczą wskazań pozarejestracyjnych zwykle odniesienie się do takich wskazań w rekomendacji jest niemożliwe z uwarunkowań prawnych. Dodatkowe uwagi Rady Brak uwag. Biorąc pod uwagę powyższe argumenty, Rada Przejrzystości przyjęła stanowisko jak na wstępie.... Wiceprzewodniczący Rady Przejrzystości prof. Michał Myśliwiec Tryb wydania stanowiska Stanowisko wydano na podstawie art. 31 e ustawy z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych (Dz. U. z 2008 r. Nr 164, poz.1027 z późn.zm.), z uwzględnieniem raportu Lenalidomid i Bendamustyna - we wskazaniach: C81 i C81 z rozszerzeniami AOTM-OT /2013, styczeń 2014 r. Inne wykorzystane źródła danych, oprócz wskazanych w ww. raporcie: 1. Stanowisko eksperta przekazane podczas posiedzenia r. 5/5
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 38/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 20/2014 z dnia 20 stycznia 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie winorelbiny w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 9/2012 z dnia 27 lutego 2012 w zakresie zmiany sposobu finansowania świadczenia gwarantowanego Leczenie chłoniaków
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie?
 Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 156/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 268/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie nelarabiny w rozpoznaniach
BENDAMUSTINUM HYDROCHLORIDUM
 Dziennik Urzędowy Ministra Zdrowia 1499 Poz. 71 Załącznik C.67. BENDAMUSTINUM HYDROCHLORIDUM 1. BENDAMUSTINUM HYDROCHLORIDUM C81 2. BENDAMUSTINUM HYDROCHLORIDUM C81.0 3. BENDAMUSTINUM HYDROCHLORIDUM C81.1
Dziennik Urzędowy Ministra Zdrowia 1499 Poz. 71 Załącznik C.67. BENDAMUSTINUM HYDROCHLORIDUM 1. BENDAMUSTINUM HYDROCHLORIDUM C81 2. BENDAMUSTINUM HYDROCHLORIDUM C81.0 3. BENDAMUSTINUM HYDROCHLORIDUM C81.1
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 154/2013 z dnia 28 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 154/2013 z dnia 28 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 182/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Mozobil
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 33/2012 z dnia 18 czerwca 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany jego poziomu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 162/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 27/2012 z dnia 28 maja 2012 r. w sprawie zasadności usunięcia z wykazu świadczeń gwarantowanych realizowanych
ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH
 ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie UE/EOG Austria Belgia Dania Finlandia Francja Irlandia
ANEKS I WYKAZ NAZW, POSTACI)FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCA W PAŃSTWACH CZŁONKOWSKICH 1 Państwo Członkowskie UE/EOG Austria Belgia Dania Finlandia Francja Irlandia
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 98/2012 z dnia 29 października 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 98/2012 z dnia 29 października 2012 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu
Rysunek. Układ limfatyczny.
 Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Rysunek. Układ limfatyczny.
 Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Hematoonkologia w liczbach. Dr n med. Urszula Wojciechowska
 Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 76/2014 z dnia 25 lutego 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie interferonu-alfa-2a w
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 76/2014 z dnia 25 lutego 2014 r. w sprawie usunięcia świadczenia obejmującego podawanie interferonu-alfa-2a w
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 161/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 155/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 155/2014 z dnia 23 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 163/2014 z dnia 30 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Rada Przejrzystości. Agencja Oceny Technologii Medycznych. Uzasadnienie
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 171/2014 z dnia 9 czerwca 2014 r. w sprawie oceny leku Pentaxim (kod EAN: 5909990625260) we wskazaniach: zapobieganie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 171/2014 z dnia 9 czerwca 2014 r. w sprawie oceny leku Pentaxim (kod EAN: 5909990625260) we wskazaniach: zapobieganie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 191/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Opinia Rady Przejrzystości nr 198/2015 z dnia 21 września 2015 r. w sprawie objęcia refundacją leków zawierających
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Opinia Rady Przejrzystości nr 198/2015 z dnia 21 września 2015 r. w sprawie objęcia refundacją leków zawierających
Lek. med. Krzysztof Łanda. Niekonstytucyjna nierówność dostępu do chemioterapii niestandardowej na obszarze Polski
 Lek. med. Krzysztof Łanda Niekonstytucyjna nierówność dostępu do chemioterapii niestandardowej na obszarze Polski GENEZA: ch/ns i zapomnianej już (?) f/ns 1. Wentyl bezpieczeństwa systemu (tak jak ID wyjątkowe,
Lek. med. Krzysztof Łanda Niekonstytucyjna nierówność dostępu do chemioterapii niestandardowej na obszarze Polski GENEZA: ch/ns i zapomnianej już (?) f/ns 1. Wentyl bezpieczeństwa systemu (tak jak ID wyjątkowe,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 45/2014 z dnia 10 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 45/2014 z dnia 10 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Rysunek. Układ Limfatyczny.
 Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Międzynarodowe standardy leczenia szpiczaka plazmocytowego w roku 2014
 Międzynarodowe standardy leczenia szpiczaka plazmocytowego w roku 2014 Wiesław Wiktor Jędrzejczak, Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego Tak
Międzynarodowe standardy leczenia szpiczaka plazmocytowego w roku 2014 Wiesław Wiktor Jędrzejczak, Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego Tak
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Chłoniak z obwodowych komórek T może wystąpić w każdym wieku, najczęściej jednak pojawia się u osób dorosłych, zarówno kobiet jak i mężczyzn.
 Informacja dotyczy chłoniaka z obwodowych komórek T bliżej nieokreślonego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi
Informacja dotyczy chłoniaka z obwodowych komórek T bliżej nieokreślonego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA
 Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Rysunek. Układ limfatyczny.
 Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych
 Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych Jadwiga Dwilewicz-Trojaczek Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa
Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych Jadwiga Dwilewicz-Trojaczek Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej. Szanowny Panie Marszałku,
 Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia
 Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia
 Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
VI.2 Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego Bendamustine Actavis przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Przewlekła białaczka
Innowacje w hematoonkologii ocena dostępności w Polsce
 Warszawa, 22 maja 2012 r. Seminarium edukacyjne pt.: Podsumowanie Seminarium 22 maja 2012 r. miało miejsce w Warszawie ósme z kolei seminarium Fundacji Watch Health Care pt.: " - ocena dostępności w Polsce".
Warszawa, 22 maja 2012 r. Seminarium edukacyjne pt.: Podsumowanie Seminarium 22 maja 2012 r. miało miejsce w Warszawie ósme z kolei seminarium Fundacji Watch Health Care pt.: " - ocena dostępności w Polsce".
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 197/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 197/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 150/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Adcetris (brentuksymab vedotin), EAN: 5909991004545 we
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 150/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Adcetris (brentuksymab vedotin), EAN: 5909991004545 we
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 19/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 maja 2012 r. w zakresie usunięcia lub zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu
Rekomendacja nr 19/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 28 maja 2012 r. w zakresie usunięcia lub zmiany sposobu finansowania świadczenia opieki zdrowotnej Podanie rytuksymabu w leczeniu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 189/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Wsparcie merytoryczne i logistyczne niekomercyjnych badań klinicznych
 Wsparcie merytoryczne i logistyczne niekomercyjnych badań klinicznych Badanie kliniczne definicje badaniem klinicznym jest każde badanie prowadzone z udziałem ludzi w celu odkrycia lub potwierdzenia klinicznych,
Wsparcie merytoryczne i logistyczne niekomercyjnych badań klinicznych Badanie kliniczne definicje badaniem klinicznym jest każde badanie prowadzone z udziałem ludzi w celu odkrycia lub potwierdzenia klinicznych,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 87/2014 z dnia 24 marca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Ogólne podsumowanie oceny naukowej produktu leczniczego Mifepristone Linepharma i nazw produktów związanych (patrz aneks I)
 Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Aneks II Wnioski naukowe i podstawy pozytywnej opinii zgodnie z warunkiem pozwolenia na dopuszczenie do obrotu i warunkiem zmiany charakterystyki produktu leczniczego i ulotki dla pacjenta przedstawione
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 83/2012 z dnia 24 września 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych lub zmiany sposobu finansowania
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 83/2012 z dnia 24 września 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych lub zmiany sposobu finansowania
Terapeutyczne Programy Zdrowotne 2012 Leczenie glejaków mózgu Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 181/2012 z dnia 13 sierpnia 2012 r. w sprawie objęcia refundacją produktów leczniczych zawierających temozolomid,
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 181/2012 z dnia 13 sierpnia 2012 r. w sprawie objęcia refundacją produktów leczniczych zawierających temozolomid,
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego.
 Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
TRANSGRANICZNA OPIEKA ZDROWOTNA
 TRANSGRANICZNA OPIEKA ZDROWOTNA Warszawa, 18 czerwca 2015 Rola Oddziałów Wojewódzkich NFZ w realizacji zadań wynikających z zaimplementowania do przepisów krajowych założeń dyrektywy transgranicznej. Podstawowe
TRANSGRANICZNA OPIEKA ZDROWOTNA Warszawa, 18 czerwca 2015 Rola Oddziałów Wojewódzkich NFZ w realizacji zadań wynikających z zaimplementowania do przepisów krajowych założeń dyrektywy transgranicznej. Podstawowe
MAM HAKA NA CHŁONIAKA
 MAM HAKA NA CHŁONIAKA CHARAKTERYSTYKA OGÓLNA Chłoniaki są to choroby nowotworowe, w których następuje nieprawidłowy wzrost komórek układu limfatycznego (chłonnego). Podobnie jak inne nowotwory, chłoniaki
MAM HAKA NA CHŁONIAKA CHARAKTERYSTYKA OGÓLNA Chłoniaki są to choroby nowotworowe, w których następuje nieprawidłowy wzrost komórek układu limfatycznego (chłonnego). Podobnie jak inne nowotwory, chłoniaki
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ
 Załącznik nr 38 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ ZAKRES ŚWIADCZENIA GWARANTOWANEGO
Załącznik nr 38 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ ZAKRES ŚWIADCZENIA GWARANTOWANEGO
CHŁONIAKI ZŁOŚLIWE U DZIECI
 Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
Limfocyty powstają w szpiku kostnym, czyli tam gdzie powstają wszystkie komórki krwi. Występują
 Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0)
 Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Fundusz ratunkowy jako perspektywa dla leczenia osób z chorobami rzadkimi
 Fundusz ratunkowy jako perspektywa dla leczenia osób z chorobami rzadkimi Wiesław Wiktor Jędrzejczak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego
Fundusz ratunkowy jako perspektywa dla leczenia osób z chorobami rzadkimi Wiesław Wiktor Jędrzejczak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego
Pozytywne skutki wdrożenia ustawy refundacyjnej - stanowisko rządu
 Warszawa, 23 marca 2017 r. Stanowisko organizacji wspierających pacjentów onkologicznych do sprawozdania z wykonania ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia
Warszawa, 23 marca 2017 r. Stanowisko organizacji wspierających pacjentów onkologicznych do sprawozdania z wykonania ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia
Wyzwania systemowe stojące przed hematologią onkologiczną w aspekcie starzejącego się społeczeństwa w Polsce
 Wyzwania systemowe stojące przed hematologią onkologiczną w aspekcie starzejącego się społeczeństwa w Polsce Dr n. med. Jakub Gierczyński, MBA Doradztwo i ekspertyzy Warszawa, 27.01.2016 Wykład odbywa
Wyzwania systemowe stojące przed hematologią onkologiczną w aspekcie starzejącego się społeczeństwa w Polsce Dr n. med. Jakub Gierczyński, MBA Doradztwo i ekspertyzy Warszawa, 27.01.2016 Wykład odbywa
Finansowanie świadczeń w ramach hematoonkologii miejsca na porozumienia podziału ryzyka. Magdalena Władysiuk, MD, MBA
 Finansowanie świadczeń w ramach hematoonkologii miejsca na porozumienia podziału ryzyka Magdalena Władysiuk, MD, MBA Wydatki NFZ w hematonkologii Wydatki 2010 Onkologia Hematologia JGP 1 411 500 000 zł
Finansowanie świadczeń w ramach hematoonkologii miejsca na porozumienia podziału ryzyka Magdalena Władysiuk, MD, MBA Wydatki NFZ w hematonkologii Wydatki 2010 Onkologia Hematologia JGP 1 411 500 000 zł
NON-HODGKIN S LYMPHOMA
 NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Aneks I Wykaz nazw, postać farmaceutyczna, moc produktu leczniczego, droga podania, wnioskodawcy / podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu w państwach członkowskich 1 Podmiot
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 15/2014 z dnia 20 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 15/2014 z dnia 20 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 190/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 190/2014 z dnia 4 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
SYTUACJA PACJENTÓW HEMATOONKOLOGICZNYCH I ICH BLISKICH. Aleksandra Rudnicka Rzecznik PKPO
 SYTUACJA PACJENTÓW HEMATOONKOLOGICZNYCH I ICH BLISKICH Aleksandra Rudnicka Rzecznik PKPO Koalicja to wspólny głos ponad 100 tysięcy pacjentów onkologicznych! 44 organizacje wspólnie działają na rzecz chorych
SYTUACJA PACJENTÓW HEMATOONKOLOGICZNYCH I ICH BLISKICH Aleksandra Rudnicka Rzecznik PKPO Koalicja to wspólny głos ponad 100 tysięcy pacjentów onkologicznych! 44 organizacje wspólnie działają na rzecz chorych
HEMATOLOGIA ONKOLOGICZNA ASPEKTY KLINICZNE, EKONOMICZNE I SYSTEMOWE
 HEMATOLOGIA ONKOLOGICZNA ASPEKTY KLINICZNE, EKONOMICZNE I SYSTEMOWE Raport Instytutu Zarządzania w Ochronie Zdrowia Uczelni Łazarskiego we współpracy z Instytutem Hematologii i Transfuzjologii (Prof. Krzysztof
HEMATOLOGIA ONKOLOGICZNA ASPEKTY KLINICZNE, EKONOMICZNE I SYSTEMOWE Raport Instytutu Zarządzania w Ochronie Zdrowia Uczelni Łazarskiego we współpracy z Instytutem Hematologii i Transfuzjologii (Prof. Krzysztof
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 73/2012 z dnia 24 września 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego.
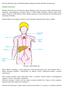 Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Bendamustyna w leczeniu opornych postaci szpiczaka mnogiego
 Bendamustyna w leczeniu opornych postaci szpiczaka mnogiego Iwona Hus, Joanna Mańko Klinika Hematonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie Nałęczów 22 listopada 2008 Bendamustyna
Bendamustyna w leczeniu opornych postaci szpiczaka mnogiego Iwona Hus, Joanna Mańko Klinika Hematonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie Nałęczów 22 listopada 2008 Bendamustyna
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 110/2014 z dnia 28 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 110/2014 z dnia 28 kwietnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2013 z dnia 14 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 138/2013 z dnia 14 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Produkty złożone (combo) stosowane w nadciśnieniu tętniczym a system refundacji leków ocena potencjału oszczędności
 Produkty złożone (combo) stosowane w nadciśnieniu tętniczym a system refundacji leków ocena potencjału oszczędności MIEJ SERCE I PATRZAJ W SERCE... I TĘTNICE HEALTH PROJECT MANAGEMENT 23 maja 2016 r. Nieprzestrzeganie
Produkty złożone (combo) stosowane w nadciśnieniu tętniczym a system refundacji leków ocena potencjału oszczędności MIEJ SERCE I PATRZAJ W SERCE... I TĘTNICE HEALTH PROJECT MANAGEMENT 23 maja 2016 r. Nieprzestrzeganie
