Profil bezpieczeństwa leflunomidu
|
|
|
- Ignacy Szewczyk
- 7 lat temu
- Przeglądów:
Transkrypt
1 Artykuł przeglądowy/review paper Reumatologia 2008; 46, 6: Profil bezpieczeństwa leflunomidu Leflunomide safety profile Bożena Targońska-Stępniak Katedra i Klinika Reumatologii i Układowych Chorób Tkanki Łącznej Uniwersytetu Medycznego w Lublinie, kierownik Katedry i Kliniki prof. dr hab. med. Maria Majdan Słowa kluczowe: leki modyfikujące przebieg choroby, leflunomid, zapalenie stawów, bezpieczeństwo. Key words: disease-modifying antirheumatic drugs, leflunomide, arthritis, safety. Streszczenie Leflunomid (LEF) jest lekiem modyfikującym przebieg choroby (LMPCh) w terapii reumatoidalnego i łuszczycowego zapalenia stawów. Wyniki badań klinicznych i następnie obserwacji postmarketingowych wykazały skuteczność działania leku, który zmniejsza aktywność choroby i poprawia jakość życia chorych. Dane dotyczące bezpieczeństwa terapii wskazują, że stosowanie LEF nie zwiększa istotnie ryzyka działań niepożądanych, w porównaniu z innymi LMPCh. Częstość występowania objawów niepożądanych LEF nie różni się istotnie od częstości takich zdarzeń podczas terapii metotreksatem lub sulfasalazyną. Najczęstszymi objawami niepożądanymi leczenia LEF są: biegunka, zwiększenie aktywności enzymów wątrobowych, wypadanie włosów i wysypka skórna. Działania niepożądane występują zwykle w ciągu pierwszych 1 3 mies. leczenia. W trakcie leczenia LEF, zwłaszcza w okresie pierwszych 6 mies., konieczna jest uważna kontrola parametrów funkcji wątroby oraz morfologii krwi. Summary Leflunomide (LEF) is one of the disease-modifying antirheumatic drugs (DMARDs) used in the treatment of rheumatoid and psoriatic arthritis. Results of clinical trials and post-marketing studies documented that LEF is effective in reducing disease activity and improving quality of life. The safety data show no increased risk of adverse events during LEF treatment, in comparison with other DMARDs. The incidence of adverse events during LEF therapy is not significantly different from that observed with methotrexate or sulfasalazine treatment. The most common LEF-associated adverse events include: diarrhoea, elevated liver enzymes, alopecia and rash. Adverse events are usually observed during the first 1-3 months of therapy. Careful monitoring of liver function tests and complete blood cell count is necessary during LEF therapy, especially within the first 6 months of treatment. Wstęp Leflunomid (LEF) jest lekiem o działaniu immunomodulującym i przeciwzapalnym, stosowanym w leczeniu reumatoidalnego zapalenia stawów (RZS), łuszczycowego zapalenia stawów (ŁZS) oraz innych chorób zapalnych i autoimmunologicznych [1]. Leflunomid jest przekształcany w błonie śluzowej jelita i wątrobie do aktywnego metabolitu A , który odpowiada za terapeutyczne działanie leku. Podstawowym mechanizmem działania LEF jest wybiórcze zablokowanie syntezy de novo pirymidyn przez hamowanie aktywności enzymu dehydrogenazy dihydroorotanowej (DHODH). Zasadniczym celem działania LEF są aktywowane limfocyty T, które do intensywnej proliferacji wymagają wielokrotnie zwiększonej puli nukleotydów pirymidynowych, powstających na szlaku de novo. Leflunomid zatrzymuje cykl komórkowy limfocytów w fazie G1, co hamuje ich proliferację i ekspansję. Lek ten wywiera mniejszy wpływ na inne komórki, które wykorzystują szlaki ratunkowe w celu wytwarzania prekursorów pirymidyn [1 3]. Leflunomid hamuje także prolifera- Adres do korespondencji: dr med. Bożena Targońska-Stępniak, Katedra i Klinika Reumatologii i Układowych Chorób Tkanki Łącznej, Uniwersytet Medyczny, ul. Jaczewskiego 8, Lublin, tel ; faks , bozena.stepniak@am.lublin.pl Praca wpłynęła: r.
2 368 Bożena Targońska-Stępniak cję aktywowanych monocytów/makrofagów oraz limfocytów B, jest również inhibitorem kinazy tyrozynowej, jednak w stężeniach znacznie większych niż osiągane podczas leczenia. Inne prawdopodobne mechanizmy działania LEF obejmują: hamowanie aktywności czynnika jądrowego κb(nuclear factor κb NFκB), hamowanie ekspresji cząsteczek adhezyjnych, upośledzenie chemotaksji granulocytów obojętnochłonnych, zmniejszenie wytwarzania przez monocyty wolnych rodników tlenowych [2]. Dane z badań klinicznych z randomizacją Wyniki wielu badań klinicznych z randomizacją i późniejszych wieloletnich obserwacji wskazują, że LEF jest skutecznym i bezpiecznym lekiem modyfikującym przebieg choroby w RZS [4 9] i ŁZS [10]. W badaniach klinicznych fazy II i III leczenie LEF przeprowadzono łącznie u 1693 chorych (w przeliczeniu 2533 pacjentolat). Oceniając działania niepożądane pomiędzy chorymi otrzymującymi LEF lub placebo, najczęściej obserwowano różnice częstości występowania biegunki (27 vs 12%), podwyższenia aktywności enzymów: aminotransferazy alaninowej (AlAT) i asparaginianowej (AspAT) (10 vs 2%), wypadania włosów (9 vs 1%) oraz wysypek skórnych (12 vs 7%) [1, 4, 11]. W większości przypadków objawy były przemijające, o łagodnym nasileniu, ustępowały podczas kontynuacji leczenia LEF lub po zmniejszeniu jego dawki [1, 11]. W 2-letnim badaniu oceniającym rezultaty leczenia LEF w porównaniu z MTX u chorych na RZS stwierdzono, że w pierwszym roku terapii u osób leczonych LEF spośród działań niepożądanych najczęściej obserwowano: biegunkę, wypadanie włosów i nudności [7]. Zwiększenie aktywności enzymów wątrobowych obserwowano 3-krotnie częściej u pacjentów leczonych MTX niż LEF (16,3 vs 5,4%). W drugim roku terapii nadciśnienie tętnicze i wysypka skórna były najczęstszymi objawami niepożądanymi związanymi z leczeniem LEF [7]. Częstość objawów niepożądanych zmniejszała się w drugim roku leczenia [7, 8]. Analiza terapii LEF prowadzonej u 214 chorych na RZS w fazie otwartej przedłużonego ponad 2 lata badania klinicznego wykazała, że profil bezpieczeństwa leku był zgodny z danymi uzyskanymi podczas wcześniejszych faz badania. Nie obserwowano żadnych dodatkowych działań niepożądanych, natomiast ich częstość zmniejszyła się podczas przedłużonego leczenia LEF [3]. Oceniono, że objawy niepożądane prawdopodobnie związane ze stosowaniem leku pojawiły się u 26,2% chorych, najczęściej były to: biegunka (5,6%), nadciśnienie tętnicze (2,8%), nieprawidłowa aktywność AlAT, AspAT (2,8%), wysypka skórna (2,8%) i wyprysk (2,3%). Poważne objawy działania niepożądanego związane z terapią LEF występowały rzadko (4,2%), mała była częstość tych objawów, które doprowadziły do przerwania leczenia (5,6%) [3]. Dane z badań obserwacyjnych W obserwacjach postmarketingowych i analizach epidemiologicznych wykazano zgodność profilu bezpieczeństwa LEF z danymi pochodzącymi z badań klinicznych. Nie obserwowano zwiększonego ryzyka działań niepożądanych podczas leczenia LEF w porównaniu z innymi LMPCh [11]. Uznano, że LEF jako LMPCh w terapii RZS charakteryzuje się pozytywnym wskaźnikiem korzyści/ryzyko leczenia [11]. Analiza przeprowadzona w grupie chorych leczonych na RZS w Stanach Zjednoczonych wykazała, że częstość występowania wszystkich objawów niepożądanych jest znacząco mniejsza podczas monoterapii LEF (94 zdarzenia/1000 pacjentolat) w porównaniu z częstością w trakcie stosowania MTX (145/1000) lub innych LMPCh (143/1000) oraz w przypadku niestosowania LMPCh (383/1000). Leczenie skojarzone LEF z MTX było związane z mniejszą częstością działań niepożądanych niż leczenie skojarzone MTX z innymi LMPCh (42,8 vs 69,5/1000 pacjentolat) [12]. Częstość objawów uszkodzenia wątroby była porównywalna u chorych leczonych LEF i innymi LMPCh (LEF 4,1/1000 pacjentolat vs MTX 6,25 vs inne LMPCh 4,2) [12]. Przerwanie leczenia z powodu działań niepożądanych Dane dotyczące zaprzestania leczenia LEF z powodu działań niepożądanych nie są jednorodne. Na podstawie analizy wyników 6 badań klinicznych, w których objęto leczeniem 2044 chorych na aktywną postać RZS, stwierdzono, że częstość przerwania leczenia i występowania objawów niepożądanych nie różniły się istotnie w grupie chorych leczonych LEF w porównaniu z osobami leczonymi sulfasalazyną (SS) czy metotreksatem (MTX) [13]. Analiza zbiorcza podsumowująca dane dotyczące bezpieczeństwa leczenia LEF w badaniach klinicznych fazy II i III wykazała podobną częstość występowania działań niepożądanych (także poważnych) podczas leczenia LEF, MTX i SS [1]. Zaprzestanie leczenia z jakiejkolwiek przyczyny lub z powodu objawów niepożądanych następowało z porównywalną częstością we wszystkich grupach. W związku z tymi objawami terapię przerwano u 20,7% osób leczonych LEF, u 19,8% MTX i 25,6% SS [1]. Spośród objawów niepożądanych, które spowodowały przerwanie leczenia LEF w pierwszym roku terapii, najczęściej opisywano: zwiększenie aktywności aminotransferaz, nudności, biegunkę i wypadanie włosów. W drugim roku leczenia przyczynami przerwania terapii LEF były: nadciśnienie tętnicze, wysypka skórna i wypadanie włosów [7].
3 Profil bezpieczeństwa leflunomidu 369 W innym badaniu obserwacyjnym trwającym 42 mies. wykazano, że częstość przerywania leczenia LEF z powodu działań niepożądanych leku była niższa niż podczas terapii MTX lub SS. Zaprzestanie leczenia następowało istotnie wcześniej u chorych leczonych LEF niż MTX [14]. Znaczny odsetek wczesnego przerwania terapii mógł wynikać ze stosowania wysokiej dawki nasycającej leku (100 mg/dobę przez 3 kolejne dni) [14]. Odmienne wnioski podano na podstawie trzyletniej obserwacji prowadzonej wśród chorych na RZS leczonych ambulatoryjnie. Stwierdzono, że w ciągu pierwszego roku leczenie LMPCh było przerywane z powodu działań niepożądanych częściej w przypadku stosowania LEF (41,6%) niż MTX (10,4%) oraz innymi LMPCh [15]. Zaprzestanie leczenia LEF było związane z objawami ze strony przewodu pokarmowego (19%), zmianami skórnymi (19%), nadciśnieniem tętniczym (18%), znaczącym ubytkiem masy ciała (12%), uszkodzeniem wątroby (podwyższenie aktywności AlAT, AspAT >2 razy powyżej normy) (10%), leukopenią (2%) oraz innymi objawami (21%). Autorzy zwracali uwagę, że grupa chorych, w której stosowano LEF, charakteryzowała się dłuższym czasem trwania RZS i starszym wiekiem, co wskazuje na to, że LEF był stosowany u chorych z ciężką postacią choroby, prawdopodobnie źle reagujących na stosowane wcześniej metody leczenia. Nietolerancja była główną przyczyną przerwania leczenia LEF [15]. W grupie chorych na ŁZS obserwowanych przez 2 lata również stwierdzono, że zaprzestanie leczenia w związku z działaniami niepożądanymi następowało częściej podczas terapii LEF (29,2%) niż MTX (10,8%), głównie w pierwszym roku leczenia. Objawami, które spowodowały przerwanie terapii, były: podwyższenie aktywności AlAT i AspAT, biegunka, nudności, nadciśnienie tętnicze oraz leukopenia [16]. Ostatnio opublikowana metaanaliza badań klinicznych oceniających skuteczność i bezpieczeństwo leczenia chorych na ŁZS wykazała, że spośród LMPCh najczęściej z powodu działań niepożądanych przerywano podawanie LEF. Mimo to, LEF charakteryzuje się jednym z najkorzystniejszych wskaźników skuteczność/tolerancja leczenia drugim po inhibitorach TNF (tumour necrosis factor, czynnik martwicy nowotworów) [17]. Na podstawie wyników badań klinicznych stwierdzono, że u chorych na RZS nie obserwuje się istotnych różnic w częstości występowania poważnych działań niepożądanych podczas leczenia LEF, MTX czy SS. W ciągu 2 lat obserwacji przerwanie leczenia z powodu objawów niepożądanych następowało z częstością 8,2% u osób leczonych LEF i 5,9% MTX oraz 10% u leczonych LEF i 15% SS [18]. Najczęściej występujące objawy niepożądane Biegunka Biegunkę jako najczęstsze działanie niepożądane LEF obserwowano u 17% chorych w trakcie badań klinicznych. Podczas leczenia LEF biegunka pojawia się zwykle w ciągu pierwszych 3 mies. terapii i może być związana z zastosowaniem dawki nasycającej LEF [1, 11]. Jest to zazwyczaj objaw przemijający, ustępuje w trakcie kontynuacji terapii LEF lub w 98% przypadków po zastosowaniu leczenia objawowego [2, 11]. Uważa się, że wystąpienie biegunki może zależeć od wpływu LEF na cykl życiowy komórek nabłonka przewodu pokarmowego, mimo że w badaniach klinicznych nie wykazano związku pomiędzy wielkością dawki LEF a objawami ze strony przewodu pokarmowego [11]. W razie pojawienia się biegunki zaleca się zmniejszenie dawki LEF, zmianę diety, zastosowanie preparatów stabilizujących florę bakteryjną jelit oraz leków przeciwbiegunkowych [11]. Upośledzenie funkcji wątroby Zaburzenia funkcji wątroby w postaci podwyższenia aktywności aminotransferaz są znanym działaniem niepożądanym LEF. Zwykle obserwuje się podwyższoną aktywność AlAT, czasami z towarzyszącym zwiększeniem aktywności AspAT. Ocenia się, że izolowany podwyższony poziom AspAT nie jest związany z działaniem LEF [11]. Objaw ten występuje zwykle podczas pierwszych 6 mies. leczenia [1, 11]. Najczęściej zwiększenie się aktywności aminotransferaz nie przekracza 2-krotnej wartości górnej granicy normy i jest przejściowe, ustępuje w trakcie dalszej terapii lub po zmniejszeniu dawki LEF [2]. W badaniach klinicznych u chorych na RZS podwyższony poziom enzymów wątrobowych stwierdzano w ok. 5% przypadków [11]. W innych publikacjach opisywano zwiększenie aktywności aminotransferaz u 15% leczonych LEF w porównaniu z 12% chorych leczonych MTX i 3% otrzymującymi placebo [4, 5]. Według raportów FDA, pomimo często obserwowanego wzrostu aktywności enzymów wątrobowych (u 2 5% chorych), podczas leczenia LEF rzadko występują poważne objawy hepatotoksyczności (np. ostra niewydolność wątroby z częstością 7,9/ pacjentolat) [1]. U wszystkich chorych leczonych LEF obowiązuje kontrola aktywności enzymów wątrobowych, zwłaszcza u pacjentów stosujących preparaty hepatotoksyczne bądź z towarzyszącymi chorobami wątroby. Według zaleceń europejskich aktywność AlAT powinna być oceniana na początku leczenia, a następnie co 2 tyg. przez 6 mies., później co 8 tyg. W przypadku zwiększenia się aktywności
4 370 Bożena Targońska-Stępniak AlAT 2 3 razy powyżej normy obowiązuje kontrola badań co tydzień. W trakcie leczenia skojarzonego LEF i MTX ocena funkcji wątroby (aktywność AlAT, AspAT, stężenie albuminy) powinna być przeprowadzana co miesiąc. W przypadku wzrostu poziomu aminotransferaz <2 razy górnej granicy normy dawka LEF powinna być zmniejszona do 10 mg/dobę [2]. Jeżeli po zmniejszeniu dawki leku aktywność aminotransferaz nadal utrzymuje się w przedziale 2 3 razy powyżej górnej granicy normy, terapia powinna być przerwana lub zalecana jest biopsja wątroby, jeśli leczenie LEF ma być kontynuowane. Terapia LEF powinna być zawsze przerwana, jeżeli aktywność AlAT wzrasta ponad trzykrotnie powyżej górnej granicy normy [1, 2]. Z uwagi na istotne przemiany metaboliczne, którym LEF podlega w hepatocytach, terapia tym lekiem nie jest zalecana u chorych z wywiadem zapalenia wątroby, hipoproteinemią, upośledzoną wydolnością wątroby oraz u alkoholików [2]. Łysienie Wypadanie włosów jest częstym objawem niepożądanym leczenia LEF (występuje u 10% chorych), zwykle przemijającym i odwracalnym [11]. Wypadanie włosów jest zazwyczaj łagodne lub średnio nasilone i prawdopodobnie zależy od stosowanej dawki leku. Przed rozpoczęciem terapii LEF chory powinien być poinformowany o możliwości wypadania włosów. W razie pojawienia się takiego objawu należy rozważyć zmniejszenie dawki LEF do 10 mg/dobę [11]. Zmiany skórne i śluzówkowe Alergiczne reakcje skórne (wysypka, plamica) były dość często opisywane w badaniach klinicznych (u <10% chorych), jednak ich nasilenie było zwykle łagodne bądź średnie, w 90% przypadków ustępowały one podczas kontynuowania terapii LEF [1, 11]. Bardzo rzadko pojawiały się doniesienia o występowaniu zespołu Stevensa- -Johnsona lub Lyella bądź martwicy toksycznej naskórka [1, 11]. Wysypka pojawia się najczęściej podczas pierwszych 1 3 mies. leczenia. Jeżeli nasilenie objawu jest łagodne, terapię LEF można kontynuować, w razie potrzeby z dołączeniem objawowych leków przeciwalergicznych. Mogą występować także inne rzadsze objawy niepożądane ze strony skóry lub błon śluzowych. Chorzy z izolowanym świądem wymagają leczenia antagonistami receptorów histaminowych H1 [11]. Chorzy z owrzodzeniami błony śluzowej jamy ustnej mogą kontynuować terapię LEF, jednak wymagają uważnej oceny, ponieważ w przypadku utrzymywania się uporczywych zmian lub ich nasilenia, leczenie LEF powinno być przerwane [11]. Nadciśnienie tętnicze Nadciśnienie tętnicze pojawiające się po rozpoczęciu terapii LEF jest opisywane z częstością ok. 1 2%, występuje zwykle w ciągu pierwszych 3 mies. leczenia. Chory powinien być poinformowany o możliwości wzrostu ciśnienia tętniczego. Zaleca się przeprowadzenie pomiarów ciśnienia przed zastosowaniem LEF i okresowo w trakcie leczenia, z większą częstością pomiarów u chorych z rozpoznanym wcześniej nadciśnieniem tętniczym. Nowo wykryte nadciśnienie wymaga wyboru skutecznego leczenia przeciwnadciśnieniowego, w razie potrzeby należy rozważyć zmniejszenie dawki lub przerwanie leczenia LEF [11]. Infekcje Częstość występowania infekcji podczas leczenia LEF w porównaniu z innymi LMPCh (nie włączając leków biologicznych) jest porównywalna [11]. Najczęściej opisywane są infekcje dróg oddechowych, zwykle o łagodnym nasileniu. W większości przypadków w trakcie infekcji utrzymywane jest leczenie LEF [11]. Z wyjątkiem 1 przypadku posocznicy zakończonej wyleczeniem, nie obserwowano zwiększenia częstości egzogennych infekcji oportunistycznych (np. Pneumocystis carinii) lub niekontrolowanych infekcji endogennych [11]. Objawy hematologiczne Nie opisywano znaczącej leukopenii lub trombocytopenii podczas terapii LEF, z wyjątkiem 20 przypadków łagodnej leukopenii w grupie 501 chorych leczonych przez 2 lata w badaniu klinicznym. Obserwowane przypadki neutropenii były odwracalne [2]. Nie opisywano eozynofilii, niedokrwistości bądź limfopenii. Zalecenia europejskie wymagają oznaczenia wszystkich parametrów morfologii krwi, z rozmazem krwinek białych, przed rozpoczęciem leczenia LEF, a następnie co 2 tyg. przez 6 mies., później co 8 tyg. [11]. Leczenie LEF powinno być przerwane w przypadku zmniejszenia się liczby granulocytów obojętnochłonnych <1000/µl. Inne powikłania Leflunomid może być stosowany u chorych z niewydolnością nerek, jednak z ostrożnością, ponieważ nerki pełnią istotną funkcję w wydalaniu metabolitu LEF. Badania farmakokinetyczne wykazały, że niewydolność nerek lub hemodializa nie wpływają na stężenia w surowicy metabolitu A [2]. Inaczej niż w przypadku MTX, nie wykazano niekorzystnego wpływu LEF na tkankę płucną [11]. Nie ma dowodów zwiększonego ryzyka rozwoju chorób limfoproliferacyjnych lub nowotworowych u chorych leczonych LEF, częstość tych schorzeń jest podobna do częstości u chorych leczonych MTX lub SS [2].
5 Profil bezpieczeństwa leflunomidu 371 Ciąża i laktacja Badania prowadzone na królikach i szczurach wykazały, że LEF jest embriotoksyczny i teratogenny [1], dlatego kobiety w wieku rozrodczym powinny stosować skuteczne metody zapobiegania ciąży podczas stosowania tego leku. Przed planowaną ciążą należy oznaczyć 2-krotnie w odstępie co najmniej 14 dni stężenie A w surowicy (norma <0,2 mg/l). Leflunomid nie może być stosowany w okresie laktacji, ponieważ nie wiadomo, czy jest wydzielany do mleka matki [2]. Nie zaleca się stosowania LEF także u mężczyzn, którzy planują posiadanie dzieci. U chorych w trakcie terapii LEF w razie objawów toksycznych, w przypadku stwierdzenia ciąży lub podjęcia decyzji o planowaniu ciąży, konieczne jest przeprowadzenie procedury wypłukania LEF. Procedura ta polega na przyjmowaniu preparatu cholestyraminy w dawce 8 g 3 razy dziennie przez 11 kolejnych dni lub zamiennie węgla aktywowanego w dawce 50 g 4 razy na dobę przez 11 dni [1, 2]. Interakcje z innymi lekami Leflunomid może nasilać działanie przeciwkrzepliwe antykoagulantów (acenokumarolu, warfaryny). A hamuje aktywność izoenzymu 2C9 cytochromu P450 i może zwiększać biodostępność leków metabolizowanych tą drogą (np. warfaryny, fenytoiny, tolbutamidu, ryfampicyny). Leflunomid nie wykazuje znaczących interakcji z niesteroidowymi lekami przeciwzapalnymi, cymetydyną czy doustnymi środkami antykoncepcyjnymi [2]. Podsumowanie W ciągu ostatnich lat LEF stał się istotnym elementem terapii zapaleń stawów. W badaniach klinicznych, a następnie w obserwacjach trwających ponad 5 lat wykazano, że LEF jest LMPCh, który hamuje postęp choroby i destrukcje stawów oraz poprawia wydolność czynnościową chorych. Profil bezpieczeństwa LEF jest porównywalny z profilem SS oraz MTX i poprawia się podczas długotrwałego stosowania leku [18]. Z uwagi na korzystny stosunek skuteczności i tolerancji leczenia, stosowanie LEF może być rozważane jako istotna opcja terapeutyczna w przebiegu RZS i ŁZS. Piśmiennictwo 1. Kaltwasser JP, Behrens F. Leflunomide: long-term clinical experience and new uses. Expert Opin Pharmacother 2005; 6: Li EK, Tam LS, Tomlinson B. Leflunomide in the treatment of rheumatoid arthritis. Clin Ther 2004; 26: Kalden JR, Schattenkirchner M, Sörensen H, et al. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis: a five-year followup study. Arthritis Rheum 2003; 48: Strand V, Cohen S, Schiff M, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Group. Arch Intern Med 1999; 159: Smolen JS, Kalden JR, Scott DL, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. European Leflunomide Study Group. Lancet 1999; 353: Sharp JT, Strand V, Leung H, et al. Treatment with leflunomide slows radiographic progression of rheumatoid arthritis. Arthritis Rheum 2000; 43: Emery P, Breedveld FC, Lemmel EM, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford) 2000; 39: Cohen S, Cannon GW, Schiff M, et al. Two-year, blinded, randomized, controlled trial of treatment of active rheumatoid arthritis with leflunomide compared with methotrexate. Utilization of Leflunomide in the Treatment of Rheumatoid Arthritis Trial Investigator Group. Arthritis Rheum 2001; 44: Targońska-Stępniak B, Chudzik D, Dryglewska M, Majdan M. Ocena wpływu leczenia leflunomidem na wskaźniki procesu zapalnego u chorych na reumatoidalne zapalenie stawów. Reumatologia 2007; 45: Kaltwasser JP, Nash P, Gladman D, et al. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial. Arthritis Rheum 2004; 50: van Riel PLCM, Smolen JS, Emery P, et al. Leflunomide: a manageable safety profile. J Rheumatol 2004; 31 Suppl 71: Cannon GW, Holden WL, Juhaeri J, et al. Adverse events with disease modifying antirheumatic drugs (DMARD): a cohort study of leflunomide compared with other DMARD. J Rheumatol 2004; 31: Osiri M, Shea B, Robinson V, et al. Leflunomide for the treatment of rheumatoid arthritis: a systematic review and metaanalysis. J Rheumatol 2003; 30: Aletaha D, Stamm T, Kapral T, et al. Survival and effectiveness of leflunomide compared with methotrexate and sulfasalazine in rheumatoid arthritis: a matched observational study. Ann Rheum Dis 2003; 62: Bettembourg-Brault I, Gossec L, Pham T, et al. Leflunomide in rheumatoid arthritis in daily practice: treatment discontinuation rates in comparison with other DMARDs. Clin Exp Rheumatol 2006; 24: Malesci D, Tirri R, Buono R, La Montagna G. Leflunomide in psoriatic arthritis: a retrospective study of discontinuation rate in daily clinical practice compared with methotrexate. Clin Exp Rheumatol 2007; 25: Ravindran V, Scott DL, Choy EH. A systematic review and meta-analysis of efficacy and toxicity of disease modifying antirheumatic drugs and biological agents for psoriatic arthritis. Ann Rheum Dis 2008; 67: Donahue KE, Gartlehner G, Jonas DE, et al. Systematic review: comparative effectiveness and harms of disease-modifying medications for rheumatoid arthritis. Ann Intern Med 2008; 148:
Metotreksat - mity i fakty. Co o stosowaniu tego leku mówią badania środa, 02 lipca :47
 Metotreksat - podstawowy lek stosowany zgodnie z zaleceniami EULAR w pierwszej linii leczenia reumatoidalnego zapalenia stawów (RZS) - nie posiada ulotki przygotowanej dla pacjentów reumatoidalnych. Część
Metotreksat - podstawowy lek stosowany zgodnie z zaleceniami EULAR w pierwszej linii leczenia reumatoidalnego zapalenia stawów (RZS) - nie posiada ulotki przygotowanej dla pacjentów reumatoidalnych. Część
Przedstawiona ulotka nie zastępuje informacji zawartej w Charakterystyce Produktu Leczniczego Leflunomide Sandoz.
 Aneks 8: Ulotka dla lekarza Informacja dotycząca bezpieczeństwa Leflunomide Sandoz 20 mg, tabletki powlekane leflunomid Leflunomide Sandoz, jako lek przeciwreumatyczny modyfikujący przebieg choroby (ang.
Aneks 8: Ulotka dla lekarza Informacja dotycząca bezpieczeństwa Leflunomide Sandoz 20 mg, tabletki powlekane leflunomid Leflunomide Sandoz, jako lek przeciwreumatyczny modyfikujący przebieg choroby (ang.
UNIWERSYTET MEDYCZNY W LUBLINIE KATEDRA I KLINIKA REUMATOLOGII I UKŁADOWYCH CHORÓB TKANKI ŁĄCZNEJ PRACA DOKTORSKA.
 UNIWERSYTET MEDYCZNY W LUBLINIE KATEDRA I KLINIKA REUMATOLOGII I UKŁADOWYCH CHORÓB TKANKI ŁĄCZNEJ PRACA DOKTORSKA Małgorzata Biskup Czynniki ryzyka sercowo-naczyniowego u chorych na reumatoidalne zapalenie
UNIWERSYTET MEDYCZNY W LUBLINIE KATEDRA I KLINIKA REUMATOLOGII I UKŁADOWYCH CHORÓB TKANKI ŁĄCZNEJ PRACA DOKTORSKA Małgorzata Biskup Czynniki ryzyka sercowo-naczyniowego u chorych na reumatoidalne zapalenie
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Zalecenia postępowania diagnostyczno-terapeutycznego Reumatologia 2016; supl. 1: DOI: /reum
 Zalecenia postępowania diagnostyczno-terapeutycznego Reumatologia 2016; supl. 1: 134 135 DOI: 10.5114/reum.2016.60016 Postępowanie okołooperacyjne w aloplastyce stawu biodrowego i kolanowego u chorych
Zalecenia postępowania diagnostyczno-terapeutycznego Reumatologia 2016; supl. 1: 134 135 DOI: 10.5114/reum.2016.60016 Postępowanie okołooperacyjne w aloplastyce stawu biodrowego i kolanowego u chorych
Leczenie łuszczycowego zapalenia stawów biologicznymi lekami modyfikującymi
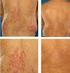 PRACA POGLĄDOWA Forum Reumatol. 2015, tom 1, nr 1, 25 29 Copyright 2015 Via Medica ISSN 2450 3088 Marcin Milchert, Marek Brzosko www.fr.viamedica.pl Klinika Reumatologii i Chorób Wewnętrznych, Pomorski
PRACA POGLĄDOWA Forum Reumatol. 2015, tom 1, nr 1, 25 29 Copyright 2015 Via Medica ISSN 2450 3088 Marcin Milchert, Marek Brzosko www.fr.viamedica.pl Klinika Reumatologii i Chorób Wewnętrznych, Pomorski
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Informacje szczegółowe dotyczące bezpieczeństwa stosowania dla wypisujących lek
 Informacje szczegółowe dotyczące bezpieczeństwa stosowania dla wypisujących lek Leflunomide Bluefish jest lekiem o działaniu immunomodulującym i przeciwzapalnym, stosowanym w leczeniu aktywnego reumatoidalnego
Informacje szczegółowe dotyczące bezpieczeństwa stosowania dla wypisujących lek Leflunomide Bluefish jest lekiem o działaniu immunomodulującym i przeciwzapalnym, stosowanym w leczeniu aktywnego reumatoidalnego
Symago (agomelatyna)
 Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Najważniejsze informacje dotyczące bezpiecznego i skutecznego stosowania produktu leczniczego Arava
 Najważniejsze informacje dotyczące bezpiecznego i skutecznego stosowania produktu leczniczego Arava Produkt leczniczy Arava (leflunomid) wskazany jest w leczeniu u dorosłych pacjentów z: aktywną postacią
Najważniejsze informacje dotyczące bezpiecznego i skutecznego stosowania produktu leczniczego Arava Produkt leczniczy Arava (leflunomid) wskazany jest w leczeniu u dorosłych pacjentów z: aktywną postacią
LECZENIE BIOLOGICZNE CHORÓB
 LECZENIE BIOLOGICZNE CHORÓB REUMATYCZNYCH U PACJENTÓW 65+ Włodzimierz Samborski Katedra Reumatologii i Rehabilitacji Uniwersytet Medyczny im. K. Marcinkowskiego w Poznaniu LECZENIE BIOLOGICZNE CHORÓB REUMATYCZNYCH
LECZENIE BIOLOGICZNE CHORÓB REUMATYCZNYCH U PACJENTÓW 65+ Włodzimierz Samborski Katedra Reumatologii i Rehabilitacji Uniwersytet Medyczny im. K. Marcinkowskiego w Poznaniu LECZENIE BIOLOGICZNE CHORÓB REUMATYCZNYCH
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Leflunomid w terapii chorych na reumatoidalne zapalenie stawów
 Artykuł oryginalny/original paper Reumatologia 2007; 45, 1: 6 10 Leflunomid w terapii chorych na reumatoidalne zapalenie stawów Leflunomide in treatment of rheumatoid arthritis patients Maria Rell-Bakalarska
Artykuł oryginalny/original paper Reumatologia 2007; 45, 1: 6 10 Leflunomid w terapii chorych na reumatoidalne zapalenie stawów Leflunomide in treatment of rheumatoid arthritis patients Maria Rell-Bakalarska
Leflunomide for the treatment of rheumatoid arthritis after methotrexate failure. Efficacy and prognostic factors for response
 Artykuł oryginalny/original paper Reumatologia 28; 46, 2: 55 6 Leflunomid w leczeniu chorych na reumatoidalne zapalenie stawów po niepowodzeniu terapii metotreksatem. Skuteczność i czynniki prognostyczne
Artykuł oryginalny/original paper Reumatologia 28; 46, 2: 55 6 Leflunomid w leczeniu chorych na reumatoidalne zapalenie stawów po niepowodzeniu terapii metotreksatem. Skuteczność i czynniki prognostyczne
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Załącznik B.45. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10: M 05, M 06) ZAKRES ŚWIADCZENIA GWARANTOWANEGO
 Załącznik B.45. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10: M 05, M 06) ZAKRES ŚWIADCZENIA GWARANTOWANEGO A. Kryteria kwalifikacji ŚWIADCZENIOBIORCY 1. Pacjent jest kwalifikowany
Załącznik B.45. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10: M 05, M 06) ZAKRES ŚWIADCZENIA GWARANTOWANEGO A. Kryteria kwalifikacji ŚWIADCZENIOBIORCY 1. Pacjent jest kwalifikowany
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
Długoterminowa skuteczność golimumabu u pacjentów z zapalnymi spondyloartropatiami wtorek, 03 lutego :06
 Skuteczność leczenia zapalnych chorób reumatycznych poprawiła się istotnie w ostatnich latach. Złożyło się na to wiele czynników, do których można zaliczyć wczesną diagnostykę i szybkie rozpoczynanie odpowiedniej
Skuteczność leczenia zapalnych chorób reumatycznych poprawiła się istotnie w ostatnich latach. Złożyło się na to wiele czynników, do których można zaliczyć wczesną diagnostykę i szybkie rozpoczynanie odpowiedniej
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
Konsensus dotyczący stosowania rituksymabu w leczeniu chorych na reumatoidalne zapalenie stawów
 Standardy leczenia/standards of treatment Reumatologia 2007; 45, 3: 115 119 Konsensus dotyczący stosowania rituksymabu w leczeniu chorych na reumatoidalne zapalenie stawów The consensus on rituximab administration
Standardy leczenia/standards of treatment Reumatologia 2007; 45, 3: 115 119 Konsensus dotyczący stosowania rituksymabu w leczeniu chorych na reumatoidalne zapalenie stawów The consensus on rituximab administration
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10: M 05, M 06)
 Dziennik Urzędowy Ministra Zdrowia 614 Poz. 56 Załącznik B.45. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10: M 05, M 06) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 614 Poz. 56 Załącznik B.45. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10: M 05, M 06) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Leflunomide Sandoz, 20 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 20 mg leflunomidu (Leflunomidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Leflunomide Sandoz, 20 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 20 mg leflunomidu (Leflunomidum).
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Karbis, 4 mg, tabletki Karbis, 8 mg, tabletki Karbis, 16 mg, tabletki Karbis, 32 mg, tabletki Candesartanum cilexetilum Należy zapoznać się z treścią ulotki
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Karbis, 4 mg, tabletki Karbis, 8 mg, tabletki Karbis, 16 mg, tabletki Karbis, 32 mg, tabletki Candesartanum cilexetilum Należy zapoznać się z treścią ulotki
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Metotreksat fakty i mity. Prof. dr hab. med. Witold Tłustochowicz Klinika Chorób Wewnętrznych i Reumatologii CSK MON WIM Warszawa Kielce 29.01.2015.
 Metotreksat fakty i mity Prof. dr hab. med. Witold Tłustochowicz Klinika Chorób Wewnętrznych i Reumatologii CSK MON WIM Warszawa Kielce 29.01.2015. Międzynarodowe rekomendacje leczenia MTX Jak działa metotreksat?
Metotreksat fakty i mity Prof. dr hab. med. Witold Tłustochowicz Klinika Chorób Wewnętrznych i Reumatologii CSK MON WIM Warszawa Kielce 29.01.2015. Międzynarodowe rekomendacje leczenia MTX Jak działa metotreksat?
Lek BI w porównaniu z lekiem Humira u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą
 Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Porównanie zmian w programie lekowym B.33 w części dotyczącej MIZS przed i po 1 maja 2016
 Porównanie zmian w programie lekowym B.33 w części dotyczącej MIZS przed i po 1 maja 2016 OBOWIĄZUJE od 1 maja 2016 zmiany oznaczono kolorem 1. Kryteria kwalifikacji: 1. Kryteria kwalifikacji: Przed 1
Porównanie zmian w programie lekowym B.33 w części dotyczącej MIZS przed i po 1 maja 2016 OBOWIĄZUJE od 1 maja 2016 zmiany oznaczono kolorem 1. Kryteria kwalifikacji: 1. Kryteria kwalifikacji: Przed 1
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Tabletki powlekane barwy białej lub białawej, okrągłe, o średnicy około 1 cm, na jednej stronie napis ZBP.
 1. NAZWA PRODUKTU LECZNICZEGO Arava 100 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 100 mg leflunomidu i 138.42 laktozy. Pełny wykaz substancji pomocniczych,
1. NAZWA PRODUKTU LECZNICZEGO Arava 100 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka powlekana zawiera 100 mg leflunomidu i 138.42 laktozy. Pełny wykaz substancji pomocniczych,
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE
 ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit
 Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit Co to są nieswoiste zapalenia jelit? Grupa chorób w których dochodzi
Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit Co to są nieswoiste zapalenia jelit? Grupa chorób w których dochodzi
URSOCAM, 250 mg, tabletki (Acidum ursodeoxycholicum)
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
Ocena ogólna: Raport całkowity z okresu od 04.05.2007 do 15.11.2007
 W Niepublicznym Zakładzie Opieki Zdrowotnej ABC medic Praktyka Grupowa Lekarzy Rodzinnych w Zielonej Górze w okresie od 04.05.2007-15.11.2007 została przeprowadzona ocena efektów klinicznych u pacjentów
W Niepublicznym Zakładzie Opieki Zdrowotnej ABC medic Praktyka Grupowa Lekarzy Rodzinnych w Zielonej Górze w okresie od 04.05.2007-15.11.2007 została przeprowadzona ocena efektów klinicznych u pacjentów
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla użytkownika. TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N
 Załącznik nr 42 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N 25.8 Inne zaburzenia
Załącznik nr 42 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N 25.8 Inne zaburzenia
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO RoActemra 20 mg/ml koncentrat do sporządzania roztworu do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml koncentratu zawiera
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO RoActemra 20 mg/ml koncentrat do sporządzania roztworu do infuzji. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml koncentratu zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 czopek zawiera jako substancję czynną 250 mg mesalazyny, tj. kwasu 5- aminosalicylowego (Mesalazinum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SALOFALK 250, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera jako substancję czynną 250 mg mesalazyny, tj. kwasu 5- aminosalicylowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO SALOFALK 250, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera jako substancję czynną 250 mg mesalazyny, tj. kwasu 5- aminosalicylowego
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
 Załącznik B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji ŚWIADCZENIOBIORCY
Załącznik B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji ŚWIADCZENIOBIORCY
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Ból uważany jest za jeden z potencjalnie istotnych czynników ryzyka dotyczących śmiertelności (Sokka).
 VI. 2 Elementy do podsumowania podawanego do publicznej wiadomości. VI. 2.1 Przegląd epidemiologii choroby Odczuwanie bólu jest powszechnym zjawiskiem wśród dzieci. Szacuje się, że ta dolegliwość może
VI. 2 Elementy do podsumowania podawanego do publicznej wiadomości. VI. 2.1 Przegląd epidemiologii choroby Odczuwanie bólu jest powszechnym zjawiskiem wśród dzieci. Szacuje się, że ta dolegliwość może
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Analiza skuteczności i bezpieczeństwa terapii leflunomidem w zależności od wieku pacjentów i czasu trwania reumatoidalnego zapalenia stawów
 Artykuł oryginalny/original paper Reumatologia 2007; 45, 1: 11 17 Analiza skuteczności i bezpieczeństwa terapii leflunomidem w zależności od wieku pacjentów i czasu trwania reumatoidalnego zapalenia stawów
Artykuł oryginalny/original paper Reumatologia 2007; 45, 1: 11 17 Analiza skuteczności i bezpieczeństwa terapii leflunomidem w zależności od wieku pacjentów i czasu trwania reumatoidalnego zapalenia stawów
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL, 5 mg, tabletki. Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL, 5 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL, 5 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Simponi jest lekiem o działaniu przeciwzapalnym. Preparat stosuje się w leczeniu następujących chorób u osób dorosłych:
 EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
Tabletki powlekane barwy żółtawej lub ochry, trójkątne, na jednej stronie napis ZBO.
 1. NAZWA PRODUKTU LECZNICZEGO Arava 20 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 20 mg leflunomidu Substancje pomocnicze o znanym działaniu: Każda tabletka zawiera 72
1. NAZWA PRODUKTU LECZNICZEGO Arava 20 mg tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 20 mg leflunomidu Substancje pomocnicze o znanym działaniu: Każda tabletka zawiera 72
Materiały edukacyjne. Diagnostyka i leczenie nadciśnienia tętniczego
 Materiały edukacyjne Diagnostyka i leczenie nadciśnienia tętniczego Klasyfikacja ciśnienia tętniczego (mmhg) (wg. ESH/ESC )
Materiały edukacyjne Diagnostyka i leczenie nadciśnienia tętniczego Klasyfikacja ciśnienia tętniczego (mmhg) (wg. ESH/ESC )
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
Ulotka dołączona do opakowania: informacja dla użytkownika. SALOFALK 250, 250 mg, czopki Mesalazinum
 Ulotka dołączona do opakowania: informacja dla użytkownika SALOFALK 250, 250 mg, czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika SALOFALK 250, 250 mg, czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
"Ścieżka leczenia chorych na RZS w Polsce"
 "Ścieżka leczenia chorych na RZS w Polsce" Jakie bolączki często dotykają chorych na RZS w Polsce? Długi proces diagnozy i oczekiwania na wizytę u specjalisty reumatologa Małe możliwości diagnostyczne
"Ścieżka leczenia chorych na RZS w Polsce" Jakie bolączki często dotykają chorych na RZS w Polsce? Długi proces diagnozy i oczekiwania na wizytę u specjalisty reumatologa Małe możliwości diagnostyczne
LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
 Dziennik Urzędowy Ministra Zdrowia 570 Poz. 56 Załącznika B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
Dziennik Urzędowy Ministra Zdrowia 570 Poz. 56 Załącznika B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL FORTE; 10 mg, tabletki Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
(ICD-10 M 05, M 06, M 08)
 B.33. (ICD10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji IADCZENIOBIORCY 1. Dawkowanie W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Badania przy kwalifikacji (leczenie
B.33. (ICD10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji IADCZENIOBIORCY 1. Dawkowanie W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Badania przy kwalifikacji (leczenie
Desogestrel SUBSTANCJE CZYNNE. Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC)
 SUBSTANCJE CZYNNE Desogestrel GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. Kod ATC: G03AC09 PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU
SUBSTANCJE CZYNNE Desogestrel GRUPA FARMAKOTERAPEUTYCZNA (KOD ATC) Grupa farmakoterapeutyczna: progestageny i estrogeny, produkty złożone. Kod ATC: G03AC09 PODMIOT ODPOWIEDZIALNY NAZWA HANDLOWA PRODUKTU
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0)
 Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
Rejestry w reumatologii Prof. dr hab. Piotr Wiland Katedra i Klinika Reumatologii i Chorób Wewnętrznych, Uniwersytet Medyczny im. Piastów Śląskich we
 Rejestry w reumatologii Prof. dr hab. Piotr Wiland Katedra i Klinika Reumatologii i Chorób Wewnętrznych, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu Warszawa 8.10. 2014 1 Rejestry chorych leczonych
Rejestry w reumatologii Prof. dr hab. Piotr Wiland Katedra i Klinika Reumatologii i Chorób Wewnętrznych, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu Warszawa 8.10. 2014 1 Rejestry chorych leczonych
Czynniki wpływające na długość remisji po zakończeniu leczenia tocylizumabem u chorych na reumatoidalne zapalenie stawów
 Forum Reumatol. 2018, tom 4, nr 3, 158 162 Copyright 2018 Via Medica ISSN 2450 3088 DOI: 10.5603/FR.2018.0003 PRACA POGLĄDOWA www.fr.viamedica.pl Katarzyna Nowacka, Anna Wawryn-Ozdowy, Wojciech Romanowski
Forum Reumatol. 2018, tom 4, nr 3, 158 162 Copyright 2018 Via Medica ISSN 2450 3088 DOI: 10.5603/FR.2018.0003 PRACA POGLĄDOWA www.fr.viamedica.pl Katarzyna Nowacka, Anna Wawryn-Ozdowy, Wojciech Romanowski
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Działania niepożądane radioterapii
 Działania niepożądane radioterapii Powikłania po radioterapii dzielimy na wczesne i późne. Powikłania wczesne ostre występują w trakcie leczenia i do 3 miesięcy po jego zakończeniu. Ostry odczyn popromienny
Działania niepożądane radioterapii Powikłania po radioterapii dzielimy na wczesne i późne. Powikłania wczesne ostre występują w trakcie leczenia i do 3 miesięcy po jego zakończeniu. Ostry odczyn popromienny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
Leczenie Farmakologiczne
 www.printo.it/pediatric-rheumatology/pl/intro Leczenie Farmakologiczne Wersja 2016 13. Leki biologiczne W ciągu ostatnich lat pojawiły się nowe perspektywy leczenia dzięki nowym lekom określanym jako leki
www.printo.it/pediatric-rheumatology/pl/intro Leczenie Farmakologiczne Wersja 2016 13. Leki biologiczne W ciągu ostatnich lat pojawiły się nowe perspektywy leczenia dzięki nowym lekom określanym jako leki
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
Przełom I co dalej. Anna Kostera-Pruszczyk Katedra i Klinika Neurologii Warszawski Uniwersytet Medyczny
 Przełom I co dalej Anna Kostera-Pruszczyk Katedra i Klinika Neurologii Warszawski Uniwersytet Medyczny Przełom miasteniczny Stan zagrożenia życia definiowany jako gwałtowne pogorszenie opuszkowe/oddechowe
Przełom I co dalej Anna Kostera-Pruszczyk Katedra i Klinika Neurologii Warszawski Uniwersytet Medyczny Przełom miasteniczny Stan zagrożenia życia definiowany jako gwałtowne pogorszenie opuszkowe/oddechowe
Ocena wpływu leczenia leflunomidem na wskaźniki procesu zapalnego u chorych na reumatoidalne zapalenie stawów
 Artykuł oryginalny/original paper Reumatologia 2007; 45, 1: 1 5 Ocena wpływu leczenia leflunomidem na wskaźniki procesu zapalnego u chorych na reumatoidalne zapalenie stawów Effects of leflunomide treatment
Artykuł oryginalny/original paper Reumatologia 2007; 45, 1: 1 5 Ocena wpływu leczenia leflunomidem na wskaźniki procesu zapalnego u chorych na reumatoidalne zapalenie stawów Effects of leflunomide treatment
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Ulotka dołączona do opakowania: informacja dla pacjenta. Asamax mg czopki Asamax mg czopki Mesalazinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Asamax 250 250 mg czopki Asamax 500 500 mg czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Asamax 250 250 mg czopki Asamax 500 500 mg czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, czopki Mesalazinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, czopki Mesalazinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
 Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Analiza leczenia ambulatoryjnego metotreksatem chorych na reumatoidalne zapalenie stawów
 Artykuł oryginalny/original paper Reumatologia 9;, : Analiza leczenia ambulatoryjnego metotreksatem chorych na reumatoidalne zapalenie stawów Analysis of outpatient administration of methotrexate for rheumatoid
Artykuł oryginalny/original paper Reumatologia 9;, : Analiza leczenia ambulatoryjnego metotreksatem chorych na reumatoidalne zapalenie stawów Analysis of outpatient administration of methotrexate for rheumatoid
