This copy is for personal use only - distribution prohibited.
|
|
|
- Laura Jaworska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Wstęp Kliniczne aplikacje technik cytogenetyki molekularnej w procesie diagnostyki prenatalnej wybranych przypadków aberracji chromosomowych Maria Constantinou, Bogdan Kałużewski Zakład Genetyki Medycznej Uniwersytetu Medycznego w Łodzi Streszczenie: Analiza cytogenetyczna zajmuje szczególne miejsce w diagnostyce prenatalnej, głównie ze względu na to, że jest często jedynym dostępnym badaniem, które może być przeprowadzone w relatywnie krótkim czasie i którego wynik może stanowić podstawę do wydania epikryzy rokowniczej. W latach 70 wprowadzono do diagnostyki cytogenetycznej szereg technik prążkowych, które umożliwiły identyfikowanie par chromosomów homologicznych w oparciu o podobny i unikalny wzór prążkowy. Dzięki temu stało się możliwe klasyfikowanie chromosomów w oparciu o zasady nomenklatury międzynarodowej oraz diagnozowanie aberracji subchromosomowych. Cytogenetyka molekularna (technika FISH) zasadniczo zwiększyła możliwości diagnostyczne chorób uwarunkowanych genetycznie i wprowadziła je na nowy poziom. Nowe narzędzia diagnostyczne cytogenetyki molekularnej pozwalają obecnie na detekcję rzadkich rearanżacji subchromosomowych, takich jak mikrodelecje czy duplikacje chromosomów w przypadkach zespołów wad rozwojowych i/lub opóźnienia rozwoju umysłowego. Znaczenie techniki FISH (ang. Fluorescence In Situ Hybridization) w procesie diagnostyki prenatalnej jest dobrze udokumentowane, natomiast wykorzystanie technik CGH (ang.: Comparative Genomic Hybridization) czy mcgh (ang.: microarray-cgh) w badaniach prenatalnych pozostaje nadal sprawą dyskusyjną. Dlatego szczególnie ważne jest określenie miejsca cytogenetyki molekularnej w procesie diagnostyki prenatalnej, tak by wyniki tych badań były wiarygodne i mogły być przez klinicystę jednoznacznie zinterpretowane. W prezentowanej pracy podjęto próbę umiejscowienia w/w technik w realiach klinicznych na przykładzie aplikacji technik FISH, M-FISH i CGH w wybranych przypadkach, które dostarczyły szeregu problemów diagnostycznych w trakcie realizowania diagnostyki prenatalnej w Zakładzie Genetyki Medycznej UM w Łodzi. Słowa kluczowe: diagnostyka prenatalna cytogenetyka molekularna FISH CGH M-FISH Adres do korespondencji: Dr n. med. Maria Constantinou, Zakład Genetyki Medycznej, Uniwersytetu Medycznego Łodzi, ul. S. Sterlinga 1/3, Łódź, majcon@kardio-sterling.lodz.pl Badania nad ludzkimi chromosomami są prowadzone od ponad 100 lat. Jednakże postęp w analizowaniu chromosomów był przez długi czas hamowany przez trudności związane z uzyskaniem odpowiedniej jakości chromosomów metafazowych. Tak było do 1956 roku, w którym Tjio i Levan podali poprawną liczbę chromosomów genomu człowieka [1]. W 1960 roku okazało się, że dodanie PHA do hodowli limfocytów krwi obwodowej umożliwia niemal jednoczesne wejście limfocytów PHA-reaktywnych w cykl życiowy komórki, zwiększając liczbę płytek metafazowych, które mogą być analizowane [1,2]. Na początku lat 70-tych wprowadzono techniki barwień prążkowych chromosomów, które pozwo- liły na uzyskanie homologicznego wzoru prążkowego w parach poszczególnych chromosomów, tym samym umożliwiły ocenę nie tylko liczbowych, ale też strukturalnych aberracji chromosomowych [2]. Opisywane osiągnięcia pozwoliły na wykorzystanie analizy cytogenetycznej w badaniach nad etiopatogenezą chorób uwarunkowanych przez aberracje chromosomowe. Dopiero jednak rozwój cytogenetyki molekularnej zasadniczo zwiększył możliwości diagnostyczne tych chorób i wprowadził je na nowy poziom. Dostęp do szerokiego panelu sond molekularnych nowej generacji, w tym sond unikalnych i telomerowych doprowadził do tego, że w chwili obecnej technika FISH (ang. Fluorescence In Situ Hybridization) w znamienny sposób wspomaga i usprawnia diagnostykę chorób genetycznie uwarunkowanych, o nie- 1
2 jasnej etiopatogenezie, zwłaszcza wtedy, gdy istnieje konieczność oceny subtelnych zmian w obrębie struktury chromosomów [3]. Nowe narzędzia diagnostyczne ilościowej cytogenetyki molekularnej CGH (ang. Comparative Genomic Hybridization) czy mcgh (ang. microarry-cgh) pozwalają na detekcję rzadkich rearanżacji subchromosomowych, takich jak mikrodelecje czy duplikacje chromosomów w przypadkach zespołów wad rozwojowych i/lub opóźnienia rozwoju umysłowego. Tym samym pozwalają także na określenie ich roli etiopatogenetycznej [4 6]. Znaczenie techniki FISH w procesie diagnostyki prenatalnej jest dobrze udokumentowane [6,7], natomiast wykorzystanie technik CGH czy mcgh w badaniach prenatalnych pozostaje nadal sprawą dyskusyjną [8 10]. Diagnostyka prenatalna to możliwość rozpoznania choroby w okresie ciąży na tyle wcześnie, by zapewnić urodzenie dziecka w optymalnych warunkach z odpowiednią opieką medyczną. Należy też jednak pamiętać, że niektóre choroby uwarunkowane genetycznie są nieuleczalne i w takich przypadkach, zgodnie z prawem rodzice mogą podjąć decyzję o przerwaniu ciąży. Z tych powodów diagnostyka prenatalna ma na celu postawienie jednoznacznego rozpoznania, jak najwcześniej i w jak najkrótszym czasie, tak by sami rodzice mogli podjąć decyzję o dalszych losach ciąży. Słaby dostęp do informacji i porady z zakresu poradnictwa genetycznego oraz do przesiewowych badań prenatalnych biochemicznych i ultrasonograficznych wykonywanych w I trymestrze ciąży w grupach ryzyka urodzenia dziecka z chorobą genetyczną płodu powodują, że cytogenetyczne badania prenatalne są wykonywane w Polsce u mniej niż 5% ciężarnych ze wskazaniami do inwazyjnej diagnostyki prenatalnej lub są wykonywane w ciążach powyżej 20 hbd [11]. Analiza cytogenetyczna jest podstawą prenatalnej i postnatalnej diagnostyki chorób i zespołów wad rozwojowych uwarunkowanych przez aberracje chromosomowe. Wynik badania cytogenetycznego stanowi podstawę lub potwierdzenie rozpoznania klinicznego choroby. Umożliwia także określenie ryzyka powtórzenia się choroby w kolejnej ciąży oraz identyfikację rodzin z grupy ryzyka genetycznego. Z tych powodów cytogenetyka prenatalna ma zasadnicze znaczenie dla poradnictwa genetycznego i związanej z nim profilaktyki chorób uwarunkowanych przez aberracje chromosomowe [12]. Cytogenetyczna ocena kariotypu płodu jest nierzadko jedynym dostępnym badaniem, które może być przeprowadzone w relatywnie krótkim czasie i którego wynik może stanowić podstawę do wydania epikryzy rokowniczej. Szczególnie istotne w diagnostyce prenatalnej są czas oczekiwania na wynik badania oraz unikalny charakter materiału diagnostycznego, które to czynniki znacznie ograniczają możliwość weryfikowania i uzupełniania badań cytogenetycznych przez stosowanie innych technik z zakresu cytogenetyki molekularnej i/lub biologii molekularnej, niezależnie od posiadanego zaplecza metodycznego. Dlatego ważne jest określenie miejsca cytogenetyki molekularnej w procesie diagnostyki prenatalnej tak, by stała się źródłem wiarygodnych informacji diagnostycznych, które mogą być jednoznacznie zinterpretowane. Zapewnić to może stosowanie w procesie diagnostycznym określonych schematów i zasad, obejmujących między innymi: (1) wybór techniki badawczej, co łączy się z zabezpieczeniem odpowiedniego materiału diagnostycznego, (2) wybór sondy/sond molekularnych w przypadku 2 Rycina 1. Schemat przedstawia proces fluorescencyjnej hybrydyzacji in situ. stosowania techniki FISH, (3) określenie kryteriów oceny preparatów oraz sposobu prezentacji wyników i ich interpretacji (epikryza diagnostyczna) tak by nie utrudniały klinicyście wydania jednoznacznej epikryzy rokowniczej. Wyżej wymienione zagadnienia powodują, że istnieje uzasadniona konieczność ustalenia algorytmu postępowania diagnostycznego w przypadku stosowania technik cytogenetyki molekularnej oraz zapewnienia wysokiej skuteczności i wiarygodności stosowania tych badań. W prezentowanej pracy podjęto próbę określenia miejsca cytogenetyki molekularnej w procesie diagnostyki prenatalnej na przykładzie aplikacji technik FISH, M-FISH i CGH w wybranych przypadkach, które dostarczyły szeregu problemów diagnostycznych w trakcie realizowania diagnostyki prenatalnej. W pierwszej części prezentacji przedstawiono procedury metod FISH, M-FISH i CGH stosowane w naszym laboratorium, natomiast w drugiej części opisano aplikacje w/w technik dla potrzeb diagnostyki prenatalnej. Opis metod cytogenetyki molekularnej Fluorescencyjna hybrydyzacja in situ (FISH) Dzięki technikom klasycznej cytogenetyki możliwe jest uzyskanie rozdzielczości na poziomie pojedynczego prążka, w obrębie którego występuje od 5 do 10 Mbp [3,4]. Aplikacja techniki FISH do analizy chromosomów metafazowych umożliwia zwiększenie rozdzielczości do 3 Mbp i detekcję genów lub sekwencji unikalnych zlokalizowanych w obrębie w/w prążków chromosomowych [13]. Tym samym technika ta stała się niezastąpionym narzędziem diagnostycznym w przypadkach chromosomów markerowych, subtelnych translokacji, translokacji obejmujących więcej niż dwa chromosomy, duplikacji czy mikrodelecji. Metoda FISH polega na hybrydyzowaniu odpowiednio skonstruowanej sondy molekularnej z komplementarnym do niej regionem chromosomowym, a następnie wizualizacji tego połączenia (dupleksu) w mikroskopie fluorescencyjnym (Rycina 1). Ocena mikroskopowa w/w zjawiska jest możliwa dzięki temu, że sonda molekularna zawiera przyłączone cząsteczki znacznika fluorochromu, który przy odpowiednich warunkach mikroskopowania emituje fluorescencję w odpowiednim zakresie długości fali i tym samym pozwala na wizualizację badanego regionu chromosomowego w jądrach interfazowych (cytogenetyka interfazowa) lub chromosomach metafazowych.
3 Przygotowanie preparatów Proces przygotowania preparatów z amniocytów niehodowanych i poddawanych hodowli komórkowej in vitro opisano już szczegółowo [14]. Stosowane sondy molekularne Wyróżniamy następujące rodzaje sond molekularnych: sondy malujące, sondy centromerowe oraz sondy unikalne. Sondy malujące zawierają heterogenną mieszaninę sekwencji unikalnych specyficznych dla ramion krótkich i/lub długich poszczególnych chromosomów człowieka. Po hybrydyzacji obserwuje się, zatem efekt w postaci pomalowania komplementarnych do sondy regionów badanych chromosomów. Tym samym sondy malujące są szczególnie przydatne w przypadkach chromosomów markerowych czy translokacji, zwłaszcza tych obejmujących więcej niż dwa chromosomy. Sondy centromerowe zawierają sekwencje powtarzalne (alfa-satelitarnego DNA) komplementarne do cetromerów poszczególnych chromosomów człowieka, tym samym są najczęściej wykorzystywane do detekcji aneuploidii chromosomowych (cytogenetyka interfazowa) lub określania pochodzenia chromosomów markerowych. Sondy unikalne zawierają sekwencje komplementarne do genów lub loci genowych, dzięki czemu są zwykle pomocne w rozpoznawaniu mikrodelcji chromosomowych oraz określaniu punktów złamań chromosomowych w przypadkach strukturalnych rearanżacji chromosomowych. Proces hybrydyzacji in situ Oddzielny proces denaturacji preparatów i sond molekularnych. Preparaty należy zdenaturować w 70% formamidzie o temperaturze C przez 2 5 minut. Przy czym temperatura i czas denaturacji zależy od rodzaju preparatu. Proces denaturacji blokuje się przez zanurzenie preparatów cytogenetycznych w oziębionym do -20 C, wzrastającym szeregu alkoholowym (po 3 minuty kolejno w każdym stężeniu). Preparaty cytogenetyczne powinny być suszone w temperaturze otoczenia a następnie oceniane przy użyciu mikroskopii kontrastowo-fazowej. Sondy malujące, centromerowe i unikalne należy zawiesić w mieszaninie hybrydyzacyjnej, a następnie zdenaturować w temperaturze C (±2 C) przez 1 5 minut, zależnie od rodzaju stosowanej sondy molekularnej. Zdenaturowaną sondę malującą poddaje się procesowi prehybrydyzacji w temperaturze 37 C przez 1 godzinę. Proces denaturacji sond centromerowych i unikalnych blokuje się przez gwałtowne schłodzenie w łaźni lodowej. 10 µl sondy molekularnej nanosi się bezpośrednio na każdy preparat cytogenetyczny. Proces hybrydyzacji powinien przebiegać w temperaturze 37 C przez godzin, pod szkiełkiem nakrywkowym po uszczelnieniu brzegów szkiełka klejem. Proces kodenaturacji preparatów i sond molekularnych. Sondy malujące, centromerowe i unikalne należy zawiesić w stosunku 1:10 w mieszaninie hybrydyzacyjnej. 10 µl sondy nanosi się bezpośrednio na każdy preparat cytogenetyczny a następnie przykrywa się szkiełkiem nakrywkowym. Tak przygotowane preparaty powinno się przenieść na hybrydyzator (płytę grzejną z możliwością programowania temperatur i czasów prowadzonych procesów). Zależnie od rodzaju sond molekularnych stosuje się następujące schematy kodenaturacji/hybrydyzacji: sondy malujące 68 C, 5 / 39 C,16 20 h, sondy centromerowe 73 C, 5 / 37 C, 4 16 h, sondy unikalne 75 C, 1 / 37 C, h, Usunięcie nadmiaru sondy i detekcja Nadmiar niezhybrydyzowanej sondy i niespecyficznie związaną sondę molekularną można usunąć poprzez dwuetapowe płukanie preparatów, kolejno: 3 minuty w 0,3% roztworze buforu NP-40 (VYSIS) o temperaturze 73 C (±2 C) oraz 1 minutę w 0,1% roztworze buforu NP-40 o temperaturze pokojowej. Przed wizualizacją obrazu w mikroskopie fluorescencyjnym przeprowadza się barwienie kontrastowe, zwykle przy użyciu DAPI, umożliwiające identyfikowanie chromosomów i jąder interfazowych. Do momentu oceny preparaty powinno się przechowywać w temperaturze 4 C. Mikroskopia i rejestracja obrazu Preparaty należy oceniać przy użyciu mikroskopu fluorescencyjnego, wyposażonego w jednopasmowe lub dwupasmowe filtry optyczne, odpowiednie do używanych fluorochromów. W naszym laboratorium wykorzystuje się mikroskop fluorescencyjny Olympus BX-61 wyposażony w dwupasmowe filtry optyczne - FITC/Rodamina i FITC/DAPI, trójpasmowy filtr optyczny: FITC/Rodamina/DAPI oraz w jednopasmowe filtry optyczne AQUA, RED, GREEN, YELLOW, BLUE (VYSIS). Informacyjne płytki metafazowe i/lub jądra interfazowe rejestrujemy przy pomocy monochromatycznej, chłodzonej kamery CCD firmy Photometrics (Photometrics Quantix, KAF 1400) oraz systemu komputerowej analizy obrazu ISIS (MetaSystems). Zasady oceny hybrydyzacji Wydajność hybrydyzacji wyraża się jako stosunek liczby płytek metafazowych i jąder interfazowych, w których wykryto specyficzne sygnały fluorescencyjne do całkowitej liczby ocenionych płytek matafazowych i jąder interfazowych. Preparaty uznaje się za informatywne w przypadku wydajności większej lub równej 90%. W poszczególnych eksperymentach powinno się oceniać od płytek metafazowych i 100 jąder interfazowych. Technika M-FISH (Multiplex FISH) Technika M-FISH pozwala na jednoczesną wizualizację wszystkich chromosomów w postaci tzw. kolorowego kariotypu (każdej parze chromosomowej odpowiada inny kolor). Dzięki temu może być wykorzystana do detekcji translokacji chromosomowych czy określania pochodzenia chromosomów markerowych w pojedynczym eksperymencie [2,6,7,16]. Metoda oparta jest na procesie hybrydyzacji in situ. Przy czym pula sekwencji DNA każdego chromosomu jest bezpośrednio znakowana jednym lub kilkoma z pięciu wykorzystywanych fluorochromów, dzięki czemu po hybrydyzacji uzyskuje się unikalny profil pięciu fluorescencji określający kolor dla każdego z 24 chromosomów.l3 Przygotowanie preparatów Bezpośrednio przed procesem hybrydyzacji preparaty powinno się poddać procesowi enzymatycznego trawienia z uży- 3
4 Rycina 2. Schemat przedstawia proces porównawczej hybrydyzacji genomowej CGH. ciem roztworu proteazy, celem uzyskania dobrej jakości chromosomów metafazowych. Proces hybrydyzacji in situ Preparaty należy zdenaturować w 1N NaOH o temperaturze pokojowej przez 1 minutę. Proces denaturacji blokuje się następnie przez zanurzenie preparatów cytogenetycznych w oziębionych do 4 C, 0,1xSSC i 1xSSC. Mieszaninę sond, znakowanych bezpośrednio pięcioma fluorochromami denaturuje się w temperaturze 70 C (±2 C) przez 5 minut. Proces hybrydyzacji przeprowadza się w temperaturze 37 C przez 3 dni, pod szkiełkiem nakrywkowym po uszczelnieniu brzegów szkiełka klejem. Usunięcie nadmiaru sondy i detekcja W/w procesy można przeprowadzić analogiczne jak w przypadku techniki FISH. Mikroskopia i rejestracja obrazu Preparaty należy oceniać przy użyciu mikroskopu fluorescencyjnego wyposażonego w jednopasmowe filtry optyczne AQUA (SpectrumAqua), RED (TeksasRed), GREEN (FITC), YELLOW (SpectrumGold), ORANGE (Rodamina). Przy czym w/w filtry optyczne są niezbędne do przeprowadzenia badania. Informacyjne płytki metafazowe należy zarejestrować przy pomocy monochromatycznej kamery, najlepiej CCD oraz systemu komputerowej analizy wyposażonej w moduł M-FISH. Pięć monochromatycznych obrazów płytek metafazowych zarejestrowanych z wykorzystaniem w/w jednopasmowych filtrów optycznych komputerowo składa się i pseudokoloryzuje z wykorzystaniem modułu M-FISH. Poszczególne pary chromosomowe klasyfikuje się automatycznie na podstawie zmierzonych profili poszczególnych fluorescencji z wykorzystaniem modułu M-FISH (analiza wyników M-FISH nie jest możliwa do przeprowadzenia na drodze bezpośredniej oceny mikroskopowej). Zasady oceny hybrydyzacji W poszczególnych eksperymentach powinno się ocenić od płytek metafazowych. 4 Rycina 3. Ocena statystycznej analizy niezrównoważenia chromosomowego metodą CGH schemat. Rycina 4. Zasada tworzenia profili fluorescencji w metodzie CGH schemat. Genomowa hybrydyzacja porównawcza technika CGH (ang. Comparative Genomic Hybridization) Technika CGH dzięki ilościowej analizie kompletnego genomu ludzkiego umożliwia ocenę utraty bądź amplifikacji dowolnego regionu chromosomowego (na poziomie prążka chromosomowego) w pojedynczym eksperymencie, niekiedy nawet wtedy, gdy aberracja chromosomowa pozostaje poza zasięgiem klasycznych technik cytogenetycznych. Przydatność techniki CGH dla potrzeb diagnostyki prenatalnej jest dyskutowana [7,8,16]. Technika CGH polega podobnie jak technika FISH na hybrydyzacji in situ, z tą różnicą, że materiał do badań (genomowe DNA), uzyskany od chorego jest hybrydyzowany (podobnie jak sonda molekularna w technice FISH) do chromosomów metafazowych, które znajdują się bezpośrednio na kontrolnym preparacie cytogenetycznym. Równe ilościowo próbki referencyjnego i badanego DNA wyznakowane różnymi fluorochromami przyłączają się w procesie hybrydyzacji do chromosomów znajdujących się na kontrolnym preparacie chromosomowym (Rycina 2). Ocena niezrównoważenia polega na półilościowym pomiarze i porównaniu natężeń obydwu fluorescencji wzdłuż wszystkich chromosomów i odniesienia uzyskanych profili do wzorców ideogramów chromosomów (Rycina 3,4). Izolowanie genomowego DNA z komórek owodniowych W naszym laboratorium DNA genomowe z amniocytów izoluje się przy użyciu komercyjnie dostępnego zestawu (T.E. Kucharczyk), zgodnie z zaleceniami producenta [16].
5 Tabela 1. Mieszanina reakcyjna do procesu znakowania na drodze Nick Translation. X µl (1 µg) Genomowe DNA 17,5 µl X Woda destylowana 2,5 µl SpectrumGreen-dUTP 5 µl dttp 10 µl dntp 5 µl 10 bufor NT 10 µl Mieszanina enzymów (DNA-za I + Polimeraza I) Fluorescencyjne znakowanie genomowego DNA Badane kompletne, genomowe DNA znakuje się bezpośrednio fluochromem, np.: SpectrumGreen lub FITC z wykorzystaniem metody Nick Translation. W tym celu odpowiednio przygotowaną mieszaninę reakcyjną (Tabela 1) inkubuje się w temperaturze 15 C przez 1 do 5 godzin, a następnie proces znakowania zatrzymuje się w tempertaurze 65 C (5 10 minut). Przy czym reakcję należy prowadzić do momentu uzyskania optymalnej wielkość fragmentów DNA (w granicach 0,5 1 kbp). Wielkość fragmentów DNA ocenia się jakościowo z wykorzystaniem elektroforezy w 4% żelu agarozowym. Hybrydyzacja in situ W procesie hybrydyzacji wykorzystuje się komercyjnie dostępne referencyjne DNA (46,XY i 46,XX), bezpośrednio znakowane innym niż badane DNA fluorochromem, np: SpectrumRed lub Rodaminą oraz kontrolne preparaty cytogenetyczne pochodzące od mężczyzny 46,XY. Równe ilości (ok. 1 µg) znakowanych różnymi fluorochromami DNA testowego i referencyjnego należy zmieszać z nadmiarem ludzkiego Cot-1-DNA, a następnie poddać procesowi prehybrydyzacji w temperaturze 37 C przez 1 godzinę w celu zablokowania sekwencji wysokopowtarzalnego DNA. Po prehybrydyzacji do mieszaniny dodaje się 0,1 objętości (v/v) octanu sodowego oraz 3 objętości (v/v) 100% etanolu, a następnie DNA strąca się w temeraturze 70 C przez 1 godzinę. Bezpośrednio przed procesem hybrydyzacji wysuszone, strącone DNA rozpuszcza się w mieszaninie hybrydyzacyjnej zawierającej 70% formamid/2xssc. Tak przygotowaną mieszaninę należy nanieść na kontrolny preparat cytogenetyczny, a następnie kodenaturować w temperaturze 75 C przez 5 10 minut i hybrydyzować w temperaturze 37 C przez 3 dni (hybrydyzator). Proces kodenaturacji można powtórzyć dwukrotnie w trakcie trzydniowej hybrydyzacji, aby uzyskać większą wydajność procesu hybrydyzacji. Usunięcie nadmiaru sondy i detekcja W/w procesy można przeprowadzić analogiczne jak w przypadku techniki FISH. Mikroskopia, rejestracja obrazu Informatywne płytki metafazowe należy rejestrować przy użyciu mikroskopu fluorescencyjnego wyposażonego w jednopasmowe filtry optyczne RED (TeksasRed lub Rodamina), GREEN (FITC), DAPI (Dapi) oraz monochromatyczną kamerę CCD. Trzy monochromatyczne obrazy płytek metafazowych zarejestrowane z wykorzystaniem jednopasmowych filtrów optycznych Red (przyłączone referencyjne DNA), Green (przyłączone testowe DNA) i DAPI (chromosomy wybarwione DAPI) komputerowo składa się i pseudokoloryzuje z wykorzystaniem systemu komputerowej analizy wyposażonej w moduł CGH. Następnie identyfikuje się poszczególne pary chromosomowe na podstawie obserwowanego wzoru pążkowego DAPI. Statystyczna ocena niezrównoważenia kariotypu Ocenę niezrównoważenia kariotypu przeprowadza się przez określenie profilu fluorescencji Green/Red uzyskanego w poszczególnych parach chromosomów homologicznych i analizie ilościowej ich wzajemnego stosunku (Rycina 3,4). Pośrednie natężenie fluorescencji poszczególnego fluorochromu szacuje się wzdłuż każdego chromosomu przy pomocy programu komputerowego z modułem CGH. Wyniki odnosi się do poszczególnych prążków chromosomowych. Statystyczna analiza polega na uśrednieniu wyników uzyskanych dla płytek metafazowych. W przypadkach niezrównoważenia kariotypu obserwuje się przesunięcie profilu fluorescencji w kierunku Green (trisomia lub duplikacja) lub Red (monosomia lub delecja) (Rycina 4). Przy czym przesunięcie w/w profilu fluorescencji obserwowane wzdłuż całego chromosomu umożliwia rozpoznanie trisomii lub monosomii, natomiast analogicznie przesunięcie w/w profilu fluorescencji obserwowane jedynie w obrębie prążka lub prążków chromosomowych przemawia za rozpoznaniem delecji lub duplikacji. Dokumentacja i wyniki badań Wynik badania, podobnie jak w przypadku klasycznego badania cytogenetycznego [12] powinien zawierać: podstawowe dane pacjenta, datę wykonania badania i jego kod, informacje o placówce i lekarzu kierującym, rozpoznanie kliniczne, wynik badania kariotypu, opis wykonanego badania, z uwzględnieniem rodzaju materiału diagnostycznego, stosowanych sond molekularnych, warunków prowadzenia hybrydyzacji, wydajności hybrydyzacji, liczby ocenionych płytek metafazowych i/lub jąder interfazowych oraz zapis kariotypu z uwzględnieniem stosowanych technik cytogenetyki molekularnej, zgodny z zasadami ISCN 1995 [14]. Dodatkowo w naszym laboratorium każdy wynik jest uzupełniony o dokumentację fotograficzną i epikryzę diagnostyczną, stanowiącą interpretację wyniku. Wyniki badań należy archiwizować w dokumentacji medycznej pacjenta oraz w wersji elektronicznej pod odpowiednim kodem badania. Kliniczne aplikacje technik cytogenetyki molekularnej w wybranych przypadkach aberracji chromosomowych Aneuploidie chromosomowe Znaczenie aberracji chromosomowych w etiopatogenezie chorób uwarunkowanych genetycznie jest dobrze udokumentowane. Aberracje chromosomowe są przyczyną ponad 400 wrodzonych zespołów klinicznych, z których większość występuje sporadycznie [17,18]. Większość z nich stanowią aberracje liczbowe chromosomów, z których najpowszechniej- 5
6 sze to trisomia chromosomu 21 i aneuploidie gonosomów. Pozostałe aneuploidie chromosomów, tj.: trisomia chromosomu 18 czy trisomia chromosomu 13 stanowią istotną przyczynę zgonów w okresie noworodkowym i wczesnym okresie niemowlęcym. Aplikacja wielokolorowej techniki FISH do niehodowanych amniocytów znacząco skraca czas oczekiwania na wynik badania przez możliwość analizowania jąder interfazowych bezpośrednio po uzyskaniu próbki płynu owodniowego [9,20,21]. Przykładem może być wdrożony do rutynowej praktyki laboratoryjnej w Zakładzie Genetyki Medycznej UM w Łodzi - test MultiVysion PGT, który umożliwia jednoczesną detekcję aneuploidii chromosomów 13, 18, 21, X i Y w pojedynczym eksperymencie [14,20]. Wynik testu dostępny jest po kilkunastu godzinach od zabiegu amniocentezy. Badanie umożliwia także określenie płci chromosomowej płodu, co ma szczególne znaczenie w przypadku podejrzenia u płodu choroby jednogenowej sprzężonej z płcią, zwłaszcza wtedy, gdy badanie w kierunku swoistej mutacji nie jest możliwe do przeprowadzenia w krótkim czasie. Należy jednak pamiętać, że liczne niezrównoważone aberracje chromosomów pozostają poza zasięgiem w/w techniki, ponieważ stosowane sondy molekularne są specyficzne jedynie dla kilku regionów chromosomowych. Aplikacja techniki FISH do niehodowanych amniocytów wzbudza dodatkowo wiele kontrowersji, głównie ze względu na fakt, że do jej przeprowadzenia konieczne jest pobranie dodatkowej ilości wód płodowych. Wymienione zagadnienia sprawiają, że detekcja powszechnych aneuploidii w niehodowanych amniocytach powinna być stosowana jako metoda z wyboru w uzasadnionych klinicznie przypadkach, co z kolei łączy się koniecznością określenia wskazań lekarskich do przeprowadzenia tego badania. Własne doświadczenie pozwoliło na określenie następujących wskazań do przeprowadzenia tego badania: 1. Konieczność przeprowadzenia diagnostyki prenatalnej w ciąży powyżej 20 hbd; 2. Stwierdzenie wad rozwojowych płodu w badaniu ultrasonograficznym; 3. Zwiekszenie przezierności karkowej NT (ang. Nuchal Translucency); 4. Zwiększone ryzyko ( 1:250) aneuploidii płodu określone biochemicznymi testami przesiewowymi MSS (ang. Maternal Serum Screening). 6 A Rycina 5. Zastosowanie techniki FISH i M-FISH w przypadkach translokacji chromosomowych, które nie zostały prawidłowo rozpoznane w badaniu kariotypu. Strzałki wskazują nieprawidłowe strukturalnie chromosomy par 16 i 20 (A), 3 i 18 (B). B Dane literaturowe wskazują, że w USA wiek kobiety ciężarnej powyżej 38 roku życia oraz posiadanie potomstwa z aneuploidią chromosomową stanowią dodatkowe wskazania do przeprowadzenia prenatalnej cytogenetyki interfazowej [19]. Jednakże w Polsce pozostaje to nadal sprawą dyskusyjną [14]. Zrównoważone translokacje chromosomowe Zrównoważone translokacje chromosomowe, mimo że występują stosunkowo często w populacji ludzkiej budzą wiele kontrowersji, a ich interpretacja pozostaje w dalszym ciągu trudnym problemem poradnictwa genetycznego [22,23]. W szczególny sposób dotyczy to przypadków diagnozowanych prenatalnie, głównie ze względu na to, że na podstawie rutynowej analizy cytogenetycznej często nie można przewidzieć konsekwencji klinicznych, nawet w przypadkach, w których obserwuje się transmisję wielopokoleniową aberracji chromosomowej. Zrównoważone translokacje chromosomowe występują u obu płci, zwykle nie powodując bezpośrednich skutków klinicznych. Mogą jednak warunkować nieprawidłowy przebieg mejozy u nosicieli w/w zrównoważonych translokacji chromosomowych, w wyniku, którego dochodzi do powstania niezrównoważonej aberracji chromosomowej u potomstwa, tj. częściowej trisomii lub monosomii. W/w niezrównoważenie chromosomowe niemal zawsze jest letalne, czasami prowadzi do ujawnienia się nieprawidłowego fenotypu, manifestującego się klinicznie licznymi cechami dysmorficznymi, wadami wrodzonymi i upośledzeniem rozwoju umysłowego. Cytogenetyczne określenie wielkości regionu chromosomowego zaangażowanego w rearanżację chromosomową jest pierwszą i często jedyną dostępną metodą umożliwiającą pośrednią ocenę ekspresji klinicznej [17,22]. Określenie wielkości tego regionu lub prawidłowe rozpoznanie zrównoważonej translokacji chromosomowej może niekiedy pozostawać poza zasięgiem klasycznej oceny kariotypu. W takich przypadkach zastosowanie techniki FISH z sondami malującymi lub M- FISH może okazać się metodą z wyboru. Przykładem mogą być zdiagnozowane de novo w naszym laboratorium translokacje zrównoważone między chromosomami 16 i 20 oraz 3 i 18, które nie zostały prawidłowo rozpoznane w trakcie klasycznej oceny kariotypu (Rycina 5A,B). Kolejnym problemem poradnictwa genetycznego są przypadki translokacji chromosomowych, w których obserwuje się transmisję wielopokoleniową aberracji. Rozpoznanie w kariotypie płodu rodzinnie występującej translokacji chromosomowej wiąże się z wyższym niż populacyjne ryzykiem ujawnienia się u potomstwa: upośledzenia rozwoju umysłowego, i/lub wrodzonych wad rozwojowych. W takiej sytuacji dobrą praktyką diagnostyczno-lekarską wydaje się być poszukiwanie niezrównoważenia chromosomowego metodą CGH, nawet w tych przypadkach, w których w kariotypie płodu stwierdzono translokację chromosomową analogiczną jak u jednego z rodziców. Niekiedy w przypadku, gdy nosicielem translokacji jest ojciec istnieje także możliwość oceny rzeczywistego ryzyka wystąpienia niezrównoważonego kariotypu (niepowodzeń rozrodu) u płodu, jeszcze przed planowaną ciążą [23]. Możliwe jest to dzięki zastosowaniu techniki FISH w zdekondensowanych główkach plemnikowych do określenia częstości występowania aneuploidii wybranych chromosomów. Podobne badania u nosicieli translokacji są rutynowo wykonywane w naszym laboratorium.
7 Rycina 6. Algorytm postępowania diagnostycznego w przypadkach PWS i AS. Zespoły mikrodelecyjne Prader-Willi (PWS) i Angelman (AS) U około 70% pacjentów z PWS jak i AS stwierdza się interstycjalne delecje regionu 15q11-q13, odpowiednio pochodzenia ojcowskiego i matczynego. Jednorodzicielska disomia chromosomu 15 pochodzenia matczynego (UPD15mat) jest wykrywana w ok. 25% przypadków PWS natomiast jednorodzicielska disomia chromosomu 15 pochodzenia ojcowskiego (UPD15pat) jedynie w ok. 4% przypadków AS. U ok. 2% chorych z rozpoznaniem klinicznym PWS i AS stwierdza się mutację w centrum imprintingu (IC) oraz u ok. 5% pacjentów z AS stwierdza się mutacje w obrębie genu UBE3A [24 27]. U pozostałych chorych z PWS i AS potwierdzenie etiopatogenezy choroby i rozpoznania klinicznego nie jest w chwili obecnej możliwe. Diagnostyka prenatalna zarówno delecyjnych przypadków PWS i AS jak też przypadków z UPD15 nie jest łatwa [26,27]. Delecja 15q11-q13 może być poza zasięgiem klasycznych badań cytogenetycznych. Aplikacja techniki FISH z sondami specyficznymi dla regionu PWACR umożliwia skuteczną diagnostykę mikrodelecji, ale może być stosowana dopiero wtedy, gdy istnieje podejrzenie wystąpienia zespołu PWS u płodu (Rycina 6). Istnieje kilka technik molekularnych umożliwiających wykrycie UPD15, np. test metylacji czy analiza mikrosatelitarna metodą PCR [25,26]. Algorytm postępowania diagnostycznego w opisywanych przypadkach prezentuje Rycina 6. Jednakże w rutynowej praktyce poradnianej nie izoluje się DNA z każdej próbki wód płodowych, a dopiero wtedy, gdy istnieją wskazania do przeprowadzenia badań z zastosowaniem biologii molekularnej. W opisywanych przypadkach DNA może być dostępne dopiero po kolejnym pasażu hodowli komórkowej, dni od wydania wyniku rozpoznania cytogenetycznego. Określenie klinicznych wskazań do badań prenatalnych w kierunku PWS nie jest łatwe, ze względu na to, że u płodu z zespołem PWS zwykle stwierdza się prawidłowe wyniki badania USG i innych nieinwazyjnych badań prenatalnych. Jedynym uchwytnym objawem może być hipotonia przedurodzeniowa, która jest prawdopodobnie przyczyną nieprawidłowej pozycji i rzadkich ruchów płodu [24,26,27]. Jednakże opisywane objawy są mało swoiste. Dodatkowo nie stwierdza się korelacji pomiędzy wiekiem matki (powyżej 35 rż.) a zwiększonym ryzykiem wystąpienia PWS u płodu. Z tych powodów diagnostyka prenatalna w kierunku zespołów PWS i AS jest możliwa do przeprowadzenia w następujących sytuacjach: 1. U ciężarnych, które posiadają już dziecko z PWS lub AS, u którego rozpoznano: a. delecję 15q11-q13 lub UPD15 - ryzyko genetyczne urodzenia kolejnego dziecka z PWS lub AS jest niskie, nie większe od ryzyka populacyjnego. Obecny stan wiedzy nie daje jednak absolutnej pewności, że nieprawidłowy fenotyp nie ujawni się, dlatego podobnym rodzinom należy także zaproponować badania w kierunku delecji 15q11-q13 i UPD15 z użyciem techniki FISH i testów molekularnych, b. rodzinnie występującą translokację chromosomową obejmującą chromosom 15 ryzyko genetyczne urodzenia kolejnego dziecka z PWS lub AS jest wyższe od ryzyka populacyjnego badania w kierunku delecji 15q11-q13 i UPD15 z użyciem techniki FISH i testów molekularnych, c. mutację w centrum imprintingu (IC) genu SNRPN. Wykrycie opisywanej mutacji u probanta oraz u jednego z rodziców wiąże się z 50% ryzykiem genetycznym urodzenia kolejnego dziecka z PWS lub AS i jest wskazaniem do diagnostyki przedurodzeniowej w przypadku kolejnej ciąży z zastosowaniem testów molekularnych. 2. U ciężarnych, u których istnieją inne wskazania lekarskie do wykonania inwazyjnej diagnostyki prenatalnej (np.: wiek powyżej 35 r.ż): a. w przypadku podejrzenia delecji regionu 15q11-q13 w badaniu kariotypu płodu z komórek trofoblastu lub amniocytów potwierdzenie delecji 15q11-q13 z zastosowaniem techniki FISH, b. w przypadku rozpoznania mozaikowości chromosomowej 47,XX(XY),+15/ 46,XX(XY) w kariotypie płodu z komórek trofoblastu lub amniocytów badania w kierunku UPD15 z użyciem testów molekularnych, c. w przypadku rozpoznania translokacji chromosomowej obejmującej chromosom 15 lub chromosomu markerowego pochodzącego z chromosomu 15 w kariotypie płodu, możliwe jest współistnienie delecji 15q11-q13 lub UPD15 z w/w aberracjami chromosomowymi badania w kierunku delecji 15q11-q13 i UPD15 z użyciem techniki FISH i testów molekularnych. Chromosomomy markerowe Małe, dodatkowe chromosomy markerowe ESACs (ang. Extra Structurally Abnormal Chromosomes) stanowią poważny problem kliniczny i diagnostyczny. Około 86% chromosomów markerowych pochodzi z chromosomów akrocentrycznych, z których ponad połowę stanowią markery pochodzące z chromosomu 15 [28 30]. Pozostałe chromosomy markerowe w większości są pochodzenia gonosomalnego. Przedurodzeniowa ocena ryzyka klinicznego związanego z obecnością dodatkowego chromosomu markerowego pozostaje wciąż trudna do określenia. Proces diagnozowania chromosomu markerowego jest każdorazowo związany z następującymi dylematami diagnostyczno-klinicznymi: 1. Jaki wpływ na fenotyp ma chromosom markerowy? 2. Czy występuje rodzinnie czy de novo? 3. Czy zawiera materiał aktywny genetycznie? (Określenie konsekwencji klinicznych). 4. Jakie dodatkowe badania można wykonać, aby zidentyfikować chromosom markerowy czy można określić, z którego chromosomu pochodzi? 5. Czy wszystkie w/w uzyskane informacje diagnostyczne pozwolą na wydanie jednoznacznej epikryzy rokowniczej? 7
8 Rycina 7. Algorytm postępowania diagnostycznego w przypadkach chromosomów markerowych pochodzenia gonosomalnego. Objawy kliniczne połączone z obecnością ESACs zależą od zawartości materiału genetycznego w markerze chromosomowym. Ponadto przyjmuje się, że jeśli ESAC występuje rodzinnie to ryzyko wystąpienia nieprawidłowego fenotypu jest zwykle niskie (chyba, że pociąga za sobą UPD), a u potomstwa należy się spodziewać prawidłowego fenotypu. Obecność markera chromosomowego wykrytego de novo i ocena ryzyka klinicznego jest bardziej złożona. Charakterystyka ESAC w oparciu o klasyczne testy cytogenetyczne jest ciągle aktualna [27 29], niemniej jednak powinna być uzupełniona o badania z zastosowaniem cytogenetyki molekularnej [28,30,31]. Algorytm postępowania diagnostycznego w przypadkach chromosomów markerowych z uwzględnieniem metod cytogenetyki molekularnej prezentują Ryciny 7 i 8. Chromosomy markerowe pochodzenia gonosomalnego Identyfikacja chromosomów markerowych pochodzących z gonosomów i odróżnienie ich od pozostałych chromosomów markerowych w trakcie diagnostyki prenatalnej jest ważne, ponieważ pozwala w wielu przypadkach na szacunkowe określenie skutków klinicznych, utrzymanie ciąży i szybkie podjecie właściwych decyzji terapeutycznych po urodzeniu się dziecka w optymalnym dla niego czasie [25,32]. Identyfikację chromosomu markerowego powinno się przeprowadzić z wykorzystaniem techniki FISH z sondami specyficznymi dla gonosomów X i Y lub techniki PCR w kierunku detekcji sekwencji specyficznych dla chromosomu Y (Rycina 7). Przykładem mogą być pacjentki z fenotypem zespołu Turnera, u których w kariotypie stwierdza się chromosom markerowy pochodzący z chromosomu Y. U tych pacjentek istnieje wysokie ryzyko rozwoju nowotworu gonad, głównie typu gonadoblastoma, zwłaszcza przy towarzyszącej dysgenzji gonad [33]. W tych przypadkach jako leczenie z wyboru stosuje się obustronną gonadektomię. Chromosomy markerowe pochodzące z chromosomów akrocentrycznych 8 Rycina 8. Algorytm postępowania diagnostycznego w przypadkach chromosomów markerowych pochodzących z chromosomu 15. Większość chromosomów markerowych z tej grupy stanowią chromosomy markerowe DAPI(+), NOR(+) euchromatyczne inv dup (15) lub heterochromatyczneh markery określane jako izochromosomy ramion krótkich chromosomu 15 i(15p) [28,29]. Wykrycie inv dup (15) w trakcie diagnostki przedurodzeniowej stwarza szereg problemów diagnostycznych, które są głównie związane z oceną ryzyka wystąpienia nieprawidłowego fenotypu. Obecnie przyjmuje się, że euchromatyczne markery nie zawierające regionu krytycznego PWACR (ang. Prader-Willi/Angelman Critical Region) zwykle nie powodują skutków klinicznych. Natomiast w przypadkach, które zawierają region PWACR obserwuje się nieprawidłowy fenotyp [26]. Należy jednak pamiętać, że nawet rodzinnie występujące, PWACR( ) ESACs(15) mogą współistnieć z delecją 15q11-q13 lub UPD15, tym samym mogą warunkować wystąpienie fenotypu PWS lub AS po urodzeniu. Aplikacja techniki FISH z sondą centromerową dla chromosomu 15 i sondami specyficznymi dla regionu PWACR umożliwia skuteczną diagnostykę ESACs(15). Jednakże dla właściwego określenia ryzyka wystąpienia nieprawidłowego fenotypu powinno się w/w badania uzupełnić o diagnostykę molekularną w kierunku UPD15 (Rycina 8). Dodatkowo diagnostykę tej grupy ESACs utrudnia fakt, że pierścieniowe chromosomy markerowe pochodzace z chromosomu 15 nie wykazują pozytywnego barwienia DAPI i NOR, tym samym bez zastosowania technik cytogenetyki molekularnej (FISH, M-FISH) ich identyfikacja nie jest zwykle możliwa. Małe, heterochromatyczne chromosomy markerowe pochodzące z pozostałych chromosomów akrocentrycznych DAPI( ), NOR(+) są zwykle związane z niskim ryzykiem wystąpienia nieprawidłowego obrazu klinicznego pacjenta [28]. Chromosomy markerowe pochodzenia autosomalnego, innego niż akrocentryczne Diagnostyka chromosomów markerowych DAPI( ), NOR( ), które nie pochodzą z gonosomów wymaga stosowania technik, takich jak M-FISH czy CGH [35,36]. Identyfikacja chromosomu markerowego z tej grupy w trakcie diagnostyki prenatalnej niemal zawsze wiąże się z niekorzystnym rokowaniem. Określenie przewidywanych skutków klinicznych jest zwykle niemożliwe, nawet w tych przypadkach, w których precyzyjnie określono punkty złamań chromosomowych. Przyczyną tego jest mała liczba lub brak opisanych klinicznie przypadków [35].
9 Rycina 9. Identyfikacja chromosomu markerowego DAPI( ), NOR( ), CBG( ) metodami CGH (A) i M-FISH (B). Neocentromery Istnieje pewna grupa chromosomów markerowych, które wykazują obecność centromerów, nie zawierających sekwencji alfa-satelitarnego DNA, tym samym nie dają pozytywnych sygnałów po hybrydyzacji z odpowiednimi sondami centromerowymi NMCs (ang. Neocentromere Marker Chromosomes) [36,37]. W tych przypadkach jedynie techniki M-FISH i CGH mogą pozwolić na określenie, z którego chromosomu powstały. Przykładem może być diagnozowany prenatalnie w naszym laboratorium przypadek chromosomu markerowego pochodzącego z chromosomu 1. W opisywanym przypadku zastosowanie technik barwień prążkowych chromosomów wykazało obecność de novo chromosomu markerowego DAPI(-), NOR(-). Zastosowanie techniki FISH z sondami centromerowymi specyficznymi dla chromosomów X i Y wykluczyło gonosomowe pochodzenie chromosomu markerowego. Technika CGH umożliwiła detekcję amplifikacji sekwencji z ramienia krótkiego chromosomu 1 (1p22.1-p31.1) (Rycina 9A). Użycie techniki M-FISH potwierdziło, że marker pochodzi z chromosomu 1 (Rycina 9B). Dodatkowo retrospektywne zastosowanie techniki FISH z sondą pancentromerową nie pozwoliło na wizualizację sekwencji alfasatelitarnego DNA w obrębie chromosomu markerowego (Rycina 10). Podsumowanie Piśmiennictwo: 1. Hsu TC: Human and mammalian cytogenetics. An historical perspective. Heidelberg Science Library, Springer-Verlag New York Inc, Barch MJ, Knutsen T, Spurbeck JL: The AGT cytogenetics laboratory manual. Third edition. Lippincott Raven Publishers Philadelphia, New York, 1997 A B Rycina 10. FISH z sondą pancentromerową w przypadku neocentromerowego chromosomu markerowego. Zielony owal wskazuje chromosom markerowy, który nie zawiera sekwencji regionu centromerowego alfa-satelitarnego DNA (brak sygnału hybrydyzacyjnego). Pozostałe chromosomy zawierają w/w sekwencje. Znaczenie aberracji chromosomowych w etiopatogenezie chorób uwarunkowanych genetycznie jest dobrze udokumentowane. Aberracje strukturalne chromosomów stanowią przyczynę licznych trudności i dylematów diagnostyczno-lekarskich w trakcie udzielania porady genetycznej. W szczególny sposób dotyczy to przypadków diagnozowanych prenatalnie, głównie ze względu na fakt, że na podstawie rutynowej analizy cytogenetycznej często nie można przewidzieć konsekwencji klinicznych, nawet w tych przypadkach, w których obserwuje się transmisję wielopokoleniową aberracji. Rutynowo przeprowadzana ocena kariotypu umożliwia stosunkowo łatwe diagnozowanie aneuploidii chromosomowych i aberracji strukturalnych chromosomów na poziomie prążka chromosomowego (5 10 Mbp) [2,12,14,25]. Rozdzielczość taka może okazać się jednak niewystarczająca do diagnozowania subtelnych rearanżacji strukturalnych chromosomów. W chwili obecnej technika FISH jest niezastąpionym narzędziem diagnostycznym w przypadkach chromosomów markerowych, subtelnych translokacji, translokacji obejmujących więcej niż dwa chromosomy, duplikacji czy mikrodelecji. Należy jednak pamiętać, że technika FISH pozwala na detekcję licznych, nawet subtelnych rearanżacji chromosomowych, ale zazwyczaj może być stosowane dopiero po przeprowadzeniu hodowli komórkowej in vitro i ocenie kariotypu, ze względu na konieczność doboru odpowiedniej sondy molekularnej. W przypadkach subtelnych translokacji czy chromosomów markerowych dobór odpowiednich sond molekularnych jest procesem często kosztownym i czsochłonnym. Z tego powodu uzyskanie możliwych informacji diagnostycznych odbywa się w relatywnie długim czasie i utrudnia ocenę ewentualnych konsekwencji klinicznych. Ma to znaczenie zwłaszcza w trakcie diagnostyki prenatalnej. Wymienione powody sprawiają, że istnieje konieczność wykorzystywania w procesie diagnostyki prenatalnej nowych technik diagnostycznych, które nie tylko umożliwią skrócenie czasu oczekiwania na wynik, ale też dostarczą szeregu istotnych informacji diagnostycznych w miarę możliwości w pojedynczym eksperymencie. Przykładem mogą być opisane w prezentowanej pracy aplikacje technik CGH czy M-FISH, których stosowanie w uzasadnionych klinicznie przypadkach powinno być decyzją diagnostyczną z wyboru. 3. Yung J-F: New FISH probes the end in sight. Nature Genet, 1996; 14: Bentz M, Plesch A, Stilgenbauer S i wsp: Minimal sizes of deletions detected by comparative genomic hybridization. Genes Chrom Cancer, 1998; 21:
10 5. Kirchhoff M, Rose H, Lundsteen C: High-resolution comparative genomic hybridisation in clinical cytogenetics. J Med Genet, 2001; 38(11): McNeil N, Ried T: Novel molecular cytogenetic techniques for identifying complex chromosomal rearrangements: technology and applications in molecular medicine. Expert Rev In Mol Med, 2000; 8: Carpenter NJ: Molecular cytogenetics. Semin Pediatr Neurol, 2001; 8(3): Lapierre JM, Cacheux V, Collot N i wsp: Comparison of comparative genomic hybridization with conventional karyotype and classical fluorescence in situ hybridization for prenatal and postnatal diagnosis of unbalanced chromosome abnormalities. Ann Genet, 1998; 41(3): Lapierre JM, Cacheux V, Luton D i wsp: Analysis of uncultured amniocytes by comparative genomic hybridization: a prospective prenatal study. Prenat Dian, 2000; 20(2): Rickert CH, Paulus W: No chromosomal imbalances detected by comparative genomic hybridisation in a case of fetal immature teratoma. Childs Nerv Syst, 2002; 18(11): Dziubińska-Michalewicz M: Aktualne dane statystyczne o kobietach. Biuro Studiów i Ekspertyz Kancelarii Sejmu, Warszawa, Bocian E: Diagnostyka cytogenetyczna chorób genetycznych. Kryteria i zasady procedury diagnostycznej oraz systemu kontroli jakości badań. Diag Lab, 2001; 37(Supl.1): Raap AK: Advances in fluorescence in situ hybridisation. Mutation Res, 1998; 400: Kałużewski B, Constantinou M, Helszer Z i wsp: Inwazyjna diagnostyka przedurodzeniowa. Doświadczenia własne 15 lat realizacji programu. Monitor Science Review, 2004; (bieżący numer) 15. ISCN(1995). An International System for Human Cytogenetic Nomenclature. (Mittelman F. ed), Karger Basel, Kałużewski B, Constantinou M, Zając E: Molecular cytogenetic techniques in detecting subtle chromosomal imbalances. J Appl Genet, 2003; 44(4): Gersen SL, Keagle MB: The principles of clinical cytogenetics. Humana Press, Totowa, New Yersey, 1999; Korniszewski L: Dysmorfologia w codziennej praktyce. Klin Ped, 1996; 4(2): Eiben B, Trawicki W, Hammans W: Rapid prenatal diagnosis of aneuploidies in uncultured amniocytes by Fluorescence In Situ Hybridization. Fetal Diagn Ther, 1999; 14: Constantinou M, Zając E, Kałużewski B: Chromosomal mosaicism on amniotic interphase nuclei detected by multiprobe FISH. J Appl Genet, 2003; 44(4): Truong K, Gibaud A, Dupont JM i wsp: Rapid prenatal diagnosis of Down syndrome using quantitative fluorescence in situ hybridization on interphase nuclei. Prenat Dian, 2003; 23(2): Midro A.T, Stasiewicz-Jarocka B: Określanie prawdopodobieństwa urodzenia dziecka z niezrównoważonym kariotypem w rodzinach nosicieli translokacji chromosomowych wzajemnych. Część II. Analiza rodowodowa. Grupy indywidualnego ryzyka genetycznego nosicieli translokacji chromosomowych wzajemnych. Diag Lab, 2001; 37(Supl.1): Midro AT, Stasiewicz-Jarocka B: Określanie prawdopodobieństwa urodzenia dziecka z niezrównoważonym kariotypem w rodzinach nosicieli translokacji chromosomowych wzajemnych. Część I. Diagnostyka cytogenetyczna translokacji. Diag Lab, 2001; 37(Supl.1): Cassidy SB, Schwartz S: Prader-Willi and Angelman Syndromes. Medicine, 1998; 77: Constantinou M, Kałużewski B: Wykorzystanie techniki FISH w diagnostyce aberracji chromosomowych trudnych do zidentyfikowania za pomocą klsycznych technik cytogenetycznych. Diag Lab, 2001; 37(Supl.1): Constantinou M, Kałużewski B, Helszer Z i wsp: Prenatal detection of maternal UPD15 in a new case with i(15p) by Timing Replication Test (TRT) and methylation analysis. J Appl Genet, 2003; 44(2): Diagnostic Testing for Prader-Willi and Angelman Syndromes: Report of the ASHG/ACMG Test and Technology Transfer Committee. (ASHG/ ACMG Report ed.), Am J Hum Genet, 1996; 58: Blennow E, Nielsen KB, Telenius H i wsp: Fifty probands with extra structurally abnormal chromosomes characterized by fluorescence in situ hybridization. Am J Med Genet, 1995; 55(1): Kałużewski B, Helszer Z, Constantinou M i wsp: Extra structurally abnormal chromosomes (ESACs) - presentation of 10 new cases. Med Sci Monit, 2001; 7(3): Helszer Z, Constantinou M, Nowacka J i wsp: Application of FISH and Q- PCR techniques in breakpoint diagnostics in three cases of marker chromosomes derived from chromosome 15. Med Sci Monit, 2001; 7(3): Helszer Z, Constantinou M, Nowacka J i wsp: Application of FISH and Q- PCR techniques in breakpoint diagnostics in three cases of marker chromosomes derived from chromosome 15. Med Sci Monit, 2001; 7(3): Hernando C, Carrera M, Ribas I i wsp: Prenatal and postnatal characterization of Y chromosome structural anomalies by molecular cytogenetic analysis. Prenat Diagn, 2002; 22(9): Helszer Z, Kałużewski B, Constantinou M: Małe dodatkowe chromosomy markerowe (ESACs). Problemy diagnostyczne i znaczenie kliniczne. Diag Lab, 2001; 37(Supl.1): Starke H, Nietzel A, Weise A i wsp: Small supernumerary marker chromosomes (SMCs): genotype-phenotype correlation and classification. Hum Genet, 2003;114(1): Liehr T, Starke H, Weise A i wsp: Multicolor FISH probe sets and their applications. Histol Histopathol, 2004; 19(1): Spiegel M, Hickmann G, Senger G i wsp: Two new cases of analphoid marker chromosomes. Am J Med Genet, 2003;116A(3): Levy B, Papenhausen P, Tepperberg J i wsp: Prenatal molecular cytogenetic diagnosis of partial tetrasomy 10p due to neocentromere formation in an inversion duplication analphoid marker chromosome. Cytogenet Cell Genet, 2000; 91(1 4):
Analiza genetyczna w niepowodzeniach ciąży i badaniach prenatalnych
 Analiza genetyczna w niepowodzeniach ciąży i badaniach prenatalnych Dr n. med. Joanna Walczak- Sztulpa Katedra i Zakład Genetyki Medycznej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Diagnostyka
Analiza genetyczna w niepowodzeniach ciąży i badaniach prenatalnych Dr n. med. Joanna Walczak- Sztulpa Katedra i Zakład Genetyki Medycznej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Diagnostyka
Załącznik nr 5 do zarządzenia Nr 53/2006 Prezesa Narodowego Funduszu Zdrowia. Program badań prenatalnych
 Program badań prenatalnych 1 I. UZASADNIENIE CELOWOŚCI WDROŻENIA PROGRAMU BADAŃ PRENATALNYCH, zwanego dalej Programem. 1. Opis problemu zdrowotnego W ostatnich latach wzrasta systematycznie średni wiek
Program badań prenatalnych 1 I. UZASADNIENIE CELOWOŚCI WDROŻENIA PROGRAMU BADAŃ PRENATALNYCH, zwanego dalej Programem. 1. Opis problemu zdrowotnego W ostatnich latach wzrasta systematycznie średni wiek
Klasyczna analiza kariotypu, techniki prążkowania chromosomów Molekularna stosowanie sond molekularnych, technika FISH
 CYTOGENETYKA seminarium III rok WLI mgr inż. Łukasz Kuszel CYTOGENETYKA: Klasyczna analiza kariotypu, techniki prążkowania chromosomów Molekularna stosowanie sond molekularnych, technika FISH BUDOWA CHROMOSOMU
CYTOGENETYKA seminarium III rok WLI mgr inż. Łukasz Kuszel CYTOGENETYKA: Klasyczna analiza kariotypu, techniki prążkowania chromosomów Molekularna stosowanie sond molekularnych, technika FISH BUDOWA CHROMOSOMU
Podstawowe techniki barwienia chromosomów
 Prążek C Chromatyna nie kondensuje równomiernie! Euchromatyna-najmniej kondensująca (fragmenty helisy DNA bogate w guaninę i cytozynę) Heterochromatyna fakultatywna Jasne prążki G Ciemne prążki G Heterochromatyna
Prążek C Chromatyna nie kondensuje równomiernie! Euchromatyna-najmniej kondensująca (fragmenty helisy DNA bogate w guaninę i cytozynę) Heterochromatyna fakultatywna Jasne prążki G Ciemne prążki G Heterochromatyna
NIPT Nieinwazyjny Test Prenatalny (ang. Non-Invasive Prenatal Test)
 NIPT Nieinwazyjny Test Prenatalny (ang. Non-Invasive Prenatal Test) Nieinwazyjne badanie krwi kobiety ciężarnej w kierunku wykluczenia najczęstszych trisomii u płodu Cel testu NIPT Celem testu NIPT jest
NIPT Nieinwazyjny Test Prenatalny (ang. Non-Invasive Prenatal Test) Nieinwazyjne badanie krwi kobiety ciężarnej w kierunku wykluczenia najczęstszych trisomii u płodu Cel testu NIPT Celem testu NIPT jest
NIFTY TM Nieinwazyjny, Genetyczny Test Prenataly określający ryzyko wystąpienia zespołu Downa, Edwardsa i Patau
 NIFTY TM Nieinwazyjny, Genetyczny Test Prenataly określający ryzyko wystąpienia zespołu Downa, Edwardsa i Patau Nieinwazyjne badania prenatalne, polegające na ocenia parametrów biochemicznych, takie jak
NIFTY TM Nieinwazyjny, Genetyczny Test Prenataly określający ryzyko wystąpienia zespołu Downa, Edwardsa i Patau Nieinwazyjne badania prenatalne, polegające na ocenia parametrów biochemicznych, takie jak
UWAGA SPECJALIZUJĄCY!
 Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs z Laboratoryjnej Genetyki Medycznej Kurs: Cytogenetyka kliniczna Moduł II: Cytogenetyka GP 8 II/2012 (tryb podstawowy)
Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs z Laboratoryjnej Genetyki Medycznej Kurs: Cytogenetyka kliniczna Moduł II: Cytogenetyka GP 8 II/2012 (tryb podstawowy)
UWAGA SPECJALIZUJĄCY!
 Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs Kurs : Cytogenetyka kliniczna z Laboratoryjnej Genetyki Medycznej Moduł II: Cytogenetyka GP 13 II/1/2016, GU 13 II/1/2016
Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs Kurs : Cytogenetyka kliniczna z Laboratoryjnej Genetyki Medycznej Moduł II: Cytogenetyka GP 13 II/1/2016, GU 13 II/1/2016
ABERRACJE CHROMOSOMOWE. KLINICZNE SKUTKI ABERRACJI CHROMOSOMOWYCH
 ABERRACJE CHROMOSOMOWE. KLINICZNE SKUTKI ABERRACJI CHROMOSOMOWYCH Anna Latos-Bieleńska Katedra i Zakład Genetyki Medycznej Akademii Medycznej w Poznaniu Około 0,6% dzieci rodzi się z aberracjami chromosomowymi
ABERRACJE CHROMOSOMOWE. KLINICZNE SKUTKI ABERRACJI CHROMOSOMOWYCH Anna Latos-Bieleńska Katedra i Zakład Genetyki Medycznej Akademii Medycznej w Poznaniu Około 0,6% dzieci rodzi się z aberracjami chromosomowymi
Jedyny nieinwazyjny test prenatalny wykonywany w Polsce
 Jedyny nieinwazyjny test prenatalny wykonywany w Polsce Od 6 września 2018 test NIFTY TM nie jest już dostępny w Polsce. Genomed zastępuje go Testem Prenatalnym SANCO. Genomed S.A. od maja 2015 roku, jako
Jedyny nieinwazyjny test prenatalny wykonywany w Polsce Od 6 września 2018 test NIFTY TM nie jest już dostępny w Polsce. Genomed zastępuje go Testem Prenatalnym SANCO. Genomed S.A. od maja 2015 roku, jako
Jedyny nieinwazyjny test prenatalny wykonywany w Polsce
 Jedyny nieinwazyjny test prenatalny wykonywany w Polsce Od 6 września 2018 test NIFTY TM nie jest już dostępny w Polsce. Genomed zastępuje go Testem Prenatalnym SANCO. Genomed S.A. od maja 2015 roku, jako
Jedyny nieinwazyjny test prenatalny wykonywany w Polsce Od 6 września 2018 test NIFTY TM nie jest już dostępny w Polsce. Genomed zastępuje go Testem Prenatalnym SANCO. Genomed S.A. od maja 2015 roku, jako
PAWEŁ J. CHOMIAK, JACEK J. PIETRZYK 1
 Zeszyty Naukowe Towarzystwa Doktorantów UJ Nauki Ścisłe, Nr 3 (2/2011) PAWEŁ J. CHOMIAK, JACEK J. PIETRZYK 1 (UNIWERSYTET JAGIELLOŃSKI) OMÓWIENIE PROBLEMU WŁAŚCIWEJ INTERPRETACJI WYNIKÓW KARIOTYPU MOLEKULARNEGO
Zeszyty Naukowe Towarzystwa Doktorantów UJ Nauki Ścisłe, Nr 3 (2/2011) PAWEŁ J. CHOMIAK, JACEK J. PIETRZYK 1 (UNIWERSYTET JAGIELLOŃSKI) OMÓWIENIE PROBLEMU WŁAŚCIWEJ INTERPRETACJI WYNIKÓW KARIOTYPU MOLEKULARNEGO
2. Pobieranie materiału do badań laboratoryjnych
 Załącznik nr 3 Standardy jakości w zakresie czynności laboratoryjnej genetyki medycznej, oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji i autoryzacji wyniku badań 1. Zlecenie
Załącznik nr 3 Standardy jakości w zakresie czynności laboratoryjnej genetyki medycznej, oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji i autoryzacji wyniku badań 1. Zlecenie
MUTACJE GENOMOWE- EUPLOIDIE MUTACJE GENOMOWE- ANEUPLOIDIE. MUTACJE spontaniczne indukowane. germinalne somatyczne
 MUTACJE spontaniczne indukowane germinalne somatyczne genomowe chromosomowe genowe euploidie aneuploidie - delecje substytucje - nullisomie - duplikacje -monosomie - trisomie - tetrasomie - inwersje -translokacje
MUTACJE spontaniczne indukowane germinalne somatyczne genomowe chromosomowe genowe euploidie aneuploidie - delecje substytucje - nullisomie - duplikacje -monosomie - trisomie - tetrasomie - inwersje -translokacje
Program specjalizacji
 CENTRUM MEDYCZNE KSZTAŁCENIA PODYPLOMOWEGO Program specjalizacji w LABORATORYJNEJ GENETYCE MEDYCZNEJ Program uzupełniający dla diagnostów laboratoryjnych posiadających specjalizację I stopnia w mikrobiologii
CENTRUM MEDYCZNE KSZTAŁCENIA PODYPLOMOWEGO Program specjalizacji w LABORATORYJNEJ GENETYCE MEDYCZNEJ Program uzupełniający dla diagnostów laboratoryjnych posiadających specjalizację I stopnia w mikrobiologii
Aberracje chromosomowe - choroby genetyczne związane z widocznymi zmianami liczby lub struktury chromosomów
 Cytogenetyka Konspekt do zajęć z przedmiotu Cytogenetyczna i molekularna diagnostyka chorób genetycznych dla kierunku Biotechnologia dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Aberracje
Cytogenetyka Konspekt do zajęć z przedmiotu Cytogenetyczna i molekularna diagnostyka chorób genetycznych dla kierunku Biotechnologia dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Aberracje
Metody: PCR, MLPA, Sekwencjonowanie, PCR-RLFP, PCR-Multiplex, PCR-ASO
 Diagnostyka molekularna Dr n.biol. Anna Wawrocka Strategia diagnostyki genetycznej: Aberracje chromosomowe: Metody:Analiza kariotypu, FISH, acgh, MLPA, QF-PCR Gen(y) znany Metody: PCR, MLPA, Sekwencjonowanie,
Diagnostyka molekularna Dr n.biol. Anna Wawrocka Strategia diagnostyki genetycznej: Aberracje chromosomowe: Metody:Analiza kariotypu, FISH, acgh, MLPA, QF-PCR Gen(y) znany Metody: PCR, MLPA, Sekwencjonowanie,
Genetyka kliniczna - opis przedmiotu
 Genetyka kliniczna - opis przedmiotu Informacje ogólne Nazwa przedmiotu Genetyka kliniczna Kod przedmiotu 12.9-WL-Lek-GK Wydział Wydział Lekarski i Nauk o Zdrowiu Kierunek Lekarski Profil praktyczny Rodzaj
Genetyka kliniczna - opis przedmiotu Informacje ogólne Nazwa przedmiotu Genetyka kliniczna Kod przedmiotu 12.9-WL-Lek-GK Wydział Wydział Lekarski i Nauk o Zdrowiu Kierunek Lekarski Profil praktyczny Rodzaj
Aberracje chromosomowe Seminarium 2 część 1
 Aberracje chromosomowe Seminarium 2 część 1 Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Aberracje chromosomowe - choroby
Aberracje chromosomowe Seminarium 2 część 1 Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Aberracje chromosomowe - choroby
Zapytaj swojego lekarza.
 Proste, bezpieczne badanie krwi, zapewniające wysoką czułość diagnostyczną Nieinwazyjne badanie oceniające ryzyko wystąpienia zaburzeń chromosomalnych, takich jak zespół Downa; opcjonalnie umożliwia również
Proste, bezpieczne badanie krwi, zapewniające wysoką czułość diagnostyczną Nieinwazyjne badanie oceniające ryzyko wystąpienia zaburzeń chromosomalnych, takich jak zespół Downa; opcjonalnie umożliwia również
Najbardziej Wiarygodny, Nieinwazyjny Test Prenatalny wykonywany w Polsce Test NIFTY : tylko mała próbka krwi ciężarnej
 Najbardziej Wiarygodny, Nieinwazyjny Test Prenatalny wykonywany w Polsce Test NIFTY : To nieinwazyjny, genetyczny test prenatalny nowej generacji, który określa ryzyko trisomii chromosomów 21, 18 i 13
Najbardziej Wiarygodny, Nieinwazyjny Test Prenatalny wykonywany w Polsce Test NIFTY : To nieinwazyjny, genetyczny test prenatalny nowej generacji, który określa ryzyko trisomii chromosomów 21, 18 i 13
S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne. Nie dotyczy
 S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne Nazwa modułu Moduł E Genetyka medyczna Rodzaj modułu/przedmiotu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok, semestr studiów
S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne Nazwa modułu Moduł E Genetyka medyczna Rodzaj modułu/przedmiotu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok, semestr studiów
Jednoznaczne ODPOWIEDZI na ważne pytania
 Jednoznaczne ODPOWIEDZI na ważne pytania TEST PRENATALNY HARMONY to nowy test DNA z krwi matki określający ryzyko zespołu Downa. Test Harmony jest bardziej dokładny niż tradycyjne testy i można go wykonywać
Jednoznaczne ODPOWIEDZI na ważne pytania TEST PRENATALNY HARMONY to nowy test DNA z krwi matki określający ryzyko zespołu Downa. Test Harmony jest bardziej dokładny niż tradycyjne testy i można go wykonywać
NARODOWY FUNDUSZ ZDROWIA
 Załącznik nr do Zarządzenia nr 17/2004 Prezesa NFZ NARODOWY FUNDUSZ ZDROWIA SZCZEGÓŁOWE MATERIAŁY INFORMACYJNE O PRZEDMIOCIE POSTĘPOWANIA W SPRAWIE ZAWIERANIA UMÓW O UDZIELANIE ŚWIADCZEŃ OPIEKI ZDROW0TNEJ
Załącznik nr do Zarządzenia nr 17/2004 Prezesa NFZ NARODOWY FUNDUSZ ZDROWIA SZCZEGÓŁOWE MATERIAŁY INFORMACYJNE O PRZEDMIOCIE POSTĘPOWANIA W SPRAWIE ZAWIERANIA UMÓW O UDZIELANIE ŚWIADCZEŃ OPIEKI ZDROW0TNEJ
Translokacje Aberracje chromosomowe. strukturalne: translokacje, inwersje, delecje, duplikacje, chromosomy koliste (izochromosomy)
 Aberracje chromosomowe strukturalne: translokacje, inwersje, delecje, duplikacje, chromosomy koliste (izochromosomy) liczbowe: aneuploidie, euploidie Poszczególne gatunki zwierząt charakteryzują się nasileniem
Aberracje chromosomowe strukturalne: translokacje, inwersje, delecje, duplikacje, chromosomy koliste (izochromosomy) liczbowe: aneuploidie, euploidie Poszczególne gatunki zwierząt charakteryzują się nasileniem
Genetyka kliniczna nowe wyzwanie dla opieki pediatrycznej. Jacek J. Pietrzyk Klinika Chorób Dzieci Katedra Pediatrii Collegium Medicum UJ
 Genetyka kliniczna nowe wyzwanie dla opieki pediatrycznej Jacek J. Pietrzyk Klinika Chorób Dzieci Katedra Pediatrii Collegium Medicum UJ Kraków, czerwiec 2005 Genetyka kliniczna Kierunki rozwoju Choroby
Genetyka kliniczna nowe wyzwanie dla opieki pediatrycznej Jacek J. Pietrzyk Klinika Chorób Dzieci Katedra Pediatrii Collegium Medicum UJ Kraków, czerwiec 2005 Genetyka kliniczna Kierunki rozwoju Choroby
SYLABUS DOTYCZY CYKLU KSZTAŁCENIA
 SYLABUS DOTYCZY CYKLU KSZTAŁCENIA 2016-2022 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej kierunek) Nazwa jednostki
SYLABUS DOTYCZY CYKLU KSZTAŁCENIA 2016-2022 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej kierunek) Nazwa jednostki
Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu
 Ćwiczenie 4 Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu Wstęp CYP2D6 kodowany przez gen występujący w co najmniej w 78 allelicznych formach związanych ze zmniejszoną
Ćwiczenie 4 Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu Wstęp CYP2D6 kodowany przez gen występujący w co najmniej w 78 allelicznych formach związanych ze zmniejszoną
Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs. Kurs : Cytogenetyka kliniczna. Moduł II: Cytogenetyka
 Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs Kurs : Cytogenetyka kliniczna z Laboratoryjnej Genetyki Medycznej Moduł II: Cytogenetyka GP 4 II//07, GU 4 II//07 odbędzie
Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs Kurs : Cytogenetyka kliniczna z Laboratoryjnej Genetyki Medycznej Moduł II: Cytogenetyka GP 4 II//07, GU 4 II//07 odbędzie
Nowa generacja nieinwazyjnych badań prenatalnych. www.neobona.pl
 Nowa generacja nieinwazyjnych badań prenatalnych www.neobona.pl Aberracje chromosomowe występują u około 1% wszystkich płodów. Diagnostyka prenatalna obejmuje testy opracowane w celu badania prawidłowego
Nowa generacja nieinwazyjnych badań prenatalnych www.neobona.pl Aberracje chromosomowe występują u około 1% wszystkich płodów. Diagnostyka prenatalna obejmuje testy opracowane w celu badania prawidłowego
prof. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Instytut Gruźlicy i Chorób Płuc w Warszawie
 prof. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Instytut Gruźlicy i Chorób Płuc w Warszawie Sekwencyjność występowania zaburzeń molekularnych w niedrobnokomórkowym raku płuca
prof. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Instytut Gruźlicy i Chorób Płuc w Warszawie Sekwencyjność występowania zaburzeń molekularnych w niedrobnokomórkowym raku płuca
Choroby genetyczne na tle zmian w genomie człowieka rodzaje, fenotyp, diagnostyka genetyczna
 Przedmiot: Genetyka kliniczna V Rok, Wydział Lekarski I Katedra i Zakład Genetyki Medycznej UM w Poznaniu Choroby genetyczne na tle zmian w genomie człowieka rodzaje, fenotyp, diagnostyka genetyczna Opracowanie:
Przedmiot: Genetyka kliniczna V Rok, Wydział Lekarski I Katedra i Zakład Genetyki Medycznej UM w Poznaniu Choroby genetyczne na tle zmian w genomie człowieka rodzaje, fenotyp, diagnostyka genetyczna Opracowanie:
INTERPRETACJA WYNIKÓW BADAŃ MOLEKULARNYCH W CHOROBIE HUNTINGTONA
 XX Międzynarodowa konferencja Polskie Stowarzyszenie Choroby Huntingtona Warszawa, 17-18- 19 kwietnia 2015 r. Metody badań i leczenie choroby Huntingtona - aktualności INTERPRETACJA WYNIKÓW BADAŃ MOLEKULARNYCH
XX Międzynarodowa konferencja Polskie Stowarzyszenie Choroby Huntingtona Warszawa, 17-18- 19 kwietnia 2015 r. Metody badań i leczenie choroby Huntingtona - aktualności INTERPRETACJA WYNIKÓW BADAŃ MOLEKULARNYCH
Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs. z Laboratoryjnej Genetyki Medycznej
 Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs Cytogenetyka kliniczna Moduł II: Cytogenetyka GP 5 II//07, GU 5 II//07 z Laboratoryjnej Genetyki Medycznej odbędzie
Biuro Oddziału Kształcenia Podyplomowego Wydziału Farmaceutycznego informuje, iż kurs Cytogenetyka kliniczna Moduł II: Cytogenetyka GP 5 II//07, GU 5 II//07 z Laboratoryjnej Genetyki Medycznej odbędzie
Program ćwiczeń z przedmiotu BIOLOGIA MOLEKULARNA I GENETYKA, część I dla kierunku Lekarskiego, rok I 2015/2016. Ćwiczenie nr 1 (06-07.10.
 Program ćwiczeń z przedmiotu BIOLOGIA MOLEKULARNA I GENETYKA, część I dla kierunku Lekarskiego, rok I 2015/2016 Ćwiczenie nr 1 (06-07.10.2015) Temat: Wprowadzenie 1. Omówienie regulaminu zajęć Temat: Wprowadzenie
Program ćwiczeń z przedmiotu BIOLOGIA MOLEKULARNA I GENETYKA, część I dla kierunku Lekarskiego, rok I 2015/2016 Ćwiczenie nr 1 (06-07.10.2015) Temat: Wprowadzenie 1. Omówienie regulaminu zajęć Temat: Wprowadzenie
Szybka diagnostyka najczęstszych aneuploidii u płodu metodą QF-PCR analiza 100 przypadków
 P R A C E O R Y G I N A L N E Ginekol Pol. 2015, 86, 694-699 Szybka diagnostyka najczęstszych aneuploidii u płodu metodą QF-PCR analiza 100 przypadków Rapid diagnosis of the most common fetal aneuploidies
P R A C E O R Y G I N A L N E Ginekol Pol. 2015, 86, 694-699 Szybka diagnostyka najczęstszych aneuploidii u płodu metodą QF-PCR analiza 100 przypadków Rapid diagnosis of the most common fetal aneuploidies
WIEDZA. wskazuje lokalizacje przebiegu procesów komórkowych
 Załącznik nr 7 do zarządzenia nr 12 Rektora UJ z 15 lutego 2012 r. Opis zakładanych efektów kształcenia na studiach podyplomowych Nazwa studiów: Medycyna Molekularna w Praktyce Klinicznej Typ studiów:
Załącznik nr 7 do zarządzenia nr 12 Rektora UJ z 15 lutego 2012 r. Opis zakładanych efektów kształcenia na studiach podyplomowych Nazwa studiów: Medycyna Molekularna w Praktyce Klinicznej Typ studiów:
2. Rozdział materiału genetycznego w czasie podziałów komórkowych - mitozy i mejozy
 Program ćwiczeń z przedmiotu BIOLOGIA MOLEKULARNA I GENETYKA, część I (GENETYKA) dla kierunku Lekarskiego, rok I 2017/2018 Ćwiczenie nr 1 (09-10.10.2017) Temat: Wprowadzenie 1. Omówienie regulaminu zajęć
Program ćwiczeń z przedmiotu BIOLOGIA MOLEKULARNA I GENETYKA, część I (GENETYKA) dla kierunku Lekarskiego, rok I 2017/2018 Ćwiczenie nr 1 (09-10.10.2017) Temat: Wprowadzenie 1. Omówienie regulaminu zajęć
INSTYTUT MATKI I DZIECKA ZAKŁAD GENETYKI MEDYCZNEJ
 INSTYTUT MATKI I DZIECKA ZAKŁAD GENETYKI MEDYCZNEJ Kierownik: prof. dr hab. n. med. Tadeusz Mazurczak ul. Kasprzaka 17a, 01-211 Warszawa Tel: (022) 632-96-57; Tel/fax: (022) 632 62 24 e-mail: genetyka@imid.med.pl
INSTYTUT MATKI I DZIECKA ZAKŁAD GENETYKI MEDYCZNEJ Kierownik: prof. dr hab. n. med. Tadeusz Mazurczak ul. Kasprzaka 17a, 01-211 Warszawa Tel: (022) 632-96-57; Tel/fax: (022) 632 62 24 e-mail: genetyka@imid.med.pl
Tranquility. Najdokładniejszenieinwazyjnebadanietrisomii Pozwalauniknądryzykaamniopunkcji
 Tranquility Najdokładniejszenieinwazyjnebadanietrisomii Pozwalauniknądryzykaamniopunkcji BezpieczneiwysoceczułebadanieDNAzkrwiwykonywane przyużyciusekwencjonowanianastępnejgeneracji Wystarczyproste pobraniekrwi,aby
Tranquility Najdokładniejszenieinwazyjnebadanietrisomii Pozwalauniknądryzykaamniopunkcji BezpieczneiwysoceczułebadanieDNAzkrwiwykonywane przyużyciusekwencjonowanianastępnejgeneracji Wystarczyproste pobraniekrwi,aby
Nowoczesne metody cytogenetyczne w diagnostyce prenatalnej i postnatalnej
 Nowoczesne metody cytogenetyczne w diagnostyce prenatalnej i postnatalnej Alicja Ilnicka Pracownia Cytogenetyczna Zakład Genetyki Instytut Psychiatrii i Neurologii 21.11.2016r. Dynamiczny rozwój genetyki,
Nowoczesne metody cytogenetyczne w diagnostyce prenatalnej i postnatalnej Alicja Ilnicka Pracownia Cytogenetyczna Zakład Genetyki Instytut Psychiatrii i Neurologii 21.11.2016r. Dynamiczny rozwój genetyki,
PRISCA 5.0 Nieinwazyjna diagnostyka prenatalna
 OCENA RYZYKA GENETYCZNYCH WAD PŁODU PRISCA 5.0 Nieinwazyjna diagnostyka prenatalna SPECJALISTYCZNY PROGRAM KOMPUTEROWY DO OCENY RYZYKA WAD CHROMOSOMOWYCH PŁODU I WAD ROZWOJOWYCHUKŁADU NERWOWEGO NA PODSTAWIE
OCENA RYZYKA GENETYCZNYCH WAD PŁODU PRISCA 5.0 Nieinwazyjna diagnostyka prenatalna SPECJALISTYCZNY PROGRAM KOMPUTEROWY DO OCENY RYZYKA WAD CHROMOSOMOWYCH PŁODU I WAD ROZWOJOWYCHUKŁADU NERWOWEGO NA PODSTAWIE
Warunki udzielania świadczeń w rodzaju: świadczenia zdrowotne kontraktowane odrębnie 8. BADANIA GENETYCZNE
 Załącznik nr do Zarządzenia.. Warunki udzielania świadczeń w rodzaju: zdrowotne kontraktowane odrębnie 8. BADANIA GENETYCZNE 8.1 WARUNKI WYMAGANE Załącznik nr 2 do rozporządzenia cz. I lit. M Lp 913-916
Załącznik nr do Zarządzenia.. Warunki udzielania świadczeń w rodzaju: zdrowotne kontraktowane odrębnie 8. BADANIA GENETYCZNE 8.1 WARUNKI WYMAGANE Załącznik nr 2 do rozporządzenia cz. I lit. M Lp 913-916
Strategia diagnostyki cytogenetycznej
 Strategia diagnostyki cytogenetycznej Prawidłowe chromosomy człowieka. Typy aberracji chromosomowych i ich kliniczne skutki. Aberracje liczby i struktury chromosomów. Techniki cytogenetyczne wprowadzenie
Strategia diagnostyki cytogenetycznej Prawidłowe chromosomy człowieka. Typy aberracji chromosomowych i ich kliniczne skutki. Aberracje liczby i struktury chromosomów. Techniki cytogenetyczne wprowadzenie
Hybrydyzacja kwasów nukleinowych
 Hybrydyzacja kwasów nukleinowych Jaka jest lokalizacja genu na chromosomie? Jakie jest jego sąsiedztwo? Hybrydyzacja - powstawanie stabilnych struktur dwuniciowych z cząsteczek jednoniciowych o komplementarnych
Hybrydyzacja kwasów nukleinowych Jaka jest lokalizacja genu na chromosomie? Jakie jest jego sąsiedztwo? Hybrydyzacja - powstawanie stabilnych struktur dwuniciowych z cząsteczek jednoniciowych o komplementarnych
Niepełnosprawność intelektualna
 Niepełnosprawność intelektualna stan badań a możliwości diagnostyki molekularnej Agnieszka Charzewska Zakład Genetyki Medycznej Instytut Matki i Dziecka Niepełnosprawność intelektualna (NI, ID) zaburzenie
Niepełnosprawność intelektualna stan badań a możliwości diagnostyki molekularnej Agnieszka Charzewska Zakład Genetyki Medycznej Instytut Matki i Dziecka Niepełnosprawność intelektualna (NI, ID) zaburzenie
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 września 2015 r. Poz. 1372 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 19 sierpnia 2015 r. zmieniające rozporządzenie w sprawie standardów jakości
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 września 2015 r. Poz. 1372 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 19 sierpnia 2015 r. zmieniające rozporządzenie w sprawie standardów jakości
Zastosowanie nowoczesnych technik cytogenetyki molekularnej w diagnostyce wrodzonych wad rozwojowych
 Perinatologia, Neonatologia i Ginekologia, tom 3, zeszyt 2, 108-116, 2010 Zastosowanie nowoczesnych technik cytogenetyki molekularnej w diagnostyce wrodzonych wad rozwojowych KRZYSZTOF SZCZAŁUBA, EWA OBERSZTYN,
Perinatologia, Neonatologia i Ginekologia, tom 3, zeszyt 2, 108-116, 2010 Zastosowanie nowoczesnych technik cytogenetyki molekularnej w diagnostyce wrodzonych wad rozwojowych KRZYSZTOF SZCZAŁUBA, EWA OBERSZTYN,
Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu
 Ćwiczenie 4 Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu Wstęp CYP2D6 kodowany przez gen występujący w co najmniej w 78 allelicznych formach związanych ze zmniejszoną
Ćwiczenie 4 Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu Wstęp CYP2D6 kodowany przez gen występujący w co najmniej w 78 allelicznych formach związanych ze zmniejszoną
SYLABUS. DOTYCZY CYKLU KSZTAŁCENIA (skrajne daty) Wykł. Ćw. Konw. Lab. Sem. ZP Prakt. GN Liczba pkt ECTS
 SYLABUS DOTYCZY CYKLU KSZTAŁCENIA 2018-2020 (skrajne daty) 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Genetyka Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej
SYLABUS DOTYCZY CYKLU KSZTAŁCENIA 2018-2020 (skrajne daty) 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Genetyka Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej
Badania cytogenetyczne w ocenie płodności kobiet
 Badania cytogenetyczne w ocenie Według WHO za niepłodność uważa się niemożność poczęcia po roku regularnego współżycia seksualnego, bez stosowania antykoncepcji [1]. Około 10-15% ciąż rozpoznanych klinicznie
Badania cytogenetyczne w ocenie Według WHO za niepłodność uważa się niemożność poczęcia po roku regularnego współżycia seksualnego, bez stosowania antykoncepcji [1]. Około 10-15% ciąż rozpoznanych klinicznie
Informacje na temat badań prenatalnych
 Informacje na temat badań prenatalnych PODSTAWOWE INFORMACJE Z ZAKRESU BIOLOGII BIOLOGIA Nasz organizm zbudowany jest z miliardów komórek. W każdej z nich zawarty jest materiał genetyczny, czyli DNA (ang.
Informacje na temat badań prenatalnych PODSTAWOWE INFORMACJE Z ZAKRESU BIOLOGII BIOLOGIA Nasz organizm zbudowany jest z miliardów komórek. W każdej z nich zawarty jest materiał genetyczny, czyli DNA (ang.
S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne
 Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Nazwa modułu Genetyka medyczna Obowiązkowy Wydział Lekarsko-Biotechnologiczny
Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Nazwa modułu Genetyka medyczna Obowiązkowy Wydział Lekarsko-Biotechnologiczny
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY)
 Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Dziennik Ustaw Nr 276 19536 Poz. 2740 ROZPORZÑDZENIE MINISTRA ZDROWIA 1) z dnia 21 grudnia 2004 r.
 Dziennik Ustaw Nr 276 19536 Poz. 2740 2740 ROZPORZÑDZENIE MINISTRA ZDROWIA 1) z dnia 21 grudnia 2004 r. w sprawie zakresu Êwiadczeƒ opieki zdrowotnej, w tym badaƒ przesiewowych, oraz okresów, w których
Dziennik Ustaw Nr 276 19536 Poz. 2740 2740 ROZPORZÑDZENIE MINISTRA ZDROWIA 1) z dnia 21 grudnia 2004 r. w sprawie zakresu Êwiadczeƒ opieki zdrowotnej, w tym badaƒ przesiewowych, oraz okresów, w których
II WYDZIAŁ LEKARSKI, II ROK
 II WYDZIAŁ LEKARSKI, II ROK PRZEDMIOT: BIOLOGIA MEDYCZNA (CZĘŚĆ 1 GENETYKA) PROGRAM ĆWICZEŃ 2009/2010 L.p. Data zajęć Temat zajęć 1. 15.02 18.02 Podstawy genetyki klasycznej (podstawowe pojęcia i definicje
II WYDZIAŁ LEKARSKI, II ROK PRZEDMIOT: BIOLOGIA MEDYCZNA (CZĘŚĆ 1 GENETYKA) PROGRAM ĆWICZEŃ 2009/2010 L.p. Data zajęć Temat zajęć 1. 15.02 18.02 Podstawy genetyki klasycznej (podstawowe pojęcia i definicje
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne. Genetyka Kliniczna. Wydział Lekarsko-Stomatologiczny(WLS)
 S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Genetyka Kliniczna Obowiązkowy
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Genetyka Kliniczna Obowiązkowy
Rozwój metod dozymetrii biologicznej oraz biofizycznych markerów i indykatorów wpływu promieniowania na organizmy żywe
 Rozwój metod dozymetrii biologicznej oraz biofizycznych markerów i indykatorów wpływu promieniowania na organizmy żywe Marcin Kruszewski Centrum Radiobiologii i Dozymetrii Biologicznej Instytut Chemii
Rozwój metod dozymetrii biologicznej oraz biofizycznych markerów i indykatorów wpływu promieniowania na organizmy żywe Marcin Kruszewski Centrum Radiobiologii i Dozymetrii Biologicznej Instytut Chemii
Spis treści. 1 Budowa genomu jądrowego (M.J. Olszewska, J. Małuszyńska) 13. Przedmowa 10
 Spis treści Przedmowa 10 1 Budowa genomu jądrowego (M.J. Olszewska, J. Małuszyńska) 13 1.1. Organizacja DNA jądrowego 13 1.1.1. Rodzaje sekwencji powtarzalnych i ich lokalizacja 14 1.1.1.1. Sekwencje rozproszone
Spis treści Przedmowa 10 1 Budowa genomu jądrowego (M.J. Olszewska, J. Małuszyńska) 13 1.1. Organizacja DNA jądrowego 13 1.1.1. Rodzaje sekwencji powtarzalnych i ich lokalizacja 14 1.1.1.1. Sekwencje rozproszone
Egzemplarz dla Pacjentki. Poniższa zgoda powinna być przed podpisaniem omówiona z lekarzem prowadzącym lub specjalistą w zakresie genetyki.
 FORMULARZ ZGODY v.01 Egzemplarz dla Pacjentki Poniższa zgoda powinna być przed podpisaniem omówiona z lekarzem prowadzącym lub specjalistą w zakresie genetyki. Placówka kierująca Kod kreskowy Wprowadzenie
FORMULARZ ZGODY v.01 Egzemplarz dla Pacjentki Poniższa zgoda powinna być przed podpisaniem omówiona z lekarzem prowadzącym lub specjalistą w zakresie genetyki. Placówka kierująca Kod kreskowy Wprowadzenie
EQAgen CYTOGENETYKA KLASYCZNA 1/2017 RAPOTR KOŃCOWY. Program Zewnętrznej Oceny Jakości
 EQAgen Program Zewnętrznej Oceny Jakości CYTOGENETYKA KLASYCZNA 1/2017 W październiku 2017 roku przeprowadziliśmy trzecią edycję zewnętrznej oceny cytogenetycznej laboratoriów wykonujących diagnostyczne
EQAgen Program Zewnętrznej Oceny Jakości CYTOGENETYKA KLASYCZNA 1/2017 W październiku 2017 roku przeprowadziliśmy trzecią edycję zewnętrznej oceny cytogenetycznej laboratoriów wykonujących diagnostyczne
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
S YLABUS MODUŁU (PRZEDMIOTU) I nformacje ogólne. Genetyka medyczna. Nie dotyczy
 Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 S YLABUS MODUŁU (PRZEDMIOTU) Genetyka
Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 S YLABUS MODUŁU (PRZEDMIOTU) Genetyka
Podstawowe techniki barwienia chromosomów
 Prążek C Chromatyna nie kondensuje równomiernie! Euchromatyna-najmniej kondensująca (fragmenty helisy DNA bogate w guaninę i cytozynę) Heterochromatyna fakultatywna Jasne prążki G Ciemne prążki G Heterochromatyna
Prążek C Chromatyna nie kondensuje równomiernie! Euchromatyna-najmniej kondensująca (fragmenty helisy DNA bogate w guaninę i cytozynę) Heterochromatyna fakultatywna Jasne prążki G Ciemne prążki G Heterochromatyna
Poradnie i Pracownie - Zakład Genetyki Medycznej przy IMiDz w Warszawie
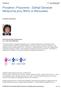 Poradnie i Pracownie - Zakład Genetyki Medycznej przy IMiDz w Warszawie Poradnia Genetyczna Kierownik Poradni Genetycznej dr n. med. Ewa Obersztyn Poradnia prowadzi działalność specjalistyczną w zakresie
Poradnie i Pracownie - Zakład Genetyki Medycznej przy IMiDz w Warszawie Poradnia Genetyczna Kierownik Poradni Genetycznej dr n. med. Ewa Obersztyn Poradnia prowadzi działalność specjalistyczną w zakresie
Zakład Genetyki Medycznej OFERTA BADAŃ DIAGNOSTYCZNYCH
 Zakład Genetyki Medycznej OFERTA BADAŃ DIAGNOSTYCZNYCH 2006/2007 Szanowni Państwo, Działalność naukowa i diagnostyczna Zakładu Genetyki Medycznej Instytutu Matki i Dziecka koncentruje się na zagadnieniach
Zakład Genetyki Medycznej OFERTA BADAŃ DIAGNOSTYCZNYCH 2006/2007 Szanowni Państwo, Działalność naukowa i diagnostyczna Zakładu Genetyki Medycznej Instytutu Matki i Dziecka koncentruje się na zagadnieniach
mikrosatelitarne, minisatelitarne i polimorfizm liczby kopii
 Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
NIFTY nieinwazyjny test prenatalny wykorzystujący sekwencjonowanie nowej generacji mgr inż. Łukasz Brejnakowski Country Sales Manager www.
 NIFTY nieinwazyjny test prenatalny wykorzystujący sekwencjonowanie nowej generacji mgr inż. Łukasz Brejnakowski Country Sales Manager www. test-nifty.com.pl BGI Beijing Genomics Institute Największe centrum
NIFTY nieinwazyjny test prenatalny wykorzystujący sekwencjonowanie nowej generacji mgr inż. Łukasz Brejnakowski Country Sales Manager www. test-nifty.com.pl BGI Beijing Genomics Institute Największe centrum
Spis treści Wykaz skrótów Wstęp Rozdział I. Status prawny podmiotu chronionego Rozdział II. Rodzice a dziecko poczęte
 Wykaz skrótów... 11 Wstęp... 15 Rozdział I. Status prawny podmiotu chronionego... 23 1. Uwagi wstępne... 23 2. Sytuacja dziecka poczętego w polskim prawie... 32 3. Status prawny dziecka poczętego de lege
Wykaz skrótów... 11 Wstęp... 15 Rozdział I. Status prawny podmiotu chronionego... 23 1. Uwagi wstępne... 23 2. Sytuacja dziecka poczętego w polskim prawie... 32 3. Status prawny dziecka poczętego de lege
Przydatność metody MLPA do szybkiej prenatalnej identyfikacji aneuploidii. Wyniki 409 badań diagnostycznych
 Przydatność metody MLPA do szybkiej prenatalnej identyfikacji aneuploidii. Wyniki 409 badań diagnostycznych Usefulness of MLPA technique for rapid prenatal detection of aneuploidy. Results of 409 diagnostic
Przydatność metody MLPA do szybkiej prenatalnej identyfikacji aneuploidii. Wyniki 409 badań diagnostycznych Usefulness of MLPA technique for rapid prenatal detection of aneuploidy. Results of 409 diagnostic
AmpliTest GMO screening-nos (Real Time PCR)
 AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Genomika praktyczna. Genomika praktyczna. Zakład Biochemii i Farmakogenomiki. prof. dr hab. Grażyna Nowicka. Rok IV. Semestr 8.
 Genomika praktyczna 1. Metryczka Nazwa Wydziału: Program kształcenia (kierunek studiów, poziom i profil kształcenia, forma studiów, np. Zdrowie publiczne I stopnia profil praktyczny, studia stacjonarne):
Genomika praktyczna 1. Metryczka Nazwa Wydziału: Program kształcenia (kierunek studiów, poziom i profil kształcenia, forma studiów, np. Zdrowie publiczne I stopnia profil praktyczny, studia stacjonarne):
PŁODU JAKO PRZYCZYNA UTRATY CIĄŻY - l e k. K a r o l i n y M a t u s z e w s k i e j
 60-535 Poznań ul. Polna 33 Polska Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Katedra Perinatologii i Ginekologii Klinika Perinatologii i Chorób Kobiecych Chair of Perinatology and Gynecology,
60-535 Poznań ul. Polna 33 Polska Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Katedra Perinatologii i Ginekologii Klinika Perinatologii i Chorób Kobiecych Chair of Perinatology and Gynecology,
TaqNova-RED. Polimeraza DNA RP20R, RP100R
 TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
Hybrydyzacja kwasów nukleinowych
 Hybrydyzacja kwasów nukleinowych Jaka jest lokalizacja tego genu na chromosomie? Jakie jest jego sąsiedztwo? Hybrydyzacja - powstawanie stabilnych struktur dwuniciowych z cząsteczek jednoniciowych o komplementarnych
Hybrydyzacja kwasów nukleinowych Jaka jest lokalizacja tego genu na chromosomie? Jakie jest jego sąsiedztwo? Hybrydyzacja - powstawanie stabilnych struktur dwuniciowych z cząsteczek jednoniciowych o komplementarnych
Podłoże molekularne NF1 i RASopatii. Możliwości diagnostyczne.
 Podłoże molekularne NF1 i RASopatii. Możliwości diagnostyczne. MONIKA G O S Z AKŁAD G ENETYKI MEDYCZ NEJ, I N STYTUT MATKI I DZIECKA SYMPOZJUM A LBA - JULIA WARSZAWA, 2-3.12.2017 Czym jest gen? Definicja:
Podłoże molekularne NF1 i RASopatii. Możliwości diagnostyczne. MONIKA G O S Z AKŁAD G ENETYKI MEDYCZ NEJ, I N STYTUT MATKI I DZIECKA SYMPOZJUM A LBA - JULIA WARSZAWA, 2-3.12.2017 Czym jest gen? Definicja:
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne. Pielęgniarstwo. I rok
 S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne Kod S-GUZR modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Genetyczne uwarunkowania
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne Kod S-GUZR modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Genetyczne uwarunkowania
Is subtelomeric MLPA test (Multiplex Ligation-Dependent Probe Amplification) useful in prenatal diagnosis of congenital malformations?
 Praca oryginalna Czy technika MLPA jest przydatna w diagnostyce prenatalnej aberracji regionów subtelomerowych u płodów z wadami rozwojowymi? Is subtelomeric MLPA test (Multiplex Ligation-Dependent Probe
Praca oryginalna Czy technika MLPA jest przydatna w diagnostyce prenatalnej aberracji regionów subtelomerowych u płodów z wadami rozwojowymi? Is subtelomeric MLPA test (Multiplex Ligation-Dependent Probe
Ultrasonograficzna ocena wzrastania płodów w I i II trymestrze ciąży w populacyjnym programie badań prenatalnych wad wrodzonych w regionie lubelskim
 Lek. med. Izabela Wnuczek-Mazurek Ultrasonograficzna ocena wzrastania płodów w I i II trymestrze ciąży w populacyjnym programie badań prenatalnych wad wrodzonych w regionie lubelskim Promotor: Dr hab.
Lek. med. Izabela Wnuczek-Mazurek Ultrasonograficzna ocena wzrastania płodów w I i II trymestrze ciąży w populacyjnym programie badań prenatalnych wad wrodzonych w regionie lubelskim Promotor: Dr hab.
PreMediCare Sp. z o.o., ul. Szamotulska 100/1, 60-566 Poznań tel./fax 061 8 164 224; e-mail: info@premedicare.pl www.premedicare.
 PreMediCare Sp. z o.o., ul. Szamotulska 100/1, 60-566 Poznań tel./fax 061 8 164 224; e-mail: info@premedicare.pl www.premedicare.pl Strona 1 z 12 Szanowni Państwo, z nieskrywaną przyjemnością i satysfakcją
PreMediCare Sp. z o.o., ul. Szamotulska 100/1, 60-566 Poznań tel./fax 061 8 164 224; e-mail: info@premedicare.pl www.premedicare.pl Strona 1 z 12 Szanowni Państwo, z nieskrywaną przyjemnością i satysfakcją
Chronimy Twoich bliskich badając geny. MIKROMACIERZE Medycyna genetyczna przyszłości
 Chronimy Twoich bliskich badając geny MIKROMACIERZE Medycyna genetyczna przyszłości Spis treści 1. Słowo wstępne 4 2. Mikromacierze kliniczne w diagnostyce genetycznej 5 3. Rozdzielczość technik stosowanych
Chronimy Twoich bliskich badając geny MIKROMACIERZE Medycyna genetyczna przyszłości Spis treści 1. Słowo wstępne 4 2. Mikromacierze kliniczne w diagnostyce genetycznej 5 3. Rozdzielczość technik stosowanych
Wprowadzenie do genetyki sądowej. Materiały biologiczne. Materiały biologiczne: prawidłowe zabezpieczanie śladów
 Wprowadzenie do genetyki sądowej 2013 Pracownia Genetyki Sądowej Katedra i Zakład Medycyny Sądowej Materiały biologiczne Inne: włosy z cebulkami, paznokcie możliwa degradacja - tkanki utrwalone w formalinie/parafinie,
Wprowadzenie do genetyki sądowej 2013 Pracownia Genetyki Sądowej Katedra i Zakład Medycyny Sądowej Materiały biologiczne Inne: włosy z cebulkami, paznokcie możliwa degradacja - tkanki utrwalone w formalinie/parafinie,
NIEPEŁNOSPRAWNOŚĆ INTELEKTUALNA. Anna Materna-Kiryluk Katedra i Zakład Genetyki Medycznej UM w Poznaniu. Niepełnosprawność intelektualna - definicja
 NIEPEŁNOSPRAWNOŚĆ INTELEKTUALNA Anna Materna-Kiryluk Katedra i Zakład Genetyki Medycznej UM w Poznaniu Niepełnosprawność intelektualna - definicja Istotnie niższe od przeciętnego funkcjonowanie intelektualne
NIEPEŁNOSPRAWNOŚĆ INTELEKTUALNA Anna Materna-Kiryluk Katedra i Zakład Genetyki Medycznej UM w Poznaniu Niepełnosprawność intelektualna - definicja Istotnie niższe od przeciętnego funkcjonowanie intelektualne
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne. Genetyka
 S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne Kod AG modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Genetyka Obowiązkowy Nauk
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma cje ogólne Kod AG modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Forma studiów Rok studiów Nazwa modułu Genetyka Obowiązkowy Nauk
Czy nowa technika kariotypowania molekularnego BACs-on-Beads TM zastąpi klasyczną cytogenetyczną diagnostykę prenatalną?
 Czy nowa technika kariotypowania molekularnego BACs-on-Beads TM zastąpi klasyczną cytogenetyczną diagnostykę prenatalną? Wyniki wstępne Will the new molecular karyotyping BACs-on-Beads TM technique replace
Czy nowa technika kariotypowania molekularnego BACs-on-Beads TM zastąpi klasyczną cytogenetyczną diagnostykę prenatalną? Wyniki wstępne Will the new molecular karyotyping BACs-on-Beads TM technique replace
This copy is for personal use only - distribution prohibited.
 Above all, the parents must understand that in undertaking prenatal diagnosis, they are under no implied obligation to terminate a pregnancy in the event that an abnormality is detected. Wstęp Inwazyjna
Above all, the parents must understand that in undertaking prenatal diagnosis, they are under no implied obligation to terminate a pregnancy in the event that an abnormality is detected. Wstęp Inwazyjna
Biologia medyczna, materiały dla studentów
 Jaka tam ewolucja. Zanim trafię na jednego myślącego, muszę stoczyć bitwę zdziewięcioma orangutanami Carlos Ruis Zafon Wierzbownica drobnokwiatowa Fitosterole, garbniki, flawonoidy Właściwości przeciwzapalne,
Jaka tam ewolucja. Zanim trafię na jednego myślącego, muszę stoczyć bitwę zdziewięcioma orangutanami Carlos Ruis Zafon Wierzbownica drobnokwiatowa Fitosterole, garbniki, flawonoidy Właściwości przeciwzapalne,
NIEPOWODZENIA ROZRODU
 NIEPOWODZENIA ROZRODU Dr n. med. Joanna Walczak- Sztulpa Katedra i Zakład Genetyki Medycznej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu NIEPOWODZENIA ROZRODU Niepłodność małżeńska Niepowodzenia
NIEPOWODZENIA ROZRODU Dr n. med. Joanna Walczak- Sztulpa Katedra i Zakład Genetyki Medycznej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu NIEPOWODZENIA ROZRODU Niepłodność małżeńska Niepowodzenia
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Krakowska Akademia im. Andrzeja Frycza Modrzewskiego. Karta przedmiotu. obowiązuje studentów, którzy rozpoczęli studia w roku akademickim 2014/2015
 Krakowska Akademia im. Andrzeja Frycza Modrzewskiego Karta przedmiotu Wydział Zdrowia i Nauk Medycznych obowiązuje studentów, którzy rozpoczęli studia w roku akademickim 014/015 Kierunek studiów: Dietetyka
Krakowska Akademia im. Andrzeja Frycza Modrzewskiego Karta przedmiotu Wydział Zdrowia i Nauk Medycznych obowiązuje studentów, którzy rozpoczęli studia w roku akademickim 014/015 Kierunek studiów: Dietetyka
TaqNovaHS. Polimeraza DNA RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925
 TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
Laboratoryjnej Genetyki Medycznej. Diagnostyka przedurodzeniowa. Koszt kursu: 335zł koszt dla wszystkich uczestników
 Oddział Kształcenia Podyplomowego Uprzejmie informuje, iż planowany jest kurs z zakresu: Laboratoryjnej Genetyki Medycznej w terminie 15-17 listopada 2010 r. Diagnostyka przedurodzeniowa Koszt kursu: 335zł
Oddział Kształcenia Podyplomowego Uprzejmie informuje, iż planowany jest kurs z zakresu: Laboratoryjnej Genetyki Medycznej w terminie 15-17 listopada 2010 r. Diagnostyka przedurodzeniowa Koszt kursu: 335zł
Tomasz Huć*, Rafał Sapierzyński 1, Jolanta Rygier 2, Barbara Pieńkowska-Grela 2
 Cytogenetics as a diagnostic approach in clinical veterinary medicine Huć T.*, Sapierzyński R. 1, Rygier J. 2, Pieńkowska-Grela B. 2, Department of Pathology and Veterinary Diagnostics, Faculty of Veterinary
Cytogenetics as a diagnostic approach in clinical veterinary medicine Huć T.*, Sapierzyński R. 1, Rygier J. 2, Pieńkowska-Grela B. 2, Department of Pathology and Veterinary Diagnostics, Faculty of Veterinary
PCR bez izolacji testujemy Direct PCR Kits od ThermoFisher Scientific
 PCR bez izolacji testujemy Direct PCR Kits od ThermoFisher Scientific Specjalnie dla Was przetestowaliśmy w naszym laboratorium odczynniki firmy Thermo Scientific umożliwiające przeprowadzanie reakcji
PCR bez izolacji testujemy Direct PCR Kits od ThermoFisher Scientific Specjalnie dla Was przetestowaliśmy w naszym laboratorium odczynniki firmy Thermo Scientific umożliwiające przeprowadzanie reakcji
Choroby genetycznie uwarunkowane edukacja i diagnostyka
 Instytut Matki i Dziecka realizuje projekt Choroby genetycznie uwarunkowane edukacja i diagnostyka współfinansowany z Europejskiego Funduszu Społecznego w ramach Programu Operacyjnego Wiedza Edukacja Rozwój
Instytut Matki i Dziecka realizuje projekt Choroby genetycznie uwarunkowane edukacja i diagnostyka współfinansowany z Europejskiego Funduszu Społecznego w ramach Programu Operacyjnego Wiedza Edukacja Rozwój
Powodzenie reakcji PCR wymaga właściwego doboru szeregu parametrów:
 Powodzenie reakcji PCR wymaga właściwego doboru szeregu parametrów: dobór warunków samej reakcji PCR (temperatury, czas trwania cykli, ilości cykli itp.) dobór odpowiednich starterów do reakcji amplifikacji
Powodzenie reakcji PCR wymaga właściwego doboru szeregu parametrów: dobór warunków samej reakcji PCR (temperatury, czas trwania cykli, ilości cykli itp.) dobór odpowiednich starterów do reakcji amplifikacji
Zasady i metody klasycznej i molekularnej diagnostyki cytogenetycznej. Beata Nowakowska,
 Zasady i metody klasycznej i molekularnej diagnostyki cytogenetycznej Beata Nowakowska, 24.10.2016 Cytogenetyka Dział genetyki zajmujący się badaniem chromosomów. Koncentruje się zarówno na kształcie jak
Zasady i metody klasycznej i molekularnej diagnostyki cytogenetycznej Beata Nowakowska, 24.10.2016 Cytogenetyka Dział genetyki zajmujący się badaniem chromosomów. Koncentruje się zarówno na kształcie jak
Badania nad występowaniem delecji chromosomu 22q11.2 i innych aberracji chromosomowych w wadach rozwojowych i zaburzeniach psychicznych.
 Prof. dr hab. n. med. Małgorzata Krajewska-Walasek Zakład Genetyki Medycznej Instytut Pomnik-Centrum Zdrowia Dziecka 04-730 Warszawa Aleja Dzieci Polskich 20 tel 22 815 74 52 fax 22 815 74 57 e-mail: genetyka@czd.pl
Prof. dr hab. n. med. Małgorzata Krajewska-Walasek Zakład Genetyki Medycznej Instytut Pomnik-Centrum Zdrowia Dziecka 04-730 Warszawa Aleja Dzieci Polskich 20 tel 22 815 74 52 fax 22 815 74 57 e-mail: genetyka@czd.pl
