WYTYCZNE DLA PRZEMYSŁU KOSMETYCZNEGO DOTYCZĄCE ZARZĄDZANIA ZGŁOSZENIAMI PRZYPADKÓW NIEPOŻĄDANYCH
|
|
|
- Wiktor Popławski
- 8 lat temu
- Przeglądów:
Transkrypt
1 WYTYCZNE DLA PRZEMYSŁU KOSMETYCZNEGO DOTYCZĄCE ZARZĄDZANIA ZGŁOSZENIAMI PRZYPADKÓW NIEPOŻĄDANYCH 1
2 Opracowano na podstawie: Colipa Guidelines on the Management of Undesirable Events przez: Polski Związek Pracodawców Prywatnych Branży Kosmetycznej oraz Polskie Stowarzyszenie Producentów Kosmetyków i Środków Czystości Warszawa, marzec
3 Spis treści: Część I Wprowadzenie 1. Wstęp 2. Definicje Część II Przypadki niepożądane 1. Zarządzanie zgłoszeniami 1.1. Przyjęcie zgłoszenia 1.2. Rejestracja założenie dokumentacji przypadku 1.3. Informacje i dokumentacja dotyczące zgłoszenia 1.4. Ocena i klasyfikacja przypadku 1.5. Zamknięcie zgłoszenia 1.6. Zapisywanie i wprowadzanie danych 1.7. Archiwizacja zgłoszeń 2. Dalsze działania 2.1. Analiza danych 2.2. Działania korygujące 3. Raportowanie danych 3.1. Raporty wewnętrzne 3.2. Włączenie informacji do dossier kosmetyku 3.3. Udostępnianie informacji o skutkach niepożądanych (wywołanych użyciem kosmetyku) 4. Ogólne zarządzanie oraz zgodność z prawem 4.1. Program zapewniania jakości 4.2. Standardowe procedury działania 4.3. Zlecanie wykonawcom zewnętrznym 4.4. Zgodność z prawem Część III Załączniki Załącznik 1. Poważny przypadek niepożądany /skutek niepożądany Załącznik 2. Metoda oceny związku przyczynowo skutkowego Załącznik 3. Przykładowa dokumentacja przypadku Załącznik 4. Przykład informacji, które należy dostarczyć w celu badania lekarskiego w przypadku zgłoszonej reakcji skórnej Załącznik 5. Akty prawne i bibliografia 3
4 Część I Wprowadzenie 4
5 1. Wstęp Zarządzanie zgłoszeniami dotyczącymi prawdziwych przypadków niepożądanych można określić jako działania związane z ich zgłaszaniem, oceną, interpretacją oraz zapobieganiem takim przypadkom. Dla producentów, zgłoszenia te odgrywają ważną rolę przy monitorowaniu produktów kosmetycznych po wprowadzeniu ich na rynek. Na mocy artykułu 7a ust. 1 lit. f) zmienionej dyrektywy Rady 76/768/EWG (dyrektywa kosmetyczna), producenci są obowiązani udostępniać właściwym organom nadzoru istniejące dane na temat niepożądanych skutków dla zdrowia ludzkiego wynikających z użycia produktu kosmetycznego. Dyrektywa 2003/15/EC, 7. poprawka do Dyrektywy Kosmetycznej stanowi ponadto, że dane te powinny być łatwo dostępne publicznie, zgodnie z artykułem 7a ust. (1) lit. (h) zmienionej Dyrektywy 76/768/EEC ( Bez uszczerbku dla ochrony, w szczególności tajemnicy handlowej oraz praw własności intelektualnej, Państwa Członkowskie zapewniają że informacja wymagana zgodnie z lit. f) jest łatwo dostępna publicznie za pośrednictwem wszystkich właściwych środków informacji, w tym środków elektronicznych ). Stowarzyszenie Colipa opracowało niniejsze wytyczne dotyczące zarządzania zgłoszeniami przypadków niepożądanych aby zminimalizować rozbieżności we wdrażaniu obowiązujących przepisów, przez dostarczenie branży kosmetycznej szczegółowych instrukcji w zakresie przyjmowania, gromadzenia, rejestracji oraz analizy zgłoszeń dotyczących prawdziwych przypadków niepożądanych. Konsekwentne generowanie wiarygodnych i sprawdzonych danych będzie kolejnym dowodem wysokiego poziomu bezpieczeństwa produktów, ułatwi monitorowanie produktów kosmetycznych wprowadzonych na rynek UE, a także będzie pomocne w procesie oceny bezpieczeństwa. Stosowanie się do niniejszych wytycznych będzie stanowiło gwarancję dla opinii publicznej oraz odpowiednich organów, że udostępniane dane są wiarygodne (zostały sprawdzone i podległy właściwej ocenie), oraz że przestrzegane są zasady ochrony prywatności konsumenta i zachowana jest tajemnica lekarska. Wdrażanie niniejszych wytycznych wymaga zarówno wsparcia wyższej kadry kierowniczej przedsiębiorstwa jak i zaangażowania pracowników wszystkich działów. Wyższa kadra kierownicza wszystkich szczebli powinna poinformować pracowników o zasadach postępowania wynikających z niniejszych wytycznych. Niniejsze wytyczne będą w razie potrzeby korygowane, przy uwzględnieniu postępu naukowego i technicznego oraz nowych uregulowań prawnych w tej dziedzinie. 5
6 2. Definicje pojęć W niniejszych wytycznych stosuje się następujące definicje: 2.1. Przypadek niepożądany Każde zdarzenie niekorzystne dla zdrowia człowieka, które: zostało dobrowolnie zgłoszone przez konsumentów, lekarzy lub właściwe organy krajowe i miało miejsce w czasie zwykłego lub dającego się przewidzieć użycia produktu kosmetycznego lub po takim użyciu, niekoniecznie ma związek z produktem. Początkowo każde zgłoszone zdarzenie należy traktować jako domniemany przypadek niepożądany. Można je uznać za prawdziwy przypadek niepożądany dopiero wtedy, gdy są dowody na to, że zdarzenie rzeczywiście miało miejsce. Informacje, które powinny być traktowane jako dowód to np. dane kontaktowe oraz osobowe konsumenta lub lekarza, opis reakcji (objawy natychmiastowe lub opóźnione), pełna identyfikacja produktu. Domniemany przypadek niepożądany jest dokładnie zdefiniowany co wyraźnie odróżnia go od anegdotycznych i nieprecyzyjnych skarg konsumentów czy doniesień opartych na odczuciach sensorycznych, jakich można oczekiwać po normalnym i dającym się przewidzieć użyciu konkretnego produktu kosmetycznego Skutek niepożądany Każdy prawdziwy przypadek niepożądany, który można w uzasadniony sposób przypisać normalnemu lub dającemu się przewidzieć użyciu danego produktu kosmetycznego zgodnie z Artykułem art. 7a ust. (1) lit. (f) Dyrektywy Kosmetycznej. Skutki niepożądane obejmują przeważnie reakcje alergiczne oraz podrażnienia skóry lub oczu (2) choć nie ograniczają się tylko do takich przypadków. W bardzo rzadkich sytuacjach skutek niepożądany może być poważny. Określenie poważny nie jest równoznaczne z określeniem ostry. Określenie ostry stosowane jest do opisu intensywności skutku (stopnia nasilenia) jak w skali: łagodny, umiarkowany lub ostry. Określenie poważny stosuje się do opisu stanu pacjenta/wyniku zdarzenia lub działania (patrz Załącznik 1) Ocena związku przyczynowo skutkowego Analiza związku przyczynowo skutkowego, dla poszczególnych przypadków, będąca próbą określenia prawdopodobieństwa, że dany produkt, zastosowany przez konsumenta, jest przyczyną prawdziwego przypadku niepożądanego. Ocena związku przyczynowo skutkowego ma więc charakter jednostkowy i odnosi się do skutków wywołanych u poszczególnych konsumentów. Nie wynika z niej ocena ryzyka produktu dla ogółu populacji. Prawdopodobieństwo związku przyczynowo skutkowego ustala się przez zastosowanie standardowej metody oceny związku przyczynowo skutkowego (patrz Załącznik 2). 6
7 Część II Przypadki niepożądane 7
8 1. Zarządzanie zgłoszeniami Każda firma powinna przygotować odpowiedni system zarządzania zgłoszeniami domniemanych przypadków niepożądanych aby zagwarantować: pełną odpowiedzialność za wytwarzane produkty kosmetyczne, podjęcie właściwych działań, kiedy jest to niezbędne. W szczególności każda firma powinna zadbać o: rejestrowanie wszystkich zgłoszeń domniemanych przypadków niepożądanych zgodnie z przepisami Dyrektywy Kosmetycznej, dokumentowanie, badanie, potwierdzanie oraz ocenę każdego zgłoszenia prawdziwego przypadku niepożądanego, klasyfikację udokumentowanych zgłoszeń w zależności od związku przyczynowo skutkowego, przechowywanie dokumentacji każdego zgłoszenia, ocenę częstotliwości, znaczenia medycznego oraz przyczyn udokumentowanych zgłoszeń, zapewnienie ochrony prywatności konsumentów i/lub lekarzy. określenie działań korygujących w razie potrzeby, zaktualizowanie dossier kosmetyku przez włączenie potwierdzonych informacji, udzielanie informacji na żądanie właściwych urzędów i/lub konsumentów zgodnie z wymogami Dyrektywy Kosmetycznej. W celu stworzenia i odpowiedniego funkcjonowania takiego systemu firma powinna wyznaczyć osobę odpowiedzialną za zgodne z niniejszymi wytycznymi zarządzanie informacjami o wszystkich zgłoszonych firmie domniemanych przypadkach niepożądanych. Osoba ta powinna posiadać doświadczenie w zakresie wszystkich elementów takiego systemu oraz, jeśli nie jest lekarzem, powinna mieć w razie konieczności możliwość konsultacji z odpowiednim specjalistą Przyjęcie zgłoszenia Poszczególne zgłoszenia od konsumentów, właściwych organów administracji lub lekarzy, mogą docierać do firmy w różny sposób (pocztą tradycyjną lub elektroniczną, telefonicznie, bezpośrednio) i być przyjmowane przez różnych pracowników. Producent powinien zadbać, aby wszystkie te zgłoszenia były bezzwłocznie przekazywane osobie odpowiedzialnej. Już podczas pierwszego kontaktu należy dołożyć starań aby uzyskać informacje niezbędne do założenia dokumentacji danego przypadku Rejestracja zgłoszenia założenie dokumentacji przypadku Dla każdego zgłoszenia dotyczącego domniemanego przypadku niepożądanego zakłada się dokumentację, jeśli zostaną pozyskane cztery rodzaje informacji: 8
9 charakter domniemanego przypadku niepożądanego data wystąpienia zdarzenia produkt kosmetyczny, który można zidentyfikować (np. nazwa produktu, kategoria, wariant, numer partii), konsument, którego można zidentyfikować (np. dane osobowe, wiek, płeć) lub inny zgłaszający, którego można zidentyfikować, jeśli nie jest to konsument (np. nazwa, adres). Każdej dokumentacji należy nadać unikalny numer identyfikacyjny. Takim numerem identyfikacyjnym powinny być oznaczane wszystkie dokumenty związane z danym przypadkiem Informacje i dokumentacja dotyczące zgłoszenia Wszystkie zgłoszenia domniemanych przypadków niepożądanych są cennym źródłem informacji i powinny być traktowane z należytą uwagą. Jednak dla celów niniejszych wytycznych oraz w kontekście wymogów Dyrektywy Kosmetycznej, pod uwagę brane są tylko te przypadki niepożądane, które są związane ze zwykłym lub dającym się przewidzieć użyciem produktu kosmetycznego. Zgłoszenia związane z nadużyciem lub niewłaściwym użyciem produktu 1, choć także istotne dla producentów kosmetyków, wykraczają poza zakres niniejszego dokumentu i powinny być klasyfikowane oddzielnie. Uzyskiwanie istotnych informacji Ze względu na brak szczegółów w niektórych zgłoszeniach konsumentów oraz w celu uzyskania wystarczających informacji, ważne jest aby osoba odpowiedzialna podejmowała odpowiednie decyzje przy rejestrowaniu i klasyfikowaniu zgłoszeń oraz rozstrzygała o sposobie dalszego postępowania z każdym zgłoszeniem. W kontaktach z konsumentami może być stosowany standardowy kwestionariusz co zagwarantuje uzyskanie jak największej ilości informacji już podczas pierwszego kontaktu. Informacje, które należy uzyskać przedstawiono w Załączniku 3. W razie konieczności należy utrzymać kontakt z konsumentem lub lekarzem prowadzącym w celu uzyskania informacji niezbędnych do uzupełnienia dokumentacji. Wszystkie informacje uzupełniające uzyskane podczas pierwszego lub następnych kontaktów muszą zostać udokumentowane, opatrzone datą i włączone do dokumentacji zgłoszenia. Dodatkowe informacje lub potwierdzenia lekarskie mogą okazać się zbędne dla nieprawdziwych przypadków niepożądanych. Za nieprawdziwy przypadek niepożądany można uznać taki, dla którego nie jest możliwe uzyskanie informacji, mogących być uznane za dowód, takich jak: tożsamość konsumenta lub lekarza i ich dane kontaktowe, opis reakcji (objawy oraz opóźnienie ich wystąpienia), pełna identyfikacja produktu, itp. 1 Użycie produktu niezgodne z jego przeznaczeniem oraz właściwymi warunkami stosowania i/lub wskazówkami dotyczącymi użycia i/lub nieuwzględniające ostrzeżeń podanych na produkcie. 9
10 Z drugiej strony, jeżeli przypadek niepożądany zostanie uznany za prawdziwy, należy dołożyć odpowiednich starań, aby uzyskać dobrowolną, świadomą zgodę na kontakt się z lekarzem prowadzącym leczenie albo uzyskać od konsumenta dodatkowe, informacje istotne z medycznego punktu widzenia. Pomoc ze strony firmy Jeśli to konieczne, firma powinna zachęcić konsumenta, żeby skonsultował się z lekarzem. Firma powinna również dostarczyć lekarzowi/dermatologowi informacje pomocne w postawieniu diagnozy dokumentację oraz/lub testy. Ogólne zalecenia dotyczące przypadków podejrzenia reakcji alergicznej, przedstawiono w Załączniku Ocena i klasyfikacja przypadku Ocena związku przyczynowo skutkowego powinna być przeprowadzana dla przypadków, które uznano za prawdziwe, oraz dla których zebrano wystarczającą ilość istotnych informacji, niezależnie od źródła tych informacji (bezpośrednie zgłoszenia konsumentów czy lekarzy). Wynik początkowej oceny może później ulec zmianie na skutek uzyskania dodatkowych informacji ze szczegółowych kwestionariuszy lub w wyniku badania lekarskiego. Ocena związku przyczynowo skutkowego może być uznana za ostateczną dopiero wtedy, gdy uzyskanie dalszych informacji, które mogłyby wpłynąć na jej zmianę stanie się mało prawdopodobne. Oceną związku przyczynowo skutkowego powinna zajmować się wykwalifikowana osoba z doświadczeniem w rozstrzyganiu reklamacji oraz odpowiednim przygotowaniem zawodowym. W niektórych przypadkach byłoby wskazane zwrócić się o pomoc w ocenie związku przyczynowo skutkowego do lekarza (zewnętrznego lub wewnątrzzakładowego), tak aby uzyskać dużą pewność co do wyniku. Powinno to zostać odnotowane w dokumentacji zgłoszenia oraz w dossier kosmetyku. Oceny związku przyczynowo skutkowego dokonuje się metodą przedstawioną w Załączniku 2. W wyniku takiej oceny związek przyczynowo skutkowy można określić na jednym z pięciu poziomów: bardzo prawdopodobny, prawdopodobny, wątpliwy, mało prawdopodobny oraz wykluczony. Możliwe, że w trakcie badania oraz oceny związku przyczynowo skutkowego zostanie ewidentnie ustalona inna przyczyna niż produkt kosmetyczny. W takim przypadku, związek pomiędzy skutkiem niepożądanym, a produktem uważany jest za wykluczony. Sklasyfikowanie skutku jako wątpliwy oraz mało prawdopodobny nie jest wystarczające do stwierdzenia, że przyczyną było użycie danego produktu kosmetycznego, a skutek taki nie musi być uwzględniany w dossier kosmetyku zgodnie z Artykułem 7 a (1) (f) Dyrektywy Kosmetycznej. Jednakże przypadki wątpliwe mogą dostarczyć cennych informacji więc powinny być starannie analizowane i w razie konieczności uwzględniane w dalszych ocenach przeprowadzanych przez firmę. 10
11 1.5. Zamknięcie zgłoszenia Rozpatrywanie danego zgłoszenia nie może być zakończone, dopóki firma ma powody uważać, że jest w stanie uzyskać dodatkowe istotne informacje, które mogłyby zmienić ocenę danego przypadku. Firma może zamknąć zgłoszenie po co najmniej dwóch udokumentowanych kontaktach, które pozostały bez odpowiedzi. Dokumentacja każdego zamkniętego zgłoszenia powinna być wyraźnie oznaczona nazwiskiem osoby odpowiedzialnej, która zajmowała się danym przypadkiem w firmie oraz opatrzona datą Zapisywanie i wprowadzanie danych Należy opracować określone procedury firmowe które będą wykorzystywane przy zapisywaniu, wprowadzaniu, kodowaniu i kontroli danych a także które zapewnią spójność i poufność informacji. Należy przy tym uwzględnić kilka ogólnych zasad: dokumentacja każdego zgłoszenia powinna być oznaczona niepowtarzalnym numerem identyfikacyjnym (patrz 1.2) w przypadku zwrotu produktu przez konsumenta, należy odpowiednio oznakować produkt i powiązać go z konkretnym głoszeniem do opisu skutków niepożądanych firma powinna stosować ujednoliconą terminologię medyczną Archiwizacja zgłoszeń Firma powinna określić jasne procedury archiwizacji i niszczenia bardzo starych dokumentów. Obowiązkiem każdej firmy, zgodnie z wymogami prawnymi obowiązującymi każde Państwo Członkowskie UE, jest ustalenie okresu przechowywania dokumentacji. Dla skutków niepożądanych okres ten powinien być dłuższy niż dla przypadków niepożądanych. 2. Dalsze działania 2.1. Analiza danych Problem związany z wpływem kosmetyku na zdrowie człowieka można zidentyfikować na podstawie jednego lub, co zdarza się częściej, kilku podobnych zgłoszeń dotyczących tego samego produktu. W razie konieczności należy przeprowadzić analizę tendencji uwzględniającą charakter, stopień nasilenia oraz częstotliwość skutków niepożądanych. Można także rozpatrywać inne czynniki, np. określone predyspozycje konsumentów, którzy doświadczyli skutków niepożądanych. 11
12 Po zidentyfikowaniu problemu związanego z wpływem kosmetyku na zdrowie człowieka, należy przeprowadzić dalsze badania, aby określić mechanizm możliwego występowania skutku niepożądanego. Częstotliwość skutków niepożądanych zwykle określa się poprzez dwa główne wskaźniki: określenie ilości nowych przypadków w danym okresie czasu, określenie wskaźnika występowania skutków niepożądanych wśród użytkowników. Wskaźnik ten wyznaczany jest przez ilość nowych zgłoszeń w danym okresie czasu w odniesieniu do ogólnej liczby sprzedanych kosmetyków lub ogólnej liczby użytkowników oszacowanej na podstawie sprzedaży kosmetyku (patrz 3.3) Działania korygujące Po przeprowadzeniu oceny danych, jeśli zajdzie potrzeba, należy podjąć kolejne działania ze względu na ochronę zdrowia konsumentów, takie, jak np. zmiana instrukcji użycia, ostrzeżeń, oznakowania na etykiecie czy modyfikacja receptury. 3. Raportowanie danych 3.1. Raporty wewnętrzne Każda firma powinna określenie rodzaje raportów, które mają być przekazywane przez wyznaczoną osobę odpowiedniemu kierownictwu. Na przykład w razie zidentyfikowania ważnego problemu dotyczącego bezpieczeństwa, mogą być potrzebne raporty szczegółowe i natychmiastowe. W innych przypadkach wystarczające będą raporty okresowe. Wszelkie nowo zaistniałe problemy dotyczące bezpieczeństwa powinny być w raportach szczególnie wyróżnione Włączenie informacji do dossier kosmetyku Zaklasyfikowanie zgłoszonych przypadków jako bardzo prawdopodobne lub prawdopodobne należy uznać za wystarczające do powiązania ich z użyciem konkretnego produktu. Przypadki takie muszą zostać włączone do dossier kosmetyku, zgodnie z Art. 7a ust 1 lit. f) Dyrektywy Kosmetycznej. Raporty te powinny być udostępniane na życzenie właściwym organom. Warto także dokonać rozróżnienia pomiędzy niepożądanymi skutkami udokumentowanymi przez lekarza, a doniesieniami opartymi wyłącznie na informacjach od konsumenta Udostępnianie informacji o skutkach niepożądanych (wywołanych użyciem kosmetyku) W nawiązaniu do art. 7bis ust. 1. lit. f) Dyrektywy Kosmetycznej 76/768/EEC, stowarzyszenie Colipa uzgodniło z Komisją oraz Państwami Członkowskimi, że dane o skutkach niepożądanych będą przedstawiane w jednolity sposób (2). W większości 12
13 przypadków ilość skutków niepożądanych podawana jest w przeliczeniu na sztuk produktu wprowadzonego do obrotu. W sytuacji, gdy rzeczywista ilość produktu wprowadzonego do obrotu jest mała (np. przy wprowadzeniu na rynek nowego produktu lub sprzedaży poprzez kanały dystrybucji selektywnej), takie obliczenia mogą zniekształcić rzeczywisty obraz sytuacji. W takich przypadkach można podać rzeczywistą liczbę skutków niepożądanych. 4. Zarządzanie ogólne i zgodność z prawem 4.1. Program zapewniania jakości Do zarządzania przypadkami niepożądanymi korzystne jest wdrożenie udokumentowanego systemu zapewniania jakości, który ma gwarantować, zgodność podejmowanych działań z zasadami opisanymi w niniejszych wytycznych Standardowe procedury działania Dla osób odpowiedzialnych za zarządzanie zgłoszeniami przypadków niepożądanych może się okazać pomocne zebranie w formie pisemnej standardowych procedur działania, określających zakres, organizację oraz zarządzanie tymi działaniami Zlecanie wykonawcom zewnętrznym Jeśli część lub całość działań opisanych w niniejszych wytycznych zostanie zlecona zewnętrznym wykonawcom, firma powinna pisemnie poinformować podwykonawcę o konieczności postępowania zgodnie z niniejszymi wytycznymi Zgodność z prawem W każdym przypadku obowiązkiem firmy jest przestrzeganie obowiązujących przepisów prawnych danego kraju. W szczególności firma oraz jej przedstawiciele powinni przestrzegać zobowiązań dotyczących gromadzenia, wykorzystywania i ujawniania danych osobowych, zgodnie z przepisami prawnymi danego kraju, wdrażającymi postanowienia unijnej dyrektywy o ochronie danych osobowych (4). Jeśli konsument nie wyrazi zgody na rejestrowanie jego danych osobowych, osoba odpowiedzialna powinna zaznaczyć w dokumentacji zgłoszenia, że jest to doniesienie konsumenta oraz że nazwisko i dane kontaktowe nie zostały ujawnione na jego prośbę. 13
14 Część III Załączniki 14
15 Załącznik 1. Poważny przypadek niepożądany / poważny skutek niepożądany W rozumieniu WHO (6) i ICH (7), poważnym przypadkiem niepożądanym/ poważnym skutkiem niepożądanym w przypadku leku, jest każdy przypadek/ skutek, który: kończy się zgonem, powoduje zagrożenia życia, powoduje trwałe/znaczne kalectwo, wymaga hospitalizacji lub ją przedłuża, powoduje wady wrodzone, wymaga interwencji aby zapobiec trwałemu upośledzeniu lub uszczerbkowi na zdrowiu. 15
16 Załącznik 2. Metoda oceny związku przyczynowo skutkowego Celem tej metody jest określenie punktu wyjścia do zrozumienia i jednolitego podejścia do dokonywania oceny przyczynowo skutkowej prawdziwych przypadków niepożądanych związanych z użyciem produktów kosmetycznych. Na początku każdy zgłaszany przypadek powinien być traktowany jako domniemany przypadek niepożądany. Status prawdziwego przypadku niepożądanego uzyskuje on dopiero wtedy, gdy pojawią się dowody na to, że zdarzenie rzeczywiście miało miejsce. Cechą charakterystyczną nieprawdziwego przypadku niepożądanego jest przede wszystkim brak możliwości uzyskania informacji, które byłyby uznane za dowód: tożsamość i dane kontaktowe konsumenta lub lekarza, opis reakcji, objawy i opóźnienie ich wystąpienia, pełna identyfikacja produktu itp. Należy zadbać o wykluczenie możliwości, że konsument dokonał zgłoszenia w złej wierze. Gdy nieprawdziwe przypadki niepożądane zostaną już odrzucone, należy przeprowadzić ocenę związku przyczynowo skutkowego niezależnie od źródła informacji (np. zgłoszenia bezpośrednio od konsumenta, lekarza itp.). W trakcie gromadzenia dalszych informacji ocena przypadku (prawdziwy czy nieprawdziwy) może ulec zmianie. Może się wówczas zdarzyć, że przypadek taki zostanie wyłączony z ostatecznej oceny związku przyczynowo skutkowego. Należy podkreślić, że właściwa ocena związku przyczynowo skutkowego może być przeprowadzona wyłącznie wtedy, gdy uzyskano pewne minimum informacji dotyczących historii zgłoszonego przypadku (w szczególności objawów i chronologii). W przeciwnym razie, przypadek należy uznać za niemożliwy do klasyfikacji. Dopóki można się spodziewać uzyskania dalszych informacji, które mogłyby zmienić ocenę przypadku sprawa nie może być uznana za zamkniętą. Firma może jednak zamknąć dane zgłoszenie jako przypadek nie dający się sklasyfikować po co najmniej dwóch udokumentowanych kontaktach, które pozostały bez odpowiedzi. Metoda oceny związku przyczynowo skutkowego oparta jest na analizie trzech kluczowych kryteriów: objawów kolejności zdarzeń (chronologii) badania lekarskiego lub ponownej ekspozycji. Wynik początkowej oceny każdego z tych kryteriów może ulec zmianie później ulec zmianie na skutek uzyskania dodatkowych informacji na podstawie szczegółowego kwestionariusza lub badania lekarskiego. Ocena związku przyczynowo skutkowego powinna być uznana za ostateczną dopiero wtedy, gdy uzyskanie dalszych informacji, które mogłyby zmienić ocenę tych trzech kryteriów, jest mało prawdopodobne. Poszczególnym kryteriom można przypisać różną wagę w ogólnej ocenie związku przyczynowo skutkowego w zależności od wiarygodności źródła informacji. Na przykład nieprecyzyjny opis charakteru objawów lub ich cech (np. kolejności występowania) przedstawiony przez konsumenta powinien być dokładnie zanalizowany w kontekście wyniku badania lekarskiego lub ponownej ekspozycji na produkt dokonanej pod kontrolą lekarza. Należy jednak podkreślić, że w ostatecznej ocenie związku przyczynowo skutkowego konieczne jest uwzględnienie wszystkich trzech kryteriów, przy sprecyzowaniu znaczenia każdego z nich. 16
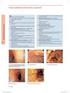
17 Za ocenę związku przyczynowo skutkowego powinna być odpowiedzialna wykwalifikowana osoba z doświadczeniem w rozstrzyganiu reklamacji oraz odpowiednim przygotowaniem zawodowym. W niektórych przypadkach przy ocenie związku przyczynowo skutkowego byłoby wskazane skorzystać z pomocy lekarza zewnętrznego lub wewnątrzzakładowego, aby uzyskać dużą pewność co do wyniku. Powinno to zostać odnotowane w dokumentacji przypadku oraz w dossier kosmetyku. Objawy Zgodność rodzaju i umiejscowienia objawów ze zgłoszonym użyciem produktu, oraz pod względem możliwych czynników zakłócających, które niezależnie mogły wywołać daną reakcję. Objaw typowy: objaw kliniczny oraz/lub biologiczny, którego można oczekiwać dla danego rodzaju produktu i który jest wystarczająco charakretystyczny, aby sugerować związek przyczynowo skutkowy. Objaw nietypowy: objaw kliniczny oraz/lub biologiczny, którego nie można oczekiwać dla danego rodzaju produktu i który nie jest wystarczająco charakterystyczny, aby sugerować związek przyczynowo skutkowy, lub który można wytłumaczyć innymi czynnikami (np. użyciem innych produktów, takich jak kosmetyki, leki, produkty gospodarstwa domowego itp., lub trwającą chorobą). Jeśli objawy nie są typowe (tj. nie sugerują skutku wywołanego przez dany produkt), końcowy wynik oceny związku przyczynowo skutkowego jest obniżany o jeden stopień ( bardzo prawdopodobny na prawdopodobny, prawdopodobny na wątpliwy, wątpliwy na mało prawdopodobny ). Przy ocenie poszczególnych przypadków należy wziąć pod uwagę pewne potencjalne czynniki, które mogą mieć wpływ lub przyczyny alternatywne 1. Nadwrażliwość na promieniowanie UVA Wiele osób wykazuje wrażliwość na działanie promieniowania UVA, szczególnie w okresie wczesnowiosennym. Wielopostaciowa wysypka wywołana promieniowaniem UVA występuje u ok. 14% kobiet i 7% mężczyzn. Objawy w postaci zmian skórnych można łatwo pomylić z łagodną reakcją alergiczną na miejscowo zastosowany produkt. 1 Wybrana literatura: a) Pao C, et al. (1994). Polimorficzna wysypka wywołana działaniem światła; powszechnie występująca w Australii oraz Anglii. Br J Dermatol. 130(1):62 4. b) Marzulli FN Maibach HI (1996) Podrażnienia wywołane przez światło, rozdział 16 opracowania Dermatotoxicology 5 th Ed, wyd. Marzulli FN & Maibach HI, pub Taylor Francis, Washington DC c) Lane Brown MM (2000) Nadwrażliwość na światło związana z preparatami ziołowymi zawierającymi dziurawiec złocisty na. Med J Austr, 172 (6): 302. d) Palanisamy A et al. (2003). Nadwrażliwość na światło u kobiet stosujących suplementy ziołowe zawierające żeń szeń, gorzknik kanadyjski (Hydrastis canadensis), pyłek pszczeli. J Toxicol Clin Toxicol, 41(6):
18 Przed dokonaniem jakiejkolwiek formalnej oceny związku przyczynowo skutkowego należy pamiętać o wykluczeniu nadwrażliwości na promienie UVA. Leki, zioła, żywność Istnieje wiele leków oraz produktów roślinnych, które przyjmowane doustnie mogą powodować fototoksyczność/fotoalergię skórną. Oto przykłady: antybiotyki: gryzeofulwina, kwas nalidyksowy, sulfanilamidy, tetracykliny. chemioterapeutyki: dakarbazyna, 5 fluorouracyl, winblastyna diuretyki: hydrochlorotiazyd, furosemid niesterydowe leki przeciwzapalne: benoksaprofen, naproksen, piroksikam, kwas tiaprofenowy, ketoprofen, diclofenac psoraleny (stosowane w chemioterapii UV): 8 metoksypsoralen, 5 metoksypsoralen porfiryny: hematoporfiryna. Inne leki: amiodaron, chloropromazyna, chlorochina, tolbutamid, leki z grupy antagonistów wapnia preparaty roślinne: dziurawiec, żeń szeń, gorzknik kanadyjski (Hydrastis canadensis), pyłek pszczeli niektóre produkty żywościowe: owoce morza, owoce i warzywa (np. pomidory, truskawki), przyprawy itp. Równoczesne stosowanie innych produktów (w tym produktów gospodarstwa domowego, kosmetyków itp.) Konsument może stosować kilka produktów w tym samym czasie. Jednocześnie może uważać, że tylko jeden z produktów był przyczyną przypadku niepożądanego. Należy to jednak dokładnie zbadać przy wykorzystaniu odpowiedniego kwestionariusza wykluczając zgłoszenia niepotwierdzone dowodami, jeśli są wątpliwości lub niejasności ze względu na równoczesne stosowanie kilku innych produktów kosmetycznych. Kolejność zdarzeń (chronologia) Kolejność zdarzeń opisuje chronologię użycia produktu i wystąpienia skutków niepożądanych, tj. czas pomiędzy zastosowaniem produktu a pojawieniem się objawów, oraz czas pomiędzy zaprzestaniem stosowania produktu a ustąpieniem objawów. Chronologia zgodna: kolejność zdarzeń pomiędzy zastosowaniem produktu a wystąpieniem objawów oraz pomiędzy zaprzestaniem stosowania produktu a ustąpieniem objawów jest prawdopodobna z medycznego punktu widzenia i może być przypisana użyciu danego produktu i wystąpieniu niepożądanego skutku. Chronologia niezgodna: kolejność zdarzeń pomiędzy wystąpieniem i/lub ustąpieniem objawów nie jest prawdopodobna z medycznego punktu widzenia i nie można jej w uzasadniony sposób oczekiwać w odniesieniu do danego użycia produktu i obserwowanego skutku niepożądanego. W takim przypadku związek pomiędzy skutkiem niepożądanym a produktem uznawany jest za wykluczony. 18
19 Chronologia nieoczywista: kolejność wystąpienia i/lub ustąpienia objawów, która z medycznego punktu widzenia nie jest oczekiwana i nie może być w typowy sposób przewidziana dla danego użycia produktu i skutku niepożądanego. Badanie lekarskie, ponowna ekspozycja Wyniki szczegółowych badań lekarskich oraz/lub wyniki kontrolowanej, ponownej ekspozycji na działanie podejrzanego produktu mogą przemawiać za związkiem przyczynowo skutkowym, mogą być niejednoznaczne lub mogą takiego związku nie potwierdzać. Może się także zdarzyć, że w trakcie tych badań zostanie wyraźnie ustalona inna przyczyna niż zastosowanie danego produktu kosmetycznego. W tym przypadku związek pomiędzy skutkiem niepożądanym a produktem uznawany jest za wykluczony. Kontrolowana ponowna ekspozycja na działanie produktu powinna uwzględniać warunki istniejące podczas wystąpienia przypadku niepożądanego. Jeżeli uzasadniona jest ponowna ekspozycja należy ją przeprowadzić pod nadzorem lekarskim przy użyciu specyficznych testów popartych protokołem kontrolnym. Wyniki ponownej aplikacji kosmetyku zgłoszone przez konsumenta mogą być uznane przez specjalistę z firmy za równoważne wynikom testu ponownej ekspozycji, jeśli są wystarczająco udokumentowane i przeprowadzone pod kontrolą. 19
20 Należy y podkreśli lić, że e oceny związku zku przyczynowo skutkowego można dokonać jedynie wtedy, gdy zgromadzono wystarczającą ilość informacji na temat danego przypadku (w szczególno lności objawów w i chronologii). Objawy Chronologia zgodna Chronologia niejasna lub nieznana Szczegółowe badania lekarskie i/lub testu ponownej ekspozycji dają wynik negatywny Szczegółowe badania lekarskie i/lub test ponownej ekspozycji nie zostały przeprowadzone lub dają wynik niejednoznaczny Szczegółowe badania lekarskie i/lub test ponownej ekspozycji dają wynik pozytywny Szczegółowe badania lekarskie i/lub test ponownej ekspozycji dają wynik pozytywny Szczegółowe badania lekarskie i/lub test ponownej ekspozycji nie zostały przeprowadzone lub dają wynik niejednoznaczny Szczegółowe badania lekarskie i/lub testu ponownej dają wynik ekspozycji negatywny bardzo prawdopodobny prawdopodobny prawdopodobny wątpliwy wątpliwy Objawy: Jeśli objawy nie są s typowe (tj. nie sugerują skutku wywołanego przez dany produkt), końcowy wynik oceny związku zku przyczynowo skutkowego jest obniżany o jeden stopień (bardzo prawdopodobny na prawdopodobny, prawdopodobny na wątpliwy, w wątpliwy na mało prawdopodobny). mało prawdopodobny Chronologia zgodna: kolejność zdarzeń pomiędzy użyciem u produktu i wystąpieniem objawów, w, jak równie r wnież pomiędzy zaprzestaniem używania u produktu i ustąpieniem objawów w jest prawdopodobna z medycznego punktu widzenia i jej przewidywanie dla d takiego użycia u produktu i skutku niepożą żądanego jest uzasadnione. Jeśli chronologia nie jest zgodna, związek zek przyczynowo skutkowy jest wykluczony. Test ponownej ekspozycji: : kontrolowana, ponowna ekspozycja na działanie anie produktu, uwzględniaj dniająca warunki ekspozycji istniejące podczas wystąpienia przypadku niepożą żądanego. 20
CosmetoVigilance jak zaimplementować wymagania prawne związane z raportowaniem zdarzeń niepożądanych. Izabela Słowik
 CosmetoVigilance jak zaimplementować wymagania prawne związane z raportowaniem zdarzeń niepożądanych Izabela Słowik REGULACJE PRAWNE DOTYCZACE COSMETOVIGILANCE: Rozporządzenie Parlamentu Europejskiego
CosmetoVigilance jak zaimplementować wymagania prawne związane z raportowaniem zdarzeń niepożądanych Izabela Słowik REGULACJE PRAWNE DOTYCZACE COSMETOVIGILANCE: Rozporządzenie Parlamentu Europejskiego
Formularz pojedynczego zgłoszenia zdarzenia niepożądanego i sytuacji specjalnej (ICSR Adverse Event and Special Situation Form)
 Instrukcja: Ten formularz może być użyty do zgłaszania zdarzeń niepożądanych i/lub sytuacji specjalnych z okresu po wprowadzeniu do obrotu wliczając, ale nie ograniczając się do raportów spontanicznych
Instrukcja: Ten formularz może być użyty do zgłaszania zdarzeń niepożądanych i/lub sytuacji specjalnych z okresu po wprowadzeniu do obrotu wliczając, ale nie ograniczając się do raportów spontanicznych
Wytyczne w sprawie rozpatrywania skarg w sektorze papierów wartościowych i bankowości
 04/10/2018 JC 2018 35 Wytyczne w sprawie rozpatrywania skarg w sektorze papierów wartościowych i bankowości Wytyczne w sprawie rozpatrywania skarg w sektorze papierów wartościowych (ESMA) i bankowości
04/10/2018 JC 2018 35 Wytyczne w sprawie rozpatrywania skarg w sektorze papierów wartościowych i bankowości Wytyczne w sprawie rozpatrywania skarg w sektorze papierów wartościowych (ESMA) i bankowości
WYTYCZNE W SPRAWIE ZGŁASZANIA CIĘŻKICH DZIAŁAŃ
 Ref. Ares(2015)4460770-21/10/2015 WYTYCZNE W SPRAWIE ZGŁASZANIA CIĘŻKICH DZIAŁAŃ NIEPOŻĄDANYCH 1. Wprowadzenie Rozporządzenie (WE) nr 1223/2009 dotyczące produktów kosmetycznych ( rozporządzenie kosmetyczne
Ref. Ares(2015)4460770-21/10/2015 WYTYCZNE W SPRAWIE ZGŁASZANIA CIĘŻKICH DZIAŁAŃ NIEPOŻĄDANYCH 1. Wprowadzenie Rozporządzenie (WE) nr 1223/2009 dotyczące produktów kosmetycznych ( rozporządzenie kosmetyczne
JC May Joint Committee Wytyczne dotyczące obsługi skarg dla sektora papierów wartościowych (ESMA) i sektora bankowości (EUNB)
 JC 2014 43 27 May 2014 Joint Committee Wytyczne dotyczące obsługi skarg dla sektora papierów wartościowych (ESMA) i sektora bankowości (EUNB) 1 Spis treści Wytyczne dotyczące obsługi skarg dla sektora
JC 2014 43 27 May 2014 Joint Committee Wytyczne dotyczące obsługi skarg dla sektora papierów wartościowych (ESMA) i sektora bankowości (EUNB) 1 Spis treści Wytyczne dotyczące obsługi skarg dla sektora
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Wytyczne w sprawie. rozpatrywania skarg przez zakłady. ubezpieczeń
 EIOPA-BoS-12/069 PL Wytyczne w sprawie rozpatrywania skarg przez zakłady ubezpieczeń 1/8 1. Wytyczne Wprowadzenie 1. Zgodnie z art. 16 rozporządzenia w sprawie ustanowienia Europejskiego Urzędu Nadzoru
EIOPA-BoS-12/069 PL Wytyczne w sprawie rozpatrywania skarg przez zakłady ubezpieczeń 1/8 1. Wytyczne Wprowadzenie 1. Zgodnie z art. 16 rozporządzenia w sprawie ustanowienia Europejskiego Urzędu Nadzoru
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
NADZÓR NAD BEZPIECZEŃSTWEM FARMAKOTERAPII PHARMACOVIGILANCE
 NADZÓR NAD BEZPIECZEŃSTWEM FARMAKOTERAPII PHARMACOVIGILANCE WZZ HERBAPOL S.A. LEK. MED. ANETTA WARZOCHA, QPPV CEL SZKOLENIA Omówienie tematu Pharmacovigilance Omówienie zasad zgłaszania podejrzenia o wystąpieniu
NADZÓR NAD BEZPIECZEŃSTWEM FARMAKOTERAPII PHARMACOVIGILANCE WZZ HERBAPOL S.A. LEK. MED. ANETTA WARZOCHA, QPPV CEL SZKOLENIA Omówienie tematu Pharmacovigilance Omówienie zasad zgłaszania podejrzenia o wystąpieniu
Wytyczne w sprawie rozpatrywania skarg przez pośredników ubezpieczeniowych
 EIOPA(BoS(13/164 PL Wytyczne w sprawie rozpatrywania skarg przez pośredników ubezpieczeniowych EIOPA WesthafenTower Westhafenplatz 1 60327 Frankfurt Germany Phone: +49 69 951119(20 Fax: +49 69 951119(19
EIOPA(BoS(13/164 PL Wytyczne w sprawie rozpatrywania skarg przez pośredników ubezpieczeniowych EIOPA WesthafenTower Westhafenplatz 1 60327 Frankfurt Germany Phone: +49 69 951119(20 Fax: +49 69 951119(19
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE
 ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
HACCP- zapewnienie bezpieczeństwa zdrowotnego żywności Strona 1
 CO TO JEST HACCP? HACCP ANALIZA ZAGROŻEŃ I KRYTYCZNE PUNKTY KONTROLI HAZARD ryzyko, niebezpieczeństwo, potencjalne zagrożenie przez wyroby dla zdrowia konsumenta ANALYSIS ocena, analiza, kontrola zagrożenia
CO TO JEST HACCP? HACCP ANALIZA ZAGROŻEŃ I KRYTYCZNE PUNKTY KONTROLI HAZARD ryzyko, niebezpieczeństwo, potencjalne zagrożenie przez wyroby dla zdrowia konsumenta ANALYSIS ocena, analiza, kontrola zagrożenia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
I. INFORMACJE O PACJENCIE II. INFORMACJE O PRODUKCIE LECZNICZYM PODEJRZEWANYM O SPOWODOWANIE DZIAŁANIA
 FORMULARZ ZGŁOSZENIA DZIAŁANIA NIEPOŻĄDANEGO DLA FACHOWEGO PRACOWNIKA SŁUŻBY ZDROWIA RAPORT: WSTĘPNY UZUPEŁNIAJĄCY I. INFORMACJE O PACJENCIE INICJAŁY PACJENTA KRAJ WYSTĄPIENIA DZIAŁANIA NIEPOŻĄDANEGO DATA
FORMULARZ ZGŁOSZENIA DZIAŁANIA NIEPOŻĄDANEGO DLA FACHOWEGO PRACOWNIKA SŁUŻBY ZDROWIA RAPORT: WSTĘPNY UZUPEŁNIAJĄCY I. INFORMACJE O PACJENCIE INICJAŁY PACJENTA KRAJ WYSTĄPIENIA DZIAŁANIA NIEPOŻĄDANEGO DATA
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania
 Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
Aneks I. Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Komisji Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych
 PARLAMENT EUROPEJSKI 2009-2014 Komisja Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych 15.3.2013 2012/0192(COD) PROJEKT OPINII Komisji Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych
PARLAMENT EUROPEJSKI 2009-2014 Komisja Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych 15.3.2013 2012/0192(COD) PROJEKT OPINII Komisji Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych
Implementacja przepisów dotyczących zgłoszeń od pacjentów w Polsce
 URZĄD REJESTRACJI PRODUKTÓW LECZNICZYCH, WYROBÓW MEDYCZNYCH I PRODUKTÓW BIOBÓJCZYCH Implementacja przepisów dotyczących zgłoszeń od pacjentów w Polsce Andrzej Czesławski Dyrektor Departament Monitorowania
URZĄD REJESTRACJI PRODUKTÓW LECZNICZYCH, WYROBÓW MEDYCZNYCH I PRODUKTÓW BIOBÓJCZYCH Implementacja przepisów dotyczących zgłoszeń od pacjentów w Polsce Andrzej Czesławski Dyrektor Departament Monitorowania
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 lutego 2011 r.
 Dziennik Ustaw Nr 33 2534 Poz. 167 167 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 lutego 2011 r. w sprawie kryteriów raportowania zdarzeń z wyrobami, sposobu zgłaszania incydentów medycznych i działań
Dziennik Ustaw Nr 33 2534 Poz. 167 167 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 lutego 2011 r. w sprawie kryteriów raportowania zdarzeń z wyrobami, sposobu zgłaszania incydentów medycznych i działań
P6_TA-PROV(2005)0329 Ochrona zdrowia i bezpieczeństwo pracy: narażenie pracowników na promieniowanie optyczne ***II
 P6_TA-PROV(2005)0329 Ochrona zdrowia i bezpieczeństwo pracy: narażenie pracowników na promieniowanie optyczne ***II Rezolucja legislacyjna Parlamentu Europejskiego w sprawie wspólnego stanowiska Rady mającego
P6_TA-PROV(2005)0329 Ochrona zdrowia i bezpieczeństwo pracy: narażenie pracowników na promieniowanie optyczne ***II Rezolucja legislacyjna Parlamentu Europejskiego w sprawie wspólnego stanowiska Rady mającego
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Wytyczne. dotyczące procedur składania skarg w związku z możliwymi naruszeniami przepisów drugiej dyrektywy w sprawie usług płatniczych EBA/GL/2017/13
 EBA/GL/2017/13 05/12/2017 Wytyczne dotyczące procedur składania skarg w związku z możliwymi naruszeniami przepisów drugiej dyrektywy w sprawie usług płatniczych 1. Zgodność i obowiązki sprawozdawcze Status
EBA/GL/2017/13 05/12/2017 Wytyczne dotyczące procedur składania skarg w związku z możliwymi naruszeniami przepisów drugiej dyrektywy w sprawie usług płatniczych 1. Zgodność i obowiązki sprawozdawcze Status
Monitorowanie systemów IT
 Monitorowanie systemów IT Zmiany w Ustawie o Ochronie Danych Osobowych Adam Wódz CISSP QSA ASV Business Unit Director Security Solution Cybercom Poland Agenda Co i kiedy zmieni się w ustawie o ochronie
Monitorowanie systemów IT Zmiany w Ustawie o Ochronie Danych Osobowych Adam Wódz CISSP QSA ASV Business Unit Director Security Solution Cybercom Poland Agenda Co i kiedy zmieni się w ustawie o ochronie
WYTYCZNE W SPRAWIE TESTÓW, OCEN LUB DZIAŁAŃ MOGĄCYCH DOPROWADZIĆ DO ZASTOSOWANIA ŚRODKÓW WSPARCIA EBA/GL/2014/ września 2014 r.
 EBA/GL/2014/09 22 września 2014 r. Wytyczne w sprawie rodzajów testów, ocen lub działań mogących doprowadzić do zastosowania środków wsparcia zgodnie z art. 32 ust. 4 lit. d) ppkt (iii) dyrektywy w sprawie
EBA/GL/2014/09 22 września 2014 r. Wytyczne w sprawie rodzajów testów, ocen lub działań mogących doprowadzić do zastosowania środków wsparcia zgodnie z art. 32 ust. 4 lit. d) ppkt (iii) dyrektywy w sprawie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
14. Sprawdzanie funkcjonowania systemu zarządzania bezpieczeństwem i higieną pracy
 14. Sprawdzanie funkcjonowania systemu zarządzania bezpieczeństwem i higieną pracy 14.1. Co to jest monitorowanie bezpieczeństwa i higieny pracy? Funkcjonowanie systemu zarządzania bezpieczeństwem i higieną
14. Sprawdzanie funkcjonowania systemu zarządzania bezpieczeństwem i higieną pracy 14.1. Co to jest monitorowanie bezpieczeństwa i higieny pracy? Funkcjonowanie systemu zarządzania bezpieczeństwem i higieną
Organizacja leczenia krwią i jej składnikami w podmiotach leczniczych
 Organizacja leczenia krwią i jej składnikami w podmiotach leczniczych Rozporządzenie Ministra Zdrowia z dnia 16 października 2017 r. w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych
Organizacja leczenia krwią i jej składnikami w podmiotach leczniczych Rozporządzenie Ministra Zdrowia z dnia 16 października 2017 r. w sprawie leczenia krwią i jej składnikami w podmiotach leczniczych
ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE)
 10.11.2015 L 293/15 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2015/1973 z dnia 8 lipca 2015 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 514/2014 przepisami szczegółowymi dotyczącymi
10.11.2015 L 293/15 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2015/1973 z dnia 8 lipca 2015 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 514/2014 przepisami szczegółowymi dotyczącymi
Projekt rozporządzenia Ministra Zdrowia. w sprawie sposobu i zakresu kontroli systemu monitorowania bezpieczeństwa stosowania produktów leczniczych
 Projekt rozporządzenia Ministra Zdrowia w sprawie sposobu i zakresu kontroli systemu monitorowania bezpieczeństwa stosowania produktów leczniczych Przekazany do uzgodnień zewnętrznych w dniu 26 kwietnia
Projekt rozporządzenia Ministra Zdrowia w sprawie sposobu i zakresu kontroli systemu monitorowania bezpieczeństwa stosowania produktów leczniczych Przekazany do uzgodnień zewnętrznych w dniu 26 kwietnia
Krajowy System Informowania o Kosmetykach. mgr Katarzyna Kobza - Sindlewska
 Krajowy System Informowania o Kosmetykach mgr Katarzyna Kobza - Sindlewska Art. 8 Tworzy się Krajowy System Informowania o Kosmetykach wprowadzonych do obrotu, zwany dalej krajowym systemem W krajowym
Krajowy System Informowania o Kosmetykach mgr Katarzyna Kobza - Sindlewska Art. 8 Tworzy się Krajowy System Informowania o Kosmetykach wprowadzonych do obrotu, zwany dalej krajowym systemem W krajowym
PROJEKT BEZPIECZNEJ PRAKTYKI MEDYCZNEJ
 Konsultant Krajowy w dz. Pielęgniarstwa dr n. biol. Grażyna Kruk- Kupiec Samodzielny Publiczny Wojewódzki Szpital Chirurgii Urazowej, Piekary Śląskie 41-940 ul. Bytomska 62, Tel. 032 3934 299 Piekary Śląskie
Konsultant Krajowy w dz. Pielęgniarstwa dr n. biol. Grażyna Kruk- Kupiec Samodzielny Publiczny Wojewódzki Szpital Chirurgii Urazowej, Piekary Śląskie 41-940 ul. Bytomska 62, Tel. 032 3934 299 Piekary Śląskie
Formularz pojedynczego zgłoszenia zdarzenia niepożądanego i sytuacji specjalnej (ICSR Adverse Event and Special Situation Form)
 W przypadku badań nieinterwencyjnych (NIS), kierownicy badań postępują zgodnie z instrukcjami poniżej i usuwają tę stronę przed wysłaniem do badaczy: Zmodyfikuj następujące pole przed wysłaniem tego formularza
W przypadku badań nieinterwencyjnych (NIS), kierownicy badań postępują zgodnie z instrukcjami poniżej i usuwają tę stronę przed wysłaniem do badaczy: Zmodyfikuj następujące pole przed wysłaniem tego formularza
WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO DO WDROŻENIA PRZEZ KRAJE CZŁONKOWSKIE
 ANEKS 1 WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO DO WDROŻENIA PRZEZ KRAJE CZŁONKOWSKIE Kraj członkowski musi upewnić się ze wszystkie warunki lub ograniczenia
ANEKS 1 WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO DO WDROŻENIA PRZEZ KRAJE CZŁONKOWSKIE Kraj członkowski musi upewnić się ze wszystkie warunki lub ograniczenia
ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE)
 L 293/6 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2015/1971 z dnia 8 lipca 2015 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1306/2013 przepisami szczegółowymi dotyczącymi zgłaszania
L 293/6 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2015/1971 z dnia 8 lipca 2015 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1306/2013 przepisami szczegółowymi dotyczącymi zgłaszania
5. Planowanie działań w systemie zarządzania bezpieczeństwem i higieną pracy
 5. Planowanie działań w systemie zarządzania bezpieczeństwem i higieną pracy 5.1. Jakie znaczenie ma planowanie działań w systemie zarządzania bezpieczeństwem i higieną pracy? Planowanie jest ważnym elementem
5. Planowanie działań w systemie zarządzania bezpieczeństwem i higieną pracy 5.1. Jakie znaczenie ma planowanie działań w systemie zarządzania bezpieczeństwem i higieną pracy? Planowanie jest ważnym elementem
Dziennik Urzędowy Unii Europejskiej
 6.1.2016 L 3/41 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/9 z dnia 5 stycznia 2016 r. w sprawie wspólnego przedkładania i udostępniania danych zgodnie z rozporządzeniem (WE) nr 1907/2006 Parlamentu Europejskiego
6.1.2016 L 3/41 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/9 z dnia 5 stycznia 2016 r. w sprawie wspólnego przedkładania i udostępniania danych zgodnie z rozporządzeniem (WE) nr 1907/2006 Parlamentu Europejskiego
(Akty o charakterze nieustawodawczym) ROZPORZĄDZENIA
 10.11.2015 L 293/1 II (Akty o charakterze nieustawodawczym) ROZPORZĄDZENIA ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2015/1970 z dnia 8 lipca 2015 r. uzupełniające rozporządzenie Parlamentu Europejskiego
10.11.2015 L 293/1 II (Akty o charakterze nieustawodawczym) ROZPORZĄDZENIA ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2015/1970 z dnia 8 lipca 2015 r. uzupełniające rozporządzenie Parlamentu Europejskiego
ROZPORZĄDZENIE PARLAMENTU EUROPEJSKIEGO I RADY (WE) NR 2232/96. z dnia 28 października 1996 r.
 Dz.U.UE.L.96.299.1 Dz.U.UE-sp.13-18-42 ROZPORZĄDZENIE PARLAMENTU EUROPEJSKIEGO I RADY (WE) NR 2232/96 z dnia 28 października 1996 r. ustanawiające wspólnotową procedurę dla substancji aromatycznych używanych
Dz.U.UE.L.96.299.1 Dz.U.UE-sp.13-18-42 ROZPORZĄDZENIE PARLAMENTU EUROPEJSKIEGO I RADY (WE) NR 2232/96 z dnia 28 października 1996 r. ustanawiające wspólnotową procedurę dla substancji aromatycznych używanych
Formularz pojedynczego zgłoszenia zdarzenia niepożądanego i sytuacji specjalnej
 W przypadku badań nieinterwencyjnych (NIS), kierownicy badań postępują zgodnie z instrukcjami poniżej i usuwają tę stronę przed wysłaniem do badaczy: Zmodyfikuj następujące pole przed wysłaniem tego formularza
W przypadku badań nieinterwencyjnych (NIS), kierownicy badań postępują zgodnie z instrukcjami poniżej i usuwają tę stronę przed wysłaniem do badaczy: Zmodyfikuj następujące pole przed wysłaniem tego formularza
(Tekst mający znaczenie dla EOG)
 30.12.2017 L 351/55 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2017/2468 z dnia 20 grudnia 2017 r. określające wymogi administracyjne i naukowe w odniesieniu do tradycyjnej żywności z państw trzecich zgodnie
30.12.2017 L 351/55 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2017/2468 z dnia 20 grudnia 2017 r. określające wymogi administracyjne i naukowe w odniesieniu do tradycyjnej żywności z państw trzecich zgodnie
Wytyczne dotyczące rozporządzenia w sprawie nadużyć na rynku Osoby, do których są adresowane badania rynku
 Wytyczne dotyczące rozporządzenia w sprawie nadużyć na rynku Osoby, do których są adresowane badania rynku 10/11/2016 ESMA/2016/1477 PL Spis treści 1 Zakres... 3 2 Odniesienia, skróty i definicje... 3
Wytyczne dotyczące rozporządzenia w sprawie nadużyć na rynku Osoby, do których są adresowane badania rynku 10/11/2016 ESMA/2016/1477 PL Spis treści 1 Zakres... 3 2 Odniesienia, skróty i definicje... 3
Poradnik dotyczący interpretacji spontanicznych zgłoszeń przypadków podejrzewanych działań niepożądanych leków
 30 styczeń 2017 r. Wydział ds. inspekcji, nadzoru nad bezpieczeństwem stosowania produktów leczniczych u ludzi i komisji EMA/749446/2016 Zmiana nr 1* Poradnik dotyczący interpretacji spontanicznych zgłoszeń
30 styczeń 2017 r. Wydział ds. inspekcji, nadzoru nad bezpieczeństwem stosowania produktów leczniczych u ludzi i komisji EMA/749446/2016 Zmiana nr 1* Poradnik dotyczący interpretacji spontanicznych zgłoszeń
OŚWIADCZENIE O OCHRONIE PRYWATNOŚCI
 OŚWIADCZENIE O OCHRONIE PRYWATNOŚCI Niniejsze oświadczenie dotyczy przetwarzania danych osobowych w kontekście prowadzonych przez Komisję dochodzeń w sprawie pomocy państwa oraz związanych z nimi działań
OŚWIADCZENIE O OCHRONIE PRYWATNOŚCI Niniejsze oświadczenie dotyczy przetwarzania danych osobowych w kontekście prowadzonych przez Komisję dochodzeń w sprawie pomocy państwa oraz związanych z nimi działań
dotyczące ukrytego wsparcia dla transakcji sekurytyzacyjnych
 EBA/GL/2016/08 24/11/2016 Wytyczne dotyczące ukrytego wsparcia dla transakcji sekurytyzacyjnych 1 1. Zgodność i obowiązki sprawozdawcze Status niniejszych wytycznych 1. Niniejszy dokument zawiera wytyczne
EBA/GL/2016/08 24/11/2016 Wytyczne dotyczące ukrytego wsparcia dla transakcji sekurytyzacyjnych 1 1. Zgodność i obowiązki sprawozdawcze Status niniejszych wytycznych 1. Niniejszy dokument zawiera wytyczne
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) / z dnia r.
 KOMISJA EUROPEJSKA Bruksela, dnia 20.12.2017 r. C(2017) 8874 final ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) / z dnia 20.12.2017 r. określające wymogi administracyjne i naukowe dotyczące wniosków, o których
KOMISJA EUROPEJSKA Bruksela, dnia 20.12.2017 r. C(2017) 8874 final ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) / z dnia 20.12.2017 r. określające wymogi administracyjne i naukowe dotyczące wniosków, o których
Raport bezpieczeństwa produktu kosmetycznego zawiera co najmniej następujące elementy: CZĘŚĆ A
 Zgodnie z załącznikiem I ROZPORZĄDZENIA PARLAMENTU EUROPEJSKIEGO I RADY (WE) NR 1223/2009 dotyczące produktów kosmetycznych zawiera co najmniej następujące elementy: CZĘŚĆ A Informacje na temat bezpieczeństwa
Zgodnie z załącznikiem I ROZPORZĄDZENIA PARLAMENTU EUROPEJSKIEGO I RADY (WE) NR 1223/2009 dotyczące produktów kosmetycznych zawiera co najmniej następujące elementy: CZĘŚĆ A Informacje na temat bezpieczeństwa
PARLAMENT EUROPEJSKI 2009-2014. Komisji Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych
 PARLAMENT EUROPEJSKI 2009-2014 Komisja Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych 21.11.2013 2013/0165(COD) PROJEKT OPINII Komisji Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych
PARLAMENT EUROPEJSKI 2009-2014 Komisja Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych 21.11.2013 2013/0165(COD) PROJEKT OPINII Komisji Wolności Obywatelskich, Sprawiedliwości i Spraw Wewnętrznych
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Opinia 3/2018. w sprawie projektu wykazu sporządzonego przez właściwy bułgarski organ nadzorczy. dotyczącego
 Opinia 3/2018 w sprawie projektu wykazu sporządzonego przez właściwy bułgarski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 3/2018 w sprawie projektu wykazu sporządzonego przez właściwy bułgarski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
PL Zjednoczona w różnorodności PL A8-0046/291. Poprawka 291 Mireille D'Ornano w imieniu grupy ENF
 7.3.2016 A8-0046/291 Poprawka 291 Mireille D'Ornano w imieniu grupy ENF Sprawozdanie Françoise Grossetête Weterynaryjne produkty lecznicze COM(2014)0558 C8-0164/2014 2014/0257(COD) A8-0046/2016 Wniosek
7.3.2016 A8-0046/291 Poprawka 291 Mireille D'Ornano w imieniu grupy ENF Sprawozdanie Françoise Grossetête Weterynaryjne produkty lecznicze COM(2014)0558 C8-0164/2014 2014/0257(COD) A8-0046/2016 Wniosek
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
PROJEKT ZAŁOŻEŃ PROJEKTU USTAWY O ZMIANIE USTAWY O WYROBACH BUDOWLANYCH ORAZ NIEKTÓRYCH INNYCH USTAW
 Projekt, z dnia 29 sierpnia 2012 r. PROJEKT ZAŁOŻEŃ PROJEKTU USTAWY O ZMIANIE USTAWY O WYROBACH BUDOWLANYCH ORAZ NIEKTÓRYCH INNYCH USTAW I. WPROWADZENIE Z dniem 24 kwietnia 2011 r. weszło w życie rozporządzenie
Projekt, z dnia 29 sierpnia 2012 r. PROJEKT ZAŁOŻEŃ PROJEKTU USTAWY O ZMIANIE USTAWY O WYROBACH BUDOWLANYCH ORAZ NIEKTÓRYCH INNYCH USTAW I. WPROWADZENIE Z dniem 24 kwietnia 2011 r. weszło w życie rozporządzenie
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Kolejna nowelizacja Deklaracji Helsinskiej
 Kolejna nowelizacja Deklaracji Helsinskiej M. Czarkowski Warszawski Uniwersytet Medyczny Ośrodek Bioetyki NRL 1 Historia powstania Przyjęta przez 18 Zgromadzenie Ogólne Światowego Stowarzyszenia Lekarzy
Kolejna nowelizacja Deklaracji Helsinskiej M. Czarkowski Warszawski Uniwersytet Medyczny Ośrodek Bioetyki NRL 1 Historia powstania Przyjęta przez 18 Zgromadzenie Ogólne Światowego Stowarzyszenia Lekarzy
W art. 1 projektu ustawy o zmianie ustawy o przeciwdziałaniu narkomanii (Druk nr 812 wraz z autopoprawką) pkt 1 otrzymuje następujące brzmienie:
 Projekt poprawek W art. 1 projektu ustawy o zmianie ustawy o przeciwdziałaniu narkomanii (Druk nr 812 wraz z autopoprawką) pkt 1 otrzymuje następujące brzmienie: 1) po rozdziale 4 dodaje się rozdział 4a
Projekt poprawek W art. 1 projektu ustawy o zmianie ustawy o przeciwdziałaniu narkomanii (Druk nr 812 wraz z autopoprawką) pkt 1 otrzymuje następujące brzmienie: 1) po rozdziale 4 dodaje się rozdział 4a
Zasady GMP/GHP, które należy wdrożyć przed wprowadzeniem HACCP
 System HACCP Od przystąpienia Polski do Unii Europejskiej wszystkie firmy zajmujące się produkcją i dystrybucją żywności muszą wdrożyć i stosować zasady systemu HACCP. Przed opisaniem podstaw prawnych
System HACCP Od przystąpienia Polski do Unii Europejskiej wszystkie firmy zajmujące się produkcją i dystrybucją żywności muszą wdrożyć i stosować zasady systemu HACCP. Przed opisaniem podstaw prawnych
(Tekst mający znaczenie dla EOG)
 L 131/48 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/779 z dnia 18 maja 2016 r. ustanawiające jednolite zasady dotyczące procedur ustalania, czy dany wyrób tytoniowy ma aromat charakterystyczny (Tekst
L 131/48 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/779 z dnia 18 maja 2016 r. ustanawiające jednolite zasady dotyczące procedur ustalania, czy dany wyrób tytoniowy ma aromat charakterystyczny (Tekst
U S T A W A z dnia 2007 r. o zmianie ustawy Prawo farmaceutyczne oraz o zmianie niektórych innych ustaw 1)
 PROJEKT 26.01.07r. U S T A W A z dnia 2007 r. o zmianie ustawy Prawo farmaceutyczne oraz o zmianie niektórych innych ustaw 1) Art. 1. W ustawie z dnia 6 września 2001 r. Prawo farmaceutyczne (Dz. U. z
PROJEKT 26.01.07r. U S T A W A z dnia 2007 r. o zmianie ustawy Prawo farmaceutyczne oraz o zmianie niektórych innych ustaw 1) Art. 1. W ustawie z dnia 6 września 2001 r. Prawo farmaceutyczne (Dz. U. z
Przedszkole Nr 30 - Śródmieście
 RAPORT OCENA KONTROLI ZARZĄDCZEJ Przedszkole Nr 30 - Śródmieście raport za rok: 2016 Strona 1 z 12 I. WSTĘP: Kontrolę zarządczą w jednostkach sektora finansów publicznych stanowi ogół działań podejmowanych
RAPORT OCENA KONTROLI ZARZĄDCZEJ Przedszkole Nr 30 - Śródmieście raport za rok: 2016 Strona 1 z 12 I. WSTĘP: Kontrolę zarządczą w jednostkach sektora finansów publicznych stanowi ogół działań podejmowanych
(Tekst mający znaczenie dla EOG)
 L 87/224 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2017/582 z dnia 29 czerwca 2016 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 600/2014 w odniesieniu do regulacyjnych standardów
L 87/224 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2017/582 z dnia 29 czerwca 2016 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 600/2014 w odniesieniu do regulacyjnych standardów
QP-PJ/2-00 ZDARZENIA NIEPOŻĄDANE W TRAKCIE UDZIELANIA ŚWIADCZEŃ ZDROWOTNYCH W SPZOZ NR 1 W BEŁŻYCACH
 Strona 1 z 9 SPIS TREŚCI 1. Cel procedury... 2 2. Przedmiot procedury... 2 3. Zakres stosowania... 2 4. Określenia i definicje... 2 5. Sposób postępowania... 3 6. Odpowiedzialność i uprawnienia... 5 7.
Strona 1 z 9 SPIS TREŚCI 1. Cel procedury... 2 2. Przedmiot procedury... 2 3. Zakres stosowania... 2 4. Określenia i definicje... 2 5. Sposób postępowania... 3 6. Odpowiedzialność i uprawnienia... 5 7.
Dziennik Urzędowy Unii Europejskiej
 L 77/6 20.3.2018 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2018/456 z dnia 19 marca 2018 r. w sprawie etapów procedury konsultacji w celu ustalenia statusu nowej żywności zgodnie z rozporządzeniem (UE) 2015/2283
L 77/6 20.3.2018 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2018/456 z dnia 19 marca 2018 r. w sprawie etapów procedury konsultacji w celu ustalenia statusu nowej żywności zgodnie z rozporządzeniem (UE) 2015/2283
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 16 września 2016 r. Poz. 1488 OBWIESZCZENIE MINISTRA ZDROWIA z dnia 9 września 2016 r. w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 16 września 2016 r. Poz. 1488 OBWIESZCZENIE MINISTRA ZDROWIA z dnia 9 września 2016 r. w sprawie ogłoszenia jednolitego tekstu rozporządzenia Ministra
Ochrona danych osobowych
 Ochrona danych osobowych Nowe regulacje europejskie dr Maciej Kawecki Istota ogólnego rozporządzenia Największy lobbing sektora prywatnego; Jeden z aktów prawa wtórnego UE o najszerszym zakresie zastosowania;
Ochrona danych osobowych Nowe regulacje europejskie dr Maciej Kawecki Istota ogólnego rozporządzenia Największy lobbing sektora prywatnego; Jeden z aktów prawa wtórnego UE o najszerszym zakresie zastosowania;
ANEKS I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
DYREKTYWA WYKONAWCZA KOMISJI 2012/25/UE
 10.10.2012 Dziennik Urzędowy Unii Europejskiej L 275/27 DYREKTYWY DYREKTYWA WYKONAWCZA KOMISJI 2012/25/UE z dnia 9 października 2012 r. ustanawiająca procedury przekazywania informacji w związku z wymianą
10.10.2012 Dziennik Urzędowy Unii Europejskiej L 275/27 DYREKTYWY DYREKTYWA WYKONAWCZA KOMISJI 2012/25/UE z dnia 9 października 2012 r. ustanawiająca procedury przekazywania informacji w związku z wymianą
Szkoła Podstawowa nr 336 im. Janka Bytnara Rudego - Ursynów
 RAPORT OCENA KONTROLI ZARZĄDCZEJ Szkoła Podstawowa nr 336 im. Janka Bytnara Rudego - Ursynów raport za rok: 2015 Strona 1 z 12 I. WSTĘP: Kontrolę zarządczą w jednostkach sektora finansów publicznych stanowi
RAPORT OCENA KONTROLI ZARZĄDCZEJ Szkoła Podstawowa nr 336 im. Janka Bytnara Rudego - Ursynów raport za rok: 2015 Strona 1 z 12 I. WSTĘP: Kontrolę zarządczą w jednostkach sektora finansów publicznych stanowi
ZARZĄDZENIE Nr 132/12 BURMISTRZA PASŁĘKA z dnia 28 grudnia 2012 roku
 ZARZĄDZENIE Nr 132/12 BURMISTRZA PASŁĘKA z dnia 28 grudnia 2012 roku w sprawie wprowadzenia procedury zarządzania ryzykiem w Urzędzie Miejskim w Pasłęku Na podstawie art. (69 ust. 1 pkt 3 w związku z art.
ZARZĄDZENIE Nr 132/12 BURMISTRZA PASŁĘKA z dnia 28 grudnia 2012 roku w sprawie wprowadzenia procedury zarządzania ryzykiem w Urzędzie Miejskim w Pasłęku Na podstawie art. (69 ust. 1 pkt 3 w związku z art.
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 7 Wnioski naukowe Federalny Instytut Leków i Wyrobów Medycznych (BfArM), Niemcy, i Inspektorat Opieki Zdrowotnej (IGZ) Ministerstwa Zdrowia Holandii przeprowadziły wspólną inspekcję
Aneks II Wnioski naukowe 7 Wnioski naukowe Federalny Instytut Leków i Wyrobów Medycznych (BfArM), Niemcy, i Inspektorat Opieki Zdrowotnej (IGZ) Ministerstwa Zdrowia Holandii przeprowadziły wspólną inspekcję
9. Komunikowanie się w sprawach dotyczących bezpieczeństwa i higieny pracy
 9. Komunikowanie się w sprawach dotyczących bezpieczeństwa i higieny pracy 9.1. Jakie informacje powinny być przekazywane w systemie zarządzania bezpieczeństwem i higieną pracy? Komunikowanie się jest
9. Komunikowanie się w sprawach dotyczących bezpieczeństwa i higieny pracy 9.1. Jakie informacje powinny być przekazywane w systemie zarządzania bezpieczeństwem i higieną pracy? Komunikowanie się jest
ROZPORZĄDZENIE REACH PRZEMYSŁ KOSMETYCZNY USTAWA O SUBSTANCJACH I ICH MIESZANINACH
 ROZPORZĄDZENIE REACH PRZEMYSŁ KOSMETYCZNY USTAWA O SUBSTANCJACH I ICH MIESZANINACH Monika Blezień Ruszaj Rozporządzenie REACH ROZPORZĄDZENIE (WE) NR 1907/2006 PARLAMENTU EUROPEJSKIEGO I RADY z dnia 18
ROZPORZĄDZENIE REACH PRZEMYSŁ KOSMETYCZNY USTAWA O SUBSTANCJACH I ICH MIESZANINACH Monika Blezień Ruszaj Rozporządzenie REACH ROZPORZĄDZENIE (WE) NR 1907/2006 PARLAMENTU EUROPEJSKIEGO I RADY z dnia 18
(Tekst mający znaczenie dla EOG)
 17.6.2016 L 160/29 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2016/960 z dnia 17 maja 2016 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 596/2014 w odniesieniu do regulacyjnych standardów
17.6.2016 L 160/29 ROZPORZĄDZENIE DELEGOWANE KOMISJI (UE) 2016/960 z dnia 17 maja 2016 r. uzupełniające rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 596/2014 w odniesieniu do regulacyjnych standardów
Obowiązki podmiotów gospodarczych, nowi uczestnicy łańcucha. Krzysztof Zawiślak Departament Bezpieczeństwa Gospodarczego.
 Obowiązki podmiotów gospodarczych, nowi uczestnicy łańcucha Krzysztof Zawiślak Departament Bezpieczeństwa Gospodarczego 1 Wspólne obowiązki w każdej z dyrektyw nowego podejścia DECYZJA PARLAMENTU EUROPEJSKIEGO
Obowiązki podmiotów gospodarczych, nowi uczestnicy łańcucha Krzysztof Zawiślak Departament Bezpieczeństwa Gospodarczego 1 Wspólne obowiązki w każdej z dyrektyw nowego podejścia DECYZJA PARLAMENTU EUROPEJSKIEGO
z dnia 31 maja 1999 r.
 Danuta Gillner SYGOS VIII, Ustroń 13-15.01.2011 1 DYREKTYWA 1999/45/WE z dnia 31 maja 1999 r. w sprawie zbliżenia przepisów ustawowych, wykonawczych i administracyjnych państw członkowskich odnoszących
Danuta Gillner SYGOS VIII, Ustroń 13-15.01.2011 1 DYREKTYWA 1999/45/WE z dnia 31 maja 1999 r. w sprawie zbliżenia przepisów ustawowych, wykonawczych i administracyjnych państw członkowskich odnoszących
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Co muszę wiedzieć o poważnych zdarzeniach niepożądanych
 2000 + Co muszę wiedzieć o poważnych zdarzeniach niepożądanych Informacje dla użytkowników usługi, członków rodziny i opiekunów [insert name of organisation] 1 S t r o n a Niniejsza ulotka została przygotowana
2000 + Co muszę wiedzieć o poważnych zdarzeniach niepożądanych Informacje dla użytkowników usługi, członków rodziny i opiekunów [insert name of organisation] 1 S t r o n a Niniejsza ulotka została przygotowana
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Opinia 4/2018. w sprawie projektu wykazu sporządzonego przez właściwy czeski organ nadzorczy. dotyczącego
 Opinia 4/2018 w sprawie projektu wykazu sporządzonego przez właściwy czeski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 4/2018 w sprawie projektu wykazu sporządzonego przez właściwy czeski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 9/2018. w sprawie projektu wykazu sporządzonego przez właściwy francuski organ nadzorczy. dotyczącego
 Opinia Rady (art. 64) Opinia 9/2018 w sprawie projektu wykazu sporządzonego przez właściwy francuski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków
Opinia Rady (art. 64) Opinia 9/2018 w sprawie projektu wykazu sporządzonego przez właściwy francuski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Opinia 5/2018. w sprawie projektu wykazu sporządzonego przez właściwe niemieckie organy nadzorcze. dotyczącego
 Opinia 5/2018 w sprawie projektu wykazu sporządzonego przez właściwe niemieckie organy nadzorcze dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 5/2018 w sprawie projektu wykazu sporządzonego przez właściwe niemieckie organy nadzorcze dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 17/2018. w sprawie projektu wykazu sporządzonego przez właściwy polski organ nadzorczy. dotyczącego
 Opinia 17/2018 w sprawie projektu wykazu sporządzonego przez właściwy polski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 17/2018 w sprawie projektu wykazu sporządzonego przez właściwy polski organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) / z dnia r.
 KOMISJA EUROPEJSKA Bruksela, dnia 20.12.2017 r. C(2017) 8871 final ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) / z dnia 20.12.2017 r. określające wymogi administracyjne i naukowe w odniesieniu do tradycyjnej
KOMISJA EUROPEJSKA Bruksela, dnia 20.12.2017 r. C(2017) 8871 final ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) / z dnia 20.12.2017 r. określające wymogi administracyjne i naukowe w odniesieniu do tradycyjnej
przyjęta 4 grudnia 2018 r. Tekst przyjęty
 Opinia 25/2018 w sprawie projektu wykazu sporządzonego przez właściwy chorwacki organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
Opinia 25/2018 w sprawie projektu wykazu sporządzonego przez właściwy chorwacki organ nadzorczy dotyczącego rodzajów operacji przetwarzania podlegających wymogowi dokonania oceny skutków dla ochrony danych
PROCEDURA. Działania korygujące i zapobiegawcze
 I. Cel Celem niniejszej procedury jest zapewnienie, że prowadzone są skuteczne korygujące i tzn. takie, które eliminują przyczyny rzeczywistych i potencjalnych niezgodności oraz innych niepożądanych sytuacji
I. Cel Celem niniejszej procedury jest zapewnienie, że prowadzone są skuteczne korygujące i tzn. takie, które eliminują przyczyny rzeczywistych i potencjalnych niezgodności oraz innych niepożądanych sytuacji
Ulotka dołączona do opakowania: informacja dla pacjenta Avenoc, maść
 Ulotka dołączona do opakowania: informacja dla pacjenta Avenoc, maść Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten należy
Ulotka dołączona do opakowania: informacja dla pacjenta Avenoc, maść Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten należy
Regulamin Portalu
 Strona 1 z 5 Regulamin Portalu Regulamin określa zasady i warunki funkcjonowania Portalu (dalej: Portal) oraz prawa i obowiązki Użytkowników oraz Administratora Portalu. Każdy Użytkownik podczas rejestracji
Strona 1 z 5 Regulamin Portalu Regulamin określa zasady i warunki funkcjonowania Portalu (dalej: Portal) oraz prawa i obowiązki Użytkowników oraz Administratora Portalu. Każdy Użytkownik podczas rejestracji
OCENA ZGODNOŚCI - ZGODNOŚĆ Z TYPEM W OPARCIU O WEWNĘTRZNĄ KONTROLĘ PRODUKCJI ORAZ NADZOROWANE KONTROLE W LOSOWYCH ODSTĘPACH CZASU moduł C2
 1. CEL I ZAKRES PROCEDURY Celem procedury jest potwierdzenie przez jednostkę notyfikowaną zgodności wyrobu z typem opisanym w certyfikacie badania typu UE oraz potwierdzenie spełnienia mających zastosowanie
1. CEL I ZAKRES PROCEDURY Celem procedury jest potwierdzenie przez jednostkę notyfikowaną zgodności wyrobu z typem opisanym w certyfikacie badania typu UE oraz potwierdzenie spełnienia mających zastosowanie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
I. Postanowienia ogólne
 VikingCo poland sp. z o. o. Polityka prywatności obowiązuje od 25 maja 2018 r. I. Postanowienia ogólne 1. Niniejszy dokument określa zasady ochrony danych osobowych w VikingCo Poland sp. z o.o. z siedzibą
VikingCo poland sp. z o. o. Polityka prywatności obowiązuje od 25 maja 2018 r. I. Postanowienia ogólne 1. Niniejszy dokument określa zasady ochrony danych osobowych w VikingCo Poland sp. z o.o. z siedzibą
Znakowanie kosmetyku nowe przepisy. mgr Katarzyna Kobza - Sindlewska
 Znakowanie kosmetyku nowe przepisy. mgr Katarzyna Kobza - Sindlewska Rozporządzenie parlamentu Europejskiego i Rady (WE) NR 1223/2009 z dnia 30 listopada 2009 r. rozdział VI Informacje dla konsumenta art.
Znakowanie kosmetyku nowe przepisy. mgr Katarzyna Kobza - Sindlewska Rozporządzenie parlamentu Europejskiego i Rady (WE) NR 1223/2009 z dnia 30 listopada 2009 r. rozdział VI Informacje dla konsumenta art.
Klasyfikowanie problemów lekowych na podstawie klasyfikacji PCNE (wersja 6.2)
 Klasyfikowanie problemów lekowych na podstawie klasyfikacji PCNE (wersja 6.2) Europejska Sieć Opieki Farmaceutycznej (Pharmaceutical Care Network Europe, PCNE) udostępniła kolejną wersję klasyfikacji problemów
Klasyfikowanie problemów lekowych na podstawie klasyfikacji PCNE (wersja 6.2) Europejska Sieć Opieki Farmaceutycznej (Pharmaceutical Care Network Europe, PCNE) udostępniła kolejną wersję klasyfikacji problemów
ZALECENIA DLA PRACODAWCÓW I SŁUŻB KONTROLNYCH
 ZALECENIA DLA PRACODAWCÓW I SŁUŻB KONTROLNYCH Najczęściej zadawane pytania 1. Jak interpretować pojęcie KONTAKT NARAŻENIE? Instytut Medycyny Pracy w Łodzi stoi na stanowisku, że: Przez prace w kontakcie
ZALECENIA DLA PRACODAWCÓW I SŁUŻB KONTROLNYCH Najczęściej zadawane pytania 1. Jak interpretować pojęcie KONTAKT NARAŻENIE? Instytut Medycyny Pracy w Łodzi stoi na stanowisku, że: Przez prace w kontakcie
ANKIETA dla kadry kierowniczej samoocena systemu kontroli zarządczej za rok
 ANKIETA dla kadry kierowniczej samoocena systemu za rok Załącznik nr 6 do Zarządzenia nr 0050.67.2016 Burmistrza Miasta Kościerzyna z dnia 31.05.2016r. Przedstawione poniżej pytania ankietowe są elementem
ANKIETA dla kadry kierowniczej samoocena systemu za rok Załącznik nr 6 do Zarządzenia nr 0050.67.2016 Burmistrza Miasta Kościerzyna z dnia 31.05.2016r. Przedstawione poniżej pytania ankietowe są elementem
KOMISJA EUROPEJSKA DYREKCJA GENERALNA DS. RYNKU WEWNĘTRZNEGO, PRZEMYSŁU, PRZEDSIĘBIORCZOŚCI I MŚP
 KOMISJA EUROPEJSKA DYREKCJA GENERALNA DS. RYNKU WEWNĘTRZNEGO, PRZEMYSŁU, PRZEDSIĘBIORCZOŚCI I MŚP Bruksela, 1 lutego 2019 r. PYTANIA I ODPOWIEDZI ZWIĄZANE Z WYSTĄPIENIEM ZJEDNOCZONEGO KRÓLESTWA Z UNII
KOMISJA EUROPEJSKA DYREKCJA GENERALNA DS. RYNKU WEWNĘTRZNEGO, PRZEMYSŁU, PRZEDSIĘBIORCZOŚCI I MŚP Bruksela, 1 lutego 2019 r. PYTANIA I ODPOWIEDZI ZWIĄZANE Z WYSTĄPIENIEM ZJEDNOCZONEGO KRÓLESTWA Z UNII
Warszawa, dnia 19 lutego 2016 r. Poz. 206
 Warszawa, dnia 19 lutego 2016 r. Poz. 206 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 17 lutego 2016 r. zmieniające rozporządzenie w sprawie wymagań zasadniczych oraz procedur oceny zgodności aktywnych wyrobów
Warszawa, dnia 19 lutego 2016 r. Poz. 206 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 17 lutego 2016 r. zmieniające rozporządzenie w sprawie wymagań zasadniczych oraz procedur oceny zgodności aktywnych wyrobów
