Chemia zadania przygotowujące do egzaminu gimnazjalnego Zadania zamknięte
|
|
|
- Władysław Świderski
- 8 lat temu
- Przeglądów:
Transkrypt
1 Chemia zadania przygotowujące do egzaminu gimnazjalnego Zadania zamknięte Zadanie 1. (0 1) Chemiczna metoda oczyszczania ścieków polega na A. usuwaniu zanieczyszczeń nierozpuszczalnych przy użyciu urządzeń rozdrabniających i cedzących. B. zmineralizowaniu zanieczyszczeń dzięki działaniu mikroorganizmów. C. wytrąceniu niektórych związków organicznych lub ich neutralizacji. D. usunięciu zanieczyszczeń z wykorzystaniem bakterii beztlenowych. Zadanie 2. (0 1) Zasolenie Bałtyku u wybrzeży Danii wynosi średnio 1,7%. W 200 gramach wody morskiej znajduje się około A. 0,85 g soli. B. 3,4 g soli. C. 8,5 g soli. D. 34 g soli. Zadanie 3. (0 1) Robert został ugryziony przez mrówkę. Aby zobojętnić kwas mrówkowy zawarty w jadzie mrówki miejsce ugryzienia należy posmarować A. substancją o odczynie obojętnym. B. substancją o odczynie kwaśnym. C. substancją o odczynie zasadowym. D. spirytusem salicylowym. Zadanie 4. (0 1) Na opakowaniu pierogów z serem podano ich skład: mąka pszenna, mąka sojowa, oliwa, ser, cebula, sól, pieprz czarny, czosnek. Decydujący wpływ na zawartość białka w pierogach mają A. oliwa i mąka pszenna. B. ser i cebula. C. oliwa i mąka sojowa. D. mąka sojowa i ser. Zadanie 5. (0-1) Głównym składnikiem gazu ziemnego jest metan (CH 4 ). Całkowite spalanie metanu przedstawia równanie reakcji A. CH 4 + O 2 -> C + 2H 2 0 B. 2CH > 2CO + 4H 2 0 C. CH >C H 2 0 D. CH > C0 2 + H 2 0 Zadanie 6. (0-1) Po przeprowadzeniu doświadczenia, takiego jak na rysunku obok stwierdzono, że znajdujący się w probówce kamień jest wapieniem (zawiera węglan wapnia CaCO 3 ), ponieważ w wyniku reakcji wydzielił się gaz, który spowodował ^^_
2 A. zabarwienie wody wapiennej. B. zmętnienie wody wapiennej. C. wytrącenie się czarnego osadu. D. odbarwienie się wody wapien Zadanie 7. (0 1) Woda z jeziora zawiera latem dużo glonów. W ich organizmach zachodzi proces fotosyntezy, który można przedstawić równaniem: Światło słoneczne 6CO 2 + 6H 2 O > C 6 H 12 O 6 +? O 2 chlorofil Ile cząsteczek tlenu powstaje równocześnie z jedną cząsteczką glukozy? A. jedna B. trzy C. sześć D. dwanaście Zadanie 8. (0 1) Z wody z jeziora pobrano próbkę o masie 600 g zawierającą 2 g substancji rozpuszczonych. Jakie jest wagowe stężenie procentowe wody w tej próbce? A. 0,20% B. 0,33% C. 0,35% D. 0,67% Zadanie 9. (0 1) Przesączoną wodę z jeziora wykorzystano do doświadczenia przedstawionego na rysunku. Stwierdzono lekko malinowe zabarwienie wody pod wpływem fenoloftaleiny oraz, mimo silnego wstrząsania, brak piany w probówce z mydłem. Na podstawie wyników tego doświadczenia można powiedzieć, że woda w jeziorze posiada A. ph > 7 i zawiera dużo jonów Ca 2+ i Mg 2+ (jest wodą twardą ). B. ph < 7 i mieści się w I klasie czystości wód powierzchniowych. C. ph > 7 i jest wodą miękką. D. ph = 7 i zawiera dużo związków organicznych. Zadanie 10. (0 1) Jeżeli tlen gwałtownie łączy się z pierwiastkiem i towarzyszy temu świecenie oraz wydzielanie ciepła, to jest to reakcja A. rozkładu. B. spalania C. wymiany D. zobojętniania. Zadanie 11. (0 1) Jedna duża sosna produkuje w ciągu doby 14,4 m 3 tlenu. Człowiek zużywa 0,2 m 3 tlenu na godzinę. Na ile godzin wystarczy człowiekowi tlenu wyprodukowanego przez sosnę w ciągu doby? A. 2,88 B. 7,20 C. 28,80 D. 72
3 Zadanie 12. ( 0-1) W Ciechocinku do celów leczniczych wykorzystuje się naturalne wody mineralne bogate w jony siarczkowe i sodowe. Na podstawie informacji zawartych w tabeli wybierz wzory tych jonów. Rodzaj jonu Ilość protonów Ilość elektronów siarczkowy sodowy A.S 2-, Na + B.S -, Na 2+ C.S 2+, Na 2- D. S -, Na + Zadanie 13. (0-1) Wybierz gaz, który będzie najlepszy do wypełnienia balonu gazowego. właściwości Dwutlenek Wodór Hel Metan Gęstość gazu w porównaniu z gęstościa powietrza węgla Gęstość większa od powietrza Gęstość mniejsza od powietrza Gęstość mniejsza od powietrza Gęstość mniejsza od powietrza Palność gazu Nie pali się Jest gazem palnym Nie pali się A. Dwutlenek węgla B. Wodór C. Hel. D. Metan Jest gazem palnym Zadanie 14. (0-1) Podróżnik w dwóch naczyniach umieścił taką samą masę wody z Morza Martwego i z Bałtyku. W pierwszym naczyniu umieścił wodę z Morza Martwego o zasoleniu 24 %, a w drugim - wodę z Bałtyku o zasoleniu 0,8 %. Następnie odparował do sucha zawartość naczyń. Zaznacz wynik doświadczenia, który uzyskał podróżnik. A. W pierwszym naczyniu pozostało 3-krotnie mniej soli niż w drugim. B. W pierwszym naczyniu pozostało 3-krotnie więcej soli niż w drugim C. W pierwszym naczyniu pozostało 30-krotnie więcej soli niż w drugim. D. W pierwszym naczyniu pozostało 300-krotnie więcej soli niż w drugim. Informacje do zadań 15. i 16 Tabela gęstości metali Nazwa Symbol Gęstość w g/cm 3 glin Al 2,70 miedź Cu 8,93 ołów Pb 11,40 złoto Au 19,32 żelazo Fe 7,87 Zadanie 15. (0 1) W sali, w której zebrano eksponaty charakterystyczne dla Kraju Kwitnącej Wiśni Japonii, znajdował się posążek Buddy. Posążek wykonany ze złota o masie 7728 g miałby objętość A cm 3 B. 400 cm 3 C. 40 cm 3 D. 4 cm 3
4 Zadanie 16. (0 1) Gdyby z metali wymienionych w tabeli wykonane zostały posążki Buddy o takiej samej objętości, to posążek o najmniejszej masie wykonany byłby z A. glinu. B. miedzi. C. ołowiu. D. żelaza. Zadanie 17. (0 1) Rysunek przedstawia wykres zależności pomiędzy masą (m) ciała a jego objętością (v) dla czterech różnych substancji. Która z półprostych przedstawia zależność pomiędzy masą a objętością ciała o gęstości g równej 0,8 g /cm 3 A. I B. II C. III D. IV Zadanie 18. (0 1) W Londynie ogromnym problemem jest smog, składający się między innymi z tlenków siarki i tlenków azotu. Pewnego dnia w atmosferze znalazła się taka sama masa tlenków siarki co tlenków azotu. Diagramy przedstawiają źródła zanieczyszczeń powietrza tymi tlenkami. Największa łączna masa wyemitowanych tlenków azotu i tlenków siarki pochodziła z: A. Transport B. gospodarstw domowych. C.energetyki. D.przemysłu (w tym rafinerii).
5 Zadanie 19. (0 1) Badano odczyn próbek wody pobranych z różnych źródeł, używając jako wskaźnika oranżu metylowego. Jedną z próbek stanowiła woda z kwaśnych opadów zebrana w Londynie. Doświadczenie przebiegało według schematu próbka wody + oranż metylowy -> roztwór Woda zebrana w Londynie mogła znajdować się A. w zlewce I. B. w zlewce II. C. w zlewce III. D. we wszystkich zlewkach Zadanie 20. (0 1) Wskaż zestaw, który zawiera wyłącznie wzory sumaryczne soli. A. NaCl, MgSO 4, CaCl 2, HNO 3 C. NaCl, Ca(OH) 2, HCl, Mg 3 (PO 4 ) 2 B. NaCl, CaSO 4, CaCl 2, Al(OH) 3 Zadanie 21. (0 1) Wskaż reakcję zobojętniania. A. 2Na + H 2 SO 4 > Na 2 SO 4 + H 2 B. 2NaOH + H 2 SO 4 > Na 2 SO 4 + 2H 2 O D. NaCl, KNO 3, MgSO 4, CaSO 4 C. Na 2 O + H 2 SO 4 > Na 2 SO 4 + H 2 O D. Na 2 CO 3 + H 2 SO 4 > Na 2 SO 4 + H 2 CO 3 Zadanie 22. (0-1) Wiosną, w obawie przed awitaminozą, Agnieszka zmieniła dietę na roślinną z dużym udziałem jarzyn, które właśnie zaczęły wyrastać w jej ogródku. Aby ustrzec się przed niedoborami wapnia, spowodowanymi wiązaniem wapnia przez jony kwasu szczawiowego zawartego w jarzynach, powinna jeść również więcej produktów bogatych w wapń, mianowicie: A. mleka i serów. B. miodu i kakao. C. tranu i mięsa. D. szpinaku i sałaty. Zadanie 23. (0-1) Rysunek przedstawia wzór strukturalny szczawianu wapnia. Jaka jest wartościowość węgla w tym związku? A. 1 B. 2 C. 3 D. 4
6 Zadanie 24. (0-1) Sole mineralne stanowią 4% składu chemicznego organizmu człowieka. Które wyrażenie nie jest zapisem liczby kilogramów soli mineralnych zawartych w organizmie człowieka o masie 68 kg? A. 68 0,04 B. 68*100/4 C. 68*4/100 D. 0,68 4 Zadanie 25. (0-1) Kreda jest białą lub szarą, miękką, rozcieralną skałą. Zbudowana jest głównie z wapiennych skorupek organizmów morskich. Należy więc do skał A. osadowych pochodzenia organicznego. B. osadowych pochodzenia chemicznego. C. przeobrażonych. D. magmowych. Informacje do zadań 26. i 27. Głównym składnikiem kredy jest węglan wapnia CaCO 3. Jego rozkład wymaga wysokiej temperatury i przebiega według schematu: CaCO3 temperatura CaO + CO 2 Zadanie 26. (0-1) Oblicz, ile dwutlenku węgla powstało w takiej reakcji, jeżeli ze 100 g CaCO 3 otrzymano 56 g CaO. A. 156 g B.100 g C. 56 g D. 44 g Zadanie 27. (0-1) Uczniowie wykonali dwa doświadczenia z kredą: Doświadczenie I: kawałek kredy włożono do wody z dodatkiem fenoloftaleiny. Obserwacje: nie zaobserwowano zmian. Doświadczenie II: kawałek kredy ogrzano w płomieniu palnika i następnie włożono do wody z dodatkiem fenoloftaleiny. Obserwacje: ogrzana część kredy zabarwiła się na kolor malinowy. O czym świadczy zabarwienie się podgrzanej części kredy? A. Wzrosła temperatura wody. B. Obniżyła się temperatura kredy. C. Tlenek wapnia zareagował z wodą. D. Dwutlenek węgla rozpuścił się w wodzie. Zadanie 28. (0-1) Który rysunek jest symbolem recyklingu? A. 1. B. 2. C. 3. D. 4. Zadanie 29. (0 1)
7 Na podstawie informacji z poniższego fragmentu tabeli rozpuszczalności soli i wodorotlenków (w wodzie) wybierz zdanie prawdziwe. Jon SO 4 2- Cl - NO 3 - CO 3 2- Ca 2+ S R R N S Mg 2+ R R R N N S substancja słabo rozpuszczalna w wodzie N substancja praktycznie nierozpuszczalna w wodzie R substancja dobrze rozpuszczalna w wodzie A. Wodorotlenek wapnia słabo rozpuszcza się w wodzie. B. Wodorotlenek wapnia nie rozpuszcza się w wodzie. C. W tabeli nie podano informacji o rozpuszczalności wodorotlenku wapnia. D. Wodorotlenek wapnia dobrze rozpuszcza się w wodzie. OH - Zadanie 30. (0-1) Wapno gaszone Ca(OH) 2 jest składnikiem zaprawy murarskiej. Jej twardnienie zachodzi pod wpływem dwutlenku węgla. Wybierz poprawnie zapisane równanie zachodzącej wtedy reakcji. A. Ca(OH) 2 + 2CO -> CaC0 3 + H2O B. Ca(OH) 2 + CO 2 -> CaC03 + H2O C. Ca(OH) 2 + 2C0 2 -> 2CaC H 2 0 D. Ca(OH) 2 + CO -> CaC0 3 + H 2 Zadanie 31. (0 1) Aby przygotować suchą zaprawę do tynkowania ścian, należy zmieszać piasek, wapno i cement odpowiednio w stosunku 15 : 4 : 1. W którym wierszu tabeli podane są właściwe ilości składników potrzebnych do otrzymania 140 kg takiej zaprawy? Piasek (kg) Wapno (kg) Cement (kg) I II III IV A. I B. II C. III D. IV
8 Informacje do zadań 32. i 33. Wykres przedstawia zależność rozpuszczalności wybranych związków wapnia w wodzie od temperatury. Rozpuszczalność w g na 100 g wody Temperatura w o o C siarczan(vi) wapnia CaSO 4 wodorotlenek wapnia Ca(OH) 2 Zadanie 32. (0 1) Ile co najwyżej gramów wodorotlenku wapnia można rozpuścić w 1000 g wody w temperaturze 20ºC? A. 2,6 B. 0,26 C. 0,16 D. 1,6 Zadanie 33. (0 1) Które zdanie jest prawdziwe? A. Rozpuszczalność związków wapnia rośnie ze wzrostem temperatury. B. Przy podnoszeniu się temperatury od 0ºC do 20ºC rozpuszczalność siarczanu(vi) wapnia rośnie, a wodorotlenku wapnia maleje. C. Rozpuszczalność siarczanu(vi) wapnia w temperaturze 0ºC i 60ºC jest taka sama. D. Rozpuszczalność wodorotlenku wapnia jest odwrotnie proporcjonalna do temperatury.
9 Zadanie 34. (0-1) Wapno gaszone Ca(OH) 2 jest składnikiem zaprawy murarskiej. Jej twardnienie zachodzi po wpływem dwutlenku węgla. Wybierz poprawnie zapisane równanie zachodzącej wtedy reakcji. A. Ca(OH) 2 + 2CO -> CaC0 3 + H 2 0 B. Ca(OH) 2 + C0 2 -> CaC0 3 + H 2 0 C. Ca(OH) 2 + 2C0 2 -> 2CaC H 2 0 D. Ca(OH) 2 + CO -> CaC0 3 + H 2 Zadanie 35. (0 1) Aby przygotować suchą zaprawę do tynkowania ścian, należy zmieszać piasek, wapno i cement odpowiednio w stosunku 15 : 4 : 1. W którym wierszu tabeli podane są właściwe ilości składników potrzebnych do otrzymania 140 kg takiej zaprawy? Piasek (kg) Wapno(kg) Cement (kg) I II III IV A. I B. II C. III D. IV Zadanie 36. Wskaż właściwości dwutlenku siarki. A. Gaz bezbarwny, bez zapachu, potrzebny roślinom do fotosyntezy. B. Gaz, którego niewielka ilość powoduje mętnienie wody wapiennej. C. Gaz bezbarwny o charakterystycznej ostrej i duszącej woni, szkodliwy dla zdrowia. D. Gaz brunatnoczerwony, bezwonny, dobrze rozpuszczalny w wodzie, niepalny. Zadanie 37. Obecność tlenków siarki i tlenków azotu w atmosferze jest przyczyną A. efektu cieplarnianego. B. kwaśnych opadów. C. dziury ozonowej. D. fotosyntezy. Zadanie 38. W celu zmniejszenia zanieczyszczeń powietrza należy A. nawozić glebę. B. segregować odpady. C. budować oczyszczalnie ścieków. D. zakładać filtry oczyszczające gazy w zakładach przemysłowych.
10 Zadanie 39. Wskaż substraty reakcji, w wyniku której otrzymasz kwas siarkowy(vi) - H 2 SO 4. A. H 2 SO 3 + H 2 O -» B. SO 2 + H 2 O -» C. SO 3 + H 2 O -» D. S + H 2 O -» Zadanie 40. (0-1) Wapno palone to związek CaO a gaszone Ca(OH) 2. Gaszenie wapna zachodzi pod wpływem wody. Wybierz poprawnie zapisane równanie zachodzącej wtedy reakcji. A. CaO + H 2 O -> Ca(OH) 2 B. CaO + 2H 2 O -> Ca(OH) 2 + H 2 C. Ca(OH) 2 + 2CO 2 -> 2CaCO 3 + 2H 2 O D. Ca(OH) 2 + CO -> CaCO 3 + H 2 Zadania otwarte Zadanie 41. Korzystając z danych na rysunku odpowiedz na pytania. a. Czy powietrze jest związkiem chemicznym, czy mieszaniną? b. Jak zmienia się zawartość tlenu w powietrzu wydychanym w porównaniu z powietrzem wdychanym? Zadanie 42 (0 3) Tomek wykonał doświadczenie, w którym na cynk podziałał kwasem solnym. Probówkę do zbierania wydzielającego się gazu umieścił w wanience z wodą. Rysunek przedstawia schemat tego doświadczenia.
11 1. Zapisz równanie reakcji zachodzącej w doświadczeniu. 2. Nazwij powstałe produkty reakcji, uzupełniając zdanie: Produktami reakcji zachodzącej w doświadczeniu są Napisz, w jaki sposób zidentyfikujesz wydzielający się gaz. Zadanie 43 (0 2) 1 1 1H wodó 2 2 3Li lit 4Be beryl 3 11 Na sód 12Mg magnez C 7N 8O 9F węgiel azot tlen fluor 5B bor 13Al glin 14Si krzem 15P fosfor 16S siarka 17Cl chlor 18 2He hel 10Ne neon 18Ar argon Podaj nazwę pierwiastka, którego zawartość procentowa w powietrzu jest największa i korzystając z fragmentu układu okresowego uzupełnij tabelę. Nazwa pierwiastka Liczba protonów w jądrze Liczba elektronów wokół jądra
12 Zadanie 44. (0 2) Złoty pierścionek waży 3,5 g i wykonany został ze złota próby 750 (próba oznacza liczbę gramów czystego złota w 1000 g wyrobu). Ile gramów czystego złota jest w tym pierścionku? Zapisz obliczenia. Zadanie 45. (0 3) W kolumnie I podano nazwy grup związków chemicznych, a w kolumnie II nazwy produktów używanych w gospodarstwie domowym. I. 1. węglowodory 2. alkohol 3. kwasy 4. tłuszcze 5. cukry 6. białka II. a) cukier w kostkach, glukoza,mąka ziemniaczana b) masło, olej c) mleko, jaja, mięso d) gliceryna, spirytus salicylowy e) benzyna, wosk, folia polietylen f) ocet, kwasek cytrynowy g) mydło, szampon Każdej grupie związków chemicznych z kolumny I (liczby od 1 do 6) przyporządkuj jedną reprezentującą ją grupę produktów z kolumny II (litery od a do g). Wpisz odpowiednie litery w poniższe kratki. Zadanie 45. (0-3) Turysta wypoczywał w upalny dzień nad Jeziorem Górnym w Ameryce Północnej. Temperatura wody była równa 24 0 C. Oblicz, ile gramów tlenu rozpuści się w 0,2 m 3 tej wody, przyjmując, że jej gęstość wynosi 1000 Zapisz obliczenia.
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
ZESTAW 06 MATERIAŁY DLA UCZNIÓW GIMNAZJUM JEZUITÓW W GDYNI
 ZESTAW 06 MATERIAŁY DLA UCZNIÓW GIMNAZJUM JEZUITÓW W GDYNI EGZAMIN KOMPETENCYJNY KWIECIEŃ 2006 rok Informacje do zadań 1. i 2. Wykres przedstawia zależność rozpuszczalności wybranych związków wapnia w
ZESTAW 06 MATERIAŁY DLA UCZNIÓW GIMNAZJUM JEZUITÓW W GDYNI EGZAMIN KOMPETENCYJNY KWIECIEŃ 2006 rok Informacje do zadań 1. i 2. Wykres przedstawia zależność rozpuszczalności wybranych związków wapnia w
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
23 zadania z chemii. Zadanie 1 (0-1) Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym:
 23 zadania z chemii Zadanie 1 (0-1) Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym: Estrem jest związek o wzorze: Zadanie 2 (0-1) Elementy kolejki
23 zadania z chemii Zadanie 1 (0-1) Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym: Estrem jest związek o wzorze: Zadanie 2 (0-1) Elementy kolejki
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
Zadanie 2. (0 1) Uzupełnij schemat reakcji estryfikacji. Wybierz spośród podanych wzór kwasu karboksylowego A albo B oraz wzór alkoholu 1 albo 2.
 Zadanie 1. (0 1) W celu odróżnienia kwasu oleinowego od stopionego kwasu palmitynowego wykonano doświadczenie, którego przebieg przedstawiono na schemacie. W probówce I wybrany odczynnik zmienił zabarwienie.
Zadanie 1. (0 1) W celu odróżnienia kwasu oleinowego od stopionego kwasu palmitynowego wykonano doświadczenie, którego przebieg przedstawiono na schemacie. W probówce I wybrany odczynnik zmienił zabarwienie.
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2015/2016
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII
 ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
KONKURS PRZEDMIOTOWY Z CHEMII
 Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
MAŁOPOLSKI KONKURS CHEMICZNY. dla uczniów szkół podstawowych. 25 października 2019 r. Etap I (szkolny)
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE.
 BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
PODKARPACKI GIMNAZJALNY KONKURS CHEMICZNY
 12 stycznia 2017 r. PODKARPACKI GIMNAZJALNY KONKURS CHEMICZNY Szkoła (pieczątka) Imię i nazwisko ucznia Klasa Imię i nazwisko nauczyciela (tabelkę poniżej wypełnia zespół sprawdzający) Test 1 2 3 4 5 6
12 stycznia 2017 r. PODKARPACKI GIMNAZJALNY KONKURS CHEMICZNY Szkoła (pieczątka) Imię i nazwisko ucznia Klasa Imię i nazwisko nauczyciela (tabelkę poniżej wypełnia zespół sprawdzający) Test 1 2 3 4 5 6
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
I Etap szkolny 16 listopada Imię i nazwisko ucznia: Arkusz zawiera 19 zadań. Liczba punktów możliwych do uzyskania: 39 pkt.
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego I Etap szkolny 16 listopada 2017
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego I Etap szkolny 16 listopada 2017
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
Zadania egzaminacyjne z chemii OKE. Rok 2002
 Zadania egzaminacyjne z chemii OKE Rok 2002 Zadanie 10. (0 1) Marta przygotowała prowiant na wycieczkę rowerową. Pakowane przez nią produkty żywnościowe zawierają ważne dla organizmu związki chemiczne.
Zadania egzaminacyjne z chemii OKE Rok 2002 Zadanie 10. (0 1) Marta przygotowała prowiant na wycieczkę rowerową. Pakowane przez nią produkty żywnościowe zawierają ważne dla organizmu związki chemiczne.
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018. Eliminacje szkolne
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
Przemiany substancji
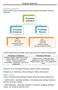 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
KONKURS CHEMICZNY DLA UCZNIÓW SZKOŁY PODSTAWOWEJ ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
TEST NA EGZAMIN POPRAWKOWY Z CHEMII DLA UCZNIA KLASY II GIMNAZJUM
 TEST NA EGZAMIN PPRAWKWY Z CHEMII DLA UCZNIA KLASY II GIMNAZJUM I. Część pisemna: 1. Które z poniższych stwierdzeń jest fałszywe? a.) Kwasy są to związki chemiczne zbudowane z wodoru i reszty kwasowej.
TEST NA EGZAMIN PPRAWKWY Z CHEMII DLA UCZNIA KLASY II GIMNAZJUM I. Część pisemna: 1. Które z poniższych stwierdzeń jest fałszywe? a.) Kwasy są to związki chemiczne zbudowane z wodoru i reszty kwasowej.
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Szkolny konkurs chemiczny Grupa B. Czas pracy 80 minut
 Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
KWASY I WODOROTLENKI. 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to:
 KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2013/2014 ETAP SZKOLNY
 Imię Nazwisko Czas pracy: 60 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2013/2014 ETAP SZKOLNY Informacje: Uzyskane punkty 1. Sprawdź, czy otrzymałeś/aś łącznie 7 stron. Ewentualny brak
Imię Nazwisko Czas pracy: 60 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2013/2014 ETAP SZKOLNY Informacje: Uzyskane punkty 1. Sprawdź, czy otrzymałeś/aś łącznie 7 stron. Ewentualny brak
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Zadanie 3 Zapisz wzory sumaryczne głównych składników przedstawionych skał i minerałów. kalcyt kreda kwarc gips agat
 CZĘŚĆ 1 Zadanie 1 Wyjaśnij pojęcia. wapno palone, hydraty, zaprawa gipsowa, zaprawa wapienna, wietrzenie skał, wapno gaszone, próchnica, degradacja gleby, właściwości sorpcyjne gleby, wapno palone, degradacja
CZĘŚĆ 1 Zadanie 1 Wyjaśnij pojęcia. wapno palone, hydraty, zaprawa gipsowa, zaprawa wapienna, wietrzenie skał, wapno gaszone, próchnica, degradacja gleby, właściwości sorpcyjne gleby, wapno palone, degradacja
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Kod ucznia Liczba punktów A X B C X
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Wojewódzki Konkurs Przedmiotowy z Chemii III etap
 KOD Ucznia Wojewódzki Konkurs Przedmiotowy z Chemii III etap Termin: 05. 04. 2004 r Czas pracy: 90 minut Ilość punktów za rozwiązanie zadań Razem Podpis Część I Cześć II Cześć III Zadania zamknięte i otwarte
KOD Ucznia Wojewódzki Konkurs Przedmiotowy z Chemii III etap Termin: 05. 04. 2004 r Czas pracy: 90 minut Ilość punktów za rozwiązanie zadań Razem Podpis Część I Cześć II Cześć III Zadania zamknięte i otwarte
Test diagnostyczny. Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł. Część A (0 5) Standard I
 strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
Układ okresowy pierwiastków chemicznych, budowa atomu. Na podstawie fragmentu układu okresowego pierwiastków odpowiedz na pytania:
 Układ okresowy pierwiastków chemicznych, budowa atomu zestaw I Na podstawie fragmentu układu okresowego pierwiastków odpowiedz na pytania: Zad 1 (0-1pkt)Wskaż nazwę pierwiastka, który leży w drugiej grupie
Układ okresowy pierwiastków chemicznych, budowa atomu zestaw I Na podstawie fragmentu układu okresowego pierwiastków odpowiedz na pytania: Zad 1 (0-1pkt)Wskaż nazwę pierwiastka, który leży w drugiej grupie
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ REJONOWY
 WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ REJONOWY KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje i postaraj
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ REJONOWY KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje i postaraj
Związki nieorganiczne
 strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
strona 1/8 Związki nieorganiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Typy związków nieorganicznych: kwasy, zasady, wodorotlenki, dysocjacja jonowa, odczyn roztworu,
XXIV KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2016/2017
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 2 maja 217 Im. Jana Kasprowicza INOWROCŁAW XXIV KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 2 maja 217 Im. Jana Kasprowicza INOWROCŁAW XXIV KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
Chemia. 3. Która z wymienionych substancji jest pierwiastkiem? A Powietrze. B Dwutlenek węgla. C Tlen. D Tlenek magnezu.
 Chemia Zestaw I 1. Na lekcjach chemii badano właściwości: żelaza, węgla, cukru, miedzi i magnezu. Który z zestawów badanych substancji zawiera tylko niemetale? A Węgiel, siarka, tlen. B Węgiel, magnez,
Chemia Zestaw I 1. Na lekcjach chemii badano właściwości: żelaza, węgla, cukru, miedzi i magnezu. Który z zestawów badanych substancji zawiera tylko niemetale? A Węgiel, siarka, tlen. B Węgiel, magnez,
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019
 Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 9 MARCA 2016 R. 1. Test konkursowy zawiera 10 zadań. Są to zadania otwarte, za które maksymalnie możesz
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 9 MARCA 2016 R. 1. Test konkursowy zawiera 10 zadań. Są to zadania otwarte, za które maksymalnie możesz
a) Sole kwasu chlorowodorowego (solnego) to... b) Sole kwasu siarkowego (VI) to... c) Sole kwasu azotowego (V) to... d) Sole kwasu węglowego to...
 Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
Karta pracy nr 73 Budowa i nazwy soli. 1. Porównaj wzory sumaryczne soli. FeCl 2 Al(NO 3 ) 3 K 2 CO 3 Cu 3 (PO 4 ) 2 K 2 SO 4 Ca(NO 3 ) 2 CaCO 3 KNO 3 PbSO 4 AlCl 3 Fe 2 (CO 3 ) 3 Fe 2 (SO 4 ) 3 AlPO 4
KONKURS Z CHEMII. dla uczniów szkół podstawowych województwa warmińsko-mazurskiego w roku szkolnym 2018/2019
 1 Nr zad. pkt 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 SUMA pkt. % KOD UCZNIA... KONKURS Z CHEMII dla uczniów szkół podstawowych województwa warmińsko-mazurskiego w roku szkolnym 2018/2019 E L I M I N A
1 Nr zad. pkt 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 SUMA pkt. % KOD UCZNIA... KONKURS Z CHEMII dla uczniów szkół podstawowych województwa warmińsko-mazurskiego w roku szkolnym 2018/2019 E L I M I N A
Informacja do zadań 1. 2. Woda morska zawiera średnio 3,5% soli.
 Informacja do zadań 1. 2. Woda morska zawiera średnio 3,5% soli. Zadanie 1. (0.1) Które zdanie jest prawdziwe? A. W 100 g wody morskiej znajduje się 3,5 g soli. B. W 103,5 g wody morskiej znajduje się
Informacja do zadań 1. 2. Woda morska zawiera średnio 3,5% soli. Zadanie 1. (0.1) Które zdanie jest prawdziwe? A. W 100 g wody morskiej znajduje się 3,5 g soli. B. W 103,5 g wody morskiej znajduje się
II Etap rejonowy 28 styczeń 2019 r. Imię i nazwisko ucznia: Czas trwania: 60 minut
 XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
Materiały i tworzywa pochodzenia naturalnego
 Materiały i tworzywa pochodzenia naturalnego 1. Przyporządkuj opisom odpowiadające im pojęcia. Wpisz litery (A I) w odpowiednie kratki. 3 p. A. hydraty D. wapno palone G. próchnica B. zaprawa wapienna
Materiały i tworzywa pochodzenia naturalnego 1. Przyporządkuj opisom odpowiadające im pojęcia. Wpisz litery (A I) w odpowiednie kratki. 3 p. A. hydraty D. wapno palone G. próchnica B. zaprawa wapienna
DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 STOPIEŃ REJONOWY R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.01.2018 R. 1. Test konkursowy zawiera 18 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.01.2018 R. 1. Test konkursowy zawiera 18 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik. Drogi gimnazjalisto!
 KOD UCZNIA:.. Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik Drogi gimnazjalisto! 1. Przed Tobą zestaw 22 zadań konkursowych, za rozwiązanie których możesz uzyskać 35 punktów. 2. Na rozwiązanie
KOD UCZNIA:.. Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik Drogi gimnazjalisto! 1. Przed Tobą zestaw 22 zadań konkursowych, za rozwiązanie których możesz uzyskać 35 punktów. 2. Na rozwiązanie
WOJEWÓDZKI KONKURS CHEMICZNY
 WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ SZKOLNY 16.11.2012 KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ SZKOLNY 16.11.2012 KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 31 stycznia 2019 r. zawody II stopnia (rejonowe) Schemat punktowania zadań
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 31 stycznia 2019 r. zawody II stopnia (rejonowe) Maksymalna liczba punktów 40. 85% 34 pkt. Schemat punktowania zadań Uwaga! 1. Wszystkie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 31 stycznia 2019 r. zawody II stopnia (rejonowe) Maksymalna liczba punktów 40. 85% 34 pkt. Schemat punktowania zadań Uwaga! 1. Wszystkie
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa kujawsko-pomorskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa kujawsko-pomorskiego w roku szkolnym 2014/2015 KOD UCZNIA Etap: Data: Czas pracy: szkolny 22 listopada 2014 r. 60 minut Informacje
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa kujawsko-pomorskiego w roku szkolnym 2014/2015 KOD UCZNIA Etap: Data: Czas pracy: szkolny 22 listopada 2014 r. 60 minut Informacje
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
Zadanie 3 (3 pkt) Przyporządkuj substancje oznaczone numerami od 1 do 8 odpowiednim kategoriom (A-C). Wstaw znak X we właściwe miejsca tabeli.
 SUBSTANCJE I ICH PRZEMIANY Zadanie 1 (2 pkt) Tabela obok przedstawia wyznaczone przez uczniów koła chemicznego objętości i masy różnych próbek metali. Określ, który metal ma najmniejszą (a), a który największą
SUBSTANCJE I ICH PRZEMIANY Zadanie 1 (2 pkt) Tabela obok przedstawia wyznaczone przez uczniów koła chemicznego objętości i masy różnych próbek metali. Określ, który metal ma najmniejszą (a), a który największą
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2010/2011
 Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2010/2011 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
Kuratorium Oświaty w Lublinie Kod ucznia KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2010/2011 ETAP SZKOLNY Drogi Uczniu, witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 3 STYCZNIA 2019 R. 1. Test konkursowy zawiera 12 zadań. Są to zadania zamknięte i
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 3 STYCZNIA 2019 R. 1. Test konkursowy zawiera 12 zadań. Są to zadania zamknięte i
Międzyszkolny konkurs chemiczny KWAS Etap I szkolny
 Warszawa 10 marca 2008r. Międzyszkolny konkurs chemiczny KWAS Etap I szkolny Kod ucznia: Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Maksymalna ilość 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Liczba uzyskana
Warszawa 10 marca 2008r. Międzyszkolny konkurs chemiczny KWAS Etap I szkolny Kod ucznia: Zadanie 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Maksymalna ilość 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Liczba uzyskana
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
Wodorotlenki O O O O. I n. I. Wiadomości ogólne o wodorotlenkach.
 Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Wodorotlenki I. Wiadomości ogólne o wodorotlenkach. Wodorotlenki są to związki chemiczne zbudowane z atomu metalu i grupy wodorotlenowej. Wzór ogólny wodorotlenków: wartościowość metalu M n ( ) grupa wodorotlenowa
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Imię i nazwisko Klasa Punkty (max 12) Ocena
 Rozdział 1. grupa A Imię i nazwisko Klasa Punkty (max 12) Ocena Data Zadanie 1. (1 pkt) Podkreśl właściwości dotyczące ditlenku węgla: gaz, rozpuszczalny w wodzie, bezbarwny, palny, żółty, powoduje zmętnienia
Rozdział 1. grupa A Imię i nazwisko Klasa Punkty (max 12) Ocena Data Zadanie 1. (1 pkt) Podkreśl właściwości dotyczące ditlenku węgla: gaz, rozpuszczalny w wodzie, bezbarwny, palny, żółty, powoduje zmętnienia
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 16.03. 2010 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III numer zadania numer
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 16.03. 2010 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III numer zadania numer
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013 KOD UCZNIA Etap: Data: Czas pracy: rejonowy 21 stycznia 2013 r. 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013 KOD UCZNIA Etap: Data: Czas pracy: rejonowy 21 stycznia 2013 r. 90 minut Informacje dla ucznia
KONKURS CHEMICZNY ETAP WOJEWÓDZKI 2010/2011
 KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1. Przeczytaj uważnie instrukcje i postaraj się prawidłowo odpowiedzieć na wszystkie pytania. 2. Przed tobą test składający się z 18 zadań:
KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1. Przeczytaj uważnie instrukcje i postaraj się prawidłowo odpowiedzieć na wszystkie pytania. 2. Przed tobą test składający się z 18 zadań:
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013 KOD UCZNIA etap: data: czas pracy: szkolny 28 listopada 2012 r. 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013 KOD UCZNIA etap: data: czas pracy: szkolny 28 listopada 2012 r. 90 minut Informacje dla ucznia
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
do zadań na konkurs z chemii etapu szkolnego w roku szkolnym 2018/2019 KONKURS Z CHEMII
 K L U C Z O D P O W I E D Z I Nr zad. do zadań na konkurs z chemii etapu szkolnego w roku szkolnym 2018/2019 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 pkt. 5 3 1 6 3 3 7 2 3 2 1 3 1 4 5 4 SUMA pkt. % 53 100
K L U C Z O D P O W I E D Z I Nr zad. do zadań na konkurs z chemii etapu szkolnego w roku szkolnym 2018/2019 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 pkt. 5 3 1 6 3 3 7 2 3 2 1 3 1 4 5 4 SUMA pkt. % 53 100
Kod ucznia... Czas trwania: 100 minut. Arkusz zawiera 17 zadań. Liczba punktów możliwych do uzyskania: 55 pkt.
 XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
Wojewódzki Konkurs Przedmiotowy. dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: Rejonowy 17 stycznia 2014 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: Rejonowy 17 stycznia 2014 90 minut Informacje dla ucznia
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin 20.01.2010 r. godz. 9 00 Czas pracy: 90 minut ETAP II Ilość punktów za rozwiązanie zadań Część I Część II Ilość punktów za zadanie Ilość punktów
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin 20.01.2010 r. godz. 9 00 Czas pracy: 90 minut ETAP II Ilość punktów za rozwiązanie zadań Część I Część II Ilość punktów za zadanie Ilość punktów
5. STECHIOMETRIA. 5. Stechiometria
 5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019. ETAP I r. Godz Zadanie 1 (10 pkt)
 XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
Zapisz równanie zachodzącej reakcji. Wskaż pierwiastki, związki chemiczne, substraty i produkty reakcji.
 test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI
 Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2014/2015
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 23 maja 2015 Im. Jana Kasprowicza INOWROCŁAW XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 23 maja 2015 Im. Jana Kasprowicza INOWROCŁAW XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
WYPEŁNIA KOMISJA KONKURSOWA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
Substancje chemiczne Powietrze
 strona 1/9 Substancje chemiczne Powietrze Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Substancje i przemiany chemiczne w otoczeniu człowieka. Metale i niemetale, mieszaniny,
strona 1/9 Substancje chemiczne Powietrze Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Substancje i przemiany chemiczne w otoczeniu człowieka. Metale i niemetale, mieszaniny,
Zadanie 4. Mrówczan metylu ma taki sam wzór sumaryczny jak: A. octan etylu. C. kwas mrówkowy. B. octan metylu. D. kwas octowy.
 Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 3 marca 2011 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 3 marca 2011 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
