Strategie przetrwania herpeswirusów latencja i apoptoza Herpesviruses survival strategies latency and apoptosis
|
|
|
- Wanda Nowak
- 8 lat temu
- Przeglądów:
Transkrypt
1 Postepy Hig Med Dosw (online), 2013; 67: e-issn Review Received: Accepted: Published: Strategie przetrwania herpeswirusów latencja i apoptoza Herpesviruses survival strategies latency and apoptosis Dariusz Miszczak 2, Anna Słońska 1, Anna Golke 1, Joanna Cymerys 1 1 Division of Virology, Department of Preclinical Sciences, Faculty of Veterinary Medicine, Warsaw University of Life Sciences SGGW 2 Interfaculty Studies of Biotechnology, Warsaw University of Life Sciences SGGW Streszczenie Apoptoza to proces śmierci komórki zachodzący pod wpływem różnych bodźców, do których należą m.in. zakażenia wirusowe. Herpeswirusy wykształciły zdolność zarówno hamowania apoptozy, jak i jej indukowania w komórkach gospodarza. Wirusy te potrafią ingerować w szlak zewnętrzny i wewnętrzny apoptozy. Szczególną cechą herpeswirusów jest ustanawianie zakażenia latentnego, podczas którego ekspresja genów wirusowych jest bardzo ograniczona i nie obserwuje się wytwarzania zakaźnych cząstek wirusowych. HSV-1 ustala latencję w neuronach, CMV w komórkach progenitorowych szpiku kostnego i monocytach, a EBV i HHV-8 w limfocytach B. Badania wykazały, że zakażenia latentne komórek gospodarza zależą także od zahamowania śmierci zakażonych komórek. Kontrola maszynerii apoptotycznej przez wirusy może być istotna dla ich replikacji oraz zapewnienia wytworzenia odpowiedniej liczby wirionów potomnych. W pracy omówiono latentne zakażenia wirusowe i mechanizmy modulacji apoptozy na wybranych przykładach wirusów z rodziny Herpesviridae. Słowa kluczowe: herpeswirusy latencja apoptoza reaktywacja Summary Apoptosis is a process of programmed cell death in response to various stimuli, including virus infection. Herpesviruses have evolved the ability to interfere with apoptosis by its inhibition or activation in host cells. They can interfere with the extrinsic and intrinsic pathways of apoptosis. A special feature of herpesviruses is establishing a latent infection, during which expression of virus genes is strongly restricted and production of infectious virus particles is not observed. HSV-1 establishes latency in neurons, CMV in bone marrow progenitor cells and monocytes, EBV and HHV-8 in B cells. Studies show that latent infections also depend on prevention of the death of the infected cells. Control of apoptosis machinery by viruses may be critical for their reproduction and provision of the adequate yield of progeny virions. The present article summarizes the current knowledge about the latent viral infection and mechanisms of apoptosis modulation by selected viruses from the Herpesviridae family. Keywords: Full-text PDF: Word count: Tables: Figures: References: herpesviruses latency apoptosis reactivation Postepy Hig Med Dosw (online), 2013; 67
2 Dariusz Miszczak i wsp. Strategie przetrwania herpeswirusów... Author s address: Wykaz skrótów: W procesie apoptozy można wyróżnić następujące etapy fazę inicjatorową (wzbudzenia), podczas której komórki otrzymują sygnały, mogące prowadzić do aktywacji szlaków PCD, fazę wykonawczą obejmującą transdukcję sygnału do systemu bezpośrednich wykonawców śmierci oraz zwiądr Joanna Cymerys, Zakład Wirusologii, Katedra Nauk Przedklinicznych, Wydział Medycyny Weterynaryjnej, Szkoła Główna Gospodarstwa Wiejskiego w Warszawie SGGW, ul. Ciszewskiego 8, Warszawa; jcymerys@op.pl ADV wirus choroby Aujeszky ego (Aujeszky s disease virus), AIF czynnik indukujący apoptozę (apoptosis inducing factor), ANA antygen jądrowy LANA (latency associated nuclear antigen), BHV-1 bydlęcy herpeswirus typu 1 (bovine herpesvirus 1), BLIMP1 czynnik transkrypcyjny BLIMP 1 (B lymphocyte-induced maturation protein 1), c/v-flip komórkowe/wirusowe białko FLIP (cellular/viral FLICE inhibitory protein), EBV wirus Epsteina-Barr (Epstein-Barr virus), FADD białko adaptorowe FADD (Fas associated death domain), HHV-1; HSV-1 ludzki herpeswirus typu 1; wirus opryszczki pospolitej typu 1(human herpesvirus type 1; herpes simplex virus type 1), HHV- 2; HSV-2 ludzki herpeswirus typu 2; wirus opryszczki typu 2 (human herpesvirus type 2; herpes simplex virus type 2), HHV-3; VZV ludzki herpeswirus typu 2; wirus ospy wietrznej/półpaśca (human herpesvirus type 3; varicella-zoster virus), HHV-4; EBV ludzki herpeswirus typu 4; wirus Epsteina-Barr (human herpesvirus type 4; Epstein-Barr virus), HHV-5; CMV ludzki herpeswirus typu 5; wirus cytomegalii (human herpesvirus type 5; cytomegalovirus), HHV-6; HHV-7 wirusy rumienia nagłego (gorączka trzydniowa) (human herpesvirus type 6; human herpesvirus type 7), HHV-8; KSHV ludzki herpeswirus typu 8; wirus mięsaka Kaposiego (human herpesvirus type 8; Kaposi s sarcoma associated herpesvirus), IAP białkowy inhibitor apoptozy (inhibitor of apoptosis protein), K-bZIP regulator transkrypcyjny K-bZIP (KSHV basic zipper), LAT transkrypt związany z latencją (latency associated transcript), LRP białko LRP (latency related protein), MIEP główny promotor genów przedwczesnych (major intermediate early promoter), PCD programowana śmierć komórki, apoptoza (programmed cell death, apoptosis), RISC kompleks wyciszający RNA (RNA induced silencing complex), SAPK kinaza białkowa SAPK (stress activated protein kinase), TNF-α czynniki martwicy nowotworu alfa (tumor necrosis factor α), TRADD białko adaptorowe TRADD (TNF receptor associated death domain). Wprowadzenie Herpeswirusy są dużymi osłonkowymi wirusami, których genomem jest dwuniciowy DNA o wielkości kb. W taksonomii herpeswirusów wyróżniono trzy podrodziny: Alphaherpesvirinae, Betaherpesvirinae, Gammaherpesvirinae. Herpeswirusy patogenne dla człowieka reprezentują wszystkie podrodziny Herpesviridae. Do pierwszej podrodziny zalicza się HSV-1 (HHV-1) i HSV-2 (HHV- 2) (wirusy opryszczki pospolitej) oraz HHV-3 (wirus ospy wietrznej i półpaśca VZV). Podrodzinę Betaherpesvirinae reprezentują: ludzki cytomegalowirus CMV (HHV-5) oraz ludzkie herpeswirusy typu 6 i 7 (HHV-6 i HHV-7). Przedstawicielami Gammaherpesvirinae są natomiast wirus Epsteina-Barr (HHV-4) oraz ludzki herpeswirus typu 8 (HHV-8). Wspólną cechą herpeswirusów jest zdolność do latencji [7], która może być zdefiniowana jako brak zakaźnych cząstek wirusowych w komórce gospodarza z jednoczesną możliwością ich wytwarzania w sprzyjających warunkach [18]. W trakcie latencji cały wirusowy genom znajduje się w komórce, a jego ekspresja jest bardzo ograniczona. Aby dane zakażenie można było zakwalifikować jako zakażenie latentne, muszą zostać spełnione dwa warunki. Zakażenie musi być trwałe, czyli utrzymane mimo odpowiedzi ze strony układu immunologicznego gospodarza, a także w obliczu innych niesprzyjających sygnałów w środowisku komórki. Musi to być zakażenie odwracalne, a więc w określonych okolicznościach dochodzi do reaktywacji wirusa, czyli następuje pełna ekspresja wirusowych genów z jednoczesnym wytwarzaniem wirionów potomnych, co jest określane jako zakażenie produktywne [48]. Latencja jest zjawiskiem swoistym komórkowo, co oznacza, że wirus wywołuje zakażenie latentne tylko w określonych komórkach. Podział herpeswirusów na podrodziny odzwierciedla ich tropizm do różnych typów komórek gospodarza: alfa- -herpeswirusy ustalają zakażenie latentne głównie w neuronach, beta-herpeswirusy w subpopulacjach komórek hematopoetycznych, natomiast miejscem latencji gamma- -herpeswirusów są limfocty B (tab. 1) [40]. Jednym z mechanizmów obronnych skierowanych przeciwko wewnątrzkomórkowym czynnikom chorobotwórczym jest programowana śmierć komórki, czyli apoptoza. Podczas apoptozy degradacji ulegają białka i kwasy nukleinowe zarówno komórki, jak i wirusa, który do niej wtargnął. W ten sposób śmierć zakażonej komórki zapobiega rozprzestrzenianiu się zakażenia. W interesie wirusów leży więc przeciwdziałanie zniszczeniu komórek, które są miejscem ich replikacji. Co więcej, w przypadku herpeswirusów, których główną strategią przetrwania w środowisku jest zdolność do ustalania zakażenia latentnego, możliwość zablokowania śmierci komórki poprzez oddziaływanie na szlaki apoptotyczne odgrywa główną rolę. 277
3 Postepy Hig Med Dosw (online), 2013; tom 67: Tabela 1. Komórki docelowe replikacji oraz komórki zakażone latentnie przez herpeswirusy Podrodzina Wirus Komórki docelowe replikacji Komórki zakażone latentnie Alphaherpesvirinae HSV-1 nabłonkowe i keratynocyty neurony HSV-2 nabłonkowe i keratynocyty neurony VZV nabłonkowe, śródbłonkowe, Langerhansa, keratynocyty, limfocyty T, sebocyty, monocyty, jednojądrzaste komórki krwi obwodowej neurony BHV-1 nabłonkowe neurony EHV-1 nabłonkowe, leukocyty leukocyty, neurony PRV nabłonkowe neurony Betaherpesvirinae HCMV makrofagi, kom. dendrytyczne, nabłonkowe, mięśni gładkich, śródbłonkowe i fibroblasty komórki szpiku kostnego CD34 + monocyty HHV-6 limfocyty T komórki progenitorowe szpiku kostnego HHV-7 limfocyty T limfocyty T Gammaherpesvirinae EBV limfocyty B i kom. nabłonkowe limfocyty B Opracowano na podstawie [3,10,40] HHV-8 limfocyty limfocyty B zaną z aktywacją proteaz i ich regulatorów, a także fazę zniszczenia, podczas której aktywne proteazy niszczą struktury komórkowe, zarówno bezpośrednio, jak i pośrednio, poprzez aktywację innych enzymów. W tej fazie dochodzi do fragmentacji DNA, rozbicia cytoszkieletu, formowania ciałek apoptotycznych oraz ich fagocytozy przez otaczające, nieuszkodzone komórki tkanki lub narządu [15,36]. Modulacja apoptozy podczas zakażenia latentnego Wirusy w trakcie ewolucji wykształciły mechanizmy ingerowania w szlaki przebiegu apoptozy, aby w ten sposób dostosować czas życia i śmierci komórki do własnych potrzeb. Z jednej strony wirusy blokują apoptozę, zapobiegając przedwczesnej śmierci komórki, gdyż ich replikacja jest całkowicie od niej uzależniona. Z drugiej strony niektóre wirusy mają zdolność indukcji apoptozy, aby w ten sposób móc łatwiej rozprzestrzenić się na sąsiadujące komórki, bez wywoływania odpowiedzi zapalnej [24,38]. Mogą również ingerować w szlaki apoptozy na różnych etapach ich przebiegu. Produkty genów wirusowych mogą wpływać na przekazanie sygnału do komórki, szlak indukcji apoptozy związany z interferonem, a ponadto mogą stanowić homologii białek Bcl-2, inhibitory kaspaz, manipulatory cyklu komórkowego, regulatory stresu oksydacyjnego, kinazy białkowe, czynniki transkrypcyjne i czynniki działające na siateczkę śródplazmatyczną, aby mieć możliwość efektywnego namnożenia się w komórce (ryc. 1) [24]. Latencja wirusa herpes simplex typu 1 Wirus opryszczki pospolitej (herpes simplex virus HSV-1) po wniknięciu do organizmu, odbywającym się na ogół przez bezpośredni kontakt błony śluzowej przedsionka jamy ustnej, replikuje się w komórkach nabłonkowych i wnika do zakończeń neuronów czuciowych w pobliżu miejsca pierwotnej replikacji. Wirion HSV-1 poprzez transport aksonalny przemieszcza się do ciała komórek nerwowych umiejscowionych w zwoju nerwu trójdzielnego [7]. Ustanowienie zakażenia latentnego wiąże się z wygaszeniem ekspresji genów przedwczesnych, odpowiedzialnych za aktywację pozostałych genów. Prawdopodobnie odbywa się to na skutek utraty funkcji białka VP16 lub zablokowania genów przedwczesnych, mimo obecności funkcji VP16. Białko to jest składnikiem tegumentu wirusa i wraz z białkami komórkowymi: HCF-1 (host cell factor-1) i Oct odpowiada za uruchomienie pełnej ekspresji genów wirusowych [40]. Najnowsze doniesienia [11] wskazują również na rolę układu immunologicznego w procesie ustanowienia latencji. Dowiedziono, iż interferon alfa jest konieczny do skutecznego ustanowienia latencji przez herpeswirusy. Zakażenie latentne polega na przetrwaniu genomu wirusowego w komórce oraz utrzymaniu komórki przy życiu. Jedynym transkryptem wykrywanym w latentnie zakażonej komórce jest transkrypt związany z latencją (latency associated transcript LAT). Jego promotor ma miejsca wiązania dla czynników transkrypcyjnych swoistych dla neuronów oraz w przeciwieństwie do promotorów genów uczestniczących w fazie litycznej jest powiązany z histonami wykazującymi cechy aktywnej transkrypcyjnie euchromatyny. Dotąd nie wykazano, aby LAT kodował jakiekolwiek białko. Raczej uznaje się, że LAT jest przekształcany w cząsteczki mirna i przynajmniej jedna z nich ma zdolność do wyciszania mrna kodowanych przez przedwczesny gen ICP0, który może indukować ekspresję innych genów wirusowych i w ten sposób aktywować cykl lityczny [40]. LAT wykrywany jest głównie w jądrze komórkowym, ale jest także obecny w cytoplazmie, związany z polirybosomami lub czynnikami odpowiadającymi za splicing. Locus 278
4 Dariusz Miszczak i wsp. Strategie przetrwania herpeswirusów... Ryc. 1. Schemat ingerencji herpeswirusów w szlaki apoptotyczne. Wirusy i produkty genów wirusowych promujące apoptozę są oznaczone na zielono, natomiast hamujące apoptozę na czerwono. Opracowanie własne na podstawie [24] LAT koduje małe niekodujące RNA, które mogą odpowiadać za regulację ekspresji genów. LAT mir-h6 zmniejsza stężenie białka ICP4, natomiast LAT mir-h2-3p zmniejsza stężenie białka ICP0. Oba rodzaje mirna nie mają wpływu na poziom cząsteczek mrna, które je kodują. Blokowanie syntezy białek ICP0 i ICP4 przez mirna sugeruje, że mogą być ważne w ustanowieniu lub utrzymaniu zakażenia latentnego [41]. Istotną rolę w reaktywacji zakażenia latentnego HSV-1 odgrywa odpowiedź centralnego i obwodowego układu nerwowego na uraz, stres czy immunosupresję. Stres podwyższa poziom kortykosteroidów, które z kolei wpływają na aktywność neuronów. Stwierdzono, że deksametazon, syntetyczny kortykosteroid, aktywuje ekspresję genów wirusowych i stymuluje miejsce replikacji HSV-1 (ori-l) w komórkach nerwowych [41]. Białkiem najczęściej uznawanym za induktora reaktywacji jest ICP0. Na modelach zwierzęcych dowiedziono, iż wirusy z mutacją w tym genie wyraźnie nie wykazują zdolności do reaktywacji. Bezpośrednim zdarzeniem rozpoczynającym reaktywację jest prawdopodobnie ekspresja białka VP16 de novo, na skutek aktywacji jego promotora pod wpływem czynników stresowych [40]. Jak już wcześniej wspomniano, główną rolę w ochronie komórki przed bodźcami apoptotycznymi podczas latencji zapewnia LAT. Główny LAT (major LAT mlat) obejmuje transkrypt o długości 8,3 kb zaczynający się od nukleotydu do miejsca poliadenylacji nukleotyd [2]. Pierwotny 8,3 kb LAT ulega splicingowi, dając stabilny 2,0 kb intron z dosyntetyzowanym ogonkiem polya [31,39]. Badania wykazały, iż LAT wpływa na akumulację transkryptów (Bcl-XL i Bcl-XS), których białka biorą udział w regulacji apoptozy. Hamuje akumulację proapoptotycznego Bcl-XS, co wskazuje, że LAT nasila splicing Bcl-X w kierunku antyapoptotycznego Bcl-XL lub stabilizuje Bcl-XL RNA i jednocześnie destabilizuje Bcl-XS RNA [39]. Badania Li i wsp. [31], wskazują na in- 279
5 Postepy Hig Med Dosw (online), 2013; tom 67: terakcje sekwencji kodowanych przez LAT (bezpośrednio lub pośrednio) z białkową kinazą serynowo-treoninową Akt, znaną także jako kinaza białkowa B (protein kinase B PKB). Wpływa m.in. na fosforylację Akt (seryna 473) podczas indukcji apoptozy, wywołanej niedoborem surowicy w komórkach mysiej neuroblastomy. Podczas zakażenia produktywnego HSV-1 bardzo ważną rolę pełni wirusowa kinaza serynowo-treoninowa Us3, która fosforyluje białka w obrębie sekwencji bogatych w argininę. We współpracy z Us5 silnie hamuje apoptozę zaindukowaną zarówno aktywacją receptora Fas, jak i pod wpływem promieniowania UV [24,38]. Przypisuje się jej także inne role, takie jak: regulacja opuszczania jądra przez nukleokapsydy wirusa czy obniżenie ilości osłonkowej glikoproteiny B na powierzchni komórki [35,45]. Kinaza białkowa Us3 może także powodować hiperfosforylację deacetylazy histonowej 2, która wycisza transkrypcję wirusowego DNA, a w efekcie replikację wirusa, powodując deacetylację lizyny w ogonkach histonowych, co skutkuje kondensacją chromatyny [53]. Mechanizm działania kinazy Us5 nie został jeszcze poznany, za to dowiedziono, że w zakażonych komórkach jest umiejscowiona w różnych strukturach błonowych i może wpływać na generowanie reaktywnych form tlenu, których wpływ na apoptozę jest złożony (zarówno pro- jak i antyapoptotyczny) [4]. Ekspresja Us5 chroni przed apoptozą indukowaną granzymem B i aktywacją receptora Fas [21]. Ochronę przed śmiercią komórki zapewnia także podjednostka R1 reduktazy rybonukleotydowej występująca zarówno u HSV-1 jak i HSV-2. Chroni ona komórkę przed apoptozą spowodowaną przez TNF-α i FasL pod wpływem oddziaływania z kaspazą 8. Dokładniejszy mechanizm działania został zaproponowany dla podjednostki R1 należącej do HSV-2 [14]. Ostatnim już białkiem uczestniczącym w ochronie komórki przed apoptozą jest glikoproteina D, która dodatkowo odgrywa ważną rolę w procesie przenikania HSV-1 do komórki gospodarza. Badania nad tą glikoproteiną wskazują, że ma ona oddzielne domeny pełniące dwie różne funkcje: wniknięcie do komórki i hamowanie apoptozy [55]. Aubert i wsp. [5], zaproponowali nowy mechanizm zapobiegający śmierci komórki przez HSV-1. Wykazali, że HSV-1 hamuje apoptozę zakażonych ludzkich komórek nabłonkowych przez niedopuszczenie do uwolnienia cytochromu c z mitochondrium niezależnie od aktywacji kaspaz. Mechanizm tego zjawiska opiera się na blokowaniu translokacji proapoptotycznego białka Bax do mitochondriów. HSV-1 poza blokowaniem programowanej śmierci komórki, ma także zdolność wytwarzania czynników, mogących indukować apoptozę w komórkach układu immunologicznego limfocytach T, limfocytach B, makrofagach i komórkach dendrytycznych [21,27]. Apoptoza w komórkach dendrytycznych przez HSV-1 jest spowodowana przez obniżenie ekspresji komórkowych białek blokujących aktywację kaspazy 8 cflip (na poziomie białka przez wirusowe lub komórkowe proteazy), a także zmniejszenie ekspresji LAT [27,33]. Mechanizm wywołania apoptozy w limfocytach T nie jest do końca wyjaśniony, ale odkryto, że wirus opryszczki podczas infekcji blokuje transdukcję sygnału spowodowaną aktywacją receptora TcR [21]. Latencja wirusa cytomegalii cmv powoduje długotrwałe zakażenie latentne komórek hematopoetycznych linii mieloidalnej. Dzięki technice PCR, DNA tego wirusa wykryto w komórkach o fenotypie CD34 i CD33 w szpiku, a także w jednojądrzastych komórkach krwi obwodowej o fenotypie CD14 [47]. Badania Reevesa i wsp. [44] wykazują, że CMV występuje także w progenitorowych komórkach dendrytycznych pochodzących z linii mieloidalnej. Ustanowienie latencji jest bezpośrednio związane z procesem wyciszenia genów przedwczesnych. Ekspresja genów wirusa cytomegalii, podobnie jak innych herpeswirusów, następuje w sposób kaskadowy. Głównymi transaktywatorami ekspresji genów są białka IE1 oraz IE2 [47]. Ekspresja obu białek pozostaje pod kontrolą głównego promotora genów przedwczesnych (major intermediate early promoter MIEP), który jest uzależniony od białka pp71 będącego składnikiem tegumentu. Po zakażeniu komórki pp71 przemieszcza się do jądra komórkowego i aktywuje MIEP przez inaktywację komórkowych mechanizmów obronnych wyciszających ekspresję genów CMV, co umożliwia replikację lityczną. Szczególnym wydarzeniem w przeciwdziałaniu temu procesowi jest degradacja białka Daxx zaindukowana przez pp71. Jak wcześniej wspomniano, podczas ustanawiania latencji nie dochodzi do ekspresji genów przedwczesnych CMV. Przypuszczalnie następuje to w wyniku utraty funkcji przez pp71, blokowanie IE lub kombinację obu mechanizmów. Wydaje się, iż w populacji komórek CD34 + oba mechanizmy są wykorzystywane, a degradacja Daxx przez pp71 jest niemożliwa ze względu na brak transportu pp71 do jądra komórkowego [40]. Utrzymanie latencji przez CMV jest słabo poznane. W przeciwieństwie do innych beta-herpeswirusów, które mają zdolność insercji genomu do genomu komórkowego, genom CMV w czasie latencji jest episomalną, kolistą cząsteczką [40]. Podczas latencji CMV ekspresji ulega tylko kilka genów, do których należą CLTs, US28, vil-10, LUNA i UL138. CLTs (CMV latency transcripts) są sensownymi i antysensownymi cząsteczkami RNA mogącymi ulegać translacji. US28 jest receptorem dla chemokiny, którego rola w latencji nie została jeszcze zbadana. vil-10 jest wirusowym analogiem IL-10, która może zapewniać ochronę przed nadzorem immunologicznym. LUNA (latency unidentified nuclear antigen) stanowi ramkę odczytu kodowaną przez transkrypt antysensowny do regionu genomu UL81-UL82. LUNA może być białkiem funkcjonalnym, a transkrypt ma możliwość regulacji ekspresji pp71 de novo (pp71 kodowany jest przez gen UL82). UL138 koduje białko niezbędne do utrzymania latencji [40]. Wykazano, iż przerwanie sekwencji kodującej tego genu uniemożliwiło ustanowienie latencji i doprowadziło do produktywnej replikacji wirusa. Gen ten koduje trzy 280
6 Dariusz Miszczak i wsp. Strategie przetrwania herpeswirusów... transkrypty, z których otrzymywanych jest następnie kilka białek (pul133, pul135, pul136, pul138), co dowodzi, że może być genem odpowiadającym za koordynację ekspresji genów odpowiedzialnych za latencję [19]. Różnicowanie się monocytów krwi obwodowej prowadzi do powstania fenotypu pozwalającego na infekcję, a w komórkach, które przetrzymywały genom wirusowy w stanie utajonym umożliwia to indukcję ekspresji genów przedwczesnych. Sugeruje to, że ekspresja genów przedwczesnych jest zależna od stopnia zróżnicowania komórki. Procesowi różnicowania towarzyszy wzrost poziomu aktywatorów MIEP i dlatego wydaje się prawdopodobne, że stan latencji CMV jest uzależniony od równowagi między aktywatorami i represorami genów przedwczesnych tego wirusa. Zmiany zachodzące podczas różnicowania się monocytów w makrofagii prowadzą do obniżenia poziomu represorów i wzrostu poziomu aktywatorów, co uaktywnia MIEP, ekspresję genów przedwczesnych oraz pozostałych, co z kolei skutkuje reaktywacją i uwolnieniem zakaźnych cząstek wirusowych [47]. Indukcja reaktywacji CMV jest procesem nie do końca poznanym. Zaproponowano dwa modele: ekspresję de novo komórkowych czynników transkrypcyjnych swoistych dla MIEP po różnicowaniu lub syntezę de novo białka pp71 [40]. CMV ma dwa geny przedwczesne, których produkty w sposób niezależny blokują apoptozę. IE1 i IE2 są czynnikami transkrypcyjnymi; IE2 wiążą się z białkami oddziałującymi z sekwencjami TATA box prb i p53. Wykazano, że IE2 hamuje aktywność transkrypcyjną p53, co może świadczyć o jego zdolności do zapobiegania śmierci komórki [38]. Najlepiej scharakteryzowanym czynnikiem CMV jest produkt genu UL37, znany jako vmia (viral mitochondria localized inhibitor of apoptosis), który hamuje apoptozę indukowaną różnymi bodźcami (np. aktywacja receptora śmierci czy substancje cytotoksyczne). Mimo że vmia nie wykazuje żadnego strukturalnego podobieństwa do Bcl-2, zapobiega permeabilizacji błony mitochondrialnej na poziomie mitochondrium poprzez neutralizację Bax [16]. Inny gen CMV UL36 koduje wirusowy inhibitor aktywacji kaspazy 8 (viral inhibitor of caspase 8 activation vica), który blokuje apoptozę indukowaną aktywacją receptora Fas przez wiązanie się do prodomeny kaspazy 8 i uniemożliwienie autoproteolitycznej aktywacji. Ostatnio odkryto inny mechanizm, który opiera się na interakcji 2,7 kb wirusowego RNA (β2,7) z kompleksem I łańcucha oddechowego. Zapobiega to uwolnieniu z mitochondrium podjednostki GRIM-19 kompleksu I [16]. Latencja wirusa Epsteina-Barr Podczas zakażenia wirusem Epsteina-Barr (Epstein-Barr Virus EBV), w fazie latentnej mogą wystąpić trzy różne modele ekspresji genów, dzięki czemu wyróżnia się trzy typy latencji. Pierwszy typ latencji charakteryzuje się ekspresją EBNA-1 (Epstein-Barr nuclear antigen 1) oraz małe niekodujących RNA EBER1 i EBER2 (EBV Encoded small RNA). Ten model ekspresji genów występuje w przypadku chłoniaka Burkitta. W latencji drugiego typu poza EBNA i EBER występują dodatkowo błonowe antygeny LMP-1, LMP-2A, LMP-2B (latent membrane protein). Jest on charakterystyczny dla takich chorób jak: rak nosogardzieli, chłoniak Hodgkina i chłoniak T- -komórkowy. Podczas utajenia typu trzeciego, występującego w przebiegu chorób limfoproliferacyjnych związanych z immunosupresją dochodzi do ekspresji: EBNA-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C, EBNA-LP, trzech białek błonowych LMP-1, LMP-2A i LMP-2B oraz dwóch EBERs. Ponadto we wszystkich typach latencji występują jeszcze transkrypty z regionu BamH1A genomu wirusa, których funkcja nie jest znana [8]. Wirus Epsteina-Barr wykrywany jest w krwi obwodowej głównie w spoczynkowych limfocytach B. Można go wykryć także w limfocytach Th1 oraz rzadko w monocytach. Po ustanowieniu latencji w spoczynkowych limfocytach B przedostaje się do puli komórek B pamięci. Obecność EBV stwierdzono w: limfocytach B (CD19+, sigd+), które wykazują fenotyp limfoblastów oraz typ III latencji; ośrodkach namnażania limfocytów B (typ II latencji); proliferujących limfocytach B pamięci (typ I latencji) oraz komórkach plazmatycznych, w których EBV uruchamia cykl lityczny. Genom wirusa przechodzi do jądra komórkowego, gdzie staje się kolistą cząsteczką funkcjonującą jako episom [48]. Po pierwotnej infekcji w limfocytach B dochodzi do ustanowienia w nich zakażenia latentnego. Przynajmniej trzy geny fazy litycznej ulegają ekspresji po latentnej infekcji spoczynkowych limfocytów B. Należą do nich homologii białek Bcl-2: BALF1 i BHRF1 oraz białko BZLF1. Dwa pierwsze geny kodują czynniki o aktywności antyapoptotycznej. Gen BZLF1 koduje białko Z, które jest czynnikiem transkrypcyjnym zaangażowanym w aktywację kolejnych klas genów podczas zakażenia litycznego. Rola białka Z podczas ustalania latencji jest odmienna od funkcji, jaką pełni w trakcie reaktywacji, podczas której uruchamia ekspresję wczesnych i późnych genów oraz aktywuje miejsce ori podczas zakażenia produktywnego. Podczas ustanawiania zakażenia latentnego ekspresja genów wczesnych i późnych pozostaje wyciszona, mimo obecności białka Z, co tłumaczy się brakiem metylacji genomu EBV na początku zakażenia. Białko Z wykazuje zdolność silniejszego wiązania się z metylowanym DNA w porównaniu do DNA niemetylowanego, co z kolei zwiększa aktywność metylowanych promotorów. Podczas ustanawiania latencji genom wirusa jest niemetylowany, więc białko Z nie jest w stanie włączyć ekspresji białek wczesnych i późnych [40,48]. Główną rolę w ustaleniu latencji pełni ZIIR, który jest elementem cis-regulatorowym 281
7 Postepy Hig Med Dosw (online), 2013; tom 67: promotora genu białka Z. Przyłączenie się do niego czynnika komórkowego (do tej pory niepoznanego) powoduje wyciszenie genu BZLF1 [54]. Innym białkiem wirusowym, ważnym w indukcji fazy litycznej, jest białko R kodowane przez gen BRLF1. Jest ono czynnikiem transkrypcyjnym, który w przeciwieństwie do Zta aktywuje promotory niemetylowane [40,48]. Ostatnie doniesienia wskazują na rolę białka tegumentu EBV jako niezbędnego czynnika, biorącego udział w ustanowieniu zakażenia latentnego. Białkiem tym jest BNRF1, które wiąże się do komórkowego białka Daxx oraz rozkłada kompleksy Daxx i ATRX (alpha thalassemia/mental retardation syndrome X-linked). Oba te białka hamują ekspresję wirusowych genów [51]. Badania Kruga i wsp. [28] nad mysim gamma-herpeswirusem 68 (γhv68) ustalającym zakażanie latentne podobnie jak EBV w limfocytach B, wskazują na podstawową rolę NF-κB w ustanowieniu latencji u gamma-herpeswirusów. Wirus Epsteina-Barr transformuje i powoduje immortalizację limfocytów B, tworząc w ten sposób limfoblastoidalne linie komórkowe. Komórki te ulegają podziałom, więc musi być zapewniona replikacja wirusowego genomu i przekazanie go do komórek potomnych w stanie latencji [40]. W latentnie zakażonych komórkach zidentyfikowano 9 wirusowych białek oraz kilka wirusowych, niekodujących RNA. Wirusowe białka występujące w trakcie latencji można podzielić na dwie zasadnicze grupy: 6 antygenów jądrowych (EBNAs) oraz 3 antygeny błonowe (LMPs) [48]. We wstępnej fazie zakażenia wirusem Epsteina-Barr, transkrypcja genu EBNA jest inicjowana przez promotor Wp. W genomie wirusa występuje wiele kopii tego promotora, a jego funkcją jest uruchamianie transkrypcji EBNA w nowo zainfekowanych, spoczynkowych limfocytach B. Pierwszymi białkami ulegającymi ekspresji są EBNA-LP i EBNA2, które przełączają ekspresję na inny promotor, nazywany promotorem Cp, odpowiadający za ekspresję pozostałych białek EBNA. Alternatywnym promotorem jest promotor Qp, którego transkrypty ulegają splicingowi wyłącznie do EBNA1, z jednoczesnym pominięciem białka EBNA3. W przeciwieństwie do promotorów Wp i Cp, promotor Qp nie zawiera sekwencji TATA, co wydaje się zjawiskiem podobnym dla promotorów genów housekeeping. Sugeruje to, że może pełnić on funkcję dodatkowego promotora gwarantującego ekspresję EBNA1 podczas braku inicjacji transkrypcji z promotora Cp i/lub Wp [40]. Ważnym białkiem, będącym produktem transkryptów promotora Cp, jest EBNA-1, które odgrywa główną rolę w latencji przez wiązanie się z sekwencjami orip i inicjowanie replikacji episomalnego DNA. Replikacja dokonana jest z udziałem głównie enzymów komórkowych i dokonuje się wspólnie z replikacją DNA komórkowego. Dodatkowo EBNA-1 pełni ważną funkcję w segregacji DNA w dzielących się komórkach dzięki wiązaniu się z chromosomami metafazowymi [48]. Poszczególne typy latencji są wyrażone poprzez alternatywne konformacje chromatyny. Badania wykazały, iż wzmacniacz transkrypcyjny znajdujący się w miejscu orip tworzy stabilną pętlę z jednym z dwóch różnych promotorów. W pierwszym typie latencji orip tworzy pętlę z aktywnym promotorem Qp, natomiast w trzecim typie latencji z aktywnym promotorem Cp. W tworzeniu pętli istotną rolę pełni CTCF (CCCTC binding factor) [49]. Ponadto CTCF zapobiega dryftowi epigenetycznemu [50]. Reaktywacja EBV następuje, gdy zakażone limfocyty B pamięci podczas stymulacji antygenem różnicują się w komórki plazmatyczne. Wydaje się, że istotną rolę we włączeniu litycznej ekspresji genów odgrywa aktywacja komórkowych czynników transkrypcyjnych BLIMP1 (B lymphocyte-induced maturation protein 1) i XBP-1 (X-box binding protein 1), następująca po różnicowaniu. Absolutnie niezbędne jest w czasie reaktywacji białko Z, które skutecznie aktywuje ekspresję wirusowych genów wczesnych i przedwczesnych. Jego ekspresja w czasie latencji jest blokowana przez komórkowe białka Zeb. Badania wskazują, że podczas różnicowania limfocytów B poziom mrna kodujących białka Zeb spada po utworzeniu komórek plazmatycznych. Z ostatnich badań wynika, iż do indukcji ekspresji białka Z niezbędne jest także uruchomienie de novo ekspresji genów wirusowych. Przypuszcza się, że jego ekspresja może być uruchomiona przez syntetyzowane de novo białko tegumentu BNRF1 [40]. Wirus Epsteina-Barr wytwarza wiele białek związanych z kontrolą programowanej śmierci komórki, zwłaszcza podczas zakażenia latentnego. Jednym z nich jest antygen błonowy LMP-1, który działa antyapoptotycznie przez podwyższenie ekspresji białek Bcl-2, a ponadto może ingerować w kaskadę sygnalną zainicjowaną aktywacją receptora dla TNF-α oraz receptora Fas. LMP-1 hamuje apoptozę indukowaną białkiem p53 na skutek zwiększenia ilości białka A20, które jest komórkowym czynnikiem blokującym apoptozę. A20 wpływa na zewnętrzny szlak apoptozy poprzez wiązanie się do TRAF (TNFR associated factor) 1 i 2. Heteroagregaty TRAF 1 i TRAF 2 wiążą się z LMP-1 i takie kompleksy powodują rekrutację białek IAP sprzyjających przeżyciu komórki [38]. Antygen błonowy LMP-1 został uznany za główny czynnik powodujący immortalizację limfocytów B w trakcie zakażenia latentnego [48]. Inne białka tego wirusa będące antygenami jądrowymi EBNA A oraz EBNA C, lecz nie EBNA B mogą obniżyć ekspresję białka z rodziny Bcl-2 zawierającego wyłącznie domenę BH3 białka Bim i w ten sposób obniżyć podatność komórek gospodarza na apoptozę. Ponadto udowodniono, że EBNA LP może nie tylko wpływać na transkrypcję genów gospodarza, ale również oddziałuje z maszynerią apoptotyczną. Zasugerowano, że EBNA LP może wchodzić w interakcje z Bcl-2, mimo aktywności białka HAX1 (HCLS1 associated protein X1), mitochondrialnego inhibitora apoptozy regulowanego przez Omi/HtrA2 [16]. Modulacja apoptozy przez EBV jest możliwa również dzięki BALF1 i BHRF1, które są podobne pod względem sekwencji i struktury do Bcl-2. O ile BHRF1 wyraźnie przy- 282
8 Dariusz Miszczak i wsp. Strategie przetrwania herpeswirusów... pomina Bcl-2 pod względem pełnionej funkcji, o tyle rola BALF1, który jest zdolny do interakcji z Bax i Bak, wydaje się kontrowersyjna. Badania z wykorzystaniem mikroskopii immunoelektronowej wskazały, że BHRF1 gromadzi się razem z Bcl-2 w zewnętrznej błonie mitochondrialnej. C- -końcowy fragment BHRF1, odpowiedzialny za umiejscowienie tego białka w wewnętrznych błonach komórkowych, wykazuje wysoki stopień homologii z kilkoma członkami rodziny białek Bcl-2: Bcl-2 (38%), Bcl-XL (32%) oraz Bax (34%). BHRF1 w przeciwieństwie do Bcl-2 czy Bcl-XL nie jest w stanie hamować działania białek zawierających domenę BH3, przypuszczalnie ze względu na brak miejsca wiążącego tę domenę. Mimo to, skutecznie zapobiega permeabilizacji błony mitochondrialnej i apoptozie indukowanej przez aktywację receptorów śmierci, aktywację c- -myc, granzym B, zakażenia wirusowe, uszkodzenie DNA, promieniowanie gamma i wiele chemicznych induktorów apoptozy. Ponadto hamuje apoptozę spowodowaną TRA- IL (TNF related apoptosis inducing ligand), poprzez zapobieganie permeabilizacji błony mitochondrialnej przez aktywowany proteolitycznie Bid [16]. EBV ma także możliwość regulacji apoptozy przez małe cząsteczki niepoliadenylowanego RNA EBER1 i EBER2. Uczestniczą one w ochronie przed apoptozą indukowaną IFN-α przez blokowanie szlaku białkowej kinazy R (protein kinase R PKR), w komórkach chłoniaka Burkitta. EBER zapewnia także ochronę komórki przed apoptozą spowodowaną aktywacją receptora Fas [37]. Latencja ludzkiego herpeswirusa typu 8 Ludzki herpeswirus typu 8 (HHV-8) ustanawia zakażenia latentne w limfocytach B, w których jego genom w trakcie latencji występuje w jądrze komórkowym w postaci kolistej, dwuniciowej cząsteczki DNA związanej z białkami histonowymi. Podczas ustanawiania latencji ważną rolę odgrywa odporność nieswoista, która hamuje ekspresję genów wirusowych i replikację wirusa. Głównymi czynnikami związanymi z hamowaniem replikacji wirusa są IFN-α (blokuje inicjację replikacji) i IFN-γ (blokuje końcowe etapy replikacji). Ponadto wyciszenie ekspresji genów wirusowych jest wywoływane przez modyfikacje histonów. W regionie genomu ulegającym ekspresji podczas latencji obserwuje się zmniejszone hamowanie modyfikacji H3K27-me3 w porównaniu z resztą genomu [42]. Podczas zakażenia latentnego HHV-8 ekspresji ulegają LANA (latency associated nuclear antigen), vcyklina, vflip oraz zestaw 25 dojrzałych cząsteczek mirna pochodzących z 12 prekursorowych microrna (mir-k1- -K12) oraz białka należące do rodziny kaposin [42,48]. Ludzki herpeswirus typu 8, tak jak w przypadku EBV utrzymuje się w komórce i jest przekazywany do komórek potomnych w trakcie podziału. Za utrzymanie i segregację wirusowego materiału genetycznego w limfocytach B jest odpowiedzialny antygen jądrowy LANA, którego C-końcowa domena ma swoiste sekwencje wiążące się z końcowymi powtórzeniami wirusowego DNA. Zadaniem LANA jest zainicjowanie syntezy DNA z miejsca orip oraz rozdzielenie powielonego DNA do komórek potomnych po podziale dzięki zdolności wiązania się do chromosomów metafazowych. Funkcja ta jest niezwykle ważna do utrzymania latencji w szybko dzielących się komórkach. Dodatkowo LANA spełnia inne funkcje bezpośrednio związane z utrzymaniem zakażenia latentnego, do których należą: promowanie wzrostu i przetrwania komórki poprzez inhibicję białka p53 i prb, a także bierze udział w blokowaniu ekspresji genów litycznych. Innym czynnikiem, ważnym podczas latencji jest v cyklina, która sprzyja utrzymaniu zakażenia latentnego przez promowanie proliferacji komórek. Wykazano, iż v cyklina tworzy aktywny kompleks z komórkowym białkiem CDK6, co w efekcie prowadzi do progresji cyklu komórkowego poprzez fosforylację prb [42,48]. Głównym czynnikiem zapobiegającym apoptozie jest wirusowy analog komórkowych białek hamujących aktywację prokaspazy 8, są to tzw. vflip (K13). Białko K13 odpowiada za długotrwałe przeżycie zakażonych komórek, a jego obecność w komórce sprzyja aktywacji NF-κB przez częściowo odrębne szlaki, które prowadzą do zmniejszenia wrażliwości komórki na indukcję apoptozy przez szlak zewnętrzny i wewnętrzny oraz zmniejszenia ekspresji cytokin (IL-6, IL-8) [16,42,48]. Ponadto w ochronie komórki przed apoptozą bierze udział kaposina A, która wchodzi w interakcje z septyną 4, uważaną za domniemany aktywator kaspazy 3 [48]. Reaktywacja wirusa zachodzi pod wpływem czynników, takich jak: hipoksja, zakażenie wirusem niedoboru odporności (human immunodeficiency virus HIV) i inne zakażenia, stan zapalny oraz stres oksydacyjny. Genami niezbędnymi w trakcie reaktywacji i mającymi na celu uruchomienie produktywnego cyklu replikacyjnego HHV-8 są geny natychmiastowo wczesne i wczesne: Rta, Mta oraz K-bZIP, których zadaniem jest regulacja ekspresji pozostałych genów wirusowych [42]. Podczas zakażenia produktywnego ochronę przed apoptozą zapewnia gen ORF16, który koduje homolog białka Bcl- 2, białko KSBcl-2, wykazujące niewielkie podobieństwo sekwencji (15-20%) do białek takich jak: Bcl-2, Bcl-XL, Bax, Bak i BHRF1. Wydaje się interesujące, że znaczące podobieństwo w sekwencji aminokwasowej tego białka dotyczy domen BH1 i BH2, ale nie BH3. Przypuszcza się, że odmienność pod względem struktury i sekwencji w porównaniu do Bcl-2 wynika z tego, że KSBcl-2 nie ulega hetero- ani homodimeryzacji z innymi członkami rodziny białek Bcl-2, co może sugerować, że w trakcie ewolucji KSBcl-2 może uniknąć negatywne efekty regulatorowe proapoptotycznych białek z rodziny Bcl-2. Innym białkiem mającym ograniczoną homologię z Bcl-2 jest glikoproteina K7, strukturalnie związana z wariantem splicingu ludzkiej surwiwiny, inhibitorem apoptozy. K7 wydajnie zapobiega apoptozie zaindukowanej aktywacją receptorów śmierci, nadekspresją Bax i stresem ER wywołanym tapsygarginą. K7 podobnie jak białkowe inhibitory apoptozy (IAP) 283
9 Postepy Hig Med Dosw (online), 2013; tom 67: wiąże i w ten sposób hamuje kaspazę 3 przez swoją domenę BIR. Antyapoptotyczne działanie białka K7 zależy od domeny BH2, która pośredniczy w interakcjach z Bcl-2. Wydaje się, że mechanizm ten polega na łączeniu kaspaz efektorowych i Bcl-2, co prowadzi do inhibicji kaspaz przez białka Bcl-2 [16]. Innym czynnikiem antyapoptotycznym, kodowanym przez HHV-8, jest mitochondrialne białko K15. Gen K15 składa się z 8 alternatywnie składanych eksonów i koduje białka membranowe ze zróżnicowaną liczbą domen transmembranowych oraz C-końcowym regionem z domniemanym miejscem wiązania dla domen homologicznych z kinazą tyrozynową Src: SH2 (Src homology) i SH3. Kodowane przez HHV-8 białko o masie cząsteczkowej 45 kda, składające się ze wszystkich 8 eksonów i zawierające 12 domen transmembranowych uczestniczy w regulacji ekspresji genów gospodarza ze względu na możliwość aktywacji kilku kinaz sygnałowych ( JNK, ERK) oraz czynników transkrypcyjnych (NF-κB oraz activatorprotein 1 AP1). Krótsze warianty białka K15 wielkości 35 i 23 kda, zawierające domniemane obszary C-końcowe MTS (mitochondrial targeting sequence), umiejscowiają się w mitochondrium i ER. Te izoformy genu K15 oddziałują z HAX-1 [16]. Blokowanie apoptozy przez HHV-8 odbywa się również dzięki onkoproteinie K1, która łączy się z receptorem Fas i w ten sposób zaburza indukcję apoptozy zainicjowanej przez FasL [6]. Ekspresja białka K1 występuje także w trakcie latencji, jednak jego poziom w komórce jest niezwykle niski i zwiększa się podczas cyklu litycznego [48]. HHV-8 jest zdolny regulować ekspresję genów gospodarza poprzez wirusowy mirna, który przyłącza się do mrna, aby w ten sposób oznaczyć transkrypt jako cel dla kompleksu RISC (RNA induced silencing complex), degradującego mrna. Wykazano, że mir-k10a kodowany przez HHV-8 wycisza ekspresję TWEAKR (tumor necrosis factor like weak inducer of apoptosis), co wydaje się ważne przy hamowaniu apoptozy w odpowiedzi na stymulację cytokinami w komórkach nowotworowych wyprowadzonych z mięsaka Kaposiego [1]. Ekspresja mir-k10a obecna jest w trakcie latencji, lecz wzrasta po indukcji fazy litycznej [42]. Jak radzą sobie z apoptozą inne herpeswirusy? Ponieważ HSV-2 jest blisko spokrewniony z HSV-1, dysponuje zbliżonymi mechanizmami modulacji apoptozy. HSV-2 ma gen kodujący białkową kinazę Us3, lecz pełni ona u tego wirusa nieco inne funkcje niż kinaza Us3 HSV- 1. Wykazano, że Us3 HSV-2 nie ma związku z regulacją ekspresji glikoproteiny B w błonie komórkowej, lokalizacją UL31 i UL34, a także z opuszczaniem jądra komórkowego przez nukleokapsydy [35]. Dokładniej zbadanym genem HSV-2 hamującym apoptozę jest gen UL39 kodujący podjednostkę R1 reduktazy rybonukleotydowej, blokującej apoptozę powodowaną przyłączeniem TNF-α i FasL do odpowiednich receptorów śmierci. Podjednostka R1 reduktazy rybonukleotydowej wchodzi w interakcję z kaspazą 8, co zaburza jej dimeryzację/aktywację i zakłóca wiązanie się kaspazy z FADD. Początkowo badania nad podjednostką R1 sugerowały jej związek ze szlakiem mitochondrialnym poprzez aktywację wielu procesów, w których uczestniczą zewnątrzkomórkowo regulowana kinaza 1/2 (extracellular regulated Kinase 1/2 ERK 1/2), kinaza fosfatydyloinozytolu 3 (phosphatidyloinositol 3 kinase PI3K) i kinaza Akt, lecz kolejne prace to wykluczyły [14]. Han i wsp. [20] udowodnili, że ekspresja genu ICP10 indukuje apoptozę w komórkach linii Jurkat, podczas gdy jego ekspresja w komórkach nabłonkowych HEp-2 (human epithelial cells), chroni komórki przed apoptozą wywołaną przez cykloheksamid i TNF-α. Sugeruje to, że skutki spowodowane przez ekspresję tego genu zależą od typu komórki. Badania Krzyżowskiej i wsp. [29] nad rolą szlaku aktywowanego przez Fas podczas zakażenia HSV-2 mysich keratynocytów i komórek nabłonkowych in vitro i in vivo, wykazują umiarkowaną liczbę keratynocytów i komórek nabłonkowych przechodzących apoptozę. Nadmierne wytwarzanie Fas i FasL sugeruje uwrażliwienie komórek na apoptozę wywołaną obecnością FasL na sąsiadujących komórkach lub dostarczanego w sposób autokrynny, jednak mimo to komórki zakażone HSV-2 są względnie odporne na apoptozę spowodowaną aktywacją receptora Fas, a śmierć tych komórek wynika z uruchomienia innego szlaku. HSV-2, podobnie jak HSV-1, ma zdolność indukcji apoptozy w komórkach układu odpornościowego [21]. Do indukcji apoptozy w limfocytach T przez HSV-2 niezbędna jest kaspaza 9, co wskazuje na udział szlaku mitochondrialnego. Jednocześnie wykluczono zaangażowanie szlaku zewnętrznego w śmierć limfocytów T [52]. Wirus ospy wietrznej i półpaśca (varicella zoster virus VZV) jest kolejnym przedstawicielem podrodziny Alphaherpesvirinae. Reaktywacja tego wirusa w trakcie zakażenia latentnego wywołuje chorobę nazywaną półpaścem. Bóle związane z wystąpieniem tej choroby są prawdopodobnie związane z uszkodzeniem tkanki nerwowej. Ze względu na to, że czuciowe neurony, w przeciwieństwie do fibroblastów, nie ulegają apoptozie pod wpływem zakażenia VZV [26] zasugerowano, że uszkodzenie tkanki nerwowej w trakcie reaktywacji in vivo może być spowodowana odpowiedzią komórek układu immunologicznego [25,30]. VZV przeciwdziała mechanizmom obronnym indukowanym poprzez IFN, wskutek unikania indukcji antywirusowych działań powiązanych z aktywnością PKR i RNAzy L. Dodatkowo, zaobserwowano przejściową aktywację szlaków kinaz z grupy MAPK (mitogen activated proteinkinase), do których zalicza się m.in.: c-jun N-terminal kinase/stress activated protein kinase ( JNK/SAPK), p38/ MAPK oraz ERK 1/2. Aktywacja szlaków MAPK skutkowała powstaniem komórkowych czynników transkrypcyjnych, niezbędnych do wirusowej replikacji, bez indukowania śmierci komórki. Wydaje się, że gen IE61 jest głównym 284
10 Dariusz Miszczak i wsp. Strategie przetrwania herpeswirusów... czynnikiem regulującym aktywność JNK/SAPK. W trakcie zakażenia VZV dochodzi również do aktywacji kaskady ERK. ERK 1/2 może fosforyzować białko Bad przez co staje się ono niezdolne do indukowania śmierci komórki [43]. Genem VZV pełniącym funkcje antyapoptotyczne jest gen ORF63, lecz mechanizm jego działania nie został jeszcze określony [25]. VZV indukuje apoptozę w komórkach nerki małpy, fibroblastach oraz w jednojądrzastych komórkach krwi obwodowej pobranych od zdrowych dawców, a także izolowanych od dzieci zakażonych tym wirusem. Jednak mechanizm indukcji apoptozy jest nieznany. Najnowsze doniesienia wykazują, że ważną rolę w indukcji apoptozy przez VZV w komórkach czerniaka linii MeWo odgrywa obniżenie ekspresji białek Bcl-2 [9]. Kolejnym członkiem podrodziny Alphaherpesvirinae jest bydlęcy herpeswirus typu I (bovine herpesvirus type 1 BHV-1), który jest czynnikiem etiologicznym zakaźnego zapalenia nosa i tchawicy oraz zapalenia sromu i pochwy u krów [12,22]. Wirus ten indukuje apoptozę w stymulowanych miogenem, jednojądrzastych komórkach krwi obwodowej. Indukcja apoptozy następuje w fazie G 0 /G 1, zatrzymując postęp cyklu komórkowego [22]. Do indukcji apoptozy wystarczy już adsorpcja BHV-1 do komórki, co wskazuje, że czynnikiem ją wywołującym jest jedna z glikoprotein wirusa. Zasugerowano, że w indukcji apoptozy w PMBC może brać udział, w sposób pośredni lub bezpośredni, glikoproteina D [23]. Badania Delhona i wsp. [12] wykazały, że neurony czuciowe nie są odporne na apoptozę wywołaną przez BHV-1, a replikacja wirusowa odgrywa rolę w wywołaniu śmierci komórki. Genem BHV-1 hamującym apoptozę jest gen LR (latency related), który zapobiega apoptozie spowodowanej C 6- -ceramidem, fumonizyną B 1, etopsydem w trzech różnych hodowlach komórkowych: CV-1 (fibroblasty nerki koczkodana zielonosiwego), w ludzkich fibroblastach i w komórkach neuroblastomy myszy. Produkt genu LR, czyli LRP, jest powiązany z kompleksami tworzonymi przez kinazy zależne od cyklin 2 (Cdk2). Hamuje wejście w fazę S cyklu komórkowego [10]. Gen LR ulega transkrypcji w latentnie zakażonych neuronach i ma dwie otwarte ramki odczytu (ORF1 i ORF2) oraz dwie ramki odczytu niemając początkowej sekwencji ATG (RF-B i RF-C). Część LR RNA ulega poliadenylacji i alternatywnemu splicingowi, co sugeruje, że różne białka LR są syntetyzowane podczas określonych etapów cyklu latencja-reaktywacja [34]. Produkty genu LR, poza inhibicją apoptozy, hamują proliferację komórek oraz ekspresję bicp0 RNA [47]. Odkryto, że siedem dni po zakażeniu syntetyzowany jest transkrypt, który koduje białko fuzyjne ORF1/ORF2 mające możliwość wiązania się z proapoptotycznymi czynnikami komórkowymi Bid i Cdc42 [34]. ORF2 kodowany przez gen LR chroni komórki neuroblastomy Neuro-2A poprzez ingerencję zarówno w szlak zewnętrzny, jak i szlak mitochondrialny [46]. Kolejnym zwierzęcym patogenem jest wirus choroby Aujeszkiego (Aujeszky s disease virus ADV), który po pierwotnej replikacji w nabłonku błony śluzowej jamy nosowo- -gardłowej atakuje ośrodkowy układ nerwowy [3,32]. ADV jest zdolny do inhibicji apoptozy w neuronach zwoju nerwu trójdzielnego zaindukowanej obecnością wirusa w komórkach, a także wywołanej przez komórki cytotoksyczne [3]. Neurony zwoju nerwu trójdzielnego charakteryzują się większą opornością na apoptozę spowodowaną zakażeniem ADV w porównaniu z innymi komórkami świni, przy czym nie zależy to od aktywności antyapoptotycznej wirusowej kinazy Us3 [17]. Inne doniesienia wskazują na tymczasowe zahamowanie apoptozy w neuronch zakażonych przez ADV, które i tak następnie ulegają programowanej śmierci [32]. Hamowanie apoptozy przez kinazę Us3 wydaje się nie mieć znaczenia w efektywnym namnożeniu się wirusa w komórce, w przeciwieństwie do innych funkcji tego białka, np. wpływu na cytoszkielet aktynowy czy regulacji transportu z jądra komórkowego [13]. Podsumowanie Herpeswirusy rozwinęły różnorodne mechanizmy ułatwiające ich ucieczkę spod kontroli układu immunologicznego gospodarza, jednakże główną strategią przetrwania w środowisku pozostaje zdolność do ustalania zakażenia latentnego. Szczególnie ważna dla utrzymania zakażenia latentnego jest regulacja szlaków apoptotycznych, dzięki czemu komórka nie ulega programowanej śmierci, zachowując zintegrowany genom wirusowy. Liczne badania wykazują, iż herpeswirusy mogą uruchamiać mechanizmy zakłócania szlaku apoptozy, a także mechanizmy umożliwiające wykorzystanie apoptozy w szerzeniu się zakażenia, przystosowujące czas życia i śmierci komórki do własnych potrzeb. Modulacja apoptozy przez herpeswirusy, pod wieloma względami, stanowi wyzwanie dla naukowców. Istnieje wciąż wiele niejasności co do sposobu przekazywania sygnału śmierci wzbudzanego przez pojawienie się wirusów w komórce gospodarza, a także molekularnych uwarunkowań komórki do włączenia, czy też zahamowania apoptozy podczas zakażenia, zwłaszcza zakażenia latentnego. U podstaw zainteresowania mechanizmem modulacji apoptozy przez herpeswirusy leży, oprócz celów poznawczych, potencjalna możliwość regulowania i kontroli procesu zakażenia wirusowego. 285
11 Postepy Hig Med Dosw (online), 2013; tom 67: Piśmiennictwo [1] Abend J.R., Uldrick T., Ziegelbauer J.Z.: Regulation of tumor necrosis factor-like weak inducer of apoptosis receptor protein (TWEAKR) expression by Kaposi s sarcoma-associated herpesvirus microrna prevents TWEAK-induced apoptosis and inflammatory cytokine expression. J. Virol., 2010; 84: [2] Ahmed M., Lock M., Miller C.G., Fraser N.W.: Regions of the herpes simplex virus type 1 latency associated transcript that protect cells from apoptosis in vitro and protect neuronal cells in vivo. J. Virol., 2002; 76: [3] Aleman N., Quiroga M.I., Lopez-Pena M., Vazquez S., Guerrero F.H., Nieto J.M.: Induction and inhibition of apoptosis by pseudorabies virus in the trigeminal ganglion during acute infection of swine. J. Virol., 2001; 75: [4] Aubert M., Chen Z., Lang R., Dang C.H., Fowler C., Sloan D.D., Jerome K.R.: The antiapoptotic herpes simplex virus glycoprotein J localizes to multiple cellular organelles and induces reactive oxygen species formation. J. Virol., 2008; 82: [5] Aubert M., Pomeranz L.E., Blaho J.A.: Herpes simplex virus blocks apoptosis by precluding mitochondrial cytochrome c release independent of caspase activation in infected human epithelial cells. Apoptosis, 2007; 12: [6] Berkova Z., Wang S., Wise J.F., Maeng H., Ji Y., Samaniego F.: Mechanism of Fas signaling regulation by human herpesvirus 8 K1 oncoprotein. J. Natl. Cancer Inst., 2009; 101: [7] Bloom D.C., Giordani N.V., Kwiatkowski D.L.: Epigenetic regulation of latent HSV-1 gene expression. Biochym. Biophys. Acta, 2010; 1799: [8] Bocian J., Januszkiewicz-Lewandowska D.: Zakażenia EBV- cykl życiowy, metody diagnostyki, chorobotwórczość. Postępy Hig. Med. Dośw, 2011; 65: [9] Brazeau E., Mahalingam E., Gilden D., Wellish M., Kaufer B.B., Osterrieder N., Pugazhenthi S.: Varicella zoster virus induced apoptosis in MeWo cells is accompanied by downregulation of Bcl-2 expression. J. Neurovirol., 2010; 16: [10] Ciacci- Zanella J., Stone M., Henderson G., Jones C.: The latency-related gene of bovine herpesvirus 1 inhibits programmed cell death. J. Virol., 1999; 73: [11] De Regge N., Van Opdenbosch N., Nauwynck H.J., Efstathiou S., Favoreel H.W.: Interferon alpha induces establishment of alphaherpesvirus latency in sensory neurons in vitro. PLoS One, 2010; 5: e13076 [12] Delhon G.A., Gonzalez M.J., Murcia P.R.: Susceptibility of sensory neurons to apoptosis following infection by bovine herpesvirus type 1. J. Gen. Virol., 2002; 83: [13] Deruelle M.J., De Corte N., Englebienne J., Nauwynck H.J., Favoreel H.W.: Pseudorabies virus Us3 mediated inhibition of apoptosis does not affect infectious virus production. J. Gen. Virol., 2010; 91: [14] Dufour F., Sasseville A.M., Chabaud S., Massie B., Siegel R.M., Langelier Y.: The ribonucleotide reductase R1 subunits of herpes simplex virus types 1 and 2 protect cells against TNFα and FasL- induced apoptosis by interacting with caspase 8. Apoptosis, 2010; 16: [15] Elmore S.: Apoptosis: a review of programmed cell death. Toxicol. Pathol., 2007; 35: [16] Galluzzi L., Brenner C., Morselli E., Touat Z., Kroemer G.: Viral control of mitochondrial apoptosis. PLoS Pathog., 2008; 4: e [17] Geenen K., Favoreel H.W., Nauwynck H.J.: Higher resistance of porcine trigeminal ganglion towards pseudorabies virus- induced cell death compared with other porcine cell types in vitro. J. Gen. Virol., 2005; 86: [18] Gesser R.M.: The role of latency in herpesvirus infections. Sem. Pediatric Infect. Dis., 1997; 8: [19] Grainger L., Cicchini L., Rak M., Petrucelli A., Fitzgerald K.D., Semler B.L., Goodrum F.: Stress inducible alternative translation initiation of human cytomegalovirus latency protein pul138. J. Virol., 2010; 84: [20] Han J.Y., Miller S.A., Wolfe T.M., Pourhassan H., Jerome K.R.: Cell type specific induction and inhibition of apoptosis by herpes simplex virus type 2 ICP10. J. Virol., 2009; 83: [21] Han J.Y., Sloan D.D., Aubert M., Miller S.A., Dang C.H., Jerome K.R.: Apoptosis and antigen receptor function in T and B cells following exposure to herpes simplex virus. Virology, 2007; 359: [22] Hanon E., Hoornaert S., Dequiedt F., Vanderplasschen A., Lyaku J., Willems L., Pastoret P.P.: Bovine herpesvirus 1- induced apoptosis occurs at the G0/G1 phase of the cell cycle. Virology, 1997; 232: [23] Hanon E., Keil G., Van Drunen Little-Van den Hurk S., Griebel P., Vanderplasschen A., Rijsewijk F.A.M., Babiuk L., Pastoret P.P.: Bovine herpes virus 1- induced apoptotic cell death: role of glycoprotein D. Virology, 1999; 257: [24] Hay S., Kannourakis G.: A time to kill: viral manipulation of the cell death program. J. Gen. Virol., 2002; 83: [25] Hood C., Cunningham A.L., Slobedman B., Arvin A.M., Sommer M.H., Kinchington P.R., Abendroth A.: Varicella zoster virus ORF63 inhibits apoptosis of primary human neurons. J. Virol., 2006; 80: [26] Hood C., Cunningham A.L., Slobedman B., Boadle R.A., Abendroth A.: Varicella-zoster virus- infected human sensory neurons are resistant to apoptosis, yet human foreskin fibroblasts are susceptible: evidence for a cell-type specific apoptotic response. J. Virol., 2003; 23: [27] Kather A., Raftery M.J., Devi-Rao G., Lippmann J., Giese T., Sandri-Goldin R.M., Schonrich G.: Herpes simplex virus type 1 (HSV-1) induced apoptosis in human dendritic cells as a result of downregulation of cellular FLICE inhibitory protein and reduced expression of HSV-1 antiapoptotic latency associated transcript sequences. J. Virol., 2010; 84: [28] Krug L.T., Moser J.M., Dickerson S.M., Speck S.H.: Inhibition of NF-κB activation in vivo impairs establishment of gammaherpesvirus latency. PLoS Pathog., 2007; 3: e11 [29] Krzyżowska M., Shestakov A., Eriksson K, Chiodi F.: Role of Fas/ FasL in regulation of inflammation in vaginal tissue during HSV-2 infection. Cell Death Dis., 2011; 2: e132 [30] Lanier L.L.: Evolutionary struggles between NK cell and viruses. Nat. Rev. Immunol., 2008; 8: [31] Li S., Carpenter D., Hsiang C., Wechsler S.L., Jones C.: Herpes simplex virus type 1 latency associated transcript inhibits apoptosis and promotes neurite sprouting in neuroblastoma cells following serum starvation by maintaining protein kinase B (AKT) levels. J. Gen. Virol., 2010; 91: [32] Marcaccini A., Aleman N., Quiroga M.I., Lopez M., Guerrero F., Nieto J.M.: Temporary inhibition of neuronal apoptosis Aujeszky s disease virus- infected swine. Vet. Microbiol., 2006; 113: [33] McLaughin B.: The kinder side of killer proteases: caspase activation contributes to neuroprotection and CNS remodeling. Apoptosis, 2004; 9: [34] Meyer F., Perez S., Geiser V., Sintek M., Inman M., Jones C.: A protein encoded by bovine herpesvirus 1 latency related gene interacts with specific cellular regulatory proteins, including CCAAT enhancer binding protein alpha. J. Virol., 2007; 81:
12 Dariusz Miszczak i wsp. Strategie przetrwania herpeswirusów... [35] Morimoto A., Arii J., Tanaka M., Sata T., Akashi H., Yamada M., Nishiyama Y., Uema M., Kawaguchi Y.: Differences in the regulatory and functional effect of the Us3 protein kinase activities of herpes simplex virus 1 and 2. J. Virol., 2009; 83: [36] Motyl T.: Apoptoza śmierć warunkująca życie. Postępy Biol. Kom., 1998; 25: [37] Nanbo A., Yoshiyama H., Takada K.: Epstein-Barr virus encoded poly(a)-rna confers resistance to apoptosis mediated through Fas by blocking the PKR pathway in human epithelial intestine 407 cells. J. Virol., 2005; 79: [38] O Brien V.: Viruses and apoptosis. J. Gen. Virol., 1998; 79: [39] Peng W., Henderson G., Perng G.C., Nesburn A.B., Wechsler S.L., Jones C.: The gene that encodes the herpes simplex virus type 1 latency associated transcript influences the accumulation of transcripts (Bcl-xl and Bcl-xs) that encode apoptotic regulatory protein. J. Virol., 2003; 77: [40] Penkert R.R., Kalejta R.F.: Tegument protein control of latent herpesvirus establishment and animation. Herpesviridae, 2011; 2: 3 [41] Perng G., Jones C.: Towards an understanding of the herpes simplex virus type I latency-reactivation cycle. Interdiscip. Perspect. Infect. Dis., 2010; [42] Rahaus M., Desloges N., Wolff M.H.: Varicella zoster virus influences the activities of components and targets of ERK signaling pathway. J. Gen. Virol., 2006; 87: [43] Reeves M.B., MacAry P.A., Lehner P.J., Sissons J.G., Sinclair J.H.: Latency, chromatin remodeling and reactivation of human cytomegalovirus in the dendritic cells in healthy carriers. Proc. Natl. Acad. Sci. USA, 2005; 102: [44] Sagou K, Imai T., Sagara H., Uema M., Kawaguchi Y.: Regulation of the catalytic activity of herpes simplex virus I protein kinase Us3 by autophosphorylation and its role in pathogenesis. J. Virol., 2009; 83: [45] Shen W., Jones C.: Open reading frame 2, encoded by the latency related gene of bovine herpesvirus 1 has antiapoptotic activity in transiently transfected neuroblastoma cells. J. Virol., 2008; 82: [46] Sissons J.G.P., Bain M., Wills M.R., Sinclair J.H.: Latency and reactivation of human cytomegalovirus. J. Infection, 2002; 44: [47] Speck S.H., Ganem D.: Viral latency and its regulation: lessons from the gammaherpesviruses, Cell Host Microbe, 2010; 8: [48] Tempera I., Klichinsky M., Lieberman P.M.: EBV latency types adopt alternative chromatin conformations. PLoS Pathog., 2011; 7: e [49] Tempera I., Wiedmer A., Dheekollu J., Lieberman P.M.: CTCF prevents the epigenetic drift of EBV latency promoter Qp. PLOS Pathog., 2010; 6: e [50] Tsai K, Thikmyanova N., Wojcechowskyj J.A., Delecluse H.J., Lieberman P.M.: EBV tegument protein BNRF1 disrupts DAXX-ATRX to activate viral early gene transcription. PLoS Pathog., 2011; 7: e [51] Vanden Oever M.J., Han J.Y.: Caspase 9 is essential for herpes simplex type 2 induced apoptosis in T cells. J. Virol., 2010; 84: [52] Walters M.S., Kinchington P.R., Banfield B.W., Silverstein S.: Hyperphosphorylation of histone deacetylase 2 by alphaherpesvirus Us3 kinases. J. Virol., 2010; 84: [53] Ye F., Lei X., Gao S.J.: Mechanisms of Kaposi s sarcoma-associated herpesvirus latency and reactivation. Adv. Virol., 2011 [54] Yu X., McCarthy P.J., Lim H.J., Iempridee T., Kraus R.J., Gorlen D.A., Mertz J.E.: The ZIIR element of the Epstein Barr virus BZLF1 promoter plays a central role in establishment and maintenance of viral latency. J. Virol., 2011; 85: [55] Zhou G., Avitabile E., Campadelli-Fiume G., Roizman B.: The domains of glycoprotein D required to block apoptosis induced by herpes simplex virus 1 are largely distinct from those involved in cell-cell fusion and binding to nectin 1. J. Virol., 2003; 77: Autorzy deklarują brak potencjalnych konfliktów interesów. 287
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej)
 PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
Gdański Uniwersytet Medyczny Wydział Lekarski. Udział mikrorna w procesie starzenia się ludzkich limfocytów T. Joanna Frąckowiak
 Gdański Uniwersytet Medyczny Wydział Lekarski Udział mikrorna w procesie starzenia się ludzkich limfocytów T Joanna Frąckowiak Rozprawa doktorska Praca wykonana w Katedrze i Zakładzie Fizjopatologii Gdańskiego
Gdański Uniwersytet Medyczny Wydział Lekarski Udział mikrorna w procesie starzenia się ludzkich limfocytów T Joanna Frąckowiak Rozprawa doktorska Praca wykonana w Katedrze i Zakładzie Fizjopatologii Gdańskiego
Wykład 13. Regulacja cyklu komórkowego w odpowiedzi na uszkodzenia DNA. Mechanizmy powstawania nowotworów
 Wykład 13 Regulacja cyklu komórkowego w odpowiedzi na uszkodzenia DNA Mechanizmy powstawania nowotworów Uszkodzenie DNA Wykrycie uszkodzenia Naprawa DNA Zatrzymanie cyklu kom. Apoptoza Źródła uszkodzeń
Wykład 13 Regulacja cyklu komórkowego w odpowiedzi na uszkodzenia DNA Mechanizmy powstawania nowotworów Uszkodzenie DNA Wykrycie uszkodzenia Naprawa DNA Zatrzymanie cyklu kom. Apoptoza Źródła uszkodzeń
Fizjologia człowieka
 Fizjologia człowieka Wykład 2, część A CZYNNIKI WZROSTU CYTOKINY 2 1 Przykłady czynników wzrostu pobudzających proliferację: PDGF - cz.wzrostu z płytek krwi działa na proliferację i migrację fibroblastów,
Fizjologia człowieka Wykład 2, część A CZYNNIKI WZROSTU CYTOKINY 2 1 Przykłady czynników wzrostu pobudzających proliferację: PDGF - cz.wzrostu z płytek krwi działa na proliferację i migrację fibroblastów,
TATA box. Enhancery. CGCG ekson intron ekson intron ekson CZĘŚĆ KODUJĄCA GENU TERMINATOR. Elementy regulatorowe
 Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
TRANSKRYPCJA - I etap ekspresji genów
 Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Zawartość. Wstęp 1. Historia wirusologii. 2. Klasyfikacja wirusów
 Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Rozmnażanie i wzrost komórek sąściśle kontrolowane. Genetyczne podłoże nowotworzenia
 Rozmnażanie i wzrost komórek sąściśle kontrolowane Genetyczne podłoże nowotworzenia Rozmnażanie i wzrost komórek sąściśle kontrolowane Rozmnażanie i wzrost komórek sąściśle kontrolowane Połączenia komórek
Rozmnażanie i wzrost komórek sąściśle kontrolowane Genetyczne podłoże nowotworzenia Rozmnażanie i wzrost komórek sąściśle kontrolowane Rozmnażanie i wzrost komórek sąściśle kontrolowane Połączenia komórek
INICJACJA ELONGACJA TERMINACJA
 INICJACJA ELONGACJA TERMINACJA 2007 by National Academy of Sciences Kornberg R D PNAS 2007;104:12955-12961 Struktura chromatyny pozwala na różny sposób odczytania informacji zawartej w DNA. Możliwe staje
INICJACJA ELONGACJA TERMINACJA 2007 by National Academy of Sciences Kornberg R D PNAS 2007;104:12955-12961 Struktura chromatyny pozwala na różny sposób odczytania informacji zawartej w DNA. Możliwe staje
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
Podstawy mikrobiologii. Wirusy bezkomórkowe formy materii oŝywionej
 Podstawy mikrobiologii Wykład 3 Wirusy bezkomórkowe formy materii oŝywionej Budowa wirusów Wirusy nie mają budowy komórkowej, zatem pod względem biologicznym nie są organizmami Ŝywymi! Są to twory nukleinowo
Podstawy mikrobiologii Wykład 3 Wirusy bezkomórkowe formy materii oŝywionej Budowa wirusów Wirusy nie mają budowy komórkowej, zatem pod względem biologicznym nie są organizmami Ŝywymi! Są to twory nukleinowo
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
Diagnostyka zakażeń EBV
 Diagnostyka zakażeń EBV Jakie wyróżniamy główne konsekwencje kliniczne zakażenia EBV: 1) Mononukleoza zakaźna 2) Chłoniak Burkitta 3) Potransplantacyjny zespół limfoproliferacyjny Jakie są charakterystyczne
Diagnostyka zakażeń EBV Jakie wyróżniamy główne konsekwencje kliniczne zakażenia EBV: 1) Mononukleoza zakaźna 2) Chłoniak Burkitta 3) Potransplantacyjny zespół limfoproliferacyjny Jakie są charakterystyczne
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna
 Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Wykład 5. Remodeling chromatyny
 Wykład 5 Remodeling chromatyny 1 Plan wykładu: 1. Przebudowa chromatyny 2. Struktura, funkcje oraz mechanizm działania kompleksów remodelujących chromatynę 3. Charakterystyka kompleksów typu SWI/SNF 4.
Wykład 5 Remodeling chromatyny 1 Plan wykładu: 1. Przebudowa chromatyny 2. Struktura, funkcje oraz mechanizm działania kompleksów remodelujących chromatynę 3. Charakterystyka kompleksów typu SWI/SNF 4.
TRANSLACJA II etap ekspresji genów
 TRANSLACJA II etap ekspresji genów Tłumaczenie informacji genetycznej zawartej w mrna (po transkrypcji z DNA) na aminokwasy budujące konkretne białko. trna Operon (wg. Jacob i Monod) Zgrupowane w jednym
TRANSLACJA II etap ekspresji genów Tłumaczenie informacji genetycznej zawartej w mrna (po transkrypcji z DNA) na aminokwasy budujące konkretne białko. trna Operon (wg. Jacob i Monod) Zgrupowane w jednym
starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg
 STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
CHOROBY NOWOTWOROWE. Twór składający się z patologicznych komórek
 CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
DNA musi współdziałać z białkami!
 DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
TERAPIA GENOWA. dr Marta Żebrowska
 TERAPIA GENOWA dr Marta Żebrowska Pracownia Diagnostyki Molekularnej i Farmakogenomiki, Zakładu Biochemii Farmaceutycznej, Uniwersytetu Medycznego w Łodzi Źródło zdjęcia: httpblog.ebdna.plindex.phpjednoznajwiekszychzagrozenludzkosciwciazniepokonane
TERAPIA GENOWA dr Marta Żebrowska Pracownia Diagnostyki Molekularnej i Farmakogenomiki, Zakładu Biochemii Farmaceutycznej, Uniwersytetu Medycznego w Łodzi Źródło zdjęcia: httpblog.ebdna.plindex.phpjednoznajwiekszychzagrozenludzkosciwciazniepokonane
Lp. tydzień wykłady seminaria ćwiczenia
 Lp. tydzień wykłady seminaria ćwiczenia 21.02. Wprowadzeniedozag adnieńzwiązanychzi mmunologią, krótka historiaimmunologii, rozwójukładuimmun ologicznego. 19.02. 20.02. Wprowadzenie do zagadnień z immunologii.
Lp. tydzień wykłady seminaria ćwiczenia 21.02. Wprowadzeniedozag adnieńzwiązanychzi mmunologią, krótka historiaimmunologii, rozwójukładuimmun ologicznego. 19.02. 20.02. Wprowadzenie do zagadnień z immunologii.
WPŁYW KOMÓREK HODOWLI NAMALWA NA REPLIKACJĘ HSV-1
 MED. DOŚW. MIKROBIOL., 2009, 61: 197-202 Magdalena Wieczorek, Bogumiła Litwińska WPŁYW KOMÓREK HODOWLI NAMALWA NA REPLIKACJĘ HSV-1 Zakład Wirusologii NIZP-PZH w Warszawie Kierownik: doc. dr hab. B. Litwińska
MED. DOŚW. MIKROBIOL., 2009, 61: 197-202 Magdalena Wieczorek, Bogumiła Litwińska WPŁYW KOMÓREK HODOWLI NAMALWA NA REPLIKACJĘ HSV-1 Zakład Wirusologii NIZP-PZH w Warszawie Kierownik: doc. dr hab. B. Litwińska
Zgodnie z tzw. modelem interpunkcji trna, cząsteczki mt-trna wyznaczają miejsca
 Tytuł pracy: Autor: Promotor rozprawy: Recenzenci: Funkcje białek ELAC2 i SUV3 u ssaków i ryb Danio rerio. Praca doktorska wykonana w Instytucie Genetyki i Biotechnologii, Wydział Biologii UW Lien Brzeźniak
Tytuł pracy: Autor: Promotor rozprawy: Recenzenci: Funkcje białek ELAC2 i SUV3 u ssaków i ryb Danio rerio. Praca doktorska wykonana w Instytucie Genetyki i Biotechnologii, Wydział Biologii UW Lien Brzeźniak
Tolerancja transplantacyjna. Grażyna Korczak-Kowalska Zakład Immunologii Klinicznej Instytut Transplantologii, Warszawski Uniwersytet Medyczny
 Tolerancja transplantacyjna Grażyna Korczak-Kowalska Zakład Immunologii Klinicznej Instytut Transplantologii, Warszawski Uniwersytet Medyczny Darrell J., et al., Transfusion. 2001, 41 : 419-430. Darrell
Tolerancja transplantacyjna Grażyna Korczak-Kowalska Zakład Immunologii Klinicznej Instytut Transplantologii, Warszawski Uniwersytet Medyczny Darrell J., et al., Transfusion. 2001, 41 : 419-430. Darrell
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz. III): Aktywacja i funkcje efektorowe limfocytów B
 PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz. III): Aktywacja i funkcje efektorowe limfocytów B Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt wykładu Rozpoznanie antygenu
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz. III): Aktywacja i funkcje efektorowe limfocytów B Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt wykładu Rozpoznanie antygenu
Mam Haka na Raka. Chłoniak
 Mam Haka na Raka Chłoniak Nowotwór Pojęciem nowotwór określa się niekontrolowany rozrost nieprawidłowych komórek w organizmie człowieka. Nieprawidłowość komórek oznacza, że różnią się one od komórek otaczających
Mam Haka na Raka Chłoniak Nowotwór Pojęciem nowotwór określa się niekontrolowany rozrost nieprawidłowych komórek w organizmie człowieka. Nieprawidłowość komórek oznacza, że różnią się one od komórek otaczających
Streszczenie wykładu AUTOSTOPEM DO JĄDRA KOMÓRKOWEGO CZYLI MECHANIZMY ZAKAŻENIA WIRUSEM HPV16
 Dr n. biol. Małgorzata Bieńkowska-Haba Streszczenie wykładu AUTOSTOPEM DO JĄDRA KOMÓRKOWEGO CZYLI MECHANIZMY ZAKAŻENIA WIRUSEM HPV16 Podstawowym celem każdego wirusa jest bezpieczne dostarczenie genomu
Dr n. biol. Małgorzata Bieńkowska-Haba Streszczenie wykładu AUTOSTOPEM DO JĄDRA KOMÓRKOWEGO CZYLI MECHANIZMY ZAKAŻENIA WIRUSEM HPV16 Podstawowym celem każdego wirusa jest bezpieczne dostarczenie genomu
BUDOWA I FUNKCJA GENOMU LUDZKIEGO
 BUDOWA I FUNKCJA GENOMU LUDZKIEGO Magdalena Mayer Katedra i Zakład Genetyki Medycznej UM w Poznaniu 1. Projekt poznania genomu człowieka: Cele programu: - skonstruowanie szczegółowych map fizycznych i
BUDOWA I FUNKCJA GENOMU LUDZKIEGO Magdalena Mayer Katedra i Zakład Genetyki Medycznej UM w Poznaniu 1. Projekt poznania genomu człowieka: Cele programu: - skonstruowanie szczegółowych map fizycznych i
Odpowiedź układu immunologicznego na zakażenie wirusami brodawczaka ludzkiego wpływ na kancerogenezę i wyniki leczenia przeciwnowotworowego
 Odpowiedź układu immunologicznego na zakażenie wirusami brodawczaka ludzkiego wpływ na kancerogenezę i wyniki leczenia przeciwnowotworowego Beata Biesaga Zakład Radiobiologii Klinicznej, Centrum Onkologii
Odpowiedź układu immunologicznego na zakażenie wirusami brodawczaka ludzkiego wpływ na kancerogenezę i wyniki leczenia przeciwnowotworowego Beata Biesaga Zakład Radiobiologii Klinicznej, Centrum Onkologii
Regulacja Ekspresji Genów
 Regulacja Ekspresji Genów Wprowadzenie o Ekspresja genu jest to złożony proces jego transkrypcji do mrna, o Obróbki tego mrna, a następnie o Translacji do białka. 4/17/2019 2 4/17/2019 3 E 1 GEN 3 Promotor
Regulacja Ekspresji Genów Wprowadzenie o Ekspresja genu jest to złożony proces jego transkrypcji do mrna, o Obróbki tego mrna, a następnie o Translacji do białka. 4/17/2019 2 4/17/2019 3 E 1 GEN 3 Promotor
WYKŁAD: Klasyczny przepływ informacji ( Dogmat) Klasyczny przepływ informacji. Ekspresja genów realizacja informacji zawartej w genach
 WYKŁAD: Ekspresja genów realizacja informacji zawartej w genach Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Klasyczny przepływ informacji ( Dogmat) Białka Retrowirusy Białka Klasyczny
WYKŁAD: Ekspresja genów realizacja informacji zawartej w genach Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Klasyczny przepływ informacji ( Dogmat) Białka Retrowirusy Białka Klasyczny
WYBRANE SKŁADNIKI POKARMOWE A GENY
 WYBRANE SKŁADNIKI POKARMOWE A GENY d r i n ż. Magdalena Górnicka Zakład Oceny Żywienia Katedra Żywienia Człowieka WitaminyA, E i C oraz karotenoidy Selen Flawonoidy AKRYLOAMID Powstaje podczas przetwarzania
WYBRANE SKŁADNIKI POKARMOWE A GENY d r i n ż. Magdalena Górnicka Zakład Oceny Żywienia Katedra Żywienia Człowieka WitaminyA, E i C oraz karotenoidy Selen Flawonoidy AKRYLOAMID Powstaje podczas przetwarzania
oporność odporność oporność odporność odporność oporność
 oporność odporność odporność nieswoista bierna - niskie ph na powierzchni skóry (mydła!) - enzymy - lizozym, pepsyna, kwas solny żołądka, peptydy o działaniu antybakteryjnym - laktoferyna- przeciwciała
oporność odporność odporność nieswoista bierna - niskie ph na powierzchni skóry (mydła!) - enzymy - lizozym, pepsyna, kwas solny żołądka, peptydy o działaniu antybakteryjnym - laktoferyna- przeciwciała
Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej
 Seminarium 1 część 1 Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Genom człowieka Genomem nazywamy całkowitą ilość DNA jaka
Seminarium 1 część 1 Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Genom człowieka Genomem nazywamy całkowitą ilość DNA jaka
Leczenie i rokowanie w zakażeniach HIV. Brygida Knysz Polskie Towarzystwo Naukowe AIDS
 Leczenie i rokowanie w zakażeniach HIV Brygida Knysz Polskie Towarzystwo Naukowe AIDS Cel terapii przeciwwirusowej Jak najdłużej maksymalna supresja replikacji HIV i utrzymanie odpowiedniej liczby limfocytów
Leczenie i rokowanie w zakażeniach HIV Brygida Knysz Polskie Towarzystwo Naukowe AIDS Cel terapii przeciwwirusowej Jak najdłużej maksymalna supresja replikacji HIV i utrzymanie odpowiedniej liczby limfocytów
Odporność nabyta: Nadzieja Drela Wydział Biologii UW, Zakład Immunologii
 Odporność nabyta: Komórki odporności nabytej: fenotyp, funkcje, powstawanie, krążenie w organizmie Cechy odporności nabytej Rozpoznawanie patogenów przez komórki odporności nabytej: receptory dla antygenu
Odporność nabyta: Komórki odporności nabytej: fenotyp, funkcje, powstawanie, krążenie w organizmie Cechy odporności nabytej Rozpoznawanie patogenów przez komórki odporności nabytej: receptory dla antygenu
SESJA 10 ODPOWIEDŹ ORGANIZMÓW NA CZYNNIKI BIOTYCZNE I ABIOTYCZNE WYKŁADY
 SESJA 10 ODPOWIEDŹ ORGANIZMÓW NA CZYNNIKI BIOTYCZNE I ABIOTYCZNE WYKŁADY 238 SESJA 10 WYKŁADY W10-01 REAKTYWNE FORMY TLENU JAKO ELEMENT REAKCJI KOMÓREK NA STRES Grzegorz Bartosz Katedra Biofizyki Molekularnej
SESJA 10 ODPOWIEDŹ ORGANIZMÓW NA CZYNNIKI BIOTYCZNE I ABIOTYCZNE WYKŁADY 238 SESJA 10 WYKŁADY W10-01 REAKTYWNE FORMY TLENU JAKO ELEMENT REAKCJI KOMÓREK NA STRES Grzegorz Bartosz Katedra Biofizyki Molekularnej
Organizacja tkanek - narządy
 Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Organizacja tkanek - narządy Architektura skóry tkanki kręgowców zbiór wielu typów komórek danej tkanki i spoza tej tkanki (wnikają podczas rozwoju lub stale, w trakcie Ŝycia ) neurony komórki glejowe,
Promotor: prof. dr hab. Katarzyna Bogunia-Kubik Promotor pomocniczy: dr inż. Agnieszka Chrobak
 INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
Składniki diety a stabilność struktury DNA
 Składniki diety a stabilność struktury DNA 1 DNA jedyna makrocząsteczka, której synteza jest ściśle kontrolowana, a powstałe błędy są naprawiane DNA jedyna makrocząsteczka naprawiana in vivo Replikacja
Składniki diety a stabilność struktury DNA 1 DNA jedyna makrocząsteczka, której synteza jest ściśle kontrolowana, a powstałe błędy są naprawiane DNA jedyna makrocząsteczka naprawiana in vivo Replikacja
Właściwości szlaku sygnalizacyjnego białka p53 ujawnione podczas analizy skutków traktowania komórek rezweratrolem.
 Właściwości szlaku sygnalizacyjnego białka p53 ujawnione podczas analizy skutków traktowania komórek rezweratrolem. Streszczenie Ogólnym celem niniejszej pracy było lepsze zrozumienie funkcjonowania szlaku
Właściwości szlaku sygnalizacyjnego białka p53 ujawnione podczas analizy skutków traktowania komórek rezweratrolem. Streszczenie Ogólnym celem niniejszej pracy było lepsze zrozumienie funkcjonowania szlaku
FOCUS Plus - Silniejsza ryba radzi sobie lepiej w trudnych warunkach
 FOCUS Plus - Silniejsza ryba radzi sobie lepiej w trudnych warunkach FOCUS Plus to dodatek dostępny dla standardowych pasz tuczowych BioMaru, dostosowany specjalnie do potrzeb ryb narażonych na trudne
FOCUS Plus - Silniejsza ryba radzi sobie lepiej w trudnych warunkach FOCUS Plus to dodatek dostępny dla standardowych pasz tuczowych BioMaru, dostosowany specjalnie do potrzeb ryb narażonych na trudne
Marek Figlerowicz 1, Agata Tyczewska 1, Magdalena Figlerowicz 2
 PRZEGL EPIDEMIOL 2006; 60: 693 700 Marek Figlerowicz 1, Agata Tyczewska 1, Magdalena Figlerowicz 2 Wpływ małych regulatorowych RNA na przebieg zakażeń wirusowych nowe strategie leczenia zakażeń HCV 1 Zespół
PRZEGL EPIDEMIOL 2006; 60: 693 700 Marek Figlerowicz 1, Agata Tyczewska 1, Magdalena Figlerowicz 2 Wpływ małych regulatorowych RNA na przebieg zakażeń wirusowych nowe strategie leczenia zakażeń HCV 1 Zespół
Sirtuiny - eliksir młodości nowej generacji?
 WYKŁAD: 4 Sirtuiny - eliksir młodości nowej generacji? Prof. dr hab. Małgorzata Milkiewicz Zakład Biologii Medycznej 1 Dieta niskokaloryczna (calorie restriction,cr) 2 3 4 Zdjęcie 2. Stuletnia mieszkanka
WYKŁAD: 4 Sirtuiny - eliksir młodości nowej generacji? Prof. dr hab. Małgorzata Milkiewicz Zakład Biologii Medycznej 1 Dieta niskokaloryczna (calorie restriction,cr) 2 3 4 Zdjęcie 2. Stuletnia mieszkanka
Immunologia komórkowa
 Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Biologia molekularna wirusów. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego.
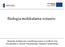 Biologia molekularna wirusów Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Co to jest wirus? Cząsteczka złożona z kwasu nukleinowego (DNA
Biologia molekularna wirusów Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Co to jest wirus? Cząsteczka złożona z kwasu nukleinowego (DNA
Analizy DNA in silico - czyli czego można szukać i co można znaleźć w sekwencjach nukleotydowych???
 Analizy DNA in silico - czyli czego można szukać i co można znaleźć w sekwencjach nukleotydowych??? Alfabet kwasów nukleinowych jest stosunkowo ubogi!!! Dla sekwencji DNA (RNA) stosuje się zasadniczo*
Analizy DNA in silico - czyli czego można szukać i co można znaleźć w sekwencjach nukleotydowych??? Alfabet kwasów nukleinowych jest stosunkowo ubogi!!! Dla sekwencji DNA (RNA) stosuje się zasadniczo*
Komórka eukariotyczna
 Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
DNA superhelikalny eukariota DNA kolisty bakterie plazmidy mitochondria DNA liniowy wirusy otrzymywany in vitro
 DNA- kwas deoksyrybonukleinowy: DNA superhelikalny eukariota DNA kolisty bakterie plazmidy mitochondria DNA liniowy wirusy otrzymywany in vitro RNA- kwasy rybonukleinowe: RNA matrycowy (mrna) transkrybowany
DNA- kwas deoksyrybonukleinowy: DNA superhelikalny eukariota DNA kolisty bakterie plazmidy mitochondria DNA liniowy wirusy otrzymywany in vitro RNA- kwasy rybonukleinowe: RNA matrycowy (mrna) transkrybowany
Badanie funkcji genu
 Badanie funkcji genu Funkcję genu można zbadać różnymi sposobami Przypadkowa analizy funkcji genu MUTACJA FENOTYP GEN Strategia ukierunkowanej analizy funkcji genu GEN 1. wprowadzenie mutacji w genie 2.
Badanie funkcji genu Funkcję genu można zbadać różnymi sposobami Przypadkowa analizy funkcji genu MUTACJA FENOTYP GEN Strategia ukierunkowanej analizy funkcji genu GEN 1. wprowadzenie mutacji w genie 2.
Do moich badań wybrałam przede wszystkim linię kostniakomięsaka 143B ze względu na jej wysoki potencjał przerzutowania. Do wykonania pracy
 Streszczenie Choroby nowotworowe stanowią bardzo ważny problem zdrowotny na świecie. Dlatego, medycyna dąży do znalezienia nowych skutecznych leków, ale również rozwiązań do walki z nowotworami. Głównym
Streszczenie Choroby nowotworowe stanowią bardzo ważny problem zdrowotny na świecie. Dlatego, medycyna dąży do znalezienia nowych skutecznych leków, ale również rozwiązań do walki z nowotworami. Głównym
Analizy wielkoskalowe w badaniach chromatyny
 Analizy wielkoskalowe w badaniach chromatyny Analizy wielkoskalowe wykorzystujące mikromacierze DNA Genotypowanie: zróżnicowane wewnątrz genów RNA Komórka eukariotyczna Ekspresja genów: Które geny? Poziom
Analizy wielkoskalowe w badaniach chromatyny Analizy wielkoskalowe wykorzystujące mikromacierze DNA Genotypowanie: zróżnicowane wewnątrz genów RNA Komórka eukariotyczna Ekspresja genów: Które geny? Poziom
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN
 MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Prokariota i Eukariota
 Prokariota i Eukariota W komórkach organizmów żywych ilość DNA jest zazwyczaj stała i charakterystyczna dla danego gatunku. ILOŚĆ DNA PRZYPADAJĄCA NA APARAT GENETYCZNY WZRASTA WRAZ Z BARDZIEJ FILOGENETYCZNIE
Prokariota i Eukariota W komórkach organizmów żywych ilość DNA jest zazwyczaj stała i charakterystyczna dla danego gatunku. ILOŚĆ DNA PRZYPADAJĄCA NA APARAT GENETYCZNY WZRASTA WRAZ Z BARDZIEJ FILOGENETYCZNIE
Geny i działania na nich
 Metody bioinformatyki Geny i działania na nich prof. dr hab. Jan Mulawka Trzy królestwa w biologii Prokaryota organizmy, których komórki nie zawierają jądra, np. bakterie Eukaryota - organizmy, których
Metody bioinformatyki Geny i działania na nich prof. dr hab. Jan Mulawka Trzy królestwa w biologii Prokaryota organizmy, których komórki nie zawierają jądra, np. bakterie Eukaryota - organizmy, których
WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS
 WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS KOLOKWIA; 15% KOLOKWIA-MIN; 21% WEJŚCIÓWKI; 6% WEJŚCIÓWKI-MIN; 5% EGZAMIN; 27% EGZAMIN-MIN; 26% WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS kolokwium I 12% poprawa kolokwium
WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS KOLOKWIA; 15% KOLOKWIA-MIN; 21% WEJŚCIÓWKI; 6% WEJŚCIÓWKI-MIN; 5% EGZAMIN; 27% EGZAMIN-MIN; 26% WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS kolokwium I 12% poprawa kolokwium
mechanizmach latencji i onkogenezy BLV. Wykazano, że zakażenie BLV powoduje wzrost aktywności telomerazy i skracanie sekwencji telomerowych we
 STRESZCZENIE Celem pracy była ocena sekrecji cytokin oraz aktywności telomerazy i długości telomerów w populacjach komórek dendrytycznych (DCs) generowanych z krwi i tkanek limfatycznych zwierząt zakażonych
STRESZCZENIE Celem pracy była ocena sekrecji cytokin oraz aktywności telomerazy i długości telomerów w populacjach komórek dendrytycznych (DCs) generowanych z krwi i tkanek limfatycznych zwierząt zakażonych
Wykład 14 Biosynteza białek
 BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
Wirusy oddechowe jako czynniki etiologiczne zakażeń szpitalnych
 Wirusy oddechowe jako czynniki etiologiczne zakażeń szpitalnych LEK MED. JOLANTA KLUZ-ZAWADZKA WIRUSY ODDECHOWE : Określenie kliniczne, związane z umiejscowieniem objawów zakażenia i drogą jego szerzenia
Wirusy oddechowe jako czynniki etiologiczne zakażeń szpitalnych LEK MED. JOLANTA KLUZ-ZAWADZKA WIRUSY ODDECHOWE : Określenie kliniczne, związane z umiejscowieniem objawów zakażenia i drogą jego szerzenia
Leczenie biologiczne co to znaczy?
 Leczenie biologiczne co to znaczy? lek med. Anna Bochenek Centrum Badawcze Współczesnej Terapii C B W T 26 Październik 2006 W oparciu o materiały źródłowe edukacyjnego Grantu, prezentowanego na DDW 2006
Leczenie biologiczne co to znaczy? lek med. Anna Bochenek Centrum Badawcze Współczesnej Terapii C B W T 26 Październik 2006 W oparciu o materiały źródłowe edukacyjnego Grantu, prezentowanego na DDW 2006
Indukowane pluripotencjalne komórki macierzyste
 Indukowane pluripotencjalne komórki macierzyste Nagroda Nogla w dziedzinie medycyny i fizjologii z roku 2012 dla Brytyjczyka John B.Gurdon oraz Japooczyka Shinya Yamanaka Wykonały: Katarzyna Białek Katarzyna
Indukowane pluripotencjalne komórki macierzyste Nagroda Nogla w dziedzinie medycyny i fizjologii z roku 2012 dla Brytyjczyka John B.Gurdon oraz Japooczyka Shinya Yamanaka Wykonały: Katarzyna Białek Katarzyna
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Diagnostyka wirusologiczna w praktyce klinicznej
 Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Część praktyczna: Metody pozyskiwania komórek do badań laboratoryjnych cz. I
 Ćwiczenie 1 Część teoretyczna: Budowa i funkcje układu odpornościowego 1. Układ odpornościowy - główne funkcje, typy odpowiedzi immunologicznej, etapy odpowiedzi odpornościowej. 2. Komórki układu immunologicznego.
Ćwiczenie 1 Część teoretyczna: Budowa i funkcje układu odpornościowego 1. Układ odpornościowy - główne funkcje, typy odpowiedzi immunologicznej, etapy odpowiedzi odpornościowej. 2. Komórki układu immunologicznego.
Metody bioinformatyki. Ekspresja genów. prof. dr hab. Jan Mulawka
 Metody bioinformatyki Ekspresja genów prof. dr hab. Jan Mulawka Genetyczny skład prawie wszystkich komórek somatycznych organizmów wielokomórkowych jest identyczny. Fenotyp (swoistość tkankowa lub komórkowa)
Metody bioinformatyki Ekspresja genów prof. dr hab. Jan Mulawka Genetyczny skład prawie wszystkich komórek somatycznych organizmów wielokomórkowych jest identyczny. Fenotyp (swoistość tkankowa lub komórkowa)
Podstawy genetyki molekularnej
 Podstawy genetyki molekularnej Materiał genetyczny Materiałem genetycznym są kwasy nukleinowe Materiałem genetycznym organizmów komórkowych jest kwas deoksyrybonukleinowy (DNA) 5 DNA zbudowany jest z nukleotydów
Podstawy genetyki molekularnej Materiał genetyczny Materiałem genetycznym są kwasy nukleinowe Materiałem genetycznym organizmów komórkowych jest kwas deoksyrybonukleinowy (DNA) 5 DNA zbudowany jest z nukleotydów
Odporność nabyta: podstawy rozpoznawania antygenów przez limfocyty T
 Odporność nabyta: podstawy rozpoznawania antygenów przez limfocyty T Główny układ zgodności tkankowej Restrykcja MHC Przetwarzanie i prezentacja antygenu Komórki prezentujące antygen Nadzieja Drela Wydział
Odporność nabyta: podstawy rozpoznawania antygenów przez limfocyty T Główny układ zgodności tkankowej Restrykcja MHC Przetwarzanie i prezentacja antygenu Komórki prezentujące antygen Nadzieja Drela Wydział
Odporność nabyta: podstawy rozpoznawania antygenów przez limfocyty T
 Odporność nabyta: podstawy rozpoznawania antygenów przez limfocyty T Główny układ zgodności tkankowej Restrykcja MHC Przetwarzanie i prezentacja antygenu Komórki prezentujące antygen Nadzieja Drela Wydział
Odporność nabyta: podstawy rozpoznawania antygenów przez limfocyty T Główny układ zgodności tkankowej Restrykcja MHC Przetwarzanie i prezentacja antygenu Komórki prezentujące antygen Nadzieja Drela Wydział
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czy priony zawsze są szkodliwe? SPIS TREŚCI: Wprowadzenie. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. Karty pracy. 1.
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czy priony zawsze są szkodliwe? SPIS TREŚCI: Wprowadzenie. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. Karty pracy. 1.
Alergiczny nieżyt nosa genetyczny stan wiedzy
 Alergiczny nieżyt nosa genetyczny stan wiedzy Dr hab. n. med. Aleksandra Szczepankiewicz mgr inż. Wojciech Langwiński Pracownia Badań Komórkowych i Molekularnych Kliniki Pneumonologii, Alergologii Dziecięcej
Alergiczny nieżyt nosa genetyczny stan wiedzy Dr hab. n. med. Aleksandra Szczepankiewicz mgr inż. Wojciech Langwiński Pracownia Badań Komórkowych i Molekularnych Kliniki Pneumonologii, Alergologii Dziecięcej
Rola białek szoku cieplnego w apoptozie komórek* Role of heat shock proteins in cell apoptosis
 Postepy Hig Med Dosw (online), 2010; 64: 273-283 e-issn 1732-2693 www.phmd.pl Review Received: 2010.01.14 Accepted: 2010.05.11 Published: 2010.06.09 Rola białek szoku cieplnego w apoptozie komórek* Role
Postepy Hig Med Dosw (online), 2010; 64: 273-283 e-issn 1732-2693 www.phmd.pl Review Received: 2010.01.14 Accepted: 2010.05.11 Published: 2010.06.09 Rola białek szoku cieplnego w apoptozie komórek* Role
IL-4, IL-10, IL-17) oraz czynników transkrypcyjnych (T-bet, GATA3, E4BP4, RORγt, FoxP3) wyodrębniono subpopulacje: inkt1 (T-bet + IFN-γ + ), inkt2
 Streszczenie Mimo dotychczasowych postępów współczesnej terapii, przewlekła białaczka limfocytowa (PBL) nadal pozostaje chorobą nieuleczalną. Kluczem do znalezienia skutecznych rozwiązań terapeutycznych
Streszczenie Mimo dotychczasowych postępów współczesnej terapii, przewlekła białaczka limfocytowa (PBL) nadal pozostaje chorobą nieuleczalną. Kluczem do znalezienia skutecznych rozwiązań terapeutycznych
CHOROBY REUMATYCZNE A OBNIŻENIE GĘSTOŚCI MINERALNEJ KOŚCI
 CHOROBY REUMATYCZNE A OBNIŻENIE GĘSTOŚCI MINERALNEJ KOŚCI Katarzyna Pawlak-Buś Katedra i Klinika Reumatologii i Rehabilitacji Uniwersytetu Medycznego w Poznaniu ECHA ASBMR 2018 WIELOCZYNNIKOWY CHARAKTER
CHOROBY REUMATYCZNE A OBNIŻENIE GĘSTOŚCI MINERALNEJ KOŚCI Katarzyna Pawlak-Buś Katedra i Klinika Reumatologii i Rehabilitacji Uniwersytetu Medycznego w Poznaniu ECHA ASBMR 2018 WIELOCZYNNIKOWY CHARAKTER
Dr hab. Janusz Matuszyk. Ocena rozprawy doktorskiej. Pani mgr Hanny Baurskiej
 Dr hab. Janusz Matuszyk INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ im. Ludwika Hirszfelda P OLSKIEJ A K A D E M I I N AUK Centrum Doskonałości: IMMUNE ul. Rudolfa Weigla 12, 53-114 Wrocław tel. (+48-71)
Dr hab. Janusz Matuszyk INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ im. Ludwika Hirszfelda P OLSKIEJ A K A D E M I I N AUK Centrum Doskonałości: IMMUNE ul. Rudolfa Weigla 12, 53-114 Wrocław tel. (+48-71)
Badanie funkcji genu
 Badanie funkcji genu Funkcję genu można zbadać różnymi sposobami Przypadkowa analizy funkcji genu MUTACJA FENOTYP GEN Strategia ukierunkowanej analizy funkcji genu GEN 1. wprowadzenie mutacji w genie 2.
Badanie funkcji genu Funkcję genu można zbadać różnymi sposobami Przypadkowa analizy funkcji genu MUTACJA FENOTYP GEN Strategia ukierunkowanej analizy funkcji genu GEN 1. wprowadzenie mutacji w genie 2.
Fragment cząsteczki DNA stanowiący matrycę dla syntezy cząsteczki lub podjednostki białka nazywamy GENEM
 KONTROLA EKSPRESJI GENU PRZEKAZYWANIE INFORMACJI GENETYCZNEJ Informacja genetyczna - instrukcje kierujące wszystkimi funkcjami komórki lub organizmu zapisane jako określone, swoiste sekwencje nukleotydów
KONTROLA EKSPRESJI GENU PRZEKAZYWANIE INFORMACJI GENETYCZNEJ Informacja genetyczna - instrukcje kierujące wszystkimi funkcjami komórki lub organizmu zapisane jako określone, swoiste sekwencje nukleotydów
mikrosatelitarne, minisatelitarne i polimorfizm liczby kopii
 Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
Zawartość 139371 1. Wstęp zarys historii genetyki, czyli od genetyki klasycznej do genomiki 2. Chromosomy i podziały jądra komórkowego 2.1. Budowa chromosomu 2.2. Barwienie prążkowe chromosomów 2.3. Mitoza
Spis treści 1 Komórki i wirusy Budowa komórki Budowa k
 Spis treści 1 Komórki i wirusy.......................................... 1 1.1 Budowa komórki........................................ 1 1.1.1 Budowa komórki prokariotycznej.................... 2 1.1.2
Spis treści 1 Komórki i wirusy.......................................... 1 1.1 Budowa komórki........................................ 1 1.1.1 Budowa komórki prokariotycznej.................... 2 1.1.2
Gdzie chirurg nie może - - tam wirusy pośle. czyli o przeciwnowotworowych terapiach wirusowych
 Gdzie chirurg nie może - - tam wirusy pośle czyli o przeciwnowotworowych terapiach wirusowych Wirusy zwiększające ryzyko rozwoju nowotworów HBV EBV HCV HTLV HPV HHV-8 Zmniejszenie liczby zgonów spowodowanych
Gdzie chirurg nie może - - tam wirusy pośle czyli o przeciwnowotworowych terapiach wirusowych Wirusy zwiększające ryzyko rozwoju nowotworów HBV EBV HCV HTLV HPV HHV-8 Zmniejszenie liczby zgonów spowodowanych
Antyoksydanty pokarmowe a korzyści zdrowotne. dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW
 Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją).
 Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją). Czym jest życie? metabolizm + informacja (replikacja) 2 Cząsteczki organiczne mog y powstać w atmosferze pierwotnej
Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją). Czym jest życie? metabolizm + informacja (replikacja) 2 Cząsteczki organiczne mog y powstać w atmosferze pierwotnej
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Jak działają geny. Podstawy biologii molekularnej genu
 Jak działają geny Podstawy biologii molekularnej genu Uniwersalność życia Podstawowe mechanizmy są takie same u wszystkich znanych organizmów budowa DNA i RNA kod genetyczny repertuar aminokwasów budujących
Jak działają geny Podstawy biologii molekularnej genu Uniwersalność życia Podstawowe mechanizmy są takie same u wszystkich znanych organizmów budowa DNA i RNA kod genetyczny repertuar aminokwasów budujących
Interfaza to niemal 90% cyklu komórkowego. Dzieli się na 3 fazy: G1, S i G2.
 W wyniku podziału komórki powstaje komórka potomna, która ma o połowę mniej DNA od komórki macierzystej i jest o połowę mniejsza. Aby komórka potomna była zdolna do kolejnego podziału musi osiągnąć rozmiary
W wyniku podziału komórki powstaje komórka potomna, która ma o połowę mniej DNA od komórki macierzystej i jest o połowę mniejsza. Aby komórka potomna była zdolna do kolejnego podziału musi osiągnąć rozmiary
PRZEGLĄD AKTUALNYCH NAJWAŻNIEJSZYCH WYDARZEŃ W REUMATOLOGII
 PRZEGLĄD AKTUALNYCH NAJWAŻNIEJSZYCH WYDARZEŃ W REUMATOLOGII Prof. dr hab. n med. Małgorzata Wisłowska Klinika Chorób Wewnętrznych i Reumatologii Centralnego Szpitala Klinicznego MSWiA Cytokiny Hematopoetyczne
PRZEGLĄD AKTUALNYCH NAJWAŻNIEJSZYCH WYDARZEŃ W REUMATOLOGII Prof. dr hab. n med. Małgorzata Wisłowska Klinika Chorób Wewnętrznych i Reumatologii Centralnego Szpitala Klinicznego MSWiA Cytokiny Hematopoetyczne
Recenzja rozprawy doktorskiej mgr inż. Artura Zajkowicza
 dr hab. Beata Schlichtholz Gdańsk, 20 października 2015 r. Katedra i Zakład Biochemii Gdański Uniwersytet Medyczny ul. Dębinki 1 80-211 Gdańsk Recenzja rozprawy doktorskiej mgr inż. Artura Zajkowicza pt.
dr hab. Beata Schlichtholz Gdańsk, 20 października 2015 r. Katedra i Zakład Biochemii Gdański Uniwersytet Medyczny ul. Dębinki 1 80-211 Gdańsk Recenzja rozprawy doktorskiej mgr inż. Artura Zajkowicza pt.
Tolerancja immunologiczna
 Tolerancja immunologiczna autotolerancja, tolerancja na alloantygeny i alergeny dr Katarzyna Bocian Zakład Immunologii kbocian@biol.uw.edu.pl Funkcje układu odpornościowego obrona bakterie alergie wirusy
Tolerancja immunologiczna autotolerancja, tolerancja na alloantygeny i alergeny dr Katarzyna Bocian Zakład Immunologii kbocian@biol.uw.edu.pl Funkcje układu odpornościowego obrona bakterie alergie wirusy
Pro apoptotyczne właściwości ekstraktów z kory Cochlospermum angolense Welw.
 Pro apoptotyczne właściwości ekstraktów z kory Cochlospermum angolense Welw. Paulina Wdowiak 1, Tomasz Baj 2, Magdalena Wasiak 1, Piotr Pożarowski 1, Jacek Roliński 1, Kazimierz Głowniak 2 1 Katedra i
Pro apoptotyczne właściwości ekstraktów z kory Cochlospermum angolense Welw. Paulina Wdowiak 1, Tomasz Baj 2, Magdalena Wasiak 1, Piotr Pożarowski 1, Jacek Roliński 1, Kazimierz Głowniak 2 1 Katedra i
Plan wykładu: Budowa chromatyny - nukleosomy. Wpływ nukleosomów na replikację i transkrypcję
 Nukleosomy 1 Plan wykładu: Budowa chromatyny - nukleosomy Wpływ nukleosomów na replikację i transkrypcję Metody pozwalające na wyznaczanie miejsc wiązania nukleosomów Charakterystyka obsadzenia nukleosomów
Nukleosomy 1 Plan wykładu: Budowa chromatyny - nukleosomy Wpływ nukleosomów na replikację i transkrypcję Metody pozwalające na wyznaczanie miejsc wiązania nukleosomów Charakterystyka obsadzenia nukleosomów
Translacja i proteom komórki
 Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego
 Aleksandra Sałagacka Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego Pracownia Biologii Molekularnej i Farmakogenomiki
Aleksandra Sałagacka Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego Pracownia Biologii Molekularnej i Farmakogenomiki
BIOINFORMATYKA. edycja 2016 / wykład 11 RNA. dr Jacek Śmietański
 BIOINFORMATYKA edycja 2016 / 2017 wykład 11 RNA dr Jacek Śmietański jacek.smietanski@ii.uj.edu.pl http://jaceksmietanski.net Plan wykładu 1. Rola i rodzaje RNA 2. Oddziaływania wewnątrzcząsteczkowe i struktury
BIOINFORMATYKA edycja 2016 / 2017 wykład 11 RNA dr Jacek Śmietański jacek.smietanski@ii.uj.edu.pl http://jaceksmietanski.net Plan wykładu 1. Rola i rodzaje RNA 2. Oddziaływania wewnątrzcząsteczkowe i struktury
Dr hab. Anna Bębenek Warszawa,
 Dr hab. Anna Bębenek Warszawa, 14.01. 2018 Instytut Biochemii i Biofizyki PAN Ul. Pawińskiego 5a 02-106 Warszawa Recenzja pracy doktorskiej Pana mgr Michała Płachty Pod Tytułem Regulacja funkcjonowania
Dr hab. Anna Bębenek Warszawa, 14.01. 2018 Instytut Biochemii i Biofizyki PAN Ul. Pawińskiego 5a 02-106 Warszawa Recenzja pracy doktorskiej Pana mgr Michała Płachty Pod Tytułem Regulacja funkcjonowania
Bezpośrednia embriogeneza somatyczna
 Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
