Agencja Oceny Technologii Medycznych
|
|
|
- Gabriela Muszyńska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 92/2011 z dnia 24 października 2011 r. w sprawie zakwalifikowania świadczenia opieki zdrowotnej Leczenie łuszczycy plackowatej lekami biologicznymi jako świadczenia gwarantowanego Rada Konsultacyjna uważa za zasadne zakwalifikowanie świadczenia opieki zdrowotnej Leczenie łuszczycy plackowatej lekami biologicznymi w ramach terapeutycznego programu zdrowotnego jako świadczenia gwarantowanego, pod warunkiem: uściślenia definicji remisji, ustalenia zasad ponownej kwalifikacji do leczenia biologicznego, ustalenia warunków wyboru preparatu biologicznego. Uzasadnienie W opinii Rady Konsultacyjnej przedstawione dowody naukowe uzasadniają podtrzymanie stanowiska z dnia 9. listopada 2009 r. w sprawie finansowania adalimumabu, etanerceptu, infliksymabu i ustekinumabu w leczeniu łuszczycy plackowatej. Opiniowany program obejmuje stosowanie leków skutecznych w kontroli objawów łuszczycy, których podawanie wymaga jednak ścisłej kontroli bezpieczeństwa na wszystkich etapach leczenia, od kwalifikacji, poprzez monitorowanie terapii, do monitorowania skutków odległych. Z tego względu program terapeutyczny jest najbardziej właściwą formą finansowania opiniowanego świadczenia. Inne agencje HTA rekomendują finansowanie leczenia biologicznego łuszczycy plackowatej z wykorzystaniem ocenianych interwencji, z ograniczeniem finansowania do wąskiej populacji chorych z ciężką łuszczycą, spełniającej restrykcyjne kryteria włączenia. Kryteria kwalifikacji pacjentów do opiniowanego programu zasadniczo odpowiadają proponowanym przez inne, zagraniczne agencje HTA, Rada uważa jednak za konieczne uściślenie opisu programu w innych punktach, wskazanych w uchwale. Tryb przygotowania stanowiska Niniejsze stanowisko opracowane zostało przez Radę Konsultacyjną na podstawie zlecenia Ministra Zdrowia z dnia 24 maja 2011 r. (znak pisma: MZ-PLE /BRB/11) i raportu Agencji Oceny Technologii Medycznych nr AOTM-OT Program zdrowotny leczenia łuszczycy plackowatej, z zastosowaniem tych samych substancji czynnych, był przedmiotem oceny Rady Konsultacyjnej w dniu 9. listopada 2009 r. Rada uznała wówczas za zasadne zakwalifikowanie wspomnianego programu jako świadczenia gwarantowanego, pod warunkiem kwalifikowania do leczenia pacjentów z ciężką postacią łuszczycy, niereagujących na leczenie ogólne lub nietolerujących go, kwalifikowania pacjentów do programu przez komisje specjalistyczne, zapewnienia kosztowo-efektywnego sposobu finansowania oraz objęcia leczonych chorych rejestrem klinicznym. 2 Zaopiniowanego wówczas programu zdrowotnego nie wdrożono, zakwalifikowano jednak biologiczne leczenie łuszczycy do świadczeń gwarantowanych z zakresu leczenia szpitalnego (patrz: Obecna standardowa terapia). 1 Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa, tel fax sekretariat@aotm.gov.pl
2 W ramach oceny świadczenia w Agencji informacje zebrane w ramach procesu analitycznego w 2009 r. uzupełniono o wyniki doniesień naukowych, opublikowanych po 1. maja 2009 r. Przeprowadzono również analizę ekonomiczną i analizę wpływu na budżet płatnika publicznego. 1 Problem zdrowotny Zgodnie z przedstawionym projektem, program adresowany jest do dorosłych pacjentów z umiarkowaną i ciężką postacią łuszczycy zwykłej (ICD-10: L40 - łuszczyca, L łuszczyca pospolita, L łuszczyca krostkowa uogólniona, L łuszczyca grudkowa, L inna łuszczyca, L nieokreślona łuszczyca), którzy przestali reagować na leczenie lub mają przeciwwskazania i/lub nie tolerują innych metod leczenia ogólnego (cyklosporyna, metotreksat, acytretyna, PUVA), ze wskaźnikiem PASI (The Psoriasis Area and Severity Index) większym niż 10, DLQI (Dermatology Life Quality Index) większym niż 10 i BSA (Body Surface Area) większym niż 10. Łuszczyca jest przewlekłym, nawrotowym schorzeniem skóry, którego istotą jest zwiększona proliferacja naskórka, prowadząca do powstania złuszczających się wykwitów grudkowych, które następnie ustępują bez pozostawienia śladu. Klinicznie, schorzenie manifestuje się czerwonobrunatnymi, złuszczającymi się zmianami, początkowo drobnymi, ale z czasem zlewającymi się w blaszki, szerzącymi się obwodowo. Zmiany mogą być umiejscowione w okolicy kolan, łokci, owłosionej skóry głowy, uogólniać się na tułów, pokrywać znaczne obszary skóry oraz utrzymywać się wiele lat. W patomechanizmie choroby podnosi się rolę procesów immunologicznych i autoimmunologicznych, przebiegających z aktywacją limfocytów T i udziałem wielu prozapalnych cytokin. Ponadto, w patogenezie łuszczycy pewną rolę może też odgrywać układ nerwowy. 4 Rozpowszechnienie łuszczycy w populacji ogólnej szacowane jest na 2%, a współczynnik zapadalności wynosi 100,5/100 tys. ludności. W populacji chorych na łuszczycę, pacjenci z łuszczycą umiarkowaną lub ciężką, kwalifikujący się do leczenia biologicznego stanowią, według oszacowań National Institute for Health and Clinical Excellence, 1,1%. Na tej podstawie Agencja szacuje liczbę osób w Polsce z łuszczycą umiarkowaną i ciężką, kwalifikujących się do leczenia biologicznego, na ok pacjentów, a coroczną liczbę nowych przypadków na ponad 300 osób. 1,5-7 Obecna standardowa terapia Celem leczenia łuszczycy jest usunięcie łusek, a następnie zahamowanie proliferacji naskórka. Algorytm leczenia jest następujący: I linia: leki o działaniu miejscowym +/- naświetlanie PUVA, II linia: systemowe kortykosteroidy (imunosupresyjne: metotreksat, acytretyna, cyklosporyna) +/- naświetlanie PUVA, III linia: leki biologiczne: inhibitory TNF, inhibitory interleukin, blokery aktywacji limfocytów T, inne leki biologiczne. 1,4 Oceniany program adresowany jest do pacjentów, u których standardowe metody leczenia ogólnego nie dają oczekiwanych efektów lub nie są tolerowane. Terapie biologiczne są obecnie w Polsce finansowane ze środków publicznych z budżetu Narodowego Funduszu Zdrowia. Świadczenie opieki zdrowotnej Leczenie umiarkowanej oraz ciężkiej łuszczycy plackowatej z zastosowaniem substancji czynnych: etanercept (Enbrel ), adalimumab (Humira ), infliksimab (Remicade ) oraz ustekinumab (Stelara ) jest świadczeniem gwarantowanym z zakresu leczenia szpitalnego. Wspomniane świadczenie zostało wprowadzone do wykazu świadczeń gwarantowanych z zakresu leczenia szpitalnego w 2010 r. W Zarządzeniu Prezesa NFZ nr 32/2010/DSOZ z dnia 1 lipca 2010 r., zmieniającym zarządzenie w sprawie określenia warunków zawierania i realizacji umów w rodzaju: leczenie szpitalne, do katalogu jednorodnych grup wprowadzono grupę J40 o nazwie ciężka łuszczyca. W przypadku pierwszorazowego udzielenia świadczenia ciężka łuszczyca z katalogu grup, należało udokumentować wskazania do rozpoczęcia leczenia z zastosowaniem leków biologicznych, dokonać kwalifikacji pacjenta w oparciu o ocenę stopnia zaawansowania łuszczycy (PASI>10; BSA>10, DLQI>10) oraz załączyć do historii choroby dokumentację związaną z oceną stanu klinicznego pacjenta. Obecnie obowiązuje Zarządzenie Prezesa NFZ nr 33/2011/DSOZ z dnia 6 lipca 2011 r., zgodnie z którym świadczenia w ciężkiej łuszczycy zostały umieszczone w dwóch obszarach: w katalogu świadczeń odrębnych znajduje się hospitalizacja związana z terapią biologiczną ciężkiej 2/7
3 łuszczycy, natomiast w katalogu do sumowania znajduje się lek lub wyrób medyczny niezawarty w kosztach świadczenia. 1 Na podstawie danych otrzymanych od NFZ Agencja wnioskuje o ograniczonej dostępności leczenia biologicznego dla członków populacji docelowej - tylko bardzo niewielki odsetek pacjentów kwalifikujących się do zastosowania leczenia biologicznego (1,24%) skorzystało z omawianych terapii w latach 2010 i Opis świadczenia Oceniane świadczenie obejmuje stosowanie tzw. terapii biologicznych, w tym trzech leków z grupy inhibitorów czynnika martwicy nowotworu alfa (TNF-alfa) adalimumabu, etanerceptu i infliksymabu oraz jednego leku z grupy inhibitorów interleukin (ustekinumabu). 1,3 Adalimumab (Humira) jest rekombinowanym ludzkim przeciwciałem monoklonalnym wiążącym się swoiście z TNF i neutralizującym biologiczną czynność TNF, poprzez blokowanie jego interakcji z receptorami p55 i p75 na powierzchni komórki, moduluje również odpowiedzi biologiczne indukowane lub regulowane przez TNF, w tym zmiany w poziomach cząsteczek adhezji międzykomórkowej, odpowiadających za migrację leukocytów. Lek podawany jest we wstrzyknięciach podskórnych. 8 Dawkowanie w programie: dawka początkowa 80 mg, a następnie po upływie jednego tygodnia od podania dawki początkowej, 40 mg co drugi tydzień. 3 Etanercept (Enbrel) jest białkiem receptorowym p75 Fc, wiążącym się z ludzkim czynnikiem martwicy nowotworów, które biologicznie jest dimerem chimerycznego białka i stanowi połączenie domeny receptora 2 ludzkiego czynnika martwicy nowotworów (TNFR2/p75) z zewnątrzkomórkowymi ligandami domeny Fc ludzkiej IgG1. Podawany jest we wstrzyknięciach podskórnych. 9 W ocenianym programie przewidziano dawkowanie 25 mg dwa razy w tygodniu lub 50 mg raz w tygodniu; alternatywnie: 50 mg dwa razy w tygodniu przez okres 12 tygodni, a następnie 25 mg dwa razy lub 50 mg raz w tygodniu. 3 Infliksymab (Remicade) jest chimerycznym ludzko-mysim przeciwciałem monoklonalnym IgG1 wiążącym się z dużym powinowactwem z rozpuszczalną, jak i transbłonową formą ludzkiego TNF-alfa ale nie wiążącym się z limfotoksyną alfa. Podawany jest we wlewie dożylnym. 10 Dawkowanie w programie: 5 mg/kg masy ciała w infuzji dożylnej trwającej ponad 2 godziny, następnie po 2 i 6 tygodniach od pierwszego podania dodatkowe infuzje w dawkach 5 mg/kg mc, a potem co 8 tygodni. 3 Ustekinumab (Stelara) jest w pełni ludzkim przeciwciałem monoklonalnym IgG1κ, które wiąże się z wysokim powinowactwem oraz swoistością z podjednostką białkową p40 ludzkich cytokin interleukin IL-12 i IL-23. Ustekinumab hamuje ich aktywność, zapobiegając wiązaniu tych cytokin z ich receptorem białkowym IL-12Rβ1 znajdującym się na powierzchni komórek układu odpornościowego, co zapobiega ich aktywacji i wydzielaniu cytokin zapalnych. Ustekinumab nie oddziałuje na aktywność dopełniacza, ani nie bierze udziału w zjawisku cytotoksyczności, zależnej od przeciwciał komórek receptorowych. Lek podawany jest w podskórnie. 11 Dawkowanie w programie: dawka początkowa - 45 mg, następnie 45 mg po 4 tygodniach, a potem 45 mg co 12 tygodni; u pacjentów z masą ciała powyżej 100 kg dawka początkowa - 90 mg, następnie ta sama dawka po 4 tygodniach, a potem co 12 tygodni. 3 Wskazania do stosowania wyżej wymienionych leków w opiniowanym programie są zgodne z ich zarejestrowanymi wskazaniami. 1 Stosowanie wyżej wymienionych produktów leczniczych przewidywał również program zdrowotny pozytywnie zaopiniowany przez Radę Konsultacyjną w 2009 roku; obecnie leczenie wymienionymi lekami jest finansowane ze środków publicznych. Kwalifikacja ocenianego świadczenia, jako świadczenia gwarantowanego, zasadniczo jest propozycją wprowadzenia zmiany sposobu finansowania biologicznych terapii łuszczycy plackowatej leczenie biologiczne łuszczycy miałoby być prowadzone w ramach programu zdrowotnego. W stosunku do poprzednio ocenianej wersji programu uszczegółowiono kryteria kwalifikacji, dookreślono czas, po którym następuje ocena odpowiedzi na leczenie, zaostrzono kryteria odpowiedzi na leczenie, wprowadzono modyfikacje 3/7
4 w schematach dawkowania, dodano dodatkowe kody ICD-10. Rozszerzono także zakresy badań kontrolnych oraz działań niepożądanych, których wystąpienie skutkuje wykluczeniem z programu. 1 Efektywność kliniczna W 2009 roku przedstawiono dowody naukowe efektywności klinicznej ocenianych terapii, w postaci prawidłowo zaprojektowanych badań z randomizacją, trwających tyg., porównujących wnioskowane preparaty z placebo w zakresie kontroli łuszczycy wyrażonej wskaźnikiem PASI. Nie istniały wówczas opublikowane wyniki badań, porównujących poszczególne terapie biologiczne między sobą. Każda z ocenianych terapii biologicznych okazała się istotnie skuteczniejsza od placebo, we wszystkich analizowanych punktach końcowych oraz wykazywała dużą efektywność kliniczną (NNT 2-5). Jakość życia pacjentów, oceniania kwestionariuszem DLQI, była istotnie wyższa w grupach leczonych ocenianymi lekami, niż w grupach kontrolnych (placebo). Z opublikowanego przeglądu systematycznego wynikało, że inhibitory TNF-alfa (adalimumab, etanercept i infliksimab w cytowanym badaniu nie uwzględniano ustekinumabu) są najbardziej efektywną grupą leczniczą stosowaną w terapii ogólnej łuszczycy. 2 W wyniku przeglądu systematycznego, przeprowadzonego w ramach niniejszej oceny odnaleziono 3 badania RCT oceniające skuteczność i bezpieczeństwo zastosowania leczenia biologicznego (adalimumab, etanercept, infliksymab, ustekinumab) w terapii ciężkiej lub umiarkowanej łuszczycy plackowatej. Wyniki badań z randomizacją (Griffith 2010, Asahina 2010, van de Kerhof 2008) wskazują, że: etanercept w dawce 50 mg 1x1 tyg. oraz adalimumab w dawce 80 mg w 0 tyg., od 2 tyg. 40 mg 1x2 tyg., wykazują statystycznie istotną przewagę nad placebo w zakresie wskaźników PASI 50, 75 i 90; ustekinumab w dawce 45 mg oraz 90 mg wykazuje statystycznie istotną przewagę nad etanerceptem w dawce 50 mg 2x tydzień w zakresie wskaźników PASI 75 i PASI 90; nie wykazano przewagi etanerceptu w dawce 50 mg 1x1 tyg. nad placebo w zakresie wskaźnika PASI 90. 1,12-14 Na podstawie wyników i wniosków z odnalezionych przeglądów systematycznych można stwierdzić, że najwyższą korzyść kliniczną względem placebo wykazano dla infliksymabu, oraz kolejno (zgodnie z malejącą korzyścią kliniczną), dla: ustekinumabu, adalimumabu i etanerceptu. 1 Z odnalezionych rekomendacji klinicznych (6 publikowanych po 2009 r. oraz 1 opublikowana w 2008 r.), nieuwzględnionych w poprzednim procesie analitycznym, wynika, że leczenie biologiczne łuszczycy plackowatej jest zalecane w ściśle określonej populacji docelowej, obejmującej pacjentów dorosłych z umiarkowaną lub ciężką postacią łuszczycy plackowatej, którzy nie odpowiadają na leczenie, bądź mają przeciwwskazania, lub nie tolerują innych terapii, w tym cyklosporyny, metotreksatu lub fotochemioterapii (PUVA). Zastosowanie wybranej substancji czynnej, jako terapii pierwszego wyboru w terapii biologicznej, zależy od indywidualnego stanu klinicznego pacjenta - nie zaleca się wskazywania terapii inicjującej. 1,15-21 Bezpieczeństwo stosowania Zgodnie z charakterystykami produktów leczniczych, częstymi działaniami niepożądanymi w tej grupie leków we wszystkich wskazaniach są: infekcje, gorączka oraz reakcje alergiczne, głównie w miejscu podania. Wskazywano również na poważniejsze działania niepożądane, obejmujące zespoły demielinizacyjne, kardiotoksyczność i niewydolność wątroby Na podstawie danych z badań klinicznych, analizowanych w 2009 roku, stwierdzono, że leczenie etanerceptem i adalimumabem nie wywoływało działań niepożądanych istotnie częściej niż placebo, natomiast podawanie infliksymabu zwiększało ryzyko wystąpienia działań niepożądanych przeciętnie o 20% [RR=1,21 (95% CI: 1,10-1,33); NNH=8]. 2 W aktualnej ocenie, z uwzględnieniem badań opublikowanych po 2009 roku, Agencja stwierdza, że w badaniach typu RCT zastosowanie leczenia biologicznego, związane było ze statystycznie istotnym wzrostem ryzyka działań niepożądanych takich, jak bóle pleców (ustekinumab 45 i 90 mg), reakcje w miejscu wstrzyknięcia (ryzyko występowania działań niepożądanych w leczeniu etanerceptem 4/7
5 w dawce 50 mg 2x1 tyg. jest większe, niż w leczeniu ustekinumabem w dawce 45 i 90 mg) i działania niepożądane związane z wątrobą (adalimumab). Wyniki i wnioski z odnalezionych przeglądów systematycznych wskazują, że w krótkim okresie obserwacji zastosowanie terapii biologicznej wiąże się z istotnie wyższym ryzykiem działań niepożądanych, m.in. infekcji oraz nowotworów (w porównaniu z brakiem leczenia placebo). 1 Koszty świadczenia i jego wpływ na budżet płatnika Ocenę opłacalności stosowania adalimumabu, etanerceptu, infliksymabu i ustekinumabu w leczeniu łuszczycy plackowatej oceniono w oparciu o, przeprowadzoną przez Agencję, analizę konsekwencji kosztów i przegląd opublikowanych analiz ekonomicznych. Zgodnie z uzyskanymi oszacowaniami, całkowite koszty roczne zastosowania terapii biologicznej w ramach leczenia szpitalnego, przypadające na przeciętnego pacjenta, kształtują się na poziomie od 60 tys. do 85 tys. zł, w zależności od zastosowanego leku i schematu dawkowania - średnio 71 tys. zł. Całkowite koszty roczne zastosowania terapii biologicznej w ramach programu zdrowotnego, przypadające na przeciętnego pacjenta, kształtują się na poziomie od 61 tys. do 85,7 tys. zł, w zależności od zastosowanego leku i schematu dawkowania - średnio 73 tys. zł, z czego większość stanowią koszty leków. 1 Z przeprowadzonego przeglądu opublikowanych analiz ekonomicznych wynika, że współczynniki efektywności kosztów (ICER) lub użyteczności kosztów (ICUR) dla poszczególnych opcji terapeutycznych, stosowanych w ramach leczenia biologicznego zasadniczo nie przekraczają progów opłacalności, przyjętych w poszczególnych krajach. Ponadto, z przeglądu analiz ekonomicznych wynika, że infliksymab, ustekinumab i adalimumab są bardziej opłacalnymi opcjami terapeutycznymi niż etanercept. Większość analiz ekonomicznych wskazuje, że etanercept jest najmniej opłacalną opcją terapeutyczną spośród wszystkich terapii biologicznych, stosowanych w leczeniu umiarkowanej oraz ciężkiej łuszczycy plackowatej. Wyniki analiz wskazują, że zastosowanie terapii biologicznej w przypadku pacjentów z ciężką łuszczycą z PASI >20 może być bardziej opłacalne niż leczenie pacjentów z PASI >10. 1 W celu oceny skutków finansowych dla systemu ochrony zdrowia, związanych z wprowadzeniem programu zdrowotnego leczenia łuszczycy plackowatej lekami biologicznymi, przeprowadzono analizę wpływu na system ochrony zdrowia. Na podstawie odnalezionych w literaturze wskaźników i danych epidemiologicznych, oszacowano liczebność populacji docelowej na pacjentów, którzy mogliby kwalifikować się do terapii biologicznej na podstawie ustalonych kryteriów włączenia. Roczną liczebność populacji docelowej oceniono na ok. 344 pacjentów. W analizie porównano szacowane wydatki, wynikające z realizacji scenariusza istniejącego, tj. kontynuacji finansowania terapii biologicznej ze środków publicznych w ramach leczenia szpitalnego, z nowym scenariuszem, tj. wdrożeniem opiniowanego programu zdrowotnego, w 3 wariantach: najbardziej prawdopodobnym, minimalnym i maksymalnym. W wariancie podstawowym scenariusza nowego przyjęto założenie, że populacja docelowa (zastana), kwalifikująca się do leczenia biologicznego, zostanie objęta programem w ciągu 3 lat. W I roku finansowania (tj r.) zostanie objęta leczeniem 1/3 populacji zastanej, a w kolejnych latach (II i III roku) finansowania kolejne 2/3 populacji zastanej oraz wszystkie nowe przypadki. Całkowite nakłady finansowe, związane z wprowadzeniem programu leczenia łuszczycy plackowatej lekami biologicznymi w I roku finansowania, oszacowano na 165 mln zł, w II roku - na 273 mln zł oraz 328 mln zł w III roku finansowania. Zgodnie z wynikami przeprowadzonej analizy wydatki inkrementalne w I roku finansowania będą kształtowały się na poziomie 159 mln zł (wariant podstawowy; zakres wynikający z wariantów skrajnych: 67 mln 492 mln zł), w II roku finansowania nakłady inkrementalne wyniosą 302 mln zł (71 mln mln zł), a w III roku mln zł. (75 mln 295 mln zł). 1 W wyniku przeszukiwania stron agencji HTA: NICE, SMC, HAS, PBAC, CADTH i PTAC odnaleziono 20 rekomendacji dotyczących finansowania ze środków publicznych leczenia łuszczycy plackowatej lekami biologicznymi. Wszystkie agencje rekomendują finansowanie leczenia biologicznego łuszczycy plackowatej z wykorzystaniem ocenianych interwencji, z ograniczeniem finansowania do wąskiej populacji chorych, spełniającej restrykcyjne kryteria włączenia. 1 5/7
6 Dodatkowe uwagi Rady W raporcie oceny świadczenia Agencja zgłosiła następujące zastrzeżenia do opiniowanego programu zdrowotnego: brak definicji remisji (definicja powinna jednoznacznie określać jakie kryteria kliniczne określają wejście w stan remisji), dopuszczenie kodów ICD-10 innych niż łuszczyca pospolita L.40.0, ponowne włączenie pacjenta po remisji i wznowie, bez powtórnego procesu kwalifikacji (co może powodować włączanie do programu lżejszych przypadków), brak określonych zasad przełączania pacjentów na inny lek biologiczny. Rada podziela powyższe uwagi w zakresie konieczności uściślenia definicji remisji, ustalenia zasad ponownej kwalifikacji do leczenia biologicznego oraz ustalenia warunków wyboru preparatu biologicznego. Biorąc pod uwagę powyższe argumenty Rada Konsultacyjna przyjęła stanowisko jak na wstępie. Piśmiennictwo 1. Raport ws. oceny świadczenia opieki zdrowotnej Leczenie łuszczycy plackowatej lekami biologicznymi. Raport nr: AOTM-OT Agencja Oceny Technologii Medycznych: Warszawa, październik Agencja Oceny Technologii Medycznych. Rada Konsultacyjna. Stanowisko Rady Konsultacyjnej nr 9/6/22/2009 z dnia 9 listopada 2009r. w sprawie zasadności zakwalifikowania leczenia łuszczycy zwykłej (plackowatej) przy wykorzystaniu produktów leczniczych etanercept (Enbrel ), adalimumab (Humira ), infliksimab (Remicade ) i ustekinumab (Stelara ) w ramach terapeutycznego programu zdrowotnego Narodowego Funduszu Zdrowia jako świadczenia gwarantowanego. 3. Opis programu zdrowotnego Leczenie łuszczycy plackowatej lekami biologicznymi (ICD 10: L40, L40.0, L40.4, L40.8, L40.9) załącznik nr 2 do raportu nr AOTM-OT Jabłońska S, Majewski S. Choroby skory i choroby przenoszone drogą płciową. Wydawnictwo Lekarskie PZWL, Warszawa Łuczkowska M, Żaba R. Łuszczyca. Przew Lek 2005;7: Icen M, Crowson CS, McEvoy MT, Dann FJ, Gabriel SE, Maradit Kremers H, Trends in incidence of adult-onset psoriasis over three decades: a population-based study., J Am Acad Dermatol. 2009;60(3): Stelara (ustekinumab). Costing statement. Ustekinumab for the treatment of adults with moderate to serve psoriasis. ( ). 8. Charakterystyka Produktu Leczniczego Humira. 9. Charakterystyka Produktu Leczniczego Enbrel. 10. Charakterystyka Produktu Leczniczego Remicade. 11. Charakterystyka Produktu Leczniczego Stelara. 12. Griffiths CE, Strober BE, van de KP, Ho V, Fidelus-Gort R, Yeilding N, Guzzo C, Xia Y, Zhou B, Li S, Dooley LT, Goldstein NH, Menter A: Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med 2010; 362(2): van de Kerkhof PC, Segaert S, Lahfa M, Luger TA, Karolyi Z, Kaszuba A, Leigheb G, Camacho FM, Forsea D, Zang C, Boussuge MP, Paolozzi L, Wajdula J. Once weekly administration of etanercept 50 mg is efficacious and well tolerated in patients with moderate-to-severe plaque psoriasis: a randomized controlled trial with open-label extension. Br J Dermatol Nov;159(5): Asahina A, Nakagawa H, Etoh T, Ohtsuki M: Adalimumab in Japanese patients with moderate to severe chronic plaque psoriasis: efficacy and safety results from a Phase II/III randomized controlled study; J Dermatol 2010; 37(4): Szepietowski J., Adamski Z., Chodorowska G., Gliński W., Kaszuba A. Placek W., Rudnicka L., Reich A. Rekomendacje Polskiego Towarzystwa Dermatologicznego dotyczące stosowania leków biologicznych w łuszczycy zwyczajnej i stawowej (łuszczycowym zapaleniu stawów). Przegl. Dermatol 2010, 97, /7
7 16. Smith C.H., Anstey A.V., Barker J.N.W.N. British Association of Dermatologists guidelines for biologic interventions for psoriasis British Journal of Dermatology , pp Nast. A, Kopp IB, et al. Evidence-based (S3) guidelines for the treatment of psoriasis vulgaris. Journal der Deutschen Dermatologischen Gesellschaft. 2007;vol 5, suppl. 3: Puig L., Carrascosa J.M., Daudén E. Spanish Evidence-Based Guidelines on the Treatment of Moderate to Severe Psoriasis with Biologic Agents. Actas Dermosifiliogr. 2009;100: Pathirana D., Ormerod AD., Saiag P. et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris. JEADV 2009, 23 (Suppl. 2), Gottlieb A., Neil J. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics. J Am Acad Dermatol 2008;58: ). 21. Lebwohl M., Bagel J. et al. From the Medical Board of the National Psoriasis Foundation: Monitoring and vaccinations in patients treated with biologics for psoriasis. J Am Acad Dermatol 2008;58(1): /7
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 24/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Humira (adalimumab) w ramach programu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 24/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Humira (adalimumab) w ramach programu
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1. Podczas pierwszej kwalifikacji do programu oraz gdy jest to
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1. Podczas pierwszej kwalifikacji do programu oraz gdy jest to
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD 10: L40.0) ŚWIADCZENIOBIORCY Kwalifikacja do programu A. Kryteria kwalifikacji do leczenia ustekinumabem w ramach programu 1.Do programu
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Lek BI w porównaniu z lekiem Humira u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą
 Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Leki biologiczne w łuszczycy krostkowej. pomagają czy szkodzą? Hanna Wolska Warszawa
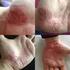 Leki biologiczne w łuszczycy krostkowej pomagają czy szkodzą? Hanna Wolska Warszawa Skuteczne leczenie lekami biologicznymi w PP Szereg dowodów z opisów przypadków i małych serii Dotyczy to głównie preparatów
Leki biologiczne w łuszczycy krostkowej pomagają czy szkodzą? Hanna Wolska Warszawa Skuteczne leczenie lekami biologicznymi w PP Szereg dowodów z opisów przypadków i małych serii Dotyczy to głównie preparatów
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 615 Poz. 27 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Adalimumab w leczeniu choroby Crohna Analiza wpływu na budżet NFZ
 Adalimumab w leczeniu choroby Crohna Analiza wpływu na budżet NFZ Tomasz Macioch, Olga, Adamowicz, Małgorzata Polkowska Warszawa Czerwiec 2012 Adalimumab w leczeniu choroby Crohna analiza wpływu na budżet
Adalimumab w leczeniu choroby Crohna Analiza wpływu na budżet NFZ Tomasz Macioch, Olga, Adamowicz, Małgorzata Polkowska Warszawa Czerwiec 2012 Adalimumab w leczeniu choroby Crohna analiza wpływu na budżet
LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Dziennik Urzędowy Ministra Zdrowia 732 Poz. 71 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
Dziennik Urzędowy Ministra Zdrowia 732 Poz. 71 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA ŚWIADCZENIOBIORCÓW Z CIĘŻKĄ, AKTYWNĄ POSTACIĄ ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M
LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Załącznik B.36. LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW ŚWIADCZENIOBIORCY W PROGRAMIE
Załącznik B.36. LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW ŚWIADCZENIOBIORCY W PROGRAMIE
Jaka jest przyszłość pacjentów chorych na łuszczycę w Polsce?
 Jaka jest przyszłość pacjentów chorych na łuszczycę w Polsce? Prof. dr hab. med. Andrzej Kaszuba Krajowy Konsultant w Dziedzinie Dermatologii i Wenerologii SKŁAD ZESPOŁU: Przewodniczący Zespołu: Prof.
Jaka jest przyszłość pacjentów chorych na łuszczycę w Polsce? Prof. dr hab. med. Andrzej Kaszuba Krajowy Konsultant w Dziedzinie Dermatologii i Wenerologii SKŁAD ZESPOŁU: Przewodniczący Zespołu: Prof.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Leczenie biologiczne co to znaczy?
 Leczenie biologiczne co to znaczy? lek med. Anna Bochenek Centrum Badawcze Współczesnej Terapii C B W T 26 Październik 2006 W oparciu o materiały źródłowe edukacyjnego Grantu, prezentowanego na DDW 2006
Leczenie biologiczne co to znaczy? lek med. Anna Bochenek Centrum Badawcze Współczesnej Terapii C B W T 26 Październik 2006 W oparciu o materiały źródłowe edukacyjnego Grantu, prezentowanego na DDW 2006
(ICD-10 M 05, M 06, M 08)
 B.33. (ICD10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji IADCZENIOBIORCY 1. Dawkowanie W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Badania przy kwalifikacji (leczenie
B.33. (ICD10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji IADCZENIOBIORCY 1. Dawkowanie W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Badania przy kwalifikacji (leczenie
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 45/2014 z dnia 28 stycznia 2014 r. w sprawie oceny leku Botox (toksyna botulinowa typu A 100 jednostek) we wskazaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 45/2014 z dnia 28 stycznia 2014 r. w sprawie oceny leku Botox (toksyna botulinowa typu A 100 jednostek) we wskazaniu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
Warszawa, dnia 18.12.2012
 Warszawa, dnia 18.12.2012 Opinia dotycząca zasad rozliczania świadczeń z zakresu lecznictwa szpitalnego chemioterapia, w oparciu o obowiązujące prawo oraz regulacje wynikające z zarządzeń Prezesa Narodowego
Warszawa, dnia 18.12.2012 Opinia dotycząca zasad rozliczania świadczeń z zakresu lecznictwa szpitalnego chemioterapia, w oparciu o obowiązujące prawo oraz regulacje wynikające z zarządzeń Prezesa Narodowego
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Zasadność finansowania mechanicznej trombektomii w leczeniu udaru mózgu. Dr n. med. Przemysław Ryś
 Zasadność finansowania mechanicznej trombektomii w leczeniu udaru mózgu Dr n. med. Przemysław Ryś Czy trombektomia powinna być refundowana? Jakie kryteria brane są pod uwagę? Kto podejmuje decyzję refundacyjną?
Zasadność finansowania mechanicznej trombektomii w leczeniu udaru mózgu Dr n. med. Przemysław Ryś Czy trombektomia powinna być refundowana? Jakie kryteria brane są pod uwagę? Kto podejmuje decyzję refundacyjną?
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.32. LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Długoterminowa skuteczność golimumabu u pacjentów z zapalnymi spondyloartropatiami wtorek, 03 lutego :06
 Skuteczność leczenia zapalnych chorób reumatycznych poprawiła się istotnie w ostatnich latach. Złożyło się na to wiele czynników, do których można zaliczyć wczesną diagnostykę i szybkie rozpoczynanie odpowiedniej
Skuteczność leczenia zapalnych chorób reumatycznych poprawiła się istotnie w ostatnich latach. Złożyło się na to wiele czynników, do których można zaliczyć wczesną diagnostykę i szybkie rozpoczynanie odpowiedniej
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska
 Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51)
 Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit
 Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit Co to są nieswoiste zapalenia jelit? Grupa chorób w których dochodzi
Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit Co to są nieswoiste zapalenia jelit? Grupa chorób w których dochodzi
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 93/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 19 grudnia 2011 r. w sprawie zasadności zakwalifikowania świadczenia opieki
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 93/2011 Prezesa Agencji Oceny Technologii Medycznych z dnia 19 grudnia 2011 r. w sprawie zasadności zakwalifikowania świadczenia opieki
Leczenie Farmakologiczne
 www.printo.it/pediatric-rheumatology/pl/intro Leczenie Farmakologiczne Wersja 2016 13. Leki biologiczne W ciągu ostatnich lat pojawiły się nowe perspektywy leczenia dzięki nowym lekom określanym jako leki
www.printo.it/pediatric-rheumatology/pl/intro Leczenie Farmakologiczne Wersja 2016 13. Leki biologiczne W ciągu ostatnich lat pojawiły się nowe perspektywy leczenia dzięki nowym lekom określanym jako leki
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
 Dziennik Urzędowy Ministra Zdrowia 570 Poz. 56 Załącznika B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
Dziennik Urzędowy Ministra Zdrowia 570 Poz. 56 Załącznika B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
BADANIA PASS ROLA CRO W PLANOWANIU I ZARZĄDZANIU
 BADANIA PASS ROLA CRO W PLANOWANIU I ZARZĄDZANIU Agnieszka Almgren- Rachtan MD PhD BADANIEM Post- authorisajon safety study Porejestracyjne badanie farmakoepidemiologiczne lub próba kliniczna przeprowadzona
BADANIA PASS ROLA CRO W PLANOWANIU I ZARZĄDZANIU Agnieszka Almgren- Rachtan MD PhD BADANIEM Post- authorisajon safety study Porejestracyjne badanie farmakoepidemiologiczne lub próba kliniczna przeprowadzona
LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08)
 Załącznik B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji ŚWIADCZENIOBIORCY
Załącznik B.33. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria kwalifikacji ŚWIADCZENIOBIORCY
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM
 XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
XTANDI (ENZALUTAMID) W LECZENIU DOROSŁYCH CHORYCH NA RAKA GRUCZOŁU KROKOWEGO OPORNEGO NA KASTRACJĘ PO NIEPOWODZENIU TERAPII DOCETAKSELEM Wykonawca: MAHTA Sp z oo ul Rejtana 17/5 02-516 Warszawa Tel 22
LECZENIE ŁUSZCZYCOWEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ŁZS) (ICD-10 L 40.5, M 07.1, M 07.2, M 07.3)
 Załącznik B.35. LECZENIE ŁUSZCZYCOWEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ŁZS) (ICD-10 L 40.5, M 07.1, M 07.2, M 07.3) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
Załącznik B.35. LECZENIE ŁUSZCZYCOWEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ŁZS) (ICD-10 L 40.5, M 07.1, M 07.2, M 07.3) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
Systemowe aspekty leczenia WZW typu C
 Systemowe aspekty leczenia WZW typu C Dr n. med. Jakub Gierczyński, MBA Narodowy Instytut Zdrowia Publicznego-PZH Instytut Zarządzania w Ochronie Zdrowia, Uczelnia Łazarskiego Warszawa, 06.06.2017 r. Systemowe
Systemowe aspekty leczenia WZW typu C Dr n. med. Jakub Gierczyński, MBA Narodowy Instytut Zdrowia Publicznego-PZH Instytut Zarządzania w Ochronie Zdrowia, Uczelnia Łazarskiego Warszawa, 06.06.2017 r. Systemowe
odpowiedź na ustekinumab u chorych na łuszczycę zwykłą leczonych i nieleczonych wcześniej preparatami anty-tnf
 odpowiedź na ustekinumab u chorych na łuszczycę zwykłą leczonych i nieleczonych wcześniej preparatami anty-tnf Anders Clemmensen, 1 Martin Spon, 1 Lone Skov, 2,3 Claus Zachariae, 2,3 Robert Gniadecki 1,3
odpowiedź na ustekinumab u chorych na łuszczycę zwykłą leczonych i nieleczonych wcześniej preparatami anty-tnf Anders Clemmensen, 1 Martin Spon, 1 Lone Skov, 2,3 Claus Zachariae, 2,3 Robert Gniadecki 1,3
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
ANALIZA EKONOMICZNA. Wersja 1.0
 ANALIZA EKONOMICZNA COSENTYX W PORÓWNANIU Z INNYMI LEKAMI BIOLOGICZNYMI W LECZENIU DOROSŁYCH PACJENTÓW Z ŁUSZCZYCĄ PLACKOWATĄ O NASILENIU UMIARKOWANYM DO CIĘŻKIEGO Wersja 1.0 Kraków lipiec 2015 Analiza
ANALIZA EKONOMICZNA COSENTYX W PORÓWNANIU Z INNYMI LEKAMI BIOLOGICZNYMI W LECZENIU DOROSŁYCH PACJENTÓW Z ŁUSZCZYCĄ PLACKOWATĄ O NASILENIU UMIARKOWANYM DO CIĘŻKIEGO Wersja 1.0 Kraków lipiec 2015 Analiza
Infliksymab (Remicade ) w leczeniu choroby Leśniowskiego-Crohna. Analiza wpływu na system ochrony zdrowia
 Infliksymab (Remicade ) w leczeniu choroby Leśniowskiego-Crohna Analiza wpływu na system ochrony zdrowia Warszawa Kwiecień 2012 Autorzy raportu: Wkład pracy: s Adres do korespondencji: Recenzja: Opracowanie
Infliksymab (Remicade ) w leczeniu choroby Leśniowskiego-Crohna Analiza wpływu na system ochrony zdrowia Warszawa Kwiecień 2012 Autorzy raportu: Wkład pracy: s Adres do korespondencji: Recenzja: Opracowanie
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Leki blokujące interleukinę 17: znaczenie we współczesnym leczeniu łuszczycy plackowatej. stanowisko ekspertów
 Leki blokujące interleukinę 17: znaczenie we współczesnym leczeniu łuszczycy plackowatej stanowisko ekspertów Adam Reich 1, Zygmunt Adamski 2, Grażyna Chodorowska 3, Andrzej Kaszuba 4, Dorota Krasowska
Leki blokujące interleukinę 17: znaczenie we współczesnym leczeniu łuszczycy plackowatej stanowisko ekspertów Adam Reich 1, Zygmunt Adamski 2, Grażyna Chodorowska 3, Andrzej Kaszuba 4, Dorota Krasowska
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych?
 Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych? prof. dr hab. med.. Piotr Fiedor Warszawski Uniwersytet Medyczny
Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych? prof. dr hab. med.. Piotr Fiedor Warszawski Uniwersytet Medyczny
GŁÓWNE POWODY NEGATYWNYCH REKOMENDACJI AOTMIT. Izabela Pieniążek. Krakowskie Sympozjum HTA/MA 2015
 GŁÓWNE POWODY NEGATYWNYCH REKOMENDACJI AOTMIT Izabela Pieniążek Krakowskie Sympozjum HTA/MA 2015 1 ZAKRES ANALIZY REKOMENDACJI REFUNDACYJNYCH Zlecenia Ministra Zdrowia dotyczące przygotowania analizy weryfikacyjnej
GŁÓWNE POWODY NEGATYWNYCH REKOMENDACJI AOTMIT Izabela Pieniążek Krakowskie Sympozjum HTA/MA 2015 1 ZAKRES ANALIZY REKOMENDACJI REFUNDACYJNYCH Zlecenia Ministra Zdrowia dotyczące przygotowania analizy weryfikacyjnej
Katalog grup Załącznik nr 1 do zarządzenia Nr 81/2014/0S0Z. Zakresy świadczeń. Kod grupy. Uwagi. Kod produktu Nazwa grupy. dermatologia i wenerologia
 Katalog grup Załącznik nr 1 do zarządzenia Nr 81/2014/0S0Z Załączni~ nr la do zarządzenia Nr 89/2013/DSOZ Kod grupy Kod produktu Nazwa grupy dermatologia i Uwagi A57 5.51.01.0001057 Choroby zapalne układu
Katalog grup Załącznik nr 1 do zarządzenia Nr 81/2014/0S0Z Załączni~ nr la do zarządzenia Nr 89/2013/DSOZ Kod grupy Kod produktu Nazwa grupy dermatologia i Uwagi A57 5.51.01.0001057 Choroby zapalne układu
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 5/2015 z dnia 26 stycznia 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 5/2015 z dnia 26 stycznia 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Rekomendacja nr 19/2016 Prezesa AOTM z dnia 6 kwietnia 2016r.
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2016 z dnia 6 kwietnia 2016r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie zakwalifikowania
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2016 z dnia 6 kwietnia 2016r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie zakwalifikowania
ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA
 ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA PONOWNE ZBADANIE OPINII CHMP Z 19 LIPCA 2007 R. NA TEMAT PREPARATU NATALIZUMAB ELAN PHARMA Podczas posiedzenia w lipcu 2007 r. CHMP przyjął
ANEKS WNIOSKI NAUKOWE I PODSTAWY DO ODMOWY PRZEDSTAWIONE PRZEZ EMEA PONOWNE ZBADANIE OPINII CHMP Z 19 LIPCA 2007 R. NA TEMAT PREPARATU NATALIZUMAB ELAN PHARMA Podczas posiedzenia w lipcu 2007 r. CHMP przyjął
LECZENIE ŁUSZCZYCOWEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ŁZS) (ICD-10 L 40.5, M 07.1, M 07.2, M 07.3)
 Dziennik Urzędowy Ministra Zdrowia 780 Poz. 17 Załącznik B.35. LECZENIE ŁUSZCZYCOWEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ŁZS) (ICD-10 L 40.5, M 07.1, M 07.2, M 07.3) ZAKRES ŚWIADCZENIA GWARANTOWANEGO
Dziennik Urzędowy Ministra Zdrowia 780 Poz. 17 Załącznik B.35. LECZENIE ŁUSZCZYCOWEGO ZAPALENIA STAWÓW O PRZEBIEGU AGRESYWNYM (ŁZS) (ICD-10 L 40.5, M 07.1, M 07.2, M 07.3) ZAKRES ŚWIADCZENIA GWARANTOWANEGO
NZJ- a problemy stawowe. Małgorzata Sochocka-Bykowska Wojewódzki Zespół Reumatologiczny w Sopocie
 NZJ- a problemy stawowe Małgorzata Sochocka-Bykowska Wojewódzki Zespół Reumatologiczny w Sopocie Przewlekłe nieswoiste zapalenia jelit charakteryzujące się występowaniem częstych powikłań jelitowych i
NZJ- a problemy stawowe Małgorzata Sochocka-Bykowska Wojewódzki Zespół Reumatologiczny w Sopocie Przewlekłe nieswoiste zapalenia jelit charakteryzujące się występowaniem częstych powikłań jelitowych i
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 5/2012 z dnia 27 lutego 2012 r. w zakresie zakwalifikowania/niezasadności zakwalifikowania leku Valdoxan (agomelatinum)
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie?
 Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Rozwiązania systemowe dla leków hematoonkologicznych dla małych populacji pacjentów - czy program lekowy to optymalne rozwiązanie? lek. med. Marek Dudziński Oddział Hematologii Wojewódzki Szpital Specjalistyczny
Simponi/golimumab Streszczenie EPAR dla ogółu społeczeństwa.
 Simponi/golimumab Streszczenie EPAR dla ogółu społeczeństwa. Niniejszy dokument stanowi streszczenie Europejskiego Publicznego Sprawozdania Oceniajc ego (EPAR). Wyja nia, jak Komitet ds. Produktów Leczniczych
Simponi/golimumab Streszczenie EPAR dla ogółu społeczeństwa. Niniejszy dokument stanowi streszczenie Europejskiego Publicznego Sprawozdania Oceniajc ego (EPAR). Wyja nia, jak Komitet ds. Produktów Leczniczych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 127/2013 z dnia 8 lipca 2013 r. w sprawie zasadności finansowania leku Benlysta (belimumab) 120 mg, EAN 5909990881123
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 127/2013 z dnia 8 lipca 2013 r. w sprawie zasadności finansowania leku Benlysta (belimumab) 120 mg, EAN 5909990881123
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA
 Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
Szanse i zagrożenia przygotowania RSS na podstawie raportu HTA Co może być istotne w procesie tworzenia RSS? Magdalena Władysiuk Ustawa refundacyjna W krajach o średnim dochodzie RSSs są szansą na finansowanie
SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE 1. Dawkowanie. 1.1 Adalimumab należy podawać w dawce 40 mg, we wstrzyknięciu podskórnym co dwa tygodnie
 Załącznik nr 1 13. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW (RZS) I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW (MIZS) O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria
Załącznik nr 1 13. LECZENIE REUMATOIDALNEGO ZAPALENIA STAWÓW (RZS) I MŁODZIEŃCZEGO IDIOPATYCZNEGO ZAPALENIA STAWÓW (MIZS) O PRZEBIEGU AGRESYWNYM (ICD-10 M 05, M 06, M 08) I. LEKI BIOLOGICZNE A. Kryteria
Zalecenia postępowania diagnostyczno-terapeutycznego Reumatologia 2016; supl. 1: DOI: /reum
 Zalecenia postępowania diagnostyczno-terapeutycznego Reumatologia 2016; supl. 1: 134 135 DOI: 10.5114/reum.2016.60016 Postępowanie okołooperacyjne w aloplastyce stawu biodrowego i kolanowego u chorych
Zalecenia postępowania diagnostyczno-terapeutycznego Reumatologia 2016; supl. 1: 134 135 DOI: 10.5114/reum.2016.60016 Postępowanie okołooperacyjne w aloplastyce stawu biodrowego i kolanowego u chorych
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację?
 Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
Wpływ nowych terapii na budżet NFZ czy stać nas na refundację? Leszek Stabrawa W A R S Z A W A, 1 1 s i e r p n i a 2 0 1 6 Dostęp do innowacyjnych terapii w Polsce o Jednym z celów ustawy refundacyjnej
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.32. LECZENIE CHOROBY LE NIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Komunikat nr 55/2018 dla świadczeniodawców realizujących świadczenia w zakresie programy lekowe
 Komunikat nr 55/2018 dla świadczeniodawców realizujących świadczenia w zakresie programy lekowe Śląski Oddział Wojewódzki NFZ przekazuje informacje dotyczące rozbudowy elektronicznego systemu monitorowania
Komunikat nr 55/2018 dla świadczeniodawców realizujących świadczenia w zakresie programy lekowe Śląski Oddział Wojewódzki NFZ przekazuje informacje dotyczące rozbudowy elektronicznego systemu monitorowania
2. Rozporządzenie wchodzi w życie z dniem 15 grudnia 2011 r.
 PROJEKT z dnia 21.11.2011 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu ambulatoryjnej opieki specjalistycznej Na podstawie art.
PROJEKT z dnia 21.11.2011 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu ambulatoryjnej opieki specjalistycznej Na podstawie art.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Promotor: prof. dr hab. Katarzyna Bogunia-Kubik Promotor pomocniczy: dr inż. Agnieszka Chrobak
 INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
Podejście AOTM do oceny wartościującej dla leków sierocych na podstawie dotychczasowych rekomendacji
 Podejście AOTM do oceny wartościującej dla leków sierocych na podstawie dotychczasowych rekomendacji Gabriela Ofierska-Sujkowska Agencja Oceny Technologii Medycznych Warszawa, 12.04.2013 r. Podejmowanie
Podejście AOTM do oceny wartościującej dla leków sierocych na podstawie dotychczasowych rekomendacji Gabriela Ofierska-Sujkowska Agencja Oceny Technologii Medycznych Warszawa, 12.04.2013 r. Podejmowanie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 36/2012 z dnia 25 czerwca 2012 r. w zakresie usunięcia z wykazu świadczeń gwarantowanych/zmiany poziomu lub sposobu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 207/2014 z dnia 1 września 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia
 Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
Lenalidomid (Revlimid ) w skojarzeniu z deksametazonem w leczeniu chorych ze szpiczakiem mnogim po niepowodzeniu wcześniejszego leczenia Analiza wpływu na system ochrony zdrowia maj 2013 Autorzy raportu:
ZAPOBIEGANIE KRWAWIENIOM U DZIECI Z HEMOFILIĄ A I B (ICD-10 D 66, D 67)
 Załącznik B.15. ZAPOBIEGANIE KRWAWIENIOM U DZIECI Z HEMOFILIĄ A I B (ICD-10 D 66, D 67) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii pierwotnej i wtórnej
Załącznik B.15. ZAPOBIEGANIE KRWAWIENIOM U DZIECI Z HEMOFILIĄ A I B (ICD-10 D 66, D 67) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii pierwotnej i wtórnej
Analizowane obawy. Obawa dotycząca bezpieczeństwa. Brak. wątpliwości w zakresie skuteczności. Brak. zminimalizowanie ryzyka
 Soolantra (Ivermectinum), krem, 10 mg/g. Numer procedury: SE/H/1428/001/DC CZĘŚĆ VI: PODSUMOWANIE DZIAŁAŃ W PLANIE ZARZĄDZANIA RYZYKIEM WEDŁUG PRODUKTU VI.1 Elementy do tabel podsumowujących w EPAR VI.1.1
Soolantra (Ivermectinum), krem, 10 mg/g. Numer procedury: SE/H/1428/001/DC CZĘŚĆ VI: PODSUMOWANIE DZIAŁAŃ W PLANIE ZARZĄDZANIA RYZYKIEM WEDŁUG PRODUKTU VI.1 Elementy do tabel podsumowujących w EPAR VI.1.1
Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r.
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy
Komunikat w sprawie elektronicznego systemu monitorowania programów lekowych (SMPT) Choroby reumatologiczne
 Komunikat w sprawie elektronicznego systemu monitorowania programów lekowych (SMPT) Choroby reumatologiczne Uprzejmie informujemy, że w dniu 18 maja 2018 roku, zostanie oddana do użytku nowa, pełna wersja
Komunikat w sprawie elektronicznego systemu monitorowania programów lekowych (SMPT) Choroby reumatologiczne Uprzejmie informujemy, że w dniu 18 maja 2018 roku, zostanie oddana do użytku nowa, pełna wersja
ANEKS I. Strona 1 z 5
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH, GATUNKI ZWIERZĄT, DROGA PODANIA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH, GATUNKI ZWIERZĄT, DROGA PODANIA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Porównanie zmian w programie lekowym B.33 w części dotyczącej MIZS przed i po 1 maja 2016
 Porównanie zmian w programie lekowym B.33 w części dotyczącej MIZS przed i po 1 maja 2016 OBOWIĄZUJE od 1 maja 2016 zmiany oznaczono kolorem 1. Kryteria kwalifikacji: 1. Kryteria kwalifikacji: Przed 1
Porównanie zmian w programie lekowym B.33 w części dotyczącej MIZS przed i po 1 maja 2016 OBOWIĄZUJE od 1 maja 2016 zmiany oznaczono kolorem 1. Kryteria kwalifikacji: 1. Kryteria kwalifikacji: Przed 1
Protokół Nr 36 Z posiedzenia Zespołu Koordynacyjnego ds. Leczenia Biologicznego w Chorobach Reumatycznych dnia 24 stycznia 2012 roku
 Protokół Nr 36 Z posiedzenia Zespołu Koordynacyjnego ds. Leczenia Biologicznego w Chorobach Reumatycznych dnia 24 stycznia 2012 roku Dnia 24 stycznia 2012 roku w Instytucie Reumatologii w Warszawie odbyło
Protokół Nr 36 Z posiedzenia Zespołu Koordynacyjnego ds. Leczenia Biologicznego w Chorobach Reumatycznych dnia 24 stycznia 2012 roku Dnia 24 stycznia 2012 roku w Instytucie Reumatologii w Warszawie odbyło
Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon
 VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 13/2012 z dnia 26 marca 2012 r w zakresie zasadności zakwalifikowania leków Clatra (bilastinum) 20 mg, tabletki,
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 13/2012 z dnia 26 marca 2012 r w zakresie zasadności zakwalifikowania leków Clatra (bilastinum) 20 mg, tabletki,
Dagmara Samselska. Przewodnicząca Unii Stowarzyszeń Chorych na Łuszczycę. Warszawa 20 kwietnia 2016
 Dagmara Samselska Przewodnicząca Unii Stowarzyszeń Chorych na Łuszczycę Warszawa 20 kwietnia 2016 przewlekła, autoagresywnie uwarunkowana, nawrotowa choroba zapalna o podłożu genetycznym nie zaraża!!!
Dagmara Samselska Przewodnicząca Unii Stowarzyszeń Chorych na Łuszczycę Warszawa 20 kwietnia 2016 przewlekła, autoagresywnie uwarunkowana, nawrotowa choroba zapalna o podłożu genetycznym nie zaraża!!!
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Preparaty biologiczne w terapii łuszczycy doświadczenia własne
 WYBRANE PROBLEMY KLINICZNE Edyta Tyc-Zdrojewska, Aleksandra Kaszuba, Iwonna Michalak, Andrzej Kaszuba Klinika Dermatologii, Dermatologii Dziecięcej i Onkologicznej Uniwersytetu Medycznego w Łodzi Preparaty
WYBRANE PROBLEMY KLINICZNE Edyta Tyc-Zdrojewska, Aleksandra Kaszuba, Iwonna Michalak, Andrzej Kaszuba Klinika Dermatologii, Dermatologii Dziecięcej i Onkologicznej Uniwersytetu Medycznego w Łodzi Preparaty
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
ZESZTYWNIAJ CEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA WIADCZENIOBIORCÓW Z CIĘŻK, AKTYWN POSTACI ZESZTYWNIAJ CEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) 1. Kryteria kwalifikacji: WIADCZENIOBIORCY 1)
Załącznik B.36. LECZENIE INHIBITORAMI TNF ALFA WIADCZENIOBIORCÓW Z CIĘŻK, AKTYWN POSTACI ZESZTYWNIAJ CEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) 1. Kryteria kwalifikacji: WIADCZENIOBIORCY 1)
