ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Ewa Rogowska
- 7 lat temu
- Przeglądów:
Transkrypt
1 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1
2 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka (0,5 ml szczepionki po rekonstytucji) zawiera: (Pierwotna zawartość proszku) Oligosacharyd meningokoków grupy A 10 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 16,7 33,3 mikrogramów (Pierwotna zawartość roztworu) Oligosacharyd meningokoków grupy C 5 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 7,1 12,5 mikrogramów Oligosacharyd meningokoków grupy W135 5 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 3,3 8,3 mikrogramów Oligosacharyd meningokoków grupy Y 5 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 5,6 10,0 mikrogramów Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek i roztwór do sporządzania roztworu do wstrzykiwań (proszek i roztwór do wstrzykiwań). Proszek ma postać krążka o barwie białej lub zbliżonej do białej. Roztwór jest klarowny i bezbarwny. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Produkt Menveo jest przeznaczony do czynnego uodpornienia młodzieży (w wieku od 11 lat) i dorosłych narażonych na kontakt z dwoinkami zapalenia opon mózgowych (Neisseria meningitidis) z grup serologicznych A, C, W135 i Y, w celu zapobiegania chorobie inwazyjnej. Szczepionkę należy stosować zgodnie z obowiązującymi oficjalnymi zaleceniami. 4.2 Dawkowanie i sposób podawania Dawkowanie Dorośli Produkt Menveo należy podawać w pojedynczym wstrzyknięciu 0,5 ml. Dzieci i młodzież Produkt Menveo jest wskazany w pojedynczym wstrzyknięciu 0,5 ml roztworu, u osób w wieku od 11 lat i starszych. 2
3 Osoby w podeszłym wieku Istnieją ograniczone dane dotyczące osób w wieku lat. Brak danych dotyczących osób w wieku powyżej 65 lat. Nie ustalono konieczności ani czasu podania dawki przypominającej produktu Menveo. Sposób podawania Produkt Menveo podaje się we wstrzyknięciu domięśniowym, najlepiej w mięsień naramienny. Nie podawać donaczyniowo, podskórnie lub śródskórnie. Jeśli w tym samym czasie podaje się inne szczepionki, należy je wstrzykiwać w różne miejsca. Informacje na temat przygotowania i rekonstytucji produktu leczniczego przed podaniem, patrz punkt Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, w tym toksoid błonicy (CRM 197 ), lub wystąpienie zagrażających życiu reakcji po uprzednim podaniu szczepionki zawierającej podobne składniki (patrz punkt 4.4). Podobnie jak w przypadku innych szczepionek podanie produktu Menveo należy odroczyć u osób z ostrą, poważną chorobą przebiegającą z gorączką. Łagodne zakażenie nie stanowi przeciwwskazania. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przed podaniem jakiejkolwiek szczepionki we wstrzyknięciu, osoba odpowiedzialna za szczepienie musi podjąć wszelkie środki ostrożności, by zapobiec reakcji alergicznej lub innej, m.in. zebrać dokładny wywiad lekarski i sprawdzić aktualny stan zdrowia. Podobnie jak w przypadku wszystkich szczepionek do wstrzykiwań należy zawsze zapewnić możliwość właściwego leczenia i nadzoru na wypadek wystąpienia rzadkich reakcji anafilaktycznych po podaniu szczepionki. Pod żadnym pozorem nie należy podawać produktu Menveo donaczyniowo. Szczepionka Menveo nie zapewnia ochrony przed zakażeniami wywołanymi przez inne niewystępujące w niej serotypy N. meningitidis. Podobnie jak w przypadku innych szczepionek, ochronna odpowiedź immunologiczna może nie wystąpić u wszystkich szczepionych osób (patrz punkt 5.1). Badania nad szczepionką Menveo z wykorzystaniem surowicy ludzkiej (hsba) jako dopełniacza wykazały zmniejszenie miana bakteriobójczego surowicy przeciw serotypowi A (patrz punkt 5.1). Znaczenie kliniczne zmniejszenia miana hsba przeciw serotypowi A nie jest znane. Obecnie dane dotyczące bezpieczeństwa dawki przypominającej są ograniczone, jednakże w przypadku podejrzewania ryzyka zakażenia meningokokami grupy A oraz jeśli od otrzymania ostatniej dawki szczepionki Menveo upłynął minimum rok, można rozważyć podanie dawki przypominającej. Brak danych dotyczących szczepień w profilaktyce po ekspozycji. U osób ze zmniejszoną odpornością szczepienie może nie wywołać odpowiedniej odpowiedzi immunologicznej. Zakażenie wirusem HIV nie stanowi przeciwwskazania, jednak nie badano szczepionki Menveo u osób ze zmniejszoną odpornością. U pacjentów z niedoborami układu dopełniacza oraz pacjentów z asplenią (czynnościową lub anatomiczną) może nie wystąpić odpowiedź immunologiczna na szczepionki skoniugowane zawierające meningokoki grupy A, C, W135 i Y. 3
4 Ze względu na ryzyko wystąpienia krwiaka nie badano produktu Menveo u osób z małopłytkowością, zaburzeniami krwotocznymi lub otrzymujących leczenie przeciwzakrzepowe. Lekarz musi rozważyć stosunek zagrożeń i korzyści w przypadku ryzyka krwiaka po wstrzyknięciu domięśniowym. Nasadka strzykawki zawiera 10% suchego kauczuku naturalnego. Ryzyko wystąpienia reakcji alergicznych na lateks jest bardzo małe, jednak zachęca się personel medyczny do rozważenia ryzyka i korzyści przed podaniem szczepionki pacjentom z rozpoznaną nadwrażliwością na lateks. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Szczepionkę Menveo oceniano w dwóch badaniach: w jednym równolegle ze szczepionką przeciw tężcowi, błonicy i krztuścowi (zredukowana dawka toksoidu przeciw błonicy i bezkomórkowy komponent przeciwkrztuścowy, Tdap), a w drugim równolegle ze szczepionką Tdap i czterowalentną szczepionką przeciw HPV (typy 6, 11, 16 i 18, rekombinowany HPV). Wyniki obu badań potwierdziły możliwość skojarzonego stosowania szczepionek. W żadnym badaniu nie stwierdzono zwiększenia odsetka reaktogenności lub zmian profilu bezpieczeństwa szczepionek. Równoległe szczepienie nie pogarszało odpowiedzi humoralnej na szczepionkę Menveo oraz komponenty przeciwko błonicy, tężcowi lub HPV. Podanie szczepionki Menveo po miesiącu od podania szczepionki Tdap powodowało statystycznie słabszą odpowiedź serologiczną na typ W135. Ponieważ nie występuje bezpośredni wpływ na seroprotekcję, aktualnie nie są znane następstwa kliniczne tego zjawiska. Stwierdzono tłumienie odpowiedzi humoralnej na dwa z trzech antygenów krztuśca, jednak znaczenie kliniczne tej obserwacji jest nieznane. Po szczepieniu u ponad 97% uczestników występowały wykrywalne miana przeciwciał przeciwko wszystkim trzem antygenom krztuścowym. Nie prowadzono badań skojarzonego stosowania produktu Menveo i innych szczepionek niż wyżej wymienione. Nie zaleca się stosowania w tym samym czasie produktu Menveo w skojarzeniu z innymi szczepionkami (zwłaszcza zawierającymi żywe drobnoustroje), chyba że jest to bezwzględnie wskazane. Stosowane równolegle szczepionki zawsze powinny być podawane w różne miejsca. Najkorzystniejsze jest wstrzyknięcie po stronie kontralateralnej. Należy zweryfikować, czy w wyniku skojarzonego podania szczepionek nie doszło do nasilenia działań niepożądanych. Odpowiedź immunologiczna na szczepienie może być osłabiona u osób otrzymujących leczenie immunosupresyjne. 4.6 Wpływ na ciążę, płodność i laktację Brak wystarczających danych klinicznych dotyczących stosowania u kobiet w ciąży. W badaniach przedklinicznych nie wykazano bezpośredniego ani pośredniego szkodliwego wpływu produktu Menveo na przebieg ciąży, rozwój zarodka (płodu), przebieg porodu lub rozwój pourodzeniowy. Zważywszy na ciężki przebieg zakażenia Neisseria meningitidis z grup serologicznych A, C, W i Y, w przypadku ewidentnego ryzyka narażenia, ciąża nie jest przeciwwskazaniem do szczepienia. Mimo niewystarczających danych klinicznych dotyczących stosowania Menveo w okresie karmienia piersią, jest mało prawdopodobne, że przeciwciała wydzielane w mleku matki byłyby szkodliwe dla karmionego piersią niemowlęcia. Dlatego szczepionkę Menveo można stosować w okresie karmienia piersią. 4
5 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Bardzo rzadko po szczepieniu opisywano zawroty głowy. Może to przejściowo wpłynąć na zdolność prowadzenia pojazdów lub obsługiwania maszyn. 4.8 Działania niepożądane Bezpieczeństwo szczepionki Menveo oceniano w pięciu randomizowanych badaniach klinicznych z grupą kontrolną, obejmujących 6185 uczestników (wiek: lat), którzy otrzymali szczepionkę Menveo. Wśród szczepionych osób produkt Menveo otrzymało 61% pacjentów w wieku lat, 17% w wieku lat, 22% w wieku lat i 3,4% w wieku lat. Dwa podstawowe badania dotyczące bezpieczeństwa były randomizowane, aktywnie kontrolowane, i obejmowały uczestników w wieku odpowiednio lat (n=2663) oraz lat (n=1606). Częstość występowania i nasilenie miejscowych, układowych i innych reakcji była w zasadzie zbliżona we wszystkich badaniach u osób (młodzieży i dorosłych) otrzymujących szczepionkę Menveo. Profil reaktogenności i częstość występowania zdarzeń niepożądanych po podaniu szczepionki Menveo były podobne u osób w wieku lat (n=216) i lat. W badaniach klinicznych najczęściej występującymi miejscowymi i układowymi działaniami niepożądanymi były: ból w miejscu wstrzyknięcia i ból głowy. Poniżej wymieniono działania niepożądane zgłaszane w trzech kluczowych i dwóch dodatkowych badaniach klinicznych, uporządkowane zgodnie z klasyfikacją układów i narządów. Najczęstsze działania niepożądane zgłaszane podczas badań klinicznych zazwyczaj występowały jedynie przez 1 do 2 dni i zwykle nie były ciężkie. Poniższa lista zawiera również działania niepożądane zgłaszane spontanicznie na całym świecie po wprowadzeniu do obrotu szczepionki Menveo. W obrębie każdej grupy częstości występowania działania niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem. Częstość występowania zdefiniowano następująco: Bardzo często: ( 1/10) Często: ( 1/100 do <1/10) Niezbyt często: ( 1/1 000 do <1/100) Rzadko: ( 1/ do <1/1 000) Bardzo rzadko: (<1/10 000) Częstość nieznana (nie może być określona na podstawie dostępnych danych) Zaburzenia układu immunologicznego: Rzadko: nadwrażliwość* Zaburzenia układu nerwowego: Bardzo często: ból głowy Niezbyt często: zawroty głowy Rzadko: omdlenie* Zaburzenia ucha i błędnika: Rzadko: zawroty głowy* Zaburzenia żołądka i jelit: Bardzo często: nudności 5
6 Zaburzenia skóry i tkanki podskórnej: Często: wysypka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często: ból mięśni Często: ból stawów Zaburzenia ogólne i stany w miejscu podania: Bardzo często: ból w miejscu wstrzyknięcia, rumień w miejscu wstrzyknięcia ( 50 mm), stwardnienie w miejscu wstrzyknięcia ( 50 mm), złe samopoczucie Często: rumień w miejscu wstrzyknięcia (>50 mm), stwardnienie w miejscu wstrzyknięcia (>50 mm); gorączka 38 C, dreszcze Niezbyt często: świąd w miejscu wstrzyknięcia Rzadko: zapalenie tkanki łącznej w miejscu wstrzyknięcia* *Działania niepożądane ze zgłoszeń spontanicznych (ponieważ działania te są zgłaszane dobrowolnie przez grupę o nieokreślonej wielkości, częstość jest określana na podstawie danych z badań klinicznych) Wśród młodzieży bezpieczeństwo i tolerancja szczepionki były korzystniejsze w porównaniu z Tdap i nie ulegały istotnym zmianom w przypadku jednoczesnego lub sekwencyjnego podawania innych szczepionek. 4.9 Przedawkowanie Nie opisano przypadków przedawkowania. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Szczepionki przeciwmeningokokowe, kod ATC: J07AH08. Immunogenność Skuteczność szczepionki Menveo oceniano pośrednio na podstawie wytwarzania przeciwciał przeciwotoczkowych swoistych serotypowo o działaniu bakteriobójczym. Aktywność bakteriobójczą surowicy (SBA) mierzono przez podanie egzogennych składników dopełniacza z surowicy ludzkiej (hsba). Składniki hsba stanowiły początkowy czynnik porównawczy dla określenia ochrony przed zakażeniem meningokokowym. Immunogenność oceniano w wieloośrodkowych badaniach klinicznych z randomizacją i aktywną kontrolą, obejmujących młodzież (11-18 lat), osoby dorosłe (19-55 lat) i w starszym wieku (56-65 lat). W kluczowym badaniu (V59P13) uczestnicy otrzymywali dawkę szczepionki Menveo (n = 2649) lub czterowalentną szczepionkę przeciwmeningokokową skoniugowaną z toksoidem błonicy (ACWY-D) (n = 875). Surowice pobierano przed szczepieniem i po 28 dniach po szczepieniu. W innym badaniu (V59P6) przeprowadzonym wśród 524 osób z grupy młodzieży porównywano immunogenność Menveo i ACWY-PS. 6
7 Immunogenność u młodzieży W kluczowym badaniu wśród populacji młodzieży w wieku lat (V59P13) immunogenność pojedynczej dawki Menveo po miesiącu od podania była podobna jak w przypadku czterowalentnej skoniugowanej szczepionki ACWY zawierającej białko toksoidu błonicy (ACWY-D). W tabeli 1 poniżej przedstawiono sumaryczne wskaźniki immunogenności po miesiącu od podania szczepionki Menveo. W podgrupie osób w wieku lat z wynikiem seronegatywnym na początku badania (hsba < 1:4), po podaniu szczepionki Menveo obserwowano następujące odsetki osób, u których uzyskano hsba 1:8: serotyp A 75% (780/1039), serotyp C 80% (735/923), serotyp W135 94% (570/609) i serotyp Y 81% (510/630). Tabela 1. Surowicza odpowiedź bakteriobójcza po upływie 1 miesiąca od podania szczepionki Menveo w grupie młodzieży w wieku lat. Serotyp n GMT hsba 1:8 A (24, 35) 75% (73, 78) C (39, 65) 85% (83, 87) W (74, 102) 96% (95, 97) Y (42, 61) 88% (85, 90) W tabeli 2 podano parametry utrzymującej się odpowiedzi immunologicznej na szczepionkę Menveo po 21 miesiącach od szczepienia wśród młodzieży w wieku lat w momencie szczepienia. Tabela 2. Parametry utrzymującej się odpowiedzi immunologicznej po około 21 miesiącach od podania szczepionki Menveo (młodzieży w wieku lat w momencie szczepienia). Serotyp GMT hsba 1:8 A 5,29 (4,63; 6,05) 36% (30, 42) C 10 (9,02; 12) 62% (56, 68) W (15, 20) 84% (79, 88) Y 12 (10, 14) 67% (61, 72) W badaniu równoważności (V59P6) immunogenność była oceniana w grupie młodzieży w wieku lat, którzy losowo otrzymywali szczepionkę Menveo lub czterowalentną szczepionkę polisacharydową przeciw meningokokom (ACWY-PS). Na podstawie parametrów odpowiedzi serologicznej, osiągniętych proporcji hsba 1:8 i wartości GMT wykazano równoważność szczepionki Menveo i ACWY-PS dla wszystkich czterech serotypów (A, C, W, Y). Tabela 3. Immunogenność jednej dawki szczepionki Menveo lub ACWY-PS u młodzieży, mierzona po upływie jednego miesiąca po szczepieniu. Serotyp hsba 1:8 GMT hsba Menveo ACWY-PS Menveo ACWY-PS A n=140 n=149 n=140 n=149 81% (74, 87) 41% (33, 49) 33 (25, 44) 7,31 (5,64; 9,47) C n=140 n=147 n=140 n=147 84% (77, 90) 61% (53, 69) 59 (39, 89) 28 (19, 41) 7
8 Serotyp hsba 1:8 GMT hsba Menveo ACWY-PS Menveo ACWY-PS W n=138 n=141 n=138 n=141 91% (84, 95) 84% (77, 89) 48 (37, 62) 28 (22, 36) Y n=139 n=147 n=139 n=147 95% (90, 98) 82% (75, 88) 92 (68, 124) 35 (27, 47) Po roku od szczepień u większego odsetka uczestników, którzy otrzymali Menveo, występowały miana hsba 1:8 przeciwciał przeciw serotypom C, W i Y, natomiast poziomy przeciwciał przeciw serotypowi A były podobne jak w grupie, która otrzymała szczepionkę ACWY-PS. W porównaniu hsba GMT obserwowano podobne wyniki. Immunogenność u dorosłych W kluczowym badaniu immunogenności (V59P13) odpowiedź immunologiczną oceniano wśród dorosłych w wieku lat. Wyniki podsumowano w tabeli 4. W podgrupie uczestników w wieku lat z wynikiem seronegatywnym na początku badania, po podaniu szczepionki obserwowano następujące odsetki osób, u których uzyskano hsba 1:8: serotyp A 67% (582/875), serotyp C 71% (401/563), serotyp W135 82% (131/160) i serotyp Y 66% (173/263). Tabela 4. Surowicza odpowiedź bakteriobójcza (hsba) po upływie 1 miesiąca od podania szczepionki Menveo osobom w wieku lat. Serotyp n GMT hsba 1:8 A (27, 36) 69% (66, 72) C (43, 59) 80% (77, 83) W (93, 132) 94% (91, 96) Y (37, 52) 79% (76, 83) Immunogenność u dorosłych w starszym wieku Prowadzono badania porównawcze immunogenności szczepionek Menveo i ACWY-PS u osób w wieku lat (badanie V59P17). Odsetek osób z hsba 1:8 był równoważny w grupie, która otrzymała szczepionkę Menveo i ACWY-PS we wszystkich czterech serotypach oraz statystycznie większy dla serotypów A i Y. Tabela 5. Immunogenność jednej dawki szczepionki Menveo lub ACWY-PS w grupie dorosłych w wieku lat, mierzona po upływie jednego miesiąca po szczepieniu. Serotyp Menveo hsba 1:8 ACWY-PS hsba 1:8 n=83 n=41 A 87% (78, 93) n=84 n=41 C 90% (82, 96) n=82 n=39 W 94% (86, 98) n=84 n=41 Y 88% (79, 94) 63% (47, 78) 83% (68, 93) 95% (83, 99) 68% (52, 82) 8
9 Europejska Agencja Leków odroczyła obowiązek przedstawienia wyników badań szczepionki Menveo w meningokokowym zapaleniu opon mózgowych w co najmniej jednej podgrupie populacji dzieci i młodzieży. Informacje dotyczące stosowania u dzieci i młodzieży, patrz punkt Właściwości farmakokinetyczne Nie dotyczy. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu wielokrotnym i toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. W badaniach laboratoryjnych na zwierzętach nie obserwowano działań niepożądanych u zaszczepionych matek królików lub ich potomstwa w okresie do 29 dni po urodzeniu. Nie stwierdzono wpływu na płodność u samic królików otrzymujących szczepionkę Menveo przed kryciem i w czasie ciąży. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Proszek Sacharoza Potasu diwodorofosforan Roztwór Sodu diwodorofosforan jednowodny Disodu fosforan dwuwodny Sodu chlorek Woda do wstrzykiwań 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie Okres ważności 3 lata. Produkt leczniczy zużyć natychmiast po rekonstytucji. Jednakże wykazano stabilność chemiczną i fizyczną produktu po rekonstytucji przez okres 8 godzin w temperaturze poniżej 25 C. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w lodówce (2 C 8 C). Nie zamrażać. Przechowywać fiolkę i strzykawkę w tekturowym pudełku w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt
10 6.5 Rodzaj i zawartość opakowania Proszek w fiolce (szkło typu I) z korkiem (guma halobutylowa) i roztwór w ampułkostrzykawce (szkło typu I) z nasadką (zamknięcie z elastomeru typu I zawierającego 10% lateksu lub zamknięcie z elastomeru typu II niezawierającego lateksu). Każde opakowanie zawiera jedną dawkę przygotowaną po zmieszaniu zawartości jednej fiolki i jednej ampułkostrzykawki. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Przed podaniem produkt Menveo należy przygotować przez poddanie rekonstytucji proszku (w fiolce) w roztworze (w ampułkostrzykawce). Przed rekonstytucją i po rekonstytucji należy wzrokowo ocenić składniki szczepionki. Zdjąć nasadkę strzykawki i założyć igłę odpowiednią do pobrania roztworu (21G, 1 ½''). Wstrzyknąć całą zawartość strzykawki (0,6 ml), aby poddać rekonstytucji proszek. Odwrócić fiolkę i energicznie nią potrząsnąć, a następnie pobrać 0,5 ml produktu po rekonstytucji. Należy zwrócić uwagę, że po pobraniu dawki w fiolce może pozostać niewielka ilość płynu. Po rekonstytucji szczepionka ma postać klarownego, bezbarwnego lub żółtawego roztworu bez widocznych cząstek. Jeśli widoczne są obce cząstki i (lub) zmiany właściwości fizycznych, należy zniszczyć szczepionkę. Przed wstrzyknięciem należy zmienić igłę na igłę odpowiednią do wstrzyknięcia (25G, 1''). Przed wstrzyknięciem szczepionki należy upewnić się, że w strzykawce nie ma pęcherzyków powietrza. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Via Fiorentina Siena, Włochy 8. NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU EU/1/10/614/ DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 15 marca DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO Szczegółowe informacje o tym produkcie leczniczym są dostępne na stronie internetowej Europejskiej Agencji Leków: 10
11 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka (0,5 ml szczepionki po rekonstytucji) zawiera: (Pierwotna zawartość proszku) Oligosacharyd meningokoków grupy A 10 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 16,7 33,3 mikrogramów (Pierwotna zawartość roztworu) Oligosacharyd meningokoków grupy C 5 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 7,1 12,5 mikrogramów Oligosacharyd meningokoków grupy W135 5 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 3,3 8,3 mikrogramów Oligosacharyd meningokoków grupy Y 5 mikrogramów Skoniugowany z białkiem CRM 197 Corynebacterium diphtheriae 5,6 10,0 mikrogramów Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Proszek i roztwór do sporządzania roztworu do wstrzykiwań (proszek i roztwór do wstrzykiwań). Proszek ma postać krążka o barwie białej lub zbliżonej do białej. Roztwór jest klarowny i bezbarwny. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Produkt Menveo jest przeznaczony do czynnego uodpornienia dzieci (w wieku od 2 lat), młodzieży i dorosłych narażonych na kontakt z dwoinkami zapalenia opon mózgowych (Neisseria meningitidis) z grup serologicznych A, C, W135 i Y, w celu zapobiegania chorobie inwazyjnej. Szczepionkę należy stosować zgodnie z obowiązującymi oficjalnymi zaleceniami. 4.2 Dawkowanie i sposób podawania Dawkowanie Dzieci (w wieku powyżej 2 lat), młodzież i dorośli Produkt Menveo należy podawać w pojedynczym wstrzyknięciu (0,5 ml). Osoby w podeszłym wieku Istnieją ograniczone dane dotyczące osób w wieku lat. Brak danych dotyczących osób w wieku powyżej 65 lat. 11
12 Dawka przypominająca Nie ustalono konieczności ani czasu podania dawki przypominającej produktu Menveo (patrz punkty 4.4 i 5.1). Sposób podawania Produkt Menveo podaje się we wstrzyknięciu domięśniowym, najlepiej w mięsień naramienny. Nie podawać donaczyniowo, podskórnie lub śródskórnie. Jeśli w tym samym czasie podaje się inne szczepionki, należy je wstrzykiwać w różne miejsca. Informacje na temat przygotowania i rekonstytucji produktu leczniczego przed podaniem, patrz punkt Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, w tym toksoid błonicy (CRM 197 ), lub wystąpienie zagrażających życiu reakcji po uprzednim podaniu szczepionki zawierającej podobne składniki (patrz punkt 4.4). Podobnie jak w przypadku innych szczepionek podanie produktu Menveo należy odroczyć u osób z ostrą, poważną chorobą przebiegającą z gorączką. Łagodne zakażenie nie stanowi przeciwwskazania. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Przed podaniem jakiejkolwiek szczepionki we wstrzyknięciu, osoba odpowiedzialna za szczepienie musi podjąć wszelkie środki ostrożności, by zapobiec reakcji alergicznej lub innej, m.in. zebrać dokładny wywiad lekarski i sprawdzić aktualny stan zdrowia. Podobnie jak w przypadku wszystkich szczepionek do wstrzykiwań należy zawsze zapewnić możliwość właściwego leczenia i nadzoru na wypadek wystąpienia rzadkich reakcji anafilaktycznych po podaniu szczepionki. Pod żadnym pozorem nie należy podawać produktu Menveo donaczyniowo. Szczepionka Menveo nie zapewnia ochrony przed zakażeniami wywołanymi przez inne niewystępujące w niej serotypy N. meningitidis. Podobnie jak w przypadku innych szczepionek, ochronna odpowiedź immunologiczna może nie wystąpić u wszystkich szczepionych osób (patrz punkt 5.1). Badania nad szczepionką Menveo z wykorzystaniem surowicy ludzkiej (hsba) jako dopełniacza wykazały zmniejszenie miana bakteriobójczego surowicy przeciw serotypowi A (patrz punkt 5.1). Znaczenie kliniczne zmniejszenia miana hsba przeciw serotypowi A nie jest znane. Obecnie dane dotyczące bezpieczeństwa dawki przypominającej są ograniczone, jednakże w przypadku podejrzewania ryzyka zakażenia meningokokami grupy A oraz jeśli od otrzymania ostatniej dawki szczepionki Menveo upłynął minimum rok, można rozważyć podanie dawki przypominającej. Brak danych dotyczących szczepień w profilaktyce po ekspozycji. U osób ze zmniejszoną odpornością szczepienie może nie wywołać odpowiedniej odpowiedzi immunologicznej. Zakażenie wirusem HIV nie stanowi przeciwwskazania, jednak nie badano szczepionki Menveo u osób ze zmniejszoną odpornością. U pacjentów z niedoborami układu dopełniacza oraz pacjentów z asplenią (czynnościową lub anatomiczną) może nie wystąpić odpowiedź immunologiczna na szczepionki skoniugowane zawierające meningokoki grupy A, C, W135 i Y. 12
13 Ze względu na ryzyko wystąpienia krwiaka nie badano produktu Menveo u osób z małopłytkowością, zaburzeniami krwotocznymi lub otrzymujących leczenie przeciwzakrzepowe. Lekarz musi rozważyć stosunek zagrożeń i korzyści w przypadku ryzyka krwiaka po wstrzyknięciu domięśniowym. 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji W grupie dzieci w wieku od 2 do 10 lat nie ma dostępnych danych na temat bezpieczeństwa i immunogenności w przypadku jednoczesnego podawania szczepionki Menveo z innymi szczepionkami przeznaczonymi dla dzieci. W grupie młodzieży (w wieku od 11 do 18 lat) szczepionkę Menveo oceniano w dwóch badaniach: w jednym równolegle ze szczepionką przeciw tężcowi, błonicy i krztuścowi (zredukowana dawka toksoidu przeciw błonicy i bezkomórkowy komponent przeciwkrztuścowy, Tdap), a w drugim równolegle ze szczepionką Tdap i czterowalentną szczepionką przeciw HPV (typy 6, 11, 16 i 18, rekombinowany HPV). Wyniki obu badań potwierdziły możliwość skojarzonego stosowania szczepionek. W żadnym badaniu nie stwierdzono zwiększenia odsetka reaktogenności lub zmian profilu bezpieczeństwa szczepionek. Równoległe szczepienie nie pogarszało odpowiedzi humoralnej na szczepionkę Menveo oraz komponenty przeciwko błonicy, tężcowi lub HPV. Podanie szczepionki Menveo po miesiącu od podania szczepionki Tdap powodowało statystycznie słabszą odpowiedź serologiczną na serotyp W135. Ponieważ nie występuje bezpośredni wpływ na seroprotekcję, aktualnie nie są znane następstwa kliniczne tego zjawiska. Stwierdzono tłumienie odpowiedzi humoralnej na dwa z trzech antygenów krztuśca, jednak znaczenie kliniczne tej obserwacji jest nieznane. Po szczepieniu u ponad 97% uczestników występowały wykrywalne miana przeciwciał przeciwko wszystkim trzem antygenom krztuścowym. Nie prowadzono badań skojarzonego stosowania produktu Menveo i innych szczepionek niż wyżej wymienione. Nie zaleca się stosowania w tym samym czasie produktu Menveo w skojarzeniu z innymi szczepionkami (zwłaszcza zawierającymi żywe drobnoustroje), chyba że jest to bezwzględnie wskazane. Stosowane równolegle szczepionki zawsze powinny być podawane w różne miejsca. Najkorzystniejsze jest wstrzyknięcie po stronie kontralateralnej. Należy zweryfikować, czy w wyniku skojarzonego podania szczepionek nie doszło do nasilenia działań niepożądanych. Odpowiedź immunologiczna na szczepienie może być osłabiona u osób otrzymujących leczenie immunosupresyjne. 4.6 Wpływ na ciążę, płodność i laktację Brak wystarczających danych klinicznych dotyczących stosowania u kobiet w ciąży. W badaniach przedklinicznych nie wykazano bezpośredniego ani pośredniego szkodliwego wpływu produktu Menveo na przebieg ciąży, rozwój zarodka (płodu), przebieg porodu lub rozwój pourodzeniowy. Zważywszy na ciężki przebieg zakażenia Neisseria meningitidis z grup serologicznych A, C, W135 i Y, w przypadku ewidentnego ryzyka narażenia, ciąża nie jest przeciwwskazaniem do szczepienia. Mimo niewystarczających danych klinicznych dotyczących stosowania Menveo w okresie karmienia piersią, jest mało prawdopodobne, że przeciwciała wydzielane w mleku matki byłyby szkodliwe dla karmionego piersią niemowlęcia. Dlatego szczepionkę Menveo można stosować w okresie karmienia piersią. 13
14 4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Bardzo rzadko po szczepieniu opisywano zawroty głowy. Może to przejściowo wpłynąć na zdolność prowadzenia pojazdów lub obsługiwania maszyn. 4.8 Działania niepożądane W obrębie każdej grupy częstości występowania działania niepożądane wymieniono zgodnie ze zmniejszającą się ciężkością. Częstość występowania zdefiniowano następująco: Bardzo często: ( 1/10) Często: ( 1/100 do <1/10) Niezbyt często: ( 1/1000 do <1/100) Rzadko: ( 1/ do <1/1000) Bardzo rzadko: (<1/10 000) Częstość nieznana (nie może być określona na podstawie dostępnych danych) Dzieci w wieku od 2 do 10 lat Bezpieczeństwo stosowania szczepionki Menveo u dzieci w wieku od 2 do 10 lat oceniano w 4 badaniach klinicznych obejmujących 3181 uczestników, którym podano szczepionkę Menveo. Najczęstsze działania niepożądane zgłaszane podczas badań klinicznych zazwyczaj występowały tylko przez jeden do dwóch dni i nie były ciężkie. Do tych działań niepożądanych należą: Zaburzenia metabolizmu i odżywiania: Często: zaburzenia łaknienia Zaburzenia układu nerwowego: Bardzo często: senność, ból głowy Zaburzenia żołądka i jelit: Często: nudności, wymioty, biegunka Zaburzenia skóry i tkanki podskórnej: Często: wysypka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Często: ból mięśni, ból stawów Zaburzenia ogólne i stany w miejscu podania: Bardzo często: drażliwość, złe samopoczucie, ból w miejscu wstrzyknięcia, rumień w miejscu wstrzyknięcia ( 50 mm), stwardnienie w miejscu wstrzyknięcia ( 50 mm) Często: rumień w miejscu wstrzyknięcia (>50 mm), stwardnienie w miejscu wstrzyknięcia (>50 mm), dreszcze, gorączka 38 o C Niezbyt często: świąd w miejscu wstrzyknięcia 14
15 Pacjenci w wieku od 11 do 65 lat U młodzieży i dorosłych bezpieczeństwo szczepionki Menveo oceniano w pięciu randomizowanych badaniach klinicznych z grupą kontrolną, obejmujących 6185 uczestników (wiek: lat), którzy otrzymali szczepionkę Menveo. Wśród szczepionych osób produkt Menveo otrzymało 61% pacjentów w wieku lat, 17% w wieku lat, 22% w wieku lat i 3,4% w wieku lat. Dwa podstawowe badania dotyczące bezpieczeństwa były randomizowane, aktywnie kontrolowane, i obejmowały uczestników w wieku odpowiednio lat (n=2663) oraz lat (n=1606). Częstość występowania i nasilenie miejscowych, układowych i innych reakcji była w zasadzie zbliżona we wszystkich badaniach u osób (młodzieży i dorosłych) otrzymujących szczepionkę Menveo. Profil reaktogenności i częstość występowania działań niepożądanych po podaniu szczepionki Menveo były podobne u osób w wieku lat (n=216) i lat. W badaniach klinicznych najczęściej występującymi miejscowymi i układowymi działaniami niepożądanymi były: ból w miejscu wstrzyknięcia i ból głowy. Poniżej wymieniono działania niepożądane zgłaszane w trzech kluczowych i dwóch dodatkowych badaniach klinicznych, uporządkowane zgodnie z klasyfikacją układów i narządów. Najczęstsze działania niepożądane zgłaszane podczas badań klinicznych zazwyczaj występowały jedynie przez 1 do 2 dni i zwykle nie były ciężkie. Poniższa lista zawiera również działania niepożądane zgłaszane spontanicznie na całym świecie po wprowadzeniu do obrotu szczepionki Menveo. Zaburzenia układu immunologicznego: Rzadko: nadwrażliwość* Zaburzenia układu nerwowego: Bardzo często: ból głowy Niezbyt często: zawroty głowy Rzadko: omdlenie* Zaburzenia ucha i błędnika: Rzadko: zawroty głowy* Zaburzenia żołądka i jelit: Bardzo często: nudności Zaburzenia skóry i tkanki podskórnej: Często: wysypka Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Bardzo często: ból mięśni Często: ból stawów Zaburzenia ogólne i stany w miejscu podania: Bardzo często: ból w miejscu wstrzyknięcia, rumień w miejscu wstrzyknięcia ( 50 mm), stwardnienie w miejscu wstrzyknięcia ( 50 mm), złe samopoczucie Często: rumień w miejscu wstrzyknięcia (>50 mm), stwardnienie w miejscu wstrzyknięcia (>50 mm); gorączka 38 C, dreszcze Niezbyt często: świąd w miejscu wstrzyknięcia 15
16 Rzadko: zapalenie tkanki łącznej w miejscu wstrzyknięcia* *Działania niepożądane ze zgłoszeń spontanicznych (ponieważ działania te są zgłaszane dobrowolnie przez grupę o nieokreślonej wielkości, częstość jest określana na podstawie danych z badań klinicznych) Wśród młodzieży bezpieczeństwo i tolerancja szczepionki były korzystniejsze w porównaniu z Tdap i nie ulegały istotnym zmianom w przypadku jednoczesnego lub sekwencyjnego podawania innych szczepionek. 4.9 Przedawkowanie Nie opisano przypadków przedawkowania. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: Szczepionki przeciwmeningokokowe, kod ATC: J07AH08. Immunogenność Skuteczność szczepionki Menveo oceniano pośrednio na podstawie wytwarzania przeciwciał przeciwotoczkowych swoistych serotypowo o działaniu bakteriobójczym. Aktywność bakteriobójczą surowicy (SBA) mierzono przez podanie egzogennych składników dopełniacza z surowicy ludzkiej (hsba). Składniki hsba stanowiły początkowy czynnik porównawczy dla określenia ochrony przed zakażeniem meningokokowym. Immunogenność oceniano w wieloośrodkowych badaniach klinicznych z randomizacją i aktywną kontrolą, obejmujących dzieci (w wieku 2-10 lat), młodzież (w wieku lat), osoby dorosłe (w wieku lat) i w starszym wieku (56-65 lat). Immunogenność u dzieci W głównym badaniu V59P20 porównywano immunogenność szczepionek Menveo i ACWY-D; 1170 dzieciom podano szczepionkę Menveo, natomiast 1161 szczepionkę ACWY-D (populacje spełniające kryteria protokołu badania). W dwóch badaniach wspomagających V59P8 i V59P10 porównywano immunogenność szczepionek Menveo i ACWY-PS. W głównym randomizowanym badaniu V59P20 z próbą ślepą, w którym uczestnicy zostali podzieleni wg wieku (2 do 5 lat i 6 do 10 lat), immunogenność pojedynczej dawki Menveo po miesiącu od podania była porównywana do szczepionki ACWY-D. W tabeli 1 poniżej przedstawiono sumaryczne wskaźniki immunogenności po miesiącu od podania szczepionki Menveo grupom pacjentów w wieku 2-5 lat i 6-10 lat. 16
17 Tabela 1: Surowicza odpowiedź bakteriobójcza (hsba) po upływie jednego miesiąca od podania szczepionki Menveo osobom w wieku 2-5 lat i 6-10 lat 2-5 lat 6-10 lat Serotyp hsba 1:8 hsba GMTs hsba 1:8 hsba GMTs A N=606 N=606 N=551 N=551 72% (68, 75) 26 (22, 30) 77% (74, 81) 35 (29, 42) C N=607 N=607 N=554 N=554 68% (64, 72) 18 (15, 20) 77% (73, 80) 36 (29, 45) W135 N=594 N=594 N=542 N=542 90% (87, 92) 43 (38, 50) 91% (88, 93) 61 (52, 72) Y N=593 N=593 N=545 N=545 76% (72, 79) 24 (20, 28) 79% (76, 83) 34 (28, 41) W innym randomizowanym badaniu z próbą ślepą (V59P8), przeprowadzonym w USA, dzieciom podano pojedynczą dawkę szczepionki Menveo (N=284) lub ACWY-PS (N=285). U dzieci w wieku 2-10 lat niezależnie od grupy wiekowej (2-5 i 6-10 lat) odpowiedź immunologiczna po 1 miesiącu od zaszczepienia, określona jako odsetek osób z surowiczą odpowiedzią bakteriobójczą hsba 1:8 i wartości GMT, nie tylko nie wykazała braku niższości w porównaniu do odpowiedzi w grupie, która otrzymała szczepionkę ACWY-PS, ale także była statystycznie wyższa dla wszystkich serotypów i wszystkich wskaźników immunologicznych. Po roku od podania odpowiedź na szczepionkę Menveo była nadal statystycznie wyższa niż w przypadku szczepionki ACWY-PS dla serotypów A, W-135 i Y (mierzona jako odsetek osób o hsba 1:8 i wartości GMT). W przypadku serotypu C wykazano brak niższości szczepionki Menveo w tych punktach końcowych (tabela 2). Znaczenie kliniczne większego odsetka odpowiedzi immunologicznych po szczepieniu nie jest znane. Tabela 2: Immunogenność jednej dawki szczepionki Menveo lub ACWY-PS u dzieci w wieku 2-10 lat, mierzona po upływie jednego oraz dwunastu miesięcy po szczepieniu. 1 miesiąc po szczepieniu 12 miesięcy po szczepieniu Serotyp hsba 1:8 hsba GMTs hsba 1:8 hsba GMTs Menveo ACWY-PS Menveo ACWY-PS Menveo ACWY-PS Menveo ACWY-PS A N=280 N=281 N=280 N=281 N=253 N=238 N=253 N=238 79% (74, 84) 37% (31, 43) 36 (30, 44) 6,31 (5,21; 7,64) 23% (18, 29) 13% (9, 18) 3,88 (3,39; 4,44) 3 (2,61; 3,44) C N=281 N=283 N=281 N=283 N=252 N=240 N=252 N=240 73% (68, 78) 54% (48, 60) 26 (21, 34) 15 (12, 20) 53% (47, 59) 44% (38, 51) 11 (8,64; 13) 9,02 (7,23; 11) W135 N=279 N=282 N=279 N=282 N=249 N=237 N=249 N=237 92% (88, 95) 66% (60, 71) 60 (50, 71) 14 (12, 17) 90% (86, 94) 45% (38, 51) 42 (35, 50) 7,57 (6,33; 9,07) Y N=280 N=282 N=280 N=282 N=250 N=239 N=250 N=239 88% (83, 91) 53% (47, 59) 54 (44, 66) 11 (9,29; 14) 77% (71, 82) 32% (26, 38) 27 (22, 33) 5,29 (4,34; 6,45) W randomizowanym badaniu V59P10 z próbą ślepą przeprowadzonym w Argentynie dzieciom podano pojedynczą dawkę szczepionki Menveo (N=949) lub ACWY-PS (N=551). Immunogenność oceniano w podgrupie 150 osób w każdej grupie zaszczepionej. Odpowiedź immunologiczna zaobserwowana u dzieci w wieku 2-10 lat była bardzo podobna do odpowiedzi zaobserwowanej w badaniu V59P8 opisanym powyżej: odpowiedź immunologiczna na szczepionkę Menveo po miesiącu od zaszczepienia, mierzona jako odsetek osób o hsba 1:8 i wartości GMT, nie była gorsza niż w przypadku szczepionki ACWY-PS. 17
18 W Polsce i Finlandii przeprowadzone zostało randomizowane badanie z próbą ślepą obejmujące dzieci w wieku od 12 do 59 miesięcy (V59P7). W badaniu tym 199 dzieciom spełniającym kryteria protokołu badania w wieku 2-5 lat podano szczepionkę Menveo, natomiast szczepionkę ACWY-PS podano 81 dzieciom w wieku 3-5 lat. Po miesiącu od zaszczepienia odsetek osób z hsba 1:8 był wyraźnie wyższy w grupie, która otrzymała szczepionkę Menveo dla wszystkich czterech serotypów (63% vs 39%, 46% vs 39%, 78% vs 59% i 65% vs 57% dla szczepionki Menveo w porównaniu ze szczepionką ACWY-PS odpowiednio dla serotypów A, C, W135 i Y). Immunogenność u osób w wieku 11 lat i powyżej W głównym badaniu (V59P13) młodzieży oraz osobom dorosłym podano dawkę szczepionki Menveo (n=2649) lub szczepionki ACWY-D (n= 875). Surowice pobierano przed szczepieniem i po miesiącu po szczepieniu. W innym badaniu (V59P6) przeprowadzonym wśród 524 osób z grupy młodzieży porównywano immunogenność Menveo i ACWY-PS. Immunogenność u młodzieży W kluczowym badaniu wśród populacji młodzieży w wieku lat (V59P13) immunogenność pojedynczej dawki Menveo po miesiącu od podania była podobna jak w przypadku szczepionki ACWY-D. W tabeli 3 poniżej przedstawiono sumaryczne wskaźniki immunogenności po miesiącu od podania szczepionki Menveo. Tabela 3. Surowicza odpowiedź bakteriobójcza po upływie miesiąca od podania szczepionki Menveo w grupie młodzieży w wieku lat. Serotyp n GMT hsba 1:8 A (24, 35) 75% (73, 78) C (39, 65) 85% (83, 87) W (74, 102) 96% (95, 97) Y (42, 61) 88% (85, 90) W podgrupie osób w wieku lat z wynikiem seronegatywnym na początku badania (hsba < 1:4), po podaniu szczepionki Menveo obserwowano następujące odsetki osób, u których uzyskano hsba 1:8: serotyp A 75% (780/1039), serotyp C 80% (735/923), serotyp W135 94% (570/609) i serotyp Y 81% (510/630). W tabeli 4 podano parametry utrzymującej się odpowiedzi immunologicznej na szczepionkę Menveo po 21 miesiącach od szczepienia wśród młodzieży w wieku lat w momencie szczepienia. Tabela 4. Parametry utrzymującej się odpowiedzi immunologicznej po około 21 miesiącach od podania szczepionki Menveo (młodzieży w wieku lat w momencie szczepienia). Serotyp GMT hsba 1:8 A 5,29 (4,63; 6,05) 36% (30, 42) C 10 (9,02; 12) 62% (56, 68) W (15, 20) 84% (79, 88) Y 12 (10, 14) 67% (61, 72) 18
19 W badaniu równoważności (V59P6) immunogenność była oceniana w grupie młodzieży w wieku lat, którzy losowo otrzymywali szczepionkę Menveo lub szczepionkę ACWY-PS. Na podstawie parametrów odpowiedzi serologicznej, osiągniętych proporcji hsba 1:8 i wartości GMT wykazano równoważność szczepionki Menveo i ACWY-PS dla wszystkich czterech serotypów (A, C, W135, Y). Tabela 5. Immunogenność jednej dawki szczepionki Menveo lub ACWY-PS u młodzieży, mierzona po upływie jednego miesiąca po szczepieniu. Serotyp hsba 1:8 GMT hsba Menveo ACWY-PS Menveo ACWY-PS A n=140 n=149 n=140 n=149 81% (74, 87) 41% (33, 49) 33 (25, 44) 7,31 (5,64; 9,47) C n=140 n=147 n=140 n=147 84% (77, 90) 61% (53, 69) 59 (39, 89) 28 (19, 41) W135 n=138 n=141 n=138 n=141 91% (84, 95) 84% (77, 89) 48 (37, 62) 28 (22, 36) Y n=139 n=147 n=139 n=147 95% (90, 98) 82% (75, 88) 92 (68, 124) 35 (27, 47) Po roku od szczepień u większego odsetka uczestników, którzy otrzymali Menveo, występowały miana hsba 1:8 przeciwciał przeciw serotypom C, W135 i Y, natomiast poziomy przeciwciał przeciw serotypowi A były podobne jak w grupie, która otrzymała szczepionkę ACWY-PS. W porównaniu hsba GMT obserwowano podobne wyniki. Immunogenność u dorosłych W kluczowym badaniu immunogenności (V59P13) odpowiedź immunologiczną oceniano wśród dorosłych w wieku lat. Wyniki podsumowano w tabeli 6. W podgrupie uczestników w wieku lat z wynikiem seronegatywnym na początku badania, po podaniu szczepionki obserwowano następujące odsetki osób, u których uzyskano hsba 1:8: serotyp A 67% (582/875), serotyp C 71% (401/563), serotyp W135 82% (131/160) i serotyp Y 66% (173/263). Tabela 6. Surowicza odpowiedź bakteriobójcza (hsba) po upływie 1 miesiąca od podania szczepionki Menveo osobom w wieku lat. Serotyp n GMT hsba 1:8 A (27, 36) 69% (66, 72) C (43, 59) 80% (77, 83) W (93, 132) 94% (91, 96) Y (37, 52) 79% (76, 83) Immunogenność u dorosłych w starszym wieku Prowadzono badania porównawcze immunogenności szczepionek Menveo i ACWY-PS u osób w wieku lat (badanie V59P17). Odsetek osób z hsba 1:8 był równoważny w grupie, która otrzymała szczepionkę Menveo i ACWY-PS we wszystkich czterech serotypach oraz statystycznie większy dla serotypów A i Y (tabela 7). 19
20 Tabela 7. Immunogenność jednej dawki szczepionki Menveo lub ACWY-PS w grupie dorosłych w wieku lat, mierzona po upływie jednego miesiąca po szczepieniu. Serotyp Menveo hsba 1:8 n=83 n=41 A 87% (78, 93) n=84 n=41 C 90% (82, 96) n=82 n=39 W135 94% (86, 98) n=84 n=41 Y 88% (79, 94) ACWY-PS hsba 1:8 63% (47, 78) 83% (68, 93) 95% (83, 99) 68% (52, 82) Europejska Agencja Leków odroczyła obowiązek przedstawienia wyników badań szczepionki Menveo w meningokokowym zapaleniu opon mózgowych w co najmniej jednej podgrupie populacji dzieci i młodzieży. Informacje dotyczące stosowania u dzieci i młodzieży, patrz punkt Właściwości farmakokinetyczne Nie dotyczy. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu wielokrotnym i toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają żadnego szczególnego zagrożenia dla człowieka. W badaniach laboratoryjnych na zwierzętach nie obserwowano działań niepożądanych u zaszczepionych matek królików lub ich potomstwa w okresie do 29 dni po urodzeniu. Nie stwierdzono wpływu na płodność u samic królików otrzymujących szczepionkę Menveo przed kryciem i w czasie ciąży. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Proszek Sacharoza Potasu diwodorofosforan Roztwór Sodu diwodorofosforan jednowodny Disodu fosforan dwuwodny Sodu chlorek Woda do wstrzykiwań 20
21 6.2 Niezgodności farmaceutyczne Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie Okres ważności 3 lata. Produkt leczniczy zużyć natychmiast po rekonstytucji. Jednakże wykazano stabilność chemiczną i fizyczną produktu po rekonstytucji przez okres 8 godzin w temperaturze poniżej 25 C. 6.4 Specjalne środki ostrożności podczas przechowywania Przechowywać w lodówce (2 C 8 C). Nie zamrażać. Przechowywać fiolki w tekturowym pudełku w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt Rodzaj i zawartość opakowania Proszek w fiolce (szkło typu I) z korkiem (guma halobutylowa) i roztwór w fiolce (szkło typu I) z korkiem (guma butylowa). Zawartość obu fiolek (proszek i roztwór) należy zmieszać ze sobą przed podaniem szczepionki, uzyskując dawkę 0,5 ml. Opakowanie zawiera jedną dawkę (2 fiolki) lub pięć dawek (10 fiolek). Nie wszystkie opakowania mogą być dostępne w sprzedaży. 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Przed podaniem produkt Menveo należy przygotować przez poddanie rekonstytucji proszku (w fiolce) w roztworze (w fiolce). Przed rekonstytucją i po rekonstytucji należy wzrokowo ocenić składniki szczepionki. Za pomocą strzykawki z odpowiednią igłą (21G, 1 ½'') pobrać całą zawartość fiolki z roztworem i wstrzyknąć ją do fiolki z proszkiem, aby poddać rekonstytucji skoniugowany komponent MenA. Odwrócić fiolkę i energicznie nią potrząsnąć, a następnie pobrać 0,5 ml produktu po rekonstytucji. Należy zwrócić uwagę, że po pobraniu dawki w fiolce może pozostać niewielka ilość płynu. Po rekonstytucji szczepionka ma postać klarownego, bezbarwnego lub żółtawego roztworu bez widocznych cząstek. Jeśli widoczne są obce cząstki i (lub) zmiany właściwości fizycznych, należy zniszczyć szczepionkę. Przed wstrzyknięciem należy zmienić igłę na igłę odpowiednią do wstrzyknięcia. Przed wstrzyknięciem szczepionki należy upewnić się, że w strzykawce nie ma pęcherzyków powietrza. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami. 21
22 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Via Fiorentina Siena, Włochy 8. NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU EU/1/10/614/002 EU/1/10/614/ DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 15 marca DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO Szczegółowe informacje o tym produkcie leczniczym są dostępne na stronie internetowej Europejskiej Agencji Leków 22
23 ANEKS II A. WYTWÓRCA BIOLOGICZNEJ SUBSTANCJI CZYNNEJ ORAZ WYTWÓRCA(Y) ODPOWIEDZIALNY(I) ZA ZWOLNIENIE SERII B. WARUNKI LUB OGRANICZENIA DOTYCZĄCE ZAOPATRZENIA I STOSOWANIA C. INNE WARUNKI I WYMAGANIA DOTYCZĄCE DOPUSZCZENIA DO OBROTU 23
24 A. WYTWÓRCA BIOLOGICZNEJ SUBSTANCJI CZYNNEJ ORAZ WYTWÓRCA ODPOWIEDZIALNY ZA ZWOLNIENIE SERII Nazwa i adres wytwórcy biologicznej substancji czynnej Bellaria-Rosia Sovicille (SI) Włochy Nazwa i adres wytwórcy odpowiedzialnego za zwolnienie serii Bellaria-Rosia Sovicille (SI) Włochy Wydrukowana ulotka dla pacjenta musi zawierać nazwę i adres wytwórcy odpowiedzialnego za zwolnienie danej serii produktu leczniczego. B. WARUNKI LUB OGRANICZENIA DOTYCZĄCE ZAOPATRZENIA I STOSOWANIA Produkt leczniczy wydawany z przepisu lekarza. Oficjalne zwalnianie serii Zgodnie z artykułem 114 dyrektywy 2001/83/WE, oficjalne zwalnianie serii będzie przeprowadzane przez laboratorium państwowe lub przez laboratorium wyznaczone do tego celu. C. INNE WARUNKI I WYMAGANIA DOTYCZĄCE DOPUSZCZENIA DO OBROTU System nadzoru nad bezpieczeństwem stosowania produktów leczniczych Podmiot odpowiedzialny musi zapewnić, by system nadzoru nad bezpieczeństwem stosowania produktów leczniczych, przedstawiony w module dokumentacji do pozwolenia na dopuszczenie do obrotu, był zorganizowany i prawidłowo funkcjonował przed dopuszczeniem i po dopuszczeniu produktu leczniczego do obrotu. Plan Zarządzania Ryzykiem (RMP) Podmiot odpowiedzialny podejmie działania wyszczególnione w planie nadzoru nad bezpieczeństwem stosowania produktów leczniczych zgodnie z wersją RMP (ang. Risk Management Plan), przedstawioną w module dokumentacji do pozwolenia na dopuszczenie do obrotu i wszelkimi jego kolejnymi aktualizacjami uzgodnionymi z Komitetem ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP, ang. Committee for Medicinal Products for Human Use). Zgodnie z Wytycznymi CHMP, dotyczącymi Systemów Zarządzania Ryzykiem dla produktów leczniczych stosowanych u ludzi, każdy uaktualniony RMP należy złożyć jednocześnie z kolejnym okresowym raportem o bezpieczeństwie (PSUR, ang. Periodic Safety Update Report). Ponadto uaktualniony RMP należy przedstawiać: jeśli uzyskano nowe informacje, które istotnie wpływają na aktualną specyfikację dotyczącą bezpieczeństwa, plan monitorowania bezpieczeństwa lub działania służące ograniczeniu ryzyka; 24
25 w ciągu 60 dni od uzyskania istotnych informacji, dotyczących bezpieczeństwa stosowania produktu leczniczego lub odnoszących się do minimalizacji ryzyka; na żądanie Europejskiej Agencji Leków. ZOBOWIĄZANIE DO WYKONANIA CZYNNOŚCI PO WPROWADZENIU DO OBROTU Podmiot odpowiedzialny wykona, w określonych ramach czasowych, następujące czynności: Opis Przeprowadzenie badania mającego na celu oszacowanie bezpośredniej i długoterminowej zmiany miana przeciwciał po podaniu jednej lub dwóch dawek szczepionki Menveo dzieciom w wieku 2 10 lat zgodnie z protokołem uzgodnionym z CHMP. Termin: 4 kwartał 2014 r. 25
26 ANEKS III OZNAKOWANIE OPAKOWAŃ I ULOTKA DLA PACJENTA 26
27 A. OZNAKOWANIE OPAKOWAŃ 27
28 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH OPAKOWANIE KARTONOWE PROSZEK W FIOLCE I ROZTWÓR W AMPUŁKOSTRZYKAWCE 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ(YCH) Po przygotowaniu jedna dawka 0,5 ml zawiera: Oligosacharydy meningokoków grupy A (10 mikrogramów) skoniugowane z białkiem CRM 197 Corynebacterium diphtheriae (16,7 33,3 mikrogramów) Oligosacharydy meningokoków grupy C (5 mikrogramów) skoniugowane z białkiem CRM 197 Corynebacterium diphtheriae (7,1 12,5 mikrogramów) Oligosacharydy meningokoków grupy W135 (5 mikrogramów) skoniugowane z białkiem CRM 197 Corynebacterium diphtheriae (3,3 8,3 mikrogramów) Oligosacharydy meningokoków grupy Y (5 mikrogramów) skoniugowane z białkiem CRM 197 Corynebacterium diphtheriae (5,6 10,0 mikrogramów) 3. WYKAZ SUBSTANCJI POMOCNICZYCH Substancje pomocnicze: potasu diwodorofosforan, sacharoza, sodu chlorek, sodu diwodorofosforan jednowodny, disodu fosforan dwuwodny, woda do wstrzykiwań. 4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA Jedna fiolka ze skoniugowanym liofilizowanym komponentem MenA i 1 ampułkostrzykawka ze skoniugowanym płynnym komponentem MenCWY. Objętość po rekonstytucji proszku (fiolka) w roztworze (ampułkostrzykawka): 0,5 ml (1 dawka) 5. SPOSÓB I DROGA(I) PODANIA Wstrzyknięcie domięśniowe. Nie podawać donaczyniowo, podskórnie ani śródskórnie. Przed użyciem energicznie wstrząsnąć. Należy zapoznać się z treścią ulotki przed zastosowaniem leku. 6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEDOSTĘPNYM I NIEWIDOCZNYM DLA DZIECI Przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. 28
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135
Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y
 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna
1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ty - Szczepionka durowa, zawiesina do wstrzykiwań Szczepionka przeciw durowi brzusznemu. Szczepionka 20 - dawkowa 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TYPHIM Vi, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum febris typhoidis polysaccharidicum Szczepionka przeciw durowi brzusznemu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Fluarix, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Mucosiffa liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO IMOVAX POLIO, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum submite, Polyvaccinum mite, Polyvaccinum forte Zawiesina do wstrzykiwań. Nieswoista szczepionka bakteryjna. 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum submite, Polyvaccinum mite, Polyvaccinum forte Zawiesina do wstrzykiwań. Nieswoista szczepionka bakteryjna. 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. nie mniej niż 30 j.m. nie mniej niż 40 j.m.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
Jedna dawka (0,5 ml) po rekonstytucji, zawiera: Polisacharyd otoczkowy Haemophilus influenzae typ b.. 10 mikrogramów
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
A. OZNAKOWANIE OPAKOWAŃ
 A. OZNAKOWANIE OPAKOWAŃ 34 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO KARTONOWE NA STRZYKAWKĘ 1. NAZWA PRODUKTU LECZNICZEGO Focetria zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka
A. OZNAKOWANIE OPAKOWAŃ 34 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO KARTONOWE NA STRZYKAWKĘ 1. NAZWA PRODUKTU LECZNICZEGO Focetria zawiesina do wstrzykiwań w ampułkostrzykawce Szczepionka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tetabulin S/D 250 j.m./ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw tężcowi Jedna dawka (1ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tetabulin S/D 250 j.m./ml roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Immunoglobulina ludzka przeciw tężcowi Jedna dawka (1ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval 3 BRSV PI3 BVD Liofilizat i zawiesina do sporządzania zawiesiny do wstrzykiwań dla bydła. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NAZWA PRODUKTU LECZNICZEGO Polyvaccinum mite, krople do nosa, zawiesina. Nieswoista szczepionka bakteryjna.. SKŁAD JAKOŚCIOWY I ILOŚCIOWY ml szczepionki zawiera inaktywowane
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika D - Szczepionka błonicza adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Nie mniej niż 30 j.m. toksoidu błoniczego/0,5
Ulotka dołączona do opakowania: informacja dla użytkownika D - Szczepionka błonicza adsorbowana zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Nie mniej niż 30 j.m. toksoidu błoniczego/0,5
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Szczepionka tężcowa adsorbowana (T), zawiesina do wstrzykiwań Szczepionka przeciw tężcowi, adsorbowana 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Szczepionka tężcowa adsorbowana (T), zawiesina do wstrzykiwań Szczepionka przeciw tężcowi, adsorbowana 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO 1 1. AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
AEKS I CHARAKTERYSTYKA PRODUKTU LECZICZEGO 1 1. AZWA PRODUKTU LECZICZEGO imenrix proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GAMMA anty-hbs 200 Roztwór do wtrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GAMMA anty-hbs 200 Roztwór do wtrzykiwań Immunoglobulinum humanum hepatitidis B Immunoglobulina ludzka przeciw wirusowemu zapaleniu wątroby
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP JUNIOR, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Charakterystyka produktu leczniczego. 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce.
 Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VAXIGRIP, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion), inaktywowana 2. SKŁAD JAKOŚCIOWY
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Ingelvac CircoFLEX zawiesina do wstrzykiwań dla świń 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Ingelvac CircoFLEX zawiesina do wstrzykiwań dla świń 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Inflexal V Zawiesina do wstrzykiwań Szczepionka przeciw grypie (antygen powierzchniowy), inaktywowana, wirosomalna Sezon 2012/2013 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Inflexal V Zawiesina do wstrzykiwań Szczepionka przeciw grypie (antygen powierzchniowy), inaktywowana, wirosomalna Sezon 2012/2013 2.
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ECOPORC SHIGA zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ECOPORC SHIGA zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac MycoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Inaktywowana Mycoplasma
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac MycoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Inaktywowana Mycoplasma
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHA RAKTERYSTYKA PRODUKTU LECZNICZEGO. Ampułko-strzykawka po 1 ml zawiera 250 j.m. immunoglobuliny ludzkiej przeciwtężcowej.
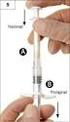 CHA RAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Igantet 250, 250j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHA RAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Igantet 250, 250j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac MycoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac MycoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO AVAXIM 160 U, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum hepatitidis A inactivatum adsorbatum Szczepionka przeciw wirusowemu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Leukocell 2 zawiesina do wstrzykiwań dla kotów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Leukocell 2 zawiesina do wstrzykiwań dla kotów 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO Substancja
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Respiporc FLU3 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Respiporc FLU3 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO RESPIPORC FLU3 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO RESPIPORC FLU3 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY. Antygen powierzchniowy wirusa zapalenia wątroby typu B (HBsAg)*
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepavax Gene TF, 20 mikrogramów, zawiesina do wstrzykiwań Szczepionka przeciw wirusowemu zapaleniu wątroby typu B (rdna) 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepavax Gene TF, 20 mikrogramów, zawiesina do wstrzykiwań Szczepionka przeciw wirusowemu zapaleniu wątroby typu B (rdna) 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO CEVAC MASS L liofilizat do sporządzania zawiesiny do podania na oczy i nozdrza dla kur 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO CEVAC MASS L liofilizat do sporządzania zawiesiny do podania na oczy i nozdrza dla kur 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gletvax 6 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH) Subastancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gletvax 6 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH) Subastancje
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
Ulotka dołączona do opakowania: informacja dla użytkownika Pseudovac, roztwór do wstrzykiwań Szczepionka poliwalentna przeciwko pałeczce ropy błękitnej Pseudomonas aeruginosa 1 ml szczepionki zawiera antygeny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DULTAVAX, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i poliomyelitis (inaktywowana) adsorbowana, o zmniejszonej zawartości
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DULTAVAX, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i poliomyelitis (inaktywowana) adsorbowana, o zmniejszonej zawartości
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Equilis West Nile zawiesina do wstrzykiwań dla koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Equilis West Nile zawiesina do wstrzykiwań dla koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
A. OZNAKOWANIE OPAKOWAŃ
 A. OZNAKOWANIE OPAKOWAŃ 1 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH OPAKOWANIE ZAWIERAJĄCE OPAKOWANIE Z 50 FIOLKAMI Z ZAWIESINĄ ORAZ 2 OPAKOWANIA Z 25 FIOLKAMI Z EMULSJĄ 1. NAZWA PRODUKTU LECZNICZEGO
A. OZNAKOWANIE OPAKOWAŃ 1 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH OPAKOWANIE ZAWIERAJĄCE OPAKOWANIE Z 50 FIOLKAMI Z ZAWIESINĄ ORAZ 2 OPAKOWANIA Z 25 FIOLKAMI Z EMULSJĄ 1. NAZWA PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. sodu glutaminian (E 621)
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Broncho-Vaxom dla dzieci, 3,5 mg, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 dawka (saszetka) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac CircoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka (1 ml)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Ingelvac CircoFLEX zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna dawka (1 ml)
Meningokoki trzeba myśleć na zapas
 Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO RESPIPORC FLUpan H1N1 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Dawka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO RESPIPORC FLUpan H1N1 zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Dawka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DULTAVAX, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani et poliomyelitidis inactivatum, antigeniis minutum, adsorbatum. Szczepionka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DULTAVAX, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani et poliomyelitidis inactivatum, antigeniis minutum, adsorbatum. Szczepionka
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
1. NAZWA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Igantet 250, 250 j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Igantet 250, 250 j.m./ml, roztwór do wstrzykiwań Immunoglobulinum humanum tetanicum 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Lydium-KLP, 5 mg/10 ml, roztwór do wstrzykiwań dla koni, bydła i świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Lydium-KLP, 5 mg/10 ml, roztwór do wstrzykiwań dla koni, bydła i świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g płynu do stosowania na skórę zawiera 100
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Purevax Rabies zawiesina do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 1 ml zawiera:
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Purevax Rabies zawiesina do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda dawka 1 ml zawiera:
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA EUVAX B, 10 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA EUVAX B, 10 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
Miejscowe oczyszczanie skóry: Wetrzeć niewielką ilość emulsji do kąpieli w zwilżoną uprzednio skórę, a następnie spłukać wodą i osuszyć ręcznikiem.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 634 mg/g, emulsja do kąpieli 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g emulsji do kąpieli zawiera 634 mg parafiny ciekłej, lekkiej (Paraffinum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 20 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 20 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 5 mikrogramów
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Nazwa produktu leczniczego ADACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona), adsorbowana, o zmniejszonej zawartości
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Nazwa produktu leczniczego ADACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona), adsorbowana, o zmniejszonej zawartości
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 g kremu zawiera 20 mg kwasu fusydynowego (Acidum fusidicum) w postaci kwasu fusydynowego półwodnego (20,3 mg).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FUSACID, 20 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 20 mg kwasu fusydynowego (Acidum fusidicum) w postaci kwasu fusydynowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FUSACID, 20 mg/g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 20 mg kwasu fusydynowego (Acidum fusidicum) w postaci kwasu fusydynowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meningitec, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum meningococcale classis C coniugatum Szczepionka meningokokowa grupy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meningitec, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum meningococcale classis C coniugatum Szczepionka meningokokowa grupy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO BioBos Respi 4, zawiesina do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO BioBos Respi 4, zawiesina do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval RS+PI3 IntraNasal 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO 1 dawka (2 ml) zawiera:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Rispoval RS+PI3 IntraNasal 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO 1 dawka (2 ml) zawiera:
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/19
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/19 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Eurican Herpes 205 - proszek i rozpuszczalnik do sporządzania emulsji do wstrzykiwań. 2.
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1/19 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Eurican Herpes 205 - proszek i rozpuszczalnik do sporządzania emulsji do wstrzykiwań. 2.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADACEL, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 11 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADACEL, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ISMIGEN tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7 mg lizatu bakterii: Staphylococcus aureus
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO ISMIGEN tabletki podjęzykowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 7 mg lizatu bakterii: Staphylococcus aureus
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Suvaxyn M.hyo - Parasuis, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Suvaxyn M.hyo - Parasuis, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego. Makrogol 3350.. 5,9 g w jednej saszetce.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 NAZWA PRODUKTU LECZNICZEGO Microlaxregula, 5,9 g, proszek do sporządzania roztworu doustnego 2 SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 3350.. 5,9 g w jednej saszetce.
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
