ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
|
|
|
- Leszek Klimek
- 8 lat temu
- Przeglądów:
Transkrypt
1 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1
2 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje pomocnicze: chlorek benzalkoniowy 0,05 mg. Pełny wykaz substancji pomocniczych, patrz punkt POSTAĆ FARMACEUTYCZNA Krople do oczu, zawiesina (krople do oczu) Jednorodna zawiesina koloru jasno-żółtego do ciemno-żółtego, ph około 7,4. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Zapobieganie i leczenie bólu pooperacyjnego i zapalenia związanego z chirurgicznym usuwaniem zaćmy (patrz punkt 5.1). 4.2 Dawkowanie i sposób podawania Stosowanie u dorosłych, w tym u pacjentów w podeszłym wieku Zalecaną dawką jest jedna kropla preparatu NEVANAC do worka spojówkowego chorego oka (oczu) 3 razy na dobę. Stosowanie leku rozpoczyna się w dniu poprzedzającym zabieg chirurgicznego usunięcia zaćmy i kontynuuje w dniu zabiegu i przez pierwsze 2 tygodnie okresu pooperacyjnego. Okres stosowania może być wydłużony do pierwszych 3 tygodni okresu pooperacyjnego, o ile zaleci to lekarz. Dodatkową kroplę należy podać na minut przed zabiegiem. Dzieci i młodzież NEVANAC nie jest zalecany do stosowania u dzieci poniżej 18 lat ze względu na brak danych dotyczących bezpieczeństwa stosowania i skuteczności. Stosowanie u pacjentów z zaburzeniem czynności wątroby i nerek Preparat NEVANAC nie był badany u pacjentów z zaburzeniem czynności wątroby i nerek. Nepafenak jest wydalany głównie poprzez procesy biotransformacji, a ekspozycja ogólnoustrojowa na ten lek po podaniu miejscowym do oczu jest bardzo mała. Nie ma konieczności dostosowania dawkowania u tych pacjentów. Sposób podawania Do stosowania do oczu. Pacjenta należy poinformować o konieczności starannego wstrząśnięcia butelką przed użyciem. Jeżeli pacjent stosuje więcej niż jeden produkt leczniczy do oczu, to każdy z leków należy podawać oddzielnie, z zachowaniem co najmniej 5-minutowej przerwy. 2
3 Aby zapobiec zanieczyszczeniu końcówki kroplomierza i roztworu, należy zachować ostrożność by nie dotykać końcówką kroplomierza powiek, okolic sąsiadujących z okiem lub innych powierzchni. Pacjenta należy pouczyć, aby pozostawiał butelkę dokładnie zamkniętą, gdy nie jest używana. 4.3 Przeciwwskazania Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą lub inne niesteroidowe leki przeciwzapalne (NLPZ). NEVANAC, podobnie jak inne NLPZ jest także przeciwwskazany u pacjentów, u których kwas acetylosalicylowy lub inne NLPZ wywołują napady astmy, pokrzywkę lub ostry nieżyt nosa. 4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Nie wstrzykiwać. Pacjenta należy pouczyć, aby nie połykał preparatu NEVANAC. Pacjenta należy pouczyć, aby unikał słońca podczas leczenia preparatem NEVANAC. Stosowanie miejscowe NLPZ może prowadzić do zapalenia rogówki. U niektórych wrażliwych pacjentów ciągłe stosowanie NLPZ może prowadzić do zniszczenia nabłonka, ścieńczenia rogówki, nadżerek rogówki, owrzodzeń rogówki lub perforacji rogówki. Zdarzenia te mogą stanowić zagrożenie dla wzroku. Pacjenci z oznakami zniszczenia nabłonka rogówki powinni natychmiast przerwać stosowanie preparatu NEVANAC i być starannie monitorowani pod kątem stanu rogówki. Miejscowo stosowane NLPZ mogą spowalniać lub opóźniać procesy gojenia. Jednoczesne stosowanie miejscowych NLPZ i miejscowych steroidów może zwiększać ryzyko zaburzeń gojenia Doświadczenia postmarketingowe dotyczące miejscowych NLPZ wskazują, że zwiększonym ryzykiem reakcji niepożądanych ze strony rogówki stanowiących zagrożenie dla wzroku obarczeni są pacjenci po skomplikowanych zabiegach chirurgicznych na oku, z odnerwieniem rogówki, nieprawidłowościami nabłonka rogówki, cukrzycą, chorobami powierzchni oka (np. zespołem suchego oka), reumatoidalnym zapaleniem stawów lub poddani zabiegom chirurgicznym na oku, które były wielokrotnie powtarzane w krótkim okresie czasu. U tych pacjentów miejscowe NLPZ powinny być stosowane z zachowaniem ostrożności. Przedłużone stosowanie miejscowych NLPZ może zwiększać narażenie pacjenta na ryzyko występowania oraz nasilenie reakcji niepożądanych ze strony rogówki. Istnieją doniesienia, że NLPZ stosowane do oczu mogą powodować zwiększone krwawienie tkanek oka (z krwotokami do komory przedniej oka włącznie) w związku z zabiegami chirurgicznymi przeprowadzanymi na oku. NEVANAC należy stosować z zachowaniem ostrożności u pacjentów ze znaną skłonnością do krwawień lub otrzymujących inne produkty lecznicze mogące wydłużać czas krwawienia. Nie ma danych na temat jednoczesnego stosowania analogów prostaglandyn i preparatu NEVANAC. Biorąc pod uwagę ich mechanizmy działania, nie zaleca się jednoczesnego stosowania tych produktów leczniczych. NEVANAC zawiera chlorek benzalkoniowy, który może powodować podrażnienie i przebarwienia miękkich soczewek kontaktowych. Ponadto, stosowanie soczewek kontaktowych nie jest zalecane w okresie pooperacyjnym po usunięciu zaćmy. Dlatego pacjenci powinni być uprzedzeni, aby nie nosić soczewek kontaktowych w trakcie leczenia preparatem NEVANAC. Istnieją doniesienia, że chlorek beznzalkoniowy, który jest powszechnie używany jako środek konserwujący w preparatach okulistycznych, może powodować punktowatą keratopatię i (lub) toksyczną wrzodziejącą keratopatię. Ponieważ NEVANAC zawiera chlorek benzalkoniowy, wymagane jest staranne monitorowanie pacjentów, którzy często lub długotrwale stosują ten preparat. 3
4 Stosowanie do oka miejscowych leków przeciwzapalnych może maskować objawy ostrego zakażenia oka. NLPZ nie działają przeciwbakteryjnie. W przypadku zakażenia oka, ich stosowanie wraz z lekami przeciw zakażeniu powinno być podejmowane z zachowaniem ostrożności. Nadwrażliwość krzyżowa Istnieje możliwość występowania nadwrażliwości krzyżowej na nepafenak i kwas acetylosalicylowy, pochodne kwasu fenylooctowego i inne NLPZ. 4.5 Interakcje z innymi lekami i inne rodzaje interakcji Badania in vitro wykazały bardzo mały potencjał występowania interakcji z innymi produktami leczniczymi i interakcji na poziomie wiązania z białkami (patrz punkt 5.2). 4.6 Ciąża i laktacja Ciąża Brak jest wystarczających danych dotyczących stosowania nepafenaku u kobiet w ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka nie jest znane. Ponieważ ogólnoustrojowa ekspozycja u kobiet nie będących w ciąży jest po leczeniu preparatem NEVANAC znikoma, ryzyko związane ze stosowaniem w ciąży można uznać za małe. Niemniej jednak, ze względu na fakt, że hamowanie syntezy prostaglandyn może mieć negatywny wpływ na przebieg ciąży i (lub) rozwój płodowy i (lub) przebieg porodu i (lub) rozwój pourodzeniowy, nie zaleca się stosowania preparatu NEVANAC w okresie ciąży, o ile korzyść nie przewyższa potencjalnego ryzyka. Karmienie piersią Nie wiadomo, czy nepafenak wydziela się do mleka ludzkiego. Badania prowadzone na zwierzętach wykazały, że jest on wydzielany do mleka szczurów. Jednakże, nie należy spodziewać się wystąpienia żadnych efektów u dziecka karmionego piersią, ponieważ ogólnoustrojowa ekspozycja na nepafenak kobiety karmiącej piersią jest znikoma. NEVANAC może być stosowany podczas karmienia piersią. 4.7 Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu Podobnie jak w przypadku innych kropli do oczu, przejściowe niewyraźne widzenie lub inne zaburzenia widzenia mogą wpływać na zdolność do prowadzenia pojazdów i obsługi maszyn. Jeżeli po zakropleniu wystąpi niewyraźne widzenie, pacjent przed rozpoczęciem jazdy lub obsługi maszyny musi odczekać, aż powróci ostrość widzenia. 4.8 Działania niepożądane W badaniach klinicznych obejmujących ponad 800 pacjentów, otrzymujących preparat NEVANAC krople do oczu, u około 5% pacjentów wystąpiły reakcje niepożądane. Prowadziły one do przerwania leczenia u 0,5% pacjentów, co stanowiło odsetek mniejszy niż wśród pacjentów leczonych placebo (1,3%) w tych samych badaniach. W tychże badaniach nie obserwowano żadnych poważnych działań niepożądanych związanych ze stosowaniem preparatu NEVANAC. Nastepujące działania niepożądane zostały ocenione jako związane z leczeniem i zostały sklasyfikowane według następującego podziału: bardzo częste ( 1/10), częste ( 1/100 do <1/10), niezbyt częste ( 1/1000 do <1/100), rzadkie ( 1/10000 do <1/1000) lub bardzo rzadkie (<1/10000). W obrębie każdej grupy określającej częstość występowania, działania niepożądane wymieniono rozpoczynając od działań najpoważniejszych. 4
5 Zaburzenia układu nerwowego Częste: bóle głowy. Zaburzenia oka Częste: punktowate zapalenie rogówki, ból oka, niewyraźne widzenie, świąd oka, suchość oka, uczucie obecności ciała obcego w oczach, strupki na brzegach powiek. Niezbyt częste: zapalenie tęczówki, zapalenie rogówki, obecność złogów w rogówce, wysięk do naczyniówki, wydzielina z oka, światłowstręt, podrażnienie oka, alergiczne zapalenie spojówek, dyskomfort w oku, choroba powiek, zwiększone łzawienie, przekrwienie spojówek. Zaburzenia żołądka i jelit Niezbyt częste: nudności, suchość w ustach. Zaburzenia skóry i tkanki podskórnej Niezbyt częste: skóra wiotka (cutis laxa). Zaburzenia układu immunologicznego Niezbyt częste: nadwrażliwość. Działania niepożądane zgłaszane w okresie po wprowadzeniu leku do obrotu, które nie były obserwowane wcześniej w badaniach klinicznych preparatu NEVANAC, wymieniono poniżej. Częstość występowania tych działań niepożądanych jest nieznana i nie może być oszacowana na podstawie dostępnych danych. Zaburzenia oka: wrzodziejące zapalenie rogówki, nieprawidłowości/choroby nabłonka rogówki, otarcie rogówki, zapalenie komory przedniej oka, upośledzenie gojenia (rogówki), zmniejszenie ostrości widzenia, blizna rogówki, zmętnienie rogówki. Pacjenci z oznakami zniszczenia nabłonka rogówki powinni natychmiast przerwać stosowanie preparatu NEVANAC i być starannie monitorowani pod kątem stanu rogówki (patrz punkt 4.4). Doświadczenia postmarketingowe dotyczące miejscowych NLPZ wskazują, że zwiększonym ryzykiem reakcji niepożądanych ze strony rogówki, stanowiących zagrożenie dla wzroku, obarczeni są pacjenci po skomplikowanych zabiegach chirurgicznych na oku, z odnerwieniem rogówki, nieprawidłowościami nabłonka rogówki, cukrzycą, chorobami powierzchni oka (np. zespołem suchego oka), reumatoidalnym zapaleniem stawów lub poddani wielokrotnym zabiegom chirurgicznym na oku w krótkim okresie czasu. 4.9 Przedawkowanie Nie ma żadnych doświadczeń na temat przedawkowania podczas stosowania do oczu. Nie jest prawdopodobne, aby podanie więcej niż jednej kropli do oka spowodowało niepożądane skutki uboczne. Praktycznie nie istnieje ryzyko wystąpienia działań niepożądanych po przypadkowym przyjęciu doustnym. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE 5.1 Właściwości farmakodynamiczne Grupa farmakoterapeutyczna: leki przeciwzapalne, niesteroidowe, Kod ATC: S01BC10 5
6 Mechanizm działania Nepafenak jest prekursorowym niesteroidowym lekiem przeciwzapalnym. Po podaniu miejscowym do oka nepafenak przenika przez rogówkę i jest przekształcany przez hydrolazę obecną w tkance oka w amfenak, niesteroidowy lek przeciwzapalny. Amfenak hamuje działanie syntazy H prostaglandyn (cyklooksygenazy), enzymu koniecznego do wytwarzania prostaglandyn. Farmakologia wtórna Wykazano, że u królików nepafenak hamuje niszczenie bariery krew-siatkówka wraz z jednoczesnym zahamowaniem syntezy PGE 2. Ex vivo wykazano, że jednorazowe miejscowe podanie do oka nepafenaku hamowało syntezę prostaglandyn w tęczówce/ciele rzęskowym (85%-95%) oraz w siatkówce/naczyniówce (55%), odpowiednio przez okres do 6 i 4 godzin. Efekty farmakodynamiczne Proces hydrolitycznego przekształcenia nepafenaku przebiega głównie w siatkówce/naczyniówce, a następnie w tęczówce/ciele rzęskowym i w rogówce, proporcjonalnie do stopnia unaczynienia tkanki. Wyniki uzyskane w badaniach klinicznych wskazują, że NEVANAC krople do oczu nie ma żadnego istotnego wpływu na ciśnienie wewnątrzgałkowe. Efekty kliniczne W celu oceny skuteczności i bezpieczeństwa stosowania preparatu NEVANAC podawanego 3 razy na dobę w zapobieganiu i leczeniu bólu pooperacyjnego i zapalenia u pacjentów poddanych chirurgicznemu usunięciu zaćmy, przeprowadzono trzy podstawowe badania kliniczne w porównaniu z placebo i (lub) trometamolem ketorolaku. W badaniach tych, lek badany rozpoczynano podawać w przeddzień zabiegu, kontynuowano w dniu zabiegu i w ciągu 2-4 tygodni okresu pooperacyjnego. Dodatkowo, prawie wszyscy pacjenci otrzymywali profilaktyczne leczenie antybiotykami, według praktyki przyjętej w danym ośrodku klinicznym. W dwóch, podwójnie zaślepionych, randomizowanych i kontrolowanych placebo badaniach klinicznych, pacjenci leczeni preparatem NEVANAC mieli znacząco mniejszy stan zapalny (komórki zapalne, zaczerwienienie) w porównaniu z pacjentami leczonymi placebo, począwszy od wczesnego okresu pooperacyjnego aż do zakończenia leczenia. W jednym, podwójnie zaślepionym, randomizowanym, kontrolowanym placebo i aktywną kontrolą badaniu klinicznym, pacjenci leczeni preparatem NEVANAC mieli znacząco mniejszy stan zapalny w porównaniu z pacjentami leczonymi placebo. Ponadto, NEVANAC nie słabiej niż ketorolak 5 mg/ml zmniejszał zapalenie i ból oka, i był nieco lepszy pod względem komfortu odczuwanego po zakropleniu. W grupie stosującej NEVANAC znacząco większy odsetek pacjentów nie zgłaszał żadnego bólu oka po operacji zaćmy w porównaniu do pacjentów z grupy placebo. 5.2 Właściwości farmakokinetyczne Wchłanianie Po podawaniu do obu oczu preparatu NEVANAC krople do oczu trzy razy na dobę, stwierdzano obecność małych, ale oznaczalnych stężeń nepafenaku i amfenaku w osoczu u większości ochotników, odpowiednio po 2 i 3 godzinach od podania. Po podaniu do oczu średnie wartości C max nepafenaku i amfenaku w osoczu w stanie stacjonarnym wynosiły odpowiednio 0,310±0,104 ng/ml i 0,422±0,121 ng/ml. Dystrybucja Amfenak ma duże powinowactwo do albumin surowicy. W badaniach in vitro, procent leku związanego z albuminą szczura, albuminą ludzką i surowicą ludzką wynosił odpowiednio 98,4%, 95,4% i 99,1%. 6
7 Badania z substancją czynną znakowaną radioaktywnie prowadzone na szczurach wykazały, że radioaktywność pochodząca z tej cząsteczki ulegała rozległej dystrybucji w organizmie po jednorazowym i wielokrotnym podawaniu 14 C-nepafenaku. Metabolizm Nepafenak podlega względnie szybkiej bioaktywacji do amfenaku przy udziale hydrolaz zlokalizowanych wewnątrz oka. Następnie, amfenak podlega intensywnemu metabolizmowi prowadzącemu do wytworzenia bardziej polarnych metabolitów, obejmującemu hydroksylację pierścienia aromatycznego, prowadzącą do wytworzenia połączeń glukuronidowych. Analiza radiochromatograficzna przeprowadzana przed i po hydrolizie przy udziale β-glukuronidazy wykazała, że wszystkie metabolity oprócz amfenaku znajdowały się w formie połączeń z kwasem glukuronidowym,. Amfenak był głównym metabolitem w osoczu, na który przypadało około 13% całkowitej radioaktywności osocza. Drugim najistotniejszym metabolitem zidentyfikowanym w osoczu był 5-hydroksynepafenak, stanowiący około 9% całkowitej radioaktywności przy C max. Interakcje z innymi produktami leczniczymi: Zarówno nepafenak, jak i amfenak nie hamują in vitro aktywności metabolicznej żadnego z głównych ludzkich izoenzymów cytochromu P450 (CYP1A2, 2C9, 2C19, 2D6, 2E1 i 3A4) w stężeniach do 300 ng/ml. A zatem, interakcje z innymi jednocześnie stosowanymi lekami, związane z metabolizmem zależnym od CYP, nie są prawdopodobne. Interakcje na poziomie wiązania z białkami również nie są prawdopodobne. Wydalanie/eliminacja Po doustnym podaniu zdrowym ochotnikom 14 C-nepafenaku, stwierdzono, że wydzielanie z moczem jest główną drogą wydalania pochodnych radioaktywnych, na którą przypada 85% dawki, podczas gdy z kałem wydala się około 6% dawki. Nepafenak i amfenak nie występowały w moczu w ilościach oznaczalnych. Po podaniu 25 pacjentom poddanym zabiegowi usunięcia zaćmy pojedynczej dawki preparatu NEVANAC, stężenia w cieczy wodnistej oznaczano po upływie 15, 30, 45 i 60 minut od podania. Maksymalne średnie stężenia w cieczy wodnistej obserwowano po 1 godzinie (nepafenak 177 ng/ml, amfenak 44,8 ng/ml). Te dane wskazują na szybkie przenikanie leku przez rogówkę. 5.3 Przedkliniczne dane o bezpieczeństwie Dane niekliniczne nie wskazują na żadne szczególne zagrożenie dla ludzi na podstawie konwencjonalnych badań farmakologii bezpieczeństwa, toksyczności po podaniu wielokrotnym i genotoksyczności. Nepafenak nie był poddawany długotrwałym badaniom rakotwórczości. W badaniach toksyczności reprodukcyjnej nepafenaku prowadzonej na szczurach, dawki toksyczne dla matek, tzn. 10 mg/kg, wiązały się z utrudnionym porodem, zwiększeniem poimplantacyjnej utraty płodów, zmniejszeniem masy i wzrostu płodu, a także przeżywalności płodów. U ciężarnych królików, dawka 30 mg/kg, powodująca słabe działanie toksyczne u matek, powodowała statystycznie istotne zwiększenie częstości wad wrodzonych u potomstwa. 6. DANE FARMACEUTYCZNE 6.1 Wykaz substancji pomocniczych Mannitol (E421) Karbomer Sodu chlorek Tyloksapol Disodu edetynian Benzalkoniowy chlorek 7
8 Sodu wodorotlenek i (lub) kwas solny (dla uzyskania właściwego ph) Woda oczyszczona. 6.2 Niezgodności farmaceutyczne Nie dotyczy. 6.3 Okres ważności 2 lata. Wyrzucić po upływie 4 tygodni od pierwszego otwarcia. 6.4 Specjalne środki ostrożności przy przechowywaniu Nie przechowywać w temperaturze powyżej 30 C. 6.5 Rodzaj i zawartość opakowania Okrągła butelka o pojemności 5 ml, wykonana z polietylenu o małej gęstości, zaopatrzona w kroplomierz i polipropylenową nakrętkę; zawierająca 5 ml zawiesiny. 6.6 Szczególne środki ostrożności dotyczące usuwania Brak szczególnych wymagań. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts HP2 7UD Wielka Brytania 8. NUMERY POZWOLEŃ NA DOPUSZCZENIA DO OBROTU 9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 8
9 ANEKS II A. WYTWÓRCA POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU, ODPOWIEDZIALNY ZA ZWOLNIENIE SERII B. WARUNKI POZWOLENIA NA DOPUSZCZENIE DO OBROTU 9
10 A. WYTWÓRCA POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU, ODPOWIEDZIALNI ZA ZWOLNIENIE SERII Nazwa i adres wytwórcy odpowiedzialnego za zwolnienie serii S.A. Alcon-Couvreur N.V. Rijksweg 14 B-2870, Puurs Belgia B. WARUNKI POZWOLENIA NA DOPUSZCZENIE DO OBROTU WARUNKI LUB OGRANICZENIA DOTYCZĄCE ZAOPATRZENIA I STOSOWANIA, NAŁOŻONE NA POSIADACZA POZWOLENIA NA DOPUSZCZENIE DO OBROTU Produkt leczniczy wydawany na receptę. WARUNKI LUB OGRANICZENIA DOTYCZĄCE BEZPIECZNEGO I SKUTECZNEGO STOSOWANIA PRODUKTU LECZNICZEGO Nie dotyczy. INNE WARUNKI System monitorowania bezpieczeństwa stosowania Przed wprowadzeniem i po wprowadzeniu produktu do obrotu, podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu musi zagwarantować wdrożenie i funkcjonowanie systemu monitorowania bezpieczeństwa stosowania, jak opisano w wersji 3,0 przedstawionej w module formularza zgłoszeniowego dopuszczającego do wprowadzenia do obrotu. Plan zarządzania ryzykiem Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu zobowiązuje się do przeprowadzenia dodatkowych badań i działań dotyczących monitorowania bezpieczeństwa stosowania jak przyjęto w wersji 2,0 w Planie Monitorowania Bezpieczeństwa Stosowania (ang. RMP, Risk Management Plan) przedstawionej w module formularza zgłoszeniowego dopuszczającego do wprowadzenia do obrotu oraz w jakichkolwiek dalszych uaktualnieniach planu monitorowania bezpieczeństwa stosowania uzgodnionych przez Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP). Zgodnie z wytycznymi CHMP w sprawie systemów zarządzania ryzykiem związanym z produktami leczniczymi do stosowania u ludzi (CHMP Guideline on Risk Management Systems for medicinal products for human use), uaktualnienie RMP należy przedłożyć jednocześnie z raportami PSUR (ang. Periodic Safety Update Report). Dodatkowo, zaktualizowany RMP należy przedłożyć W przypadku otrzymania nowej informacji, która może wpływać na bieżącą dokumentację bezpieczeństwa, plan systemu monitorowania bezpieczeństwa stosowania, lub działania minimalizujące ryzyko W ciągu 60 dni od osiągnięcia ważnego kamienia milowego (w zakresie systemu monitorowania bezpieczeństwa stosowania lub minimalizacji ryzyka) Na prośbę agencji Europejskiej Agencji ds. Produktów Leczniczych (EMEA). 10
11 ANEKS III OZNAKOWANIE OPAKOWAŃ I ULOTKI DLA PACJENTA 11
12 A. OZNAKOWANIE OPAKOWAŃ 12
13 INFORMACJE UMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO ZAWIERAJĄCE 1 BUTELKĘ 5 ml 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina Nepafenak 2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ 1 ml zawiesiny zawiera 1 mg nepafenaku. 3. WYKAZ SUBSTANCJI POMOCNICZYCH Mannitol (E421), karbomer, sodu chlorek, tyloksapol, disodu edetynian, benzalkoniowy chlorek, sodu wodorotlenek i (lub) kwas solny (dla uzyskania właściwego ph) i woda oczyszczona. Patrz dodatkowe informacje w ulotce. 4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA Krople do oczu, zawiesina 1 x 5 ml 5. SPOSÓB I DROGA PODANIA Do stosowania do oka. Dokładnie wstrząsnąć przed użyciem. Należy zapoznać się z treścią ulotki przed zastosowaniem leku. 6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEDOSTĘPNYM I NIEWIDOCZNYM DLA DZIECI Lek przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. 7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE 8. TERMIN WAŻNOŚCI Termin ważności (EXP): xx/xxxx Wyrzucić po upływie 4 tygodni od pierwszego otwarcia. Data otwarcia: 13
14 9. WARUNKI PRZECHOWYWANIA Nie przechowywać w temperaturze powyżej 30 C. 10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE 11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts HP2 7UD Wielka Brytania 12. NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU EU/0/00/000/000 1 x 5 ml 13. NUMER SERII Nr serii (Lot): xxxxx 14. KATEGORIA DOSTĘPNOŚCI Lek wydawany na receptę. 15. INSTRUKCJA UŻYCIA 16. INFORMACJA PODANA BRAJLEM nevanac 14
15 MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH, ETYKIETA NA BUTELKĘ 1. NAZWA PRODUKTU LECZNICZEGO I DROGA PODANIA NEVANAC 1 mg/ml krople do oczu Nepafenak Do stosowania do oka. 2. SPOSÓB PODAWANIA Przed zastosowaniem przeczytać ulotkę informacyjną. 3. TERMIN WAŻNOŚCI Termin ważności (EXP): xx/xxxx Wyrzucić po upływie 4 tygodni od pierwszego otwarcia. Data otwarcia: 4. NUMER SERII Lot: xxxxx 5. ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK 5 ml 6. INNE 15
16 B. ULOTKA DLA PACJENTA 16
17 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NEVANAC 1 mg/ml krople do oczu, zawiesina Nepafenak Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. - Należy zwrócić się do lekarza lub farmaceuty, gdy potrzebna jest rada lub dodatkowa informacja. - Lek ten został przepisany ściśle określonej osobie i nie należy go przekazywać innym, gdyż może im zaszkodzić, nawet jeśli objawy ich choroby są takie same. - Jeśli nasili się którykolwiek z objawów niepożądanych lub wystąpią jakiekolwiek objawy niepożądane nie wymienione w niniejszej ulotce, należy powiadomić lekarza lub farmaceutę. Spis treści ulotki: 1. Co to jest lek NEVANAC i w jakim celu się go stosuje 2. Informacje ważne przed zastosowaniem leku NEVANAC 3. Jak stosować lek NEVANAC 4. Możliwe działania niepożądane 5. Jak przechowywać lek NEVANAC 6. Inne informacje 1. CO TO JEST LEK NEVANAC I W JAKIM CELU SIĘ GO STOSUJE NEVANAC jest stosowany w zapobieganiu i łagodzeniu bólu oka oraz zapalenia po zabiegu chirurgicznego usunięcia zaćmy. NEVANAC należy do grupy leków nazywanych niesteroidowymi lekami przeciwzapalnymi (NLPZ). 2. INFORMACJE WAŻNE PRZED ZASTOSOWANIEM LEKU NEVANAC Kiedy nie stosować leku NEVANAC - Jeśli u pacjenta stwierdzono uczulenie (nadwrażliwość) na nepafenak lub którykolwiek z pozostałych składników leku NEVANAC lub na inne niesteroidowe leki przeciwzapalne. - Jeśli u pacjenta wystąpiła astma, alergia skórna lub zapalenie błony śluzowej nosa po zastosowaniu NLPZ. Przykłady NLPZ to: kwas acetylosalicylowy, ibuprofen, ketoprofen, piroksykam, diklofenak. Kiedy zachować szczególną ostrożność stosując lek NEVANAC - U dzieci. - W przypadku skłonności do występowania siniaków lub nadmiernego krwawienia, obecnie lub w przeszłości. - W przypadku jakichkolwiek innych chorób oczu (np. zakażeń oka) lub stosowania innych leków do oka (zwłaszcza miejscowo podawanych steroidów). - W przypadku cukrzycy. - W przypadku reumatoidalnego zapalenia stawów. - W przypadku wielokrotnych, powtarzanych w ciągu krótkiego okresu czasu zabiegów chirurgicznych na oku. - Podczas leczenia preparatem NEVANAC należy unikać światła słonecznego. 17
18 W razie wystąpienia którejkolwiek z wyżej wymienionych okoliczności należy poinformować lekarza. Możliwe jest, że mimo to pacjent będzie mógł stosować NEVANAC, ale wcześniej musi omówić to z lekarzem. Stosowanie leku NEVANAC z innymi lekami Należy powiedzieć lekarzowi o wszystkich przyjmowanych ostatnio lekach, również tych, które wydawane są bez recepty. Ciąża i karmienie piersią Jeśli pacjentka jest lub może być w ciąży- powinna poinformować o tym lekarza, zanim zacznie stosować NEVANAC. Jeśli pacjentka karmi piersią, to powinna wiedzieć, że lek NEVANAC może on przechodzić do mleka. Przed zastosowaniem każdego leku należy poradzić się lekarza. Prowadzenie pojazdów i obsługa maszyn Przez pewien czas po zakropleniu leku NEVANAC widzenie może być niewyraźne. Dopóki nie powróci ostrość widzenia nie wolno prowadzić pojazdów mechanicznych i obsługiwać urządzeń mechanicznych w ruchu. Ważne informacje o niektórych składnikach leku NEVANAC Środek konserwujący zawarty w preparacie NEVANAC (chlorek benzalkoniowy) może powodować przebarwienia miękkich soczewek kontaktowych i podrażnienie oka. Ponadto, po operacji usunięcia zaćmy nie zaleca się używania soczewek kontaktowych. Nie należy zatem używać soczewek kontaktowych podczas stosowania leku NEVANAC. 3. JAK STOSOWAĆ LEK NEVANAC Lek NEVANAC należy zawsze należy stosować zgodnie z zaleceniami lekarza. W przypadku wątpliwości należy ponownie skontaktować się z lekarzem lub farmaceutą. NEVANAC należy stosować do obu oczu tylko wtedy, gdy takie zalecenie zostało wydane przez lekarza. NEVANAC przeznaczony jest wyłącznie do zakraplania do oczu. Zazwyczaj stosowana dawka to Dorośli: Jedna kropla do chorego oka lub oczu, trzy razy na dobę-rano, w południe i wieczorem. Lek należy stosować o tej samej porze każdego dnia. Sposób i czas stosowania Leczenie rozpocząć w dniu poprzedzającym usunięcie zaćmy, kontynuować w dniu zabiegu. Następnie stosować tak długo, jak zalecił to lekarz. Czas stosowania leku może wynosić do 3 tygodni od przeprowadzenia operacji. 18
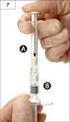
19 Sposób stosowania Przed podaniem leku umyć ręce. 1 2 Wstrząsnąć butelkę. Okręcić zakrętkę. Odwróconą butelkę trzymać między kciukiem i palcem środkowym. Odchylić głowę do tyłu. Czystym palcem odciągnąć powiekę ku dołowi, tak by między gałką oczną a powieką utworzyła się kieszonka ; do niej powinna trafić kropla (rysunek 1). Przybliżyć końcówkę butelki do oka. Dla ułatwienia można posłużyć się lustrem. Nie dotykać zakraplaczem oka ani powieki, okolic oka lub innych powierzchni. Może to doprowadzić do zakażenia kropli. Lekko nacisnąć dno butelki, aby spowodować wypłynięcie pojedynczej kropli leku NEVANAC. Nie ściskać butelki; jest ona tak zaprojektowana, że lekkie naciśnięcie dna wystarczy, aby spowodować wypłynięcie kropli (rysunek 2). W przypadku stosowania kropli do obu oczu, należy powtórzyć postępowanie opisane powyżej w stosunku do drugiego oka. Bezpośrednio po użyciu leku zakręcić butelkę. Teraz odwrócić stronę 19
20 Sposób stosowania: patrz także strona 1 Jeżeli kropla nie trafi do oka należy powtórzyć próbę zakroplenia. Zastosowanie większej niż zalecana dawki leku NEVANAC W przypadku zakroplenia nadmiernej ilości kropli należy przemyć oczy ciepłą wodą. Nie zakraplać więcej leku, aż do normalnej pory podania następnej dawki. Pominięcie zastosowania leku NEVANAC W przypadku pominięcia dawki leku NEVANAC należy, zaraz po przypomnieniu sobie, zakroplić do oka jedną kroplę. Jeśli zbliża się pora przyjęcia następnej dawki, dawkę zapomnianą należy pominąć i zastosować następną zgodnie z normalnym sposobem dawkowania. Nie należy stosować dawki podwójnej w celu uzupełnienia dawki pominiętej. Nie stosować więcej niż jedną kroplę do chorego oka (oczu) 3 razy na dobę. W przypadku stosowania innych kropli do oczu należy zachować co najmniej pięć minut przerwy między zakropleniem leku NEVANAC, a zastosowaniem innych kropli. W razie wątpliwości związanych ze stosowaniem leku należy zwrócić się do lekarza lub farmaceuty. 4. MOŻLIWE DZIAŁANIA NIEPOŻĄDANE Jak każdy lek, lek NEVANAC może powodować działania niepożądane, choć nie u każdego one wystąpią. Nie należy przerywać stosowania leku NEVANAC bez porozumienia z lekarzem. Zazwyczaj można kontynuować stosowanie kropli, o ile działania niepożądane nie są ciężkie. W razie obaw należy skonsultować się z lekarzem lub farmaceutą. Jeżeli podczas stosowania kropli oczy staną się zaczerwienione lub bardziej bolesne należy niezwłocznie skontaktować się z lekarzem. Częste działania niepożądane (1 do 10 na 100 stosujących) Objawy ze strony oczu: zapalenie powierzchni oka z utratą lub uszkodzeniem komórek, ból oka, niewyraźne widzenie, świąd oka, suchość oka, uczucie obecności ciała obcego w oku, strupki na brzegach powiek. Objawy ogólne: bóle głowy. Niezbyt częste działania niepożądane (1 do 10 na 1000 stosujących) Objawy ze strony oczu: zapalenie barwnej części oka (tęczówki), zapalenie powierzchni oka, złogi na powierzchni oka, płyn lub obrzęk tylnej części oka, wydzielina z oka, nadwrażliwość na światło, alergiczne zapalenie spojówek (alergia oka), podrażnienie oka lub ból, choroba powiek (obrzęk) lub opadanie powiek, zwiększone wytwarzanie łez, zaczerwienienie oka. Objawy ogólne: objawy alergiczne, nudności, suchość w ustach. U pacjentów stosujących NEVANAC mogą dodatkowo także wystąpić inne działania niepożądane, obejmujące: 20
21 Objawy ze strony oczu: blizny na powierzchni oka, zadrapania, zmętnienia, zapalenie lub zakażenie, stan zapalny wewnątrz oka, upośledzone gojenie oka, ograniczone widzenie. Pacjent może być bardziej narażony na problemy dotyczące powierzchni oka, które mogą prowadzić do utraty widzenia, jeżeli: - był poddany skomplikowanym zabiegom chirurgicznym w obrębie oka - był poddany zabiegom chirurgicznym w obrębie oka powtarzanym w ciągu krótkiego okresu czasu - cierpi na niektóre choroby powierzchni oka, takie jak zapalenie lub suchość oka - cierpi na niektóre choroby ogólnoustrojowe, takie jak cukrzyca lub reumatoidalne zapalenie stawów Jeśli nasili się którykolwiek z objawów niepożądanych lub wystąpią jakiekolwiek objawy niepożądane nie wymienione w ulotce, należy poinformować lekarza lub farmaceutę. 5. JAK PRZECHOWYWAĆ LEK NEVANAC Przechowywać w miejscu niedostępnym i niewidocznym dla dzieci. Nie stosować leku NEVANAC po upływie terminu ważności zamieszczonego na butelce i kartoniku, oznakowanego jako EXP. Termin ważności oznacza ostatni dzień danego miesiąca. Nie przechowywać w temperaturze powyżej 30 C. Aby zapobiec zakażeniom butelkę należy wyrzucić po upływie czterech tygodni od jej pierwszego otwarcia. Datę otwarcia każdej butelki należy zapisać w miejscu zaznaczonym na etykiecie butelki i na pudełku. Leków nie należy wyrzucać do kanalizacji lub domowych pojemników na odpadki. Należy zapytać farmaceutę co zrobić z lekami, których się już nie potrzebuje. Takie postępowanie pomoże chronić środowisko. 6. INNE INFORMACJE Co zawiera lek NEVANAC Substancją czynną leku jest nepafenak. Jeden ml zawiesiny zawiera 1 mg nepafenaku. Inne składniki leku to: benzalkoniowy chlorek, karbomer 974P, disodu edetynian, mannitol, woda oczyszczona, sodu chlorek, tyloksapol. Ponadto, do preparatu dodane są niewielkie ilości kwasu solnego lub wodorotlenku sodu w celu utrzymania w normie jego kwasowości (wartości ph). Jak wygląda lek NEVANAC i co zawiera opakowanie NEVANAC jest płynem (zawiesiną w kolorze od jasno-żółtego do ciemno-żółtego), sprzedawanym w pudełkach zawierających plastikową butelkę o pojemności 5 ml z zakrętką. Podmiot odpowiedzialny Alcon Laboratories (UK) Ltd., Boundary Way, Hemel Hempstead, Herts., HP2 7UD, Wielka Brytania. 21
22 Wytwórca S.A. Alcon-Couvreur N.V. Rijksweg 14, B-2870 Puurs, Belgia W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do przedstawiciela podmiotu odpowiedzialnego. België/Belgique/Belgien Luxembourg/Luxemburg SA Alcon-Couvreur NV + 32 (0) (België/Belgique/Belgien) България Алкон България ЕООД Česká republika Alcon Pharmaceuticals (Czech Republic) s.r.o Danmark Alcon Danmark A/S Deutschland Alcon Pharma GmbH + 49 (0) Ελλάδα Κύπρος Άλκον Λαµποράτορις Ελλάς ΑΕΒΕ (Ελλάδα) Eesti Alcon Eesti España Alcon Cusí, S.A France Laboratoires Alcon + 33 (0) Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd (0) (United Kingdom) Ísland Lietuva Alcon Services Ltd. atstovybė Magyarország Alcon Hungary Pharmaceuticals Trading Ltd Nederland Alcon Nederland BV + 31 (0) Norge Alcon Norge AS Österreich Alcon Ophthalmika GmbH + 43 (0) Polska Alcon Polska Sp. z o.o Portugal Alcon Portugal Produtos e Equipamentos Oftalmológicos, Lda România Alcon Pharmaceuticals Ltd. : Slovenija Alcon Pharmaceuticals, Podružnica v Ljubljani Slovenská Republika Alcon Pharmaceuticals Ltd oz Suomi/Finland 22
23 K. Pétursson ehf Italia Alcon Italia S.p.A Alcon Finland Oy (0) Sverige Alcon Sverige AB + 46 (0) E-post: receptionen@alconlabs.com Latvija Alcon Pharmaceuticals Ltd Data zatwierdzenia ulotki: XXXXX Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Europejskiej Agencji ds. Produktów Leczniczych (EMEA) 23
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
Ulotka dołączona do opakowania: informacja dla użytkownika. Tears Naturale II (3 mg + 1 mg)/ml, krople do oczu, roztwór Hypromellosum + Dextranum
 Ulotka dołączona do opakowania: informacja dla użytkownika Tears Naturale II (3 mg + 1 mg)/ml, krople do oczu, roztwór Hypromellosum + Dextranum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Tears Naturale II (3 mg + 1 mg)/ml, krople do oczu, roztwór Hypromellosum + Dextranum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Oftahist, 1 mg/ml, krople do oczu, roztwór Olopatadyna
 Ulotka dołączona do opakowania: informacja dla użytkownika Oftahist, 1 mg/ml, krople do oczu, roztwór Olopatadyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Oftahist, 1 mg/ml, krople do oczu, roztwór Olopatadyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 1 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 1 mg nepafenaku. Substancje
B. ULOTKA DLA PACJENTA
 B. ULOTKA DLA PACJENTA 1 Ulotka dla pacjenta: informacja dla użytkownika NEVANAC 1 mg/ml krople do oczu, zawiesina Nepafenak Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
B. ULOTKA DLA PACJENTA 1 Ulotka dla pacjenta: informacja dla użytkownika NEVANAC 1 mg/ml krople do oczu, zawiesina Nepafenak Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 3 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 3 mg nepafenaku. Substancje
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO NEVANAC 3 mg/ml krople do oczu, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera 3 mg nepafenaku. Substancje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. DICLOABAK, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DICLOABAK, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DICLOABAK, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL 0,1% 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera 1 mg diklofenaku sodowego (Diclofenacum natricum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL 0,1% 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiera 1 mg diklofenaku sodowego (Diclofenacum natricum).
Ulotka dołączona do opakowania: informacja dla użytkownika. Artelac 3,2 mg/ml, krople do oczu, roztwór (Hypromellosum)
 Ulotka dołączona do opakowania: informacja dla użytkownika Artelac 3,2 mg/ml, krople do oczu, roztwór (Hypromellosum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Artelac 3,2 mg/ml, krople do oczu, roztwór (Hypromellosum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 0,15 mg polisulfonianu sodowego azapentacenu (Azapentaceni natrii polysulfonas).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO QUINAX, 0,15 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,15 mg polisulfonianu sodowego azapentacenu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO QUINAX, 0,15 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,15 mg polisulfonianu sodowego azapentacenu
Ulotka dołączona do opakowania: informacja dla pacjenta. Tobrosopt-DEX, (3 mg + 1 mg)/ml, krople do oczu, zawiesina Tobramycinum + Dexamethasonum
 Ulotka dołączona do opakowania: informacja dla pacjenta Tobrosopt-DEX, (3 mg + 1 mg)/ml, krople do oczu, zawiesina Tobramycinum + Dexamethasonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Tobrosopt-DEX, (3 mg + 1 mg)/ml, krople do oczu, zawiesina Tobramycinum + Dexamethasonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta. Nolodon, 1 mg/ml, krople do oczu, roztwór. Olopatadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Nolodon, 1 mg/ml, krople do oczu, roztwór Olopatadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Nolodon, 1 mg/ml, krople do oczu, roztwór Olopatadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta. DIFADOL 0,1%, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum
 Ulotka dołączona do opakowania: informacja dla pacjenta DIFADOL 0,1%, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta DIFADOL 0,1%, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
Ulotka dołączona do opakowania: informacja dla pacjenta. Floxamic, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Floxamic, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Floxamic, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancja pomocnicza o znanym działaniu: benzalkoniowy chlorek, roztwór.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL 0,1%, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml zawiera 1 mg diklofenaku sodowego (Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DIFADOL 0,1%, 1 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml zawiera 1 mg diklofenaku sodowego (Diclofenacum
Ulotka dołączona do opakowania: informacja dla pacjenta. Tobrex, 3 mg/ml, krople do oczu, roztwór (Tobramycinum)
 Ulotka dołączona do opakowania: informacja dla pacjenta Tobrex, 3 mg/ml, krople do oczu, roztwór (Tobramycinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Tobrex, 3 mg/ml, krople do oczu, roztwór (Tobramycinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika. Ofloxamed, 3 mg/ml, krople do oczu, roztwór. Ofloxacinum
 Ulotka dołączona do opakowania: informacja dla użytkownika Ofloxamed, 3 mg/ml, krople do oczu, roztwór Ofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Ofloxamed, 3 mg/ml, krople do oczu, roztwór Ofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy pojemnik jednodawkowy zawiera roztwór sodu kromoglikanu o stężeniu 20 mg/ml.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alleoptical, 20 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy pojemnik jednodawkowy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
Ulotka dołączona do opakowania: informacja dla użytkownika. Oflodinex, 3 mg/ml, krople do oczu, roztwór Ofloxacinum
 Ulotka dołączona do opakowania: informacja dla użytkownika Oflodinex, 3 mg/ml, krople do oczu, roztwór Ofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Oflodinex, 3 mg/ml, krople do oczu, roztwór Ofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. ALOMIDE, 1 mg/ml, krople do oczu, roztwór Lodoxamidum
 Ulotka dołączona do opakowania: informacja dla użytkownika ALOMIDE, 1 mg/ml, krople do oczu, roztwór Lodoxamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ALOMIDE, 1 mg/ml, krople do oczu, roztwór Lodoxamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika. Mucofluid, 50 mg/ml, aerozol do nosa, roztwór. Mesnum
 Ulotka dołączona do opakowania: informacja dla użytkownika Mucofluid, 50 mg/ml, aerozol do nosa, roztwór Mesnum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla użytkownika Mucofluid, 50 mg/ml, aerozol do nosa, roztwór Mesnum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta. Floxamic Neo, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Floxamic Neo, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Floxamic Neo, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA. Ofloxacin-POS, 3 mg/ml, krople do oczu, roztwór. Ofloksacyna
 ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA Ofloxacin-POS, 3 mg/ml, krople do oczu, roztwór Ofloksacyna Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA Ofloxacin-POS, 3 mg/ml, krople do oczu, roztwór Ofloksacyna Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę
Ulotka dołączona do opakowania: informacja dla pacjenta. Floxitrat Ofta, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Floxitrat Ofta, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Floxitrat Ofta, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
B. ULOTKA DLA PACJENTA
 B. ULOTKA DLA PACJENTA 1 Ulotka dla pacjenta: informacja dla użytkownika NEVANAC 1 mg/ml krople do oczu, zawiesina nepafenak Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
B. ULOTKA DLA PACJENTA 1 Ulotka dla pacjenta: informacja dla użytkownika NEVANAC 1 mg/ml krople do oczu, zawiesina nepafenak Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
B. ULOTKA DLA PACJENTA
 B. ULOTKA DLA PACJENTA 1 Ulotka dla pacjenta: informacja dla użytkownika NEVANAC 3 mg/ml krople do oczu, zawiesina nepafenak Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
B. ULOTKA DLA PACJENTA 1 Ulotka dla pacjenta: informacja dla użytkownika NEVANAC 3 mg/ml krople do oczu, zawiesina nepafenak Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
Ulotka dołączona do opakowania: informacja dla pacjenta. Tobrexan, 3 mg/ml, krople do oczu, roztwór (Tobramycinum)
 Ulotka dołączona do opakowania: informacja dla pacjenta Tobrexan, 3 mg/ml, krople do oczu, roztwór (Tobramycinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Tobrexan, 3 mg/ml, krople do oczu, roztwór (Tobramycinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cusicrom 4%, 40 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 40 mg kromoglikanu disodu. Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cusicrom 4%, 40 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 40 mg kromoglikanu disodu. Substancja
ULOTKA DLA PACJENTA 14
 ULOTKA DLA PACJENTA 14 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA OFTAQUIX, 5 mg/ml, krople do oczu, roztwór Lewofloksacyna (Levofloxacinum) Należy zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA 14 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA OFTAQUIX, 5 mg/ml, krople do oczu, roztwór Lewofloksacyna (Levofloxacinum) Należy zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta. EMADINE 0,5 mg/ml krople do oczu, roztwór. Emedastyna
 Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór. Emedastyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór. Emedastyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta. Vidisic 2 mg/g, żel do oczu, Carbomerum
 Ulotka dołączona do opakowania: informacja dla pacjenta Vidisic 2 mg/g, żel do oczu, Carbomerum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Vidisic 2 mg/g, żel do oczu, Carbomerum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika Supremin MAX, 1,5 mg/ml, syrop Butamirati citras Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika Supremin MAX, 1,5 mg/ml, syrop Butamirati citras Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta. ROZALIN, 20 mg/ml, krople do oczu, roztwór Dorzolamidum
 Ulotka dołączona do opakowania: informacja dla pacjenta ROZALIN, 20 mg/ml, krople do oczu, roztwór Dorzolamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta ROZALIN, 20 mg/ml, krople do oczu, roztwór Dorzolamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta. Olopatadine Zentiva, 1 mg/ml, krople do oczu, roztwór Olopatadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Olopatadine Zentiva, 1 mg/ml, krople do oczu, roztwór Olopatadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta Olopatadine Zentiva, 1 mg/ml, krople do oczu, roztwór Olopatadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. NODOM, 20 mg/ml, krople do oczu, roztwór Dorzolamidum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NODOM, 20 mg/ml, krople do oczu, roztwór Dorzolamidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA NODOM, 20 mg/ml, krople do oczu, roztwór Dorzolamidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. ALLERGODIL, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ALLERGODIL, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA ALLERGODIL, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml produktu zawiera 0,345 mg wodorofumaranu ketotifenu, co odpowiada 0,25 mg ketotifenu (Ketotifenum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zaditen, 0,25 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu zawiera 0,345 mg wodorofumaranu ketotifenu,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zaditen, 0,25 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu zawiera 0,345 mg wodorofumaranu ketotifenu,
Ulotka dołączona do opakowania: informacja dla pacjenta. Xiflodrop, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum
 Ulotka dołączona do opakowania: informacja dla pacjenta Xiflodrop, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Xiflodrop, 5 mg/ml, krople do oczu, roztwór Moxifloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Azelastin POS, 0,5 mg/ml, krople do oczu, roztwór. Azelastini hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Azelastin POS, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Azelastin POS, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VERTIX, 24 MG, TABLETKI (BETAHISTINI DIHYDROCHLORIDUM)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VERTIX, 24 MG, TABLETKI (BETAHISTINI DIHYDROCHLORIDUM) Należy zapoznać się z treścią ulotki przez zastosowaniem leku. - Należy zachować tę ulotkę, aby w
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VERTIX, 24 MG, TABLETKI (BETAHISTINI DIHYDROCHLORIDUM) Należy zapoznać się z treścią ulotki przez zastosowaniem leku. - Należy zachować tę ulotkę, aby w
Ulotka dołączona do opakowania: informacja dla pacjenta. CIPRONEX 0,3%, 3 mg/ml, krople do oczu, roztwór Ciprofloxacinum
 Ulotka dołączona do opakowania: informacja dla pacjenta CIPRONEX 0,3%, 3 mg/ml, krople do oczu, roztwór Ciprofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta CIPRONEX 0,3%, 3 mg/ml, krople do oczu, roztwór Ciprofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta PRIMADEX (1 mg + 3 500 IU + 6 000 IU)/ml, krople do oczu, zawiesina Dexamethasonum + Neomycini sulfas + Polymyxini B sulfas Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla pacjenta PRIMADEX (1 mg + 3 500 IU + 6 000 IU)/ml, krople do oczu, zawiesina Dexamethasonum + Neomycini sulfas + Polymyxini B sulfas Należy uważnie zapoznać
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
Ulotka dołączona do opakowania: informacja dla pacjenta. Tobrex, 3 mg/g, maść do oczu (Tobramycinum)
 Ulotka dołączona do opakowania: informacja dla pacjenta Tobrex, 3 mg/g, maść do oczu (Tobramycinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Tobrex, 3 mg/g, maść do oczu (Tobramycinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika. Naclof, 1 mg/ml, krople do oczu, roztwór. Diclofenacum natricum
 Ulotka dołączona do opakowania: informacja dla użytkownika Naclof, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Naclof, 1 mg/ml, krople do oczu, roztwór Diclofenacum natricum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
Ulotka dołączona do opakowania: informacja dla użytkownika. VIGAMOX, 5 mg/ml, krople do oczu, roztwór Moksyfloksacyna (w postaci chlorowodorku)
 Ulotka dołączona do opakowania: informacja dla użytkownika VIGAMOX, 5 mg/ml, krople do oczu, roztwór Moksyfloksacyna (w postaci chlorowodorku) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika VIGAMOX, 5 mg/ml, krople do oczu, roztwór Moksyfloksacyna (w postaci chlorowodorku) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta. Zaditen, 0,25 mg/ml, krople do oczu, roztwór. Ketotifenum
 Ulotka dołączona do opakowania: informacja dla pacjenta Zaditen, 0,25 mg/ml, krople do oczu, roztwór Ketotifenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Zaditen, 0,25 mg/ml, krople do oczu, roztwór Ketotifenum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: Informacja dla pacjenta. ACULAR, 5 mg/ml, krople do oczu, roztwór Ketorolacum trometamolum
 Ulotka dołączona do opakowania: Informacja dla pacjenta ACULAR, 5 mg/ml, krople do oczu, roztwór Ketorolacum trometamolum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: Informacja dla pacjenta ACULAR, 5 mg/ml, krople do oczu, roztwór Ketorolacum trometamolum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta. Ciloxan, 3 mg/ml, krople do oczu, roztwór (Ciprofloxacinum)
 Ulotka dołączona do opakowania: informacja dla pacjenta Ciloxan, 3 mg/ml, krople do oczu, roztwór (Ciprofloxacinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Ciloxan, 3 mg/ml, krople do oczu, roztwór (Ciprofloxacinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
B. ULOTKA DLA PACJENTA
 B. ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika OPATANOL 1 mg/ml krople do oczu, roztwór. Olopatadyna. Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
B. ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla użytkownika OPATANOL 1 mg/ml krople do oczu, roztwór. Olopatadyna. Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 3 mg Hypromellosum (hypromelozy) i 1 mg Dextranum (dekstranu 70).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tears Naturale II, (3 mg + 1 mg)/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Hypromellosum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Tears Naturale II, (3 mg + 1 mg)/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Hypromellosum
Ulotka dołączona do opakowania: informacja dla użytkownika. Catalin 0,75 mg, tabletka i rozpuszczalnik do sporządzania kropli do oczu Pirenoxinum
 Ulotka dołączona do opakowania: informacja dla użytkownika Catalin 0,75 mg, tabletka i rozpuszczalnik do sporządzania kropli do oczu Pirenoxinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Catalin 0,75 mg, tabletka i rozpuszczalnik do sporządzania kropli do oczu Pirenoxinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
Ulotka dołączona do opakowania: informacja dla pacjenta. Mybracin, (3 mg + 1 mg)/ml, krople do oczu, zawiesina Tobramycinum + Dexamethasonum
 Ulotka dołączona do opakowania: informacja dla pacjenta Mybracin, (3 mg + 1 mg)/ml, krople do oczu, zawiesina Tobramycinum + Dexamethasonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta Mybracin, (3 mg + 1 mg)/ml, krople do oczu, zawiesina Tobramycinum + Dexamethasonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta /5000 GP PL. Należy uważnie zapoznać się z treścią ulotki przed
 Ulotka dołączona do opakowania: informacja dla pacjenta 077794/5000 GP PL Viburcol plus, krople doustne, roztwór Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta 077794/5000 GP PL Viburcol plus, krople doustne, roztwór Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta. ALLERGODIL, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta ALLERGODIL, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ALLERGODIL, 0,5 mg/ml, krople do oczu, roztwór Azelastini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta BETADRIN, (1 mg + 0,33 mg)/ml, krople do oczu, roztwór Diphenhydramini hydrochloridum + Naphazolini nitras Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta BETADRIN, (1 mg + 0,33 mg)/ml, krople do oczu, roztwór Diphenhydramini hydrochloridum + Naphazolini nitras Należy uważnie zapoznać się z treścią
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TOBROSOPT 0,3%, 3 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Tobramycinum (tobramycyny).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TOBROSOPT 0,3%, 3 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3 mg Tobramycinum (tobramycyny).
Euphorbium S. aerozol do nosa, roztwór
 Ulotka dołączona do opakowania: informacja dla pacjenta Euphorbium S aerozol do nosa, roztwór Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla
Ulotka dołączona do opakowania: informacja dla pacjenta Euphorbium S aerozol do nosa, roztwór Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta
 Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
Nieoficjalne tłumaczenie niemieckiej ulotki dla pacjenta Ulotka dla pacjenta:informacja dla użytkownika Medivitan iv ampułko-strzykawka 5 mg, 1 mg, 1,05 mg roztwór do wstrzykiwań Substancje czynne: pirydoksyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
Zawiadomienie Prezesa UR z dnia 19.03.2015 CCDS March 2014
 Ulotka dołączona do opakowania: informacja dla pacjenta PEVISONE, (10 mg + 1,1 mg)/g, krem Econazoli nitras + Triamcinoloni acetonidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta PEVISONE, (10 mg + 1,1 mg)/g, krem Econazoli nitras + Triamcinoloni acetonidum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu (Clotrimazolum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fungotac 10 mg/ml, krople do uszu, roztwór. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fungotac 10 mg/ml, krople do uszu, roztwór. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 10 mg substancji czynnej klotrymazolu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DIKLONAT P, 10 mg/g, żel (Diclofenacum natricum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje dla pacjenta. Lek ten jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Famvir i nazwy produktów związanych (patrz Aneks I) 125 mg tabletki powlekane Famvir i nazwy produktów związanych (patrz Aneks I) 250 mg tabletki powlekane
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Famvir i nazwy produktów związanych (patrz Aneks I) 125 mg tabletki powlekane Famvir i nazwy produktów związanych (patrz Aneks I) 250 mg tabletki powlekane
Ulotka dołączona do opakowania: informacja dla użytkownika. Olopatadyna Abdi, 1 mg/ml, krople do oczu, roztwór Olopatadyna
 Ulotka dołączona do opakowania: informacja dla użytkownika Olopatadyna Abdi, 1 mg/ml, krople do oczu, roztwór Olopatadyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Olopatadyna Abdi, 1 mg/ml, krople do oczu, roztwór Olopatadyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH BUTELKA Z POLIETYLENU Z DOZOWNIKIEM I NAKRĘTKĄ 1. NAZWA PRODUKTU LECZNICZEGO (9,8 mg + 9,8 mg + 245 mg)/g (Benzocainum + Mentholum + Zinci oxidum),
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH BUTELKA Z POLIETYLENU Z DOZOWNIKIEM I NAKRĘTKĄ 1. NAZWA PRODUKTU LECZNICZEGO (9,8 mg + 9,8 mg + 245 mg)/g (Benzocainum + Mentholum + Zinci oxidum),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
Ulotka dołączona do opakowania: informacja dla pacjenta Sal Ems factitium, 450 mg, tabletki musujące
 Ulotka dołączona do opakowania: informacja dla pacjenta Sal Ems factitium, 450 mg, tabletki musujące Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Sal Ems factitium, 450 mg, tabletki musujące Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika. TRUSOPT, 20 mg/ml, krople do oczu, roztwór Dorzolamidum
 Ulotka dołączona do opakowania: informacja dla użytkownika TRUSOPT, 20 mg/ml, krople do oczu, roztwór Dorzolamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika TRUSOPT, 20 mg/ml, krople do oczu, roztwór Dorzolamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
Ulotka dołączona do opakowania: informacja dla pacjenta. Flucon, 1 mg/ml, krople do oczu, zawiesina. Fluorometholonum
 Ulotka dołączona do opakowania: informacja dla pacjenta Flucon, 1 mg/ml, krople do oczu, zawiesina Fluorometholonum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Flucon, 1 mg/ml, krople do oczu, zawiesina Fluorometholonum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oilatum 700 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 700 mg parafiny ciekłej, lekkiej (Paraffinum perliquidum). Pełny
B. ULOTKA DLA PACJENTA
 B. ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór emedastyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
B. ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór emedastyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta. DEXAMETHASON WZF 0,1%, 1 mg/ml, krople do oczu, zawiesina Dexamethasonum
 Ulotka dołączona do opakowania: informacja dla pacjenta DEXAMETHASON WZF 0,1%, 1 mg/ml, krople do oczu, zawiesina Dexamethasonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta DEXAMETHASON WZF 0,1%, 1 mg/ml, krople do oczu, zawiesina Dexamethasonum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta. Ciloxan, 3 mg/g, maść do oczu (Ciprofloxacinum)
 Ulotka dołączona do opakowania: informacja dla pacjenta Ciloxan, 3 mg/g, maść do oczu (Ciprofloxacinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Ciloxan, 3 mg/g, maść do oczu (Ciprofloxacinum) Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika. Ofloxamed, 3 mg/ml, krople do oczu, roztwór. Ofloxacinum
 Ulotka dołączona do opakowania: informacja dla użytkownika Ofloxamed, 3 mg/ml, krople do oczu, roztwór Ofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika Ofloxamed, 3 mg/ml, krople do oczu, roztwór Ofloxacinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon
 VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. HIRUDOID, 0,3 g/100 g maść (Mucopolisaccharidum polisulphatum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA HIRUDOID, 0,3 g/100 g maść (Mucopolisaccharidum polisulphatum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA HIRUDOID, 0,3 g/100 g maść (Mucopolisaccharidum polisulphatum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Polibiotic, (5 mg + 5000 j.m. + 400 j.m.)/g, maść (Neomycini sulfas + Polymyxini B sulfas + Bacitracinum zincum) Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta Polibiotic, (5 mg + 5000 j.m. + 400 j.m.)/g, maść (Neomycini sulfas + Polymyxini B sulfas + Bacitracinum zincum) Należy uważnie zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta tabletki powlekane 100 mg Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla pacjenta tabletki powlekane 100 mg Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Levofloxacin Adamed, 5 mg/ml, krople do oczu, roztwór Lewofloksacyna (w postaci półwodzianu) Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla użytkownika Levofloxacin Adamed, 5 mg/ml, krople do oczu, roztwór Lewofloksacyna (w postaci półwodzianu) Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla pacjenta. PILOCARPINUM WZF 2%, 20 mg/ml, krople do oczu, roztwór Pilocarpini hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta PILOCARPINUM WZF 2%, 20 mg/ml, krople do oczu, roztwór Pilocarpini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta PILOCARPINUM WZF 2%, 20 mg/ml, krople do oczu, roztwór Pilocarpini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla pacjenta. Alcaine, 5 mg/ml, krople do oczu, roztwór Proxymetacaini hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta Alcaine, 5 mg/ml, krople do oczu, roztwór Proxymetacaini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta Alcaine, 5 mg/ml, krople do oczu, roztwór Proxymetacaini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta. Flarex, 1 mg/ml, krople do oczu, zawiesina Flurometholoni acetas
 Ulotka dołączona do opakowania: informacja dla pacjenta Flarex, 1 mg/ml, krople do oczu, zawiesina Flurometholoni acetas Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Flarex, 1 mg/ml, krople do oczu, zawiesina Flurometholoni acetas Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór, pojemnik jednodawkowy.
 Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór, pojemnik jednodawkowy. Emedastyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta EMADINE 0,5 mg/ml krople do oczu, roztwór, pojemnik jednodawkowy. Emedastyna Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dla pacjenta: Informacja dla użytkownika
 Finacea 150 mg/g żel Acidum azelaicum Ulotka dla pacjenta: Informacja dla użytkownika Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten jest dostępny bez
Finacea 150 mg/g żel Acidum azelaicum Ulotka dla pacjenta: Informacja dla użytkownika Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten jest dostępny bez
