Dna moczanowa. choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? Punkt widzenia reumatologa
|
|
|
- Bogna Makowska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? Punkt widzenia reumatologa dr n. med. Maria Rell-Bakalarska, dr n. med. Robert Rupiński
2 dr n. med. Maria Rell-Bakalarska, dr n. med. Robert Rupiński Rheuma Medicus Specjalistyczne Centrum Reumatologii i Osteoporozy ul. Pruszkowska 6, 0-8 Warszawa tel , mail: rupinski@mp.pl Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? Punkt widzenia reumatologa dr n. med. Maria Rell-Bakalarska, dr n. med. Robert Rupiński DNA MOCZANOWA I HIPERURYKEMIA Dna moczanowa stanowi zespół objawów klinicznych, który jest spowodowany krystalizacją moczanu sodu w tkankach i narządach (stawy, skóra, nerki), co jest ściśle związane ze zwiększeniem stężenia kwasu moczowego w surowicy powyżej 6,5 mg/dl (390 mmol/l). Pomimo prób stworzenia uniwersalnego zestawu kryteriów klinicznych rozpoznania (kryteria rzymskie 963, nowojorskie 966, meksykańskie 00 i holenderskie 00), złotym standardem w diagnostyce dny moczanowej pozostaje nadal wykrycie kryształów moczanu sodu w płynie stawowym lub tkankach. Badanie to jest jednak wykonywane stosunkowo rzadko (tylko w ok. 6% przypadków) ze względu na trudności techniczne (uzyskanie płynu stawowego, szybki transport do laboratorium, mikroskop ze światłem spolaryzowanym). Na uwagę zasługują jednak najnowsze (05) kryteria klasyfikacyjne dny moczanowej opracowane wspólnie przez EULAR (European League Against Rheumatism) i ACR (American College of Rheumatology) 3. Gdy u pacjenta z ostrym zapaleniem stawu bądź kaletki maziowej nie dysponujemy potwierdzeniem obecności kryształów moczanu sodowego, analizujemy pozostałe kryteria kliniczne (Tab..). Uzyskanie przynajmniej 8 punktów upoważnia nas do postawienia rozpoznania dny moczanowej. Kryteria EULAR/ACR 05 charakteryzują się dużą przydatnością nie tylko ze względu na wysoką specyficzność (89%) i czułość (9%). Bardzo dobrze opisują one także ostry napad dny moczanowej przebieg czasowy, objawy kliniczne oraz rodzaj zajętych stawów (8 punktów to typowy napad dny moczanowej z lokalizacją w stawie MTP palucha u pacjenta z kwasem moczowym 6-8mg%). Obecność moczanu sodowego w tkankach wywołuje odpowiedź organizmu w mechanizmie reakcji immunologicznej, w której uczestniczą granulocyty obojętnochłonne fagocytujące kryształy, układ dopełniacza oraz interleukina β (IL-β). Prowadzi to do ostrego zapalenia stawu (najczęściej śródstopno-paliczkowego palucha podagra) z towarzyszącymi objawami ogólnymi. Nawracające ostre zapalenia (napady), dają z czasem obraz zapalenia wielostawowego, czyli dny
3 Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? przewlekłej. Dla przewlekłej (wieloletniej) dny moczanowej, oprócz zapalenia stawów, typowe są podskórne guzki tophi (złogi kwasu moczowego z towarzszącym miejscowym odczynem Kryterium wstępne Kryterium wystarczające Pozostałe kryteria kliniczne Przynajmniej jeden epizod zapalenia stawu lub kaletki Obecność kryształów kwasu moczowego w stawie, guzku, kaletce Rodzaj zajętych stawów Staw skokowy lub śródstopie (bez stawu MTP I) Objawy zapalenia:. Rumień (zaczerwienie). Silna tkliwość 3. Znaczne trudności w chodzeniu Staw MTP I (staw śródstopno-paliczkowy palucha) Obecność: objawu objawów 3 objawów Obecność kryształów kwasu moczowego (-) - Przebieg zapalenia:. napadów pomimo leczenia. Rozwój objawów <4 godz 3. Ustąpienie objawów 4 dni 4. Całkowite ustąpienie pomiędzy napadami typowy napad zapalnym), destrukcyjne zmiany w stawach (duże brzeżne nadżerki widoczne w obrazie radiologicznym), nefropatia i kamica moczanowa a także utrzymywanie się laboratoryjnych wykładników Nawracające typowe napady Punkty 3 ogólnoustrojowego stanu zapalnego (podwyższone OB lub CRP). Hiperurykemia, czyli stężenie kwasu moczowego w surowicy przekraczające 6 mg/dl jest podstawowym czynnikiem w patogenezie dny. Zazwyczaj (ponad 90%) jest ono spowodowane upośledzonym wydalaniem kwasu moczowego przez nerki. Rozpuszczalność kwasu moczowego jest niewielka i zależy przede wszystkim od jego stężenia w roztworze (surowicy, płynie tkankowym, moczu), ph i temperatury otoczenia. Granicą rozpuszczalności dla temperatury 37,0 st. C jest stężenia 6,8 mg/dl. Z tym wiąże się także większa częstość występowania zapalenia stawów kończyn dolnych, przede wszystkim stóp, które mają zwykle niższą temperaturę niż pozostałe okolice ciała. Na stężenie kwasu moczowego wpływa przede wszystkim jego podaż. Kwas moczowy u człowieka jest końcowym produktem przemiany puryn. Powstaje on z hipoksantyny i ksantyny pod wpływem enzymu oksydazy ksantynowej. Organizm produkuje w ciągu doby mg kwasu moczowego i w takiej właśnie ilości powinien on zostać wydalony przez nerki. Puryny, które podlegają przemianie do hipoksantyny i dalej kwasu moczowego, mogą pochodzić z trzech źródeł diety, obumierających komórek (naturalny proces fizjologiczny, stany chorobowe nowotwory czy łuszczyca) oraz syntezy de novo. Choć realizacja zaleceń jest trudna, ważne jest, by każdego pacjenta z dną moczanową zachęcać do stosowania diety ubogopurynowej oraz spożywania produktów, które mogą obniżać stężenie kwasu moczowego. Pokarmy zalecane i przeciwwskazane w hiperurykemii i dnie moczanowej przedstawiono w tabeli (Tab..) 4,5. Hiperurykemia dla rozwoju dny moczanowej ma znaczenie kluczowe. Chociaż wiemy obecnie, że tylko u ok. 0% pacjentów z podwyższonym stężeniem kwasu moczowego rozwinie się zapalenie stawów, to dążenie do obniżenia poziomu kwasu moczowego w surowicy ma w przypadku dny znaczenie podstawowe. Badania epidemiologiczne wykazały, że nie tylko sama obecność hiperurykemii ale także to, do jakiego stopnia podwyższone jest stężenia kwasu moczowego, determinują rozwój choroby. W jednym z opracowań (Normative Aging Study) zapadalność na dnę moczanową (liczba świeżo rozpoznanych przypadków choroby na 000 osób w ciągu roku) w zależności od stężenia kwasu moczowego w surowicy kształtowała się następująco: poniżej 6,0 mg/dl Obecność typowych guzków dnawych (+) 4 Stężenie kwasu moczowego w surowicy <4 mg/dl -4 Produkty spożywcze 6 <8 mg/dl 8 <0 mg/dl 3 Obniżające stężenie kwasu moczowego Zwiększające stężenie kwasu moczowego 0 mg/dl 4 Niskotłuszczowe produkty mleczne Alkohol (szczególnie piwo i wódka) Obecność złogów moczanu wapnia w badaniu USG lub TK (+) 4 Owoce (szczególnie wiśnie i czereśnie) Witamina C Kawa (herbata bez wpływu) Soki owocowe Produkty spożywcze zawierające fruktozę Pokarmy mięsne, szczególnie podroby Obecność typowych zmian radiologicznych (nadżerek) (+) 4 Warzywa (w większości) Produkty zbożowe Owoce morza Grzyby Tabela. Kryteria klasyfikacyjne dny moczanowej 05 wg EULAR i ACR (zmodyfikowano na podstawie [3]). Tabela. Dieta w dnie moczanowej i hipeurykemii (zmodyfikowano na podstawie [4] i [5]). 3
4 Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? 0,8 osoby na rok; 6,0 6,9 mg/dl 0,9 osoby; 7,0 7,9 mg/dl 4, osoby; 8,0 8,9 mg/dl 8,4 osoby; 9,0 9,9 mg/dl 43, osoby (!); powyżej 0,0 mg/dl 70, osoby (!) 6. Do innych czynników ryzyka rozwoju dny moczanowej zaliczyć należy: płeć męską (mężczyźni chorują 6-razy częściej od kobiet, u kobiet choroba może przebiegać nietypowo), podeszły wiek, predyspozycje genetyczne, nadciśnienie tętnicze, nadwagę, cukrzycę (ostatnio czynnik kwestionowany), zespół metaboliczny, stan po transplantacji narządów, odwodnienie oraz stosowanie niektórych leków (diuretyki pętlowe i tiazydowe, cyklosporyna, kardiologiczne dawki kwasu acetylosalicylowego). TERAPIA DNY MOCZANOWEJ W 06 Jak wykazano powyżej, leczenie dny moczanowej powinno opierać się na dążeniu do normalizacji poziomu kwasu moczowego w surowicy. W zależności od okresu choroby nasze działania podlegają jednak pewnej modyfikacji. W okresie bezobjawowej hiperurykemii zdania co do rozpoczynania terapii farmakologicznej są podzielone. Przeważa pogląd, że pacjent powinien otrzymać pełną informację o etiologii schorzenia, pozostawać na diecie, dbać o dobre nawodnienie organizmu, wykazywać odpowiednią do wieku aktywność fizyczną oraz leczyć modyfikowalne czynniki ryzyka rozwoju dny (nadciśnienie tętnicze, nadwaga, cukrzyca, zespół metaboliczny). Powszechnie przyjmuje się, że leczenie hipourykemizujące należy zastosować w bezobjawowej hiperurykemii przy stężeniu kwasu moczowego w surowicy powyżej mg/dl, dobowym wydalaniu kwasu moczowego powyżej 00 mg oraz hiperurykemii związanej z chorobą nowotworową bądź jej leczeniem (profilaktyka tzw. zespołu rozpadu guza) 7. Na problem bezobjawowej hiperurykemii można jednak spojrzeć z drugiej strony. Obserwacje kliniczne i badania epidemiologiczne ostatnich lat wykazały, że bezobjawowa hiperurykemia stanowi niezależny czynnik ryzyka nadciśnienia tętniczego 8. U pacjentów z podwyższonym stężeniem kwasu moczowego w surowicy stwierdza się również 3-5 krotny wzrost ryzyka choroby niedokrwiennej serca i udaru mózgu 9,0. Dane te okazały się na tyle istotne, że Europejskie Towarzystwo Nadciśnienia Tętniczego i Europejskie Towarzystwo Kardiologiczne rekomendują badanie stężenia kwasu moczowego jako rutynową ocenę laboratoryjną u chorych na nadciśnienie tętnicze. Wydaje się zatem, że decyzja co do ewentualnego rozpoczęcia leczenia bezobjawowej hiperurykemii, oprócz stężenia kwasu moczowego, powinna również uwzględniać schorzenia współistniejące, przede wszystkim nadciśnienie tętnicze. Do chwili obecnej nie opublikowano jednak rekomendacji jednoznacznie określających kiedy i u jakiego pacjenta taką decyzję podjąć. Kolejny okres rozwoju dny moczanowej rozpoczyna się w momencie wystąpienia pierwszego ostrego napadu zapalenia stawów. Jak wspomniano wyżej, najczęściej (ok. 75% przypadków) dochodzi do zajęcia stawu śródstopno-paliczkowego (zwykle palucha). W tym okresie rozwoju choroby, ze względu na bardzo nasilone objawy bólowe w obrębie samego stawu, na plan dalszy schodzi dążenie do normalizacji poziomu kwasu moczowego. Jest to czas, w którym priorytet stanowi eliminacja bólu i objawów zapalenia. W leczeniu ostrego napadu dny moczanowej stosuje się niesteroidowe leki przeciwzapalne (NLPZ) w maksymalnych tolerowanych przez pacjenta dawkach, bez preferencji konkretnego preparatu. Kolejnym równoważnym pod względem skuteczności lekiem jest kolchicyna w dawce,5- mg/dobę. W przypadku przeciwwskazań, nieskuteczności lub działań niepożądanych NLPZ i kolchicyny, lekiem kolejnego wyboru są glikokortykosteroidy (GKS) podawane doustnie. W przypadku występowania wysięku, GKS można podać dostawowo. W czasie trwania ostrego napadu dny nie włączamy nowego leczenia hipourykemizującego, natomiast kontynuujemy taką terapią o ile była ona rozpoczęta wcześniej. Na marginesie trzeba dodać, że poziom kwasu moczowego mierzony w trakcie napadu dny często bywa prawidłowy. Należy zatem dokonać takiego pomiaru po zakończeniu ostrego zapalenia, tj. najlepiej ok. 4 tygodni od wystąpienia napadu dny. Dopiero to oznaczenie powinno być dla nas podstawą do rozpoczęcia terapii normalizującej poziom kwasu moczowego w surowicy. W przypadku szczególnie ciężkich napadów (bardzo silne bóle, dolegliwości bólowe, zajęcie dużych stawów, zajęcie powyżej 4 drobnych stawów), od samego początku można zastosować leczenie skojarzone kolchicyną i NLPZ. Jeśli napad przedłuża się powyżej tygodni, zazwyczaj dobry efekt terapeutyczny przynosi dołączenie GKS doustnie. Występowanie ostrych napadów dny zobowiązuje nas do włączenia leczenia normalizującego stężenie kwasu moczowego w surowicy. Leczenie hipourykemizujące to podstawa terapii w tzw. okresie międzynapadowym oraz okresie przewlekłego zapalenia stawów. Wg zaleceń EULAR lekiem pierwszego rzutu jest allopurinol 3. Allopurinol jest nieselektywnym inhibitorem oksydazy ksantynowej, który w sposób zależny od dawki hamuje syntezę kwasu moczowego. Terapię rozpoczynamy zwykle od dawki 00 mg/dobę, zwiększając ją stopniowo co 4 tygodnie o kolejne 00 mg pod kontrolą stężenia kwasu moczowego w surowicy, aż do osiągniecia satysfakcjonującego poziomu kwasu moczowego bądź dawki maksymalnej 900 mg/dobę. Przyjmuje się, że średnia dawka podtrzymująca powinna wynosić mg allopurinolu na dobę. Dawkę dobową należy zmodyfikować u chorych z niewydolnością nerek. Drugim lekiem obniżającym produkcję kwasu moczowego jest febuksostat (bardziej selektywny inhibitor oksydazy ksantynowej od allopurinolu). W dawce 40-0 mg/dobę jest on stosowany w przypadku nietolerancji bądź braku skuteczności allopurinolu. Febuksostat nie jest zalecany pacjentom z zastoinową niewydolnością krążenia oraz chorobą niedokrwienną serca. Ciekawą i nowoczesną opcją w zakresie leków zmniejszających produkcję kwasu moczowego jest rasburykaza rekombinowana oksydaza moczanowa podawana we wlewach dożylnych w leczeniu i profilaktyce zespołu rozpadu guza po chemioterapii. Normalizacja stężenia kwasu moczowego występuje zwykle w ciągu 4 godzin po podaniu rasburykazy. Inne trudniej dostępne w naszych warunkach opcje terapeutyczne obejmują stosowanie leków urykozurycznych, tj. zwiększających wydalanie kwasu moczowego przez nerki. Wskazane są one u chorych ze zmniejszonym wydalaniem kwasu moczowego (poniżej 700 mg/dobę). Do leków z tej grupy zalicza się probenecyd (jedyny dostępny w Polsce) oraz benzbromaron. W przypadku bardzo silnie wyrażonych objawów zapalenia stawów w leczeniu dny moczanowej zostały zarejestrowane 3 leki biologiczne działające poprzez hamowanie interleukiny (anakinra, kanakinumab, rylonacept). STRATEGIA TT W ostatnich latach w leczeniu innej choroby zapalnej reumatoidalnego zapalenia stawów (RZS) posługujemy się strategią treat to target (TT), czyli terapią ukierunkowana na cel 4. W skrócie można przyjąć, że chodzi w niej o stałą, systematyczną 4 5
5 Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? modyfikację naszego leczenie farmakologicznego, które w najkrótszym możliwym czasie powinno przyczynić się do osiągnięcia wyznaczonego celu terapeutycznego. Tym celem w leczeniu RZS jest remisja, tj. stan całkowitego braku klinicznej i laboratoryjnej aktywności zapalenia stawów. Można przyjąć, że celem leczenia dny moczanowej jest stałe utrzymanie poziomu kwasu moczowego poniżej 6,0 mg/dl a tym samym zapobieganie nawrotom ostrego (napady dny moczanowej) oraz przewlekłego zapalenia stawów (remisja). Ale czy na pewno jest to cel, który nas obecnie satysfakcjonuje? W badaniach klinicznych stwierdzono możliwość nie tylko zapobiegania nawrotom zaostrzeń stawowych, ale także możliwość rozpuszczania się złogów kwasu moczowego w tkankach w sytuacji utrzymywani się odpowiednio niskiego stężenia kwasu moczowego w surowicy. Podczas obserwacji 63 pacjentów z przewlekłą dną guzkową wykazano, że średni czas potrzebny na rozpuszczenie guzka dnawego przy stężeniu kwasu moczowego w surowicy na poziomie 4,0 mg/dl wyniósł 0 miesięcy, a przy stężeniu 5,4 mg/dl 9 miesięcy 5. Stąd wydaje się, że aktualnie naszym celem terapeutycznym powinno być utrzymanie stężenia kwasu moczowego raczej na poziomie 5,0 niż 6,0 a być może nawet 4,0 mg/dl 6. Utrzymywanie na stałe tak niskiego poziomu kwasu moczowego może przynieść z czasem liczne pozytywne efekty w leczeniu ostrej i przewlekłej dny moczanowej zmniejszenie ogólnoustrojowej puli moczanów, zahamowanie tworzenia nowych oraz rozpuszczenie istniejących kryształów moczanu sodu (zanikanie guzków dnawych) oraz związane z tym wyciszenie systemowego odczynu zapalnego. Cele te można realizować ponieważ dysponujemy lekami skutecznie obniżającymi produkcję kwasu moczowego (allopurinol, febuksostat). Sposobem na osiągnięcie założonego celu będzie odpowiednie racjonalne dawkowanie allopurinolu jako leku pierwszego rzutu. Posługując się konkretnym przykładem klinicznym, warto uzmysłowić sobie, jak istotna i kluczowa w zakresie TT w dnie moczanowej jest dawka leku. Nasz pacjent z dną moczanową ma stężenie kwasu moczowego w surowicy równe 9,0 mg/dl. Rozpoczynając leczenie allopurinolem od 00 mg/dobę jesteśmy w stanie (zakładając przestrzeganie przez pacjenta zaleceń lekarskich) obniżyć stężenie kwasu moczowego u tego chorego tylko do 8,0 mg/dl (00 mg allopurynolu obniża stężenie kwasu moczowego o około mg/dl). Naszym pierwszym i najważniejszym celem terapeutycznym jest 6,0 mg/dl, a więc jak łatwo obliczyć do jego realizacji będziemy potrzebowali systematycznego przyjmowania przez pacjenta dawki 300 mg allopurinolu dziennie. Jednak takie leczenie nie przyniesie nadal rozpuszczenia zdeponowanych już kryształów moczanu sodu. Aby to osiągnąć należy stopniowo dalej zwiększyć dawkę allopurinolu o kolejne mg/dobę oraz utrzymywać chorego na dawce podtrzymującej mg/dobę. Skuteczność naszej terapii należy systematycznie kontrolować oznaczając stężenie kwasu moczowego w surowicy oraz monitorując potencjalne działania niepożądane. Postępowanie takie może całkowicie uwolnić naszego pacjenta od nawrotów ostrych napadów dny oraz z czasem pozwoli na cofnięcie się wszystkich dokonanych już zmian (rozpuszczenie złogów tkankowych). Na obecnym etapie wiedzy wydaje się racjonalne wykorzystanie możliwości jakie daje nam intensywne leczenie hipourykemizujące. Dna moczanowa jest aktualnie jednym z niewielu przewlekłych zapaleń stawów o podłożu immunologicznym, w którym, przy odpowiedniej determinacji lekarza prowadzącego i współpracy ze strony pacjenta, możemy stosunkowo prostym i tanim leczeniem doprowadzić do stanu długotrwałej remisji klinicznej. TEORIA A PRAKTYKA KLINICZNA WNIOSKI NA PRZYSZŁOŚĆ Praktyka kliniczna pokazuje, że nadal nie do końca wykorzystujemy możliwości, jakie daje nam współczesne podejście do leczenia dny moczanowej. Wydaje się, że stosowane przez nas dawki allopurinolu są zbyt niskie dla uchronienia pacjenta przed nawrotami zaostrzeń choroby, nie mówiąc już o próbie odwrócenia niekorzystnego procesu odkładania złogów moczanu sodu w stawach i tkankach okołostawowych (tophi). Mówią nam o tym wyniki badania ankietowego przeprowadzonego na losowo wybranej grupie 50 reumatologów z całego kraju (praktyka ambulatoryjna minimum 3 pełne dni w tygodniu) i zawartego w raporcie Instytutu Ochrony Zdrowia z 05 roku 7. Okazało się, że średnio aż co piąty pacjent jest u reumatologa z powodu dny lub z jej podejrzeniem (statystycznie 6 takich osób w ciągu miesiąca). W tej grupie 73% stanowią chorzy kontynuujący leczenie wcześniej rozpoznanej dny moczanowej, przy czym % z nich ma nadal bardzo częste napady (przynajmniej 7 w roku), a u 35% napady występują od do 6 razy w roku. Ponad jedna trzecia (34%) pacjentów zgłaszających się po raz pierwszy do reumatologa w związku z objawami dny ma już uszkodzenia stawów związane z przebiegiem tej choroby. Świadczy to wg autorów publikacji o późnym diagnozowaniu w Polsce dny moczanowej. Najciekawsze dane dotyczą jednak terapii. Blisko 80% pacjentów zgłaszających się do reumatologa w związku z objawami dny moczanowej stosuje allopurinol, prawie dwie trzecie (63%) pacjentów otrzymuje dawkę od 00 do 00 mg na dobę, nieco ponad jedna trzecia (36%) dawkę od 300 do 500 mg na dobę, a zaledwie % dawkę 600 mg na dobę lub większą. W podsumowaniu w/w raportu p.t. Występowanie i leczenie dny moczanowej w Polsce analiza, wskazania i rekomendacje. przedstawiono 6 wniosków i rekomendacji. Wg autorów opracowania dla diagnostyki i leczenia dny moczanowej w Polsce charakterystyczne jest m.in.: zbyt rzadkie rozpoznawanie dny moczanowej u kobiet; opóźnienia w rozpoznawaniu dny u chorych z zajęciem stawów innych niż śródstopno-paliczkowe; stosowanie zbyt niskich dawek leków obniżających stężenie kwasu moczowego; stosowanie zbyt dużych dawek kolchicyny; częste przerywanie podawania leków obniżających stężenie kwasu moczowego. Obecnie standardy opieki nad pacjentem z dną moczanową nie nadążają za ugruntowaną już wiedzą z zakresu profilaktyki i leczenia tego schorzenia. Warto pamiętać, że dna jest obecnie chorobą, którą stosując odpowiednio wysokie i indywidulanie dobrane dawki tanich leków (allopurinol) można bardzo dobrze kontrolować (remisja), a być może doprowadzić nawet do wycofania się powstałych już zmian w stawach i innych tkankach organizmu ( wyleczenie ). Piśmiennictwo. Gińdzieńska-Sieśkiewicz E, Sierakowski S, Domysławska I, Sulik A. Dna moczanowa aktualne spojrzenie na diagnostykę i leczenie. Reumatologia 00; 48: Zhang W et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT). Ann Rheum Dis 006; 65: Neogi T et al. 05 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 05; 74:
6 4. Grygiel-Górniak B, Puszczewicz MJ. Dieta w dnie moczanowej i hiperurykemii mity i fakty. Reumatologia 04; 5: Dalbeth N, So A. Hyperuricaemia and gout: state of the art and future perpesctives. Ann Rheum Dis 00; 69: Rody E, Choi H. Epidemiology of gout. Rheum Dis Clin North Am 04; 40: Zimmermann-Górska I. Dna moczowa i hiperurikemia. Lekarz Rodzinny 05; : Alper AB, Chen W, Yan L et al. Childhood uric acid predicts adult blood pressure: the Bogalusa Heart Study. Hypertension 005; 45: Kim SY, Guevara JP, Kim KM et al. Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res 00; 6: Kim SY, Guevara JP, Kim KM et al. Hyperuricemia and risk of stroke: a systematic review and meta-analysis. Arthritis Rheum 009; 6: European Society of Hypertension European Society of Cardiology. 003 European Society of Hypertension European Society of Cardiology guidelines for the management of arterial hypertension. Guidelines committee. J. Hypertens. 003; : Schlesinger N et al. Serum urate during acute gout. J Rheumatol 009; 36: Sivera F, Andrés M, Carmona L et al. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann Rheum Dis 04; 73: Smolen JS, Aletaha D, Bijlsma JWJ et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 00; 69: Perez-Ruiz F et al. Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum 00; 47: Hershfield MS. Reassessing serum urate targets in the management of refractory gout: Can you go too low? Curr Opin Rheumatol 009; : Raciborski F, Maślińska M, Kłak A, Filipiak KJ, Szymański FM, Szczypior A. Występowanie i leczenie dny moczanowej w Polsce analiza, wskazania i rekomendacje. Instytut Ochrony Zdrowia, Warszawa 05 (ISBN ). Milurit (Allopurinolum). Skład i postać: Tabletki, jedna tabletka zawiera odpowiednio 00 mg lub 300 mg allopurynolu. Wskazania: Stosowanie w celu zmniejszenia wytwarzania moczanów/kwasu moczowego w chorobach, w których ich odkładanie już nastąpiło (np. dnawe zapalenie stawów, guzki dnawe, kamica nerkowa) lub w stanach klinicznych, w których istnieje takie ryzyko np. leczenie nowotworów potencjalnie prowadzące do ostrej nefropatii moczanowej). Główne stany kliniczne, w których może nastąpić odkładanie moczanów/kwasu moczowego to: Dna moczanowa, kamica moczanowa, choroby nowotworowe i zespoły mieloproliferacyjne z szybkim obrotem komórkowym, w których zwiększone stężenie moczanów występuje samoistnie lub jest wywołane leczeniem cytotoksycznym. Zaburzenia czynności niektórych enzymów prowadzące do nadprodukcji moczanów, np.: fosforybozylotransferazy hipoksantynowo-guaninowej (np. zespół Lescha-Nyhana); glukozo-6-fosfatazy (np. choroba spichrzeniowa glikogenu); syntetazy fosforybozylopirofosforanowej; amidotransferazy fosforybozylopirofosforanowej; fosforybozylotransferazy adeninowej. Allopurynol wskazany jest w leczeniu kamicy nerkowej z,8-dihydroksyadeninowymi (,8-DHA) kamieniami nerkowymi, powstałymi w wyniku zmniejszonej aktywności fosforybozylotransferazy adeninowej. Allopurynol wskazany jest w leczeniu nawracającej kamicy nerkowej, z kamieniami nerkowymi o mieszanym składzie wapniowo-szczawianowym, z towarzyszącą hiperurykozurią w przypadku gdy próby leczenia dietą, płynami i innymi sposobami okazały się nieskuteczne. Dawkowanie i sposób podania: Produkt leczniczy Milurit należy stosować doustnie raz na dobę, po posiłku. Produkt leczniczy Milurit jest dobrze tolerowany przez pacjentów, zwłaszcza jeśli przyjmowany jest po posiłkach. Jeśli dobowa dawka produktu leczniczego jest większa niż 300 mg i wystąpią objawy nietolerancji ze strony przewodu pokarmowego, lek można podawać w dawkach podzielonych. Dorośli: Podawanie allopurynolu należy rozpocząć od stosowania małej dawki leku, np. 00 mg na dobę, aby zmniejszyć ryzyko wystąpienia działań niepożądanych. Początkową dawkę należy zwiększać tylko wtedy, gdy wpływ stosowanej dawki na stężenie moczanów w surowicy nie jest zadowalający. Szczególnie ostrożnie należy postępować w przypadku pacjentów z niewydolnością nerek (patrz w punkcie: Dawkowanie u pacjentów z zaburzeniami czynności nerek). Zaleca się następujące schematy dawkowania: 00 do 00 mg na dobę w stanach lekkich; 300 do 600 mg na dobę w stanach umiarkowanie ciężkich; 700 do 900 mg na dobę w stanach ciężkich. Jeśli konieczne jest obliczenie dawki na kilogram masy ciała, należy stosować następujący zakres dawek: do 0 mg/kg masy ciała na dobę. Dzieci i młodzież (dzieci poniżej 5 lat): Zalecana dawka to 0 do 0 mg/kg masy ciała na dobę, do maksymalnej dawki 400 mg na dobę. Stosowanie produktu leczniczego u dzieci jest rzadko wskazane, z wyjątkiem chorób nowotworowych (szczególnie białaczki) i niektórych zaburzeń enzymatycznych, takich jak zespół Lescha-Nyhana. Dawkowanie u pacjentów w podeszłym wieku: Ze względu na brak specyficznych danych, należy stosować najmniejszą dawkę, która zapewnia zadowalającą redukcję moczanów. Szczególną uwagę należy zwrócić na zalecenia w zaburzonej czynności nerek i w niektórych przypadkach wymienionych w punkcie Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania. Dawkowanie u pacjentów z zaburzeniami czynności nerek: Allopurynol i jego metabolity wydalane są przez nerki, dlatego też zaburzenia czynności nerek mogą prowadzić do retencji leku i (lub) jego metabolitów, a w konsekwencji do przedłużenia ich okresów półtrwania w osoczu. W przypadku ciężkiej niewydolności nerek wskazane może być stosowanie dawki mniejszej niż 00 mg na dobę lub też podawanie dawki 00 mg w odstępach dłuższych niż 4 godziny. Jeśli możliwe jest monitorowanie stężenia oksypurynolu w osoczu, to dawkowanie allopurynolu należy ustalić tak, aby stężenie oksypurynolu było mniejsze niż 00 mmol/l (5, mg/l). Allopurynol i jego metabolity są usuwane z organizmu podczas dializy nerkowej. Jeśli pacjent wymaga dializy dwa lub trzy razy w tygodniu, należy rozważyć następujący, alternatywny schemat dawkowania: podawanie mg produktu leczniczego Milurit tuż po każdej dializie, bez podawania kolejnych dawek do czasu następnego zabiegu. U pacjentów z zaburzoną czynnością nerek jednoczesne podawanie allopurynolu i tiazydowych leków moczopędnych wymaga szczególnej ostrożności. Allopurynol należy poddawać w najmniejszej skutecznej dawce, starannie monitorując czynność nerek (patrz punkt 4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji). Dawkowanie u pacjentów z zaburzeniami czynności wątroby: U pacjentów z zaburzeniami czynności wątroby należy zmniejszyć dawki produktu leczniczego. Zaleca się okresowe wykonywanie testów czynnościowych wątroby we wstępnym okresie leczenia. Dawkowanie w leczeniu chorób z intensywnym obrotem moczanowym, np. w chorobach nowotworowych, w zespole Lescha-Nyhana. Zaleca się zastosowanie produktu leczniczego Milurit przed rozpoczęciem leczenia cytotoksycznego w celu wyrównania hiperurykemii i (lub) hiperurykozurii. Istotne jest zapewnienie właściwego nawodnienia pacjenta w celu utrzymania optymalnej diurezy oraz alkalizacja moczu w celu zwiększenia rozpuszczalności moczanów/ kwasu moczowego. Produkt leczniczy Milurit należy stosować w dawkach mieszczących się w dolnych granicach zalecanego zakresu dawkowania. W przypadku pacjentów z nefropatią moczanową lub inną patologią zaburzającą czynność nerek, należy przestrzegać zaleceń podanych w punkcie: Dawkowanie u pacjentów z zaburzeniami czynności nerek. Powyższe zalecenia mają na celu zmniejszenie ryzyka odkładania złogów ksantyny oraz (lub) oksypurynolu, co mogłoby niekorzystnie wpłynąć na stan kliniczny pacjenta. Monitorowanie pacjentów: We właściwych odstępach czasu należy oznaczać stężenie moczanów w surowicy i w moczu oraz kwasu moczowego w moczu, w celu dostosowania dawki produktu leczniczego. Przeciwwskazania: Nadwrażliwość na allopurynol lub na którąkolwiek substancję pomocniczą. Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania: Podczas stosowania leku Milurit opisywano zagrażające życiu reakcje skórne, jak zespół Stevensa-Johnsona (Stevens-Johnson syndrome; SJS) i toksyczne martwicze oddzielanie się naskórka (toxic epidermal necrolysis; TEN). Pacjentów należy pouczyć na temat podmiotowych i przedmiotowych objawów i starannie monitorować pod kątem reakcji skórnych. Największe ryzyko występowania SJS i TEN istnieje w ciągu pierwszych kilku tygodni leczenia. Jeśli pojawią się objawy SJS lub TEN (np. postępująca wysypka skórna, często z obecnością pęcherzy i zmian na błonach śluzowych), leczenie lekiem Milurit należy przerwać. Najlepsze wyniki leczenia SJS i TEN uzyskuje się po wczesnym rozpoznaniu i natychmiastowym odstawieniu podejrzewanego produktu leczniczego. Wczesne odstawienie leku wiąże się z lepszym rokowaniem. Jeśli u pacjenta doszło do SJS lub TEN podczas stosowania leku Milurit, nigdy więcej nie wolno u tego pacjenta ponownie włączać leku Milurit. Zespół nadwrażliwości, zespół Stevensa-Johnsona (SJS) i toksyczne martwicze oddzielanie się naskórka (TEN): Reakcje nadwrażliwości na allopurynol mogą przejawiać się w różnoraki sposób, w tym jako rumień grudkowo-plamkowy, zespół nadwrażliwości (znany także jako DRESS) oraz SJS/TEN. Reakcje te są rozpoznaniami klinicznymi, a ich postacie kliniczne stanowią podstawę do podejmowania decyzji. W razie wystąpienia takich reakcji w każdym momencie trwania leczenia należy natychmiast przerwać stosowanie allopurynolu. Nie należy ponownie narażać na kontakt z lekiem pacjentów z zespołem nadwrażliwości oraz SJS/TEN. Stosowanie glikokortykosteroidów może mieć korzystny wpływ na łagodzenie skórnych reakcji nadwrażliwości. Przewlekła niewydolność nerek: Pacjenci z przewlekłą niewydolnością nerek mogą być zagrożeni zwiększonym ryzykiem rozwoju reakcji nadwrażliwości, w tym SJS/TEN związanych z allopurynolem. Konieczna jest wzmożona czujność w wykrywaniu objawów zespołu nadwrażliwości lub SJS/TEN a pacjentów należy poinformować, aby w razie pojawienia się pierwszych objawów natychmiast definitywnie przerwali leczenie. Allel HLA-B*580: Wykazano związek obecności allelu HLA-B*580 z ryzykiem rozwoju zespołu nadwrażliwości oraz SJS/TEN związanych z allopurynolem. Częstość występowania allelu HLA-B*580 jest bardzo różna między populacjami etnicznymi: wynosi do 0% w populacji chińskiej należącej do grupy etnicznej Han, około % w populacji koreańskiej oraz -% u osób pochodzenia europejskiego oraz japońskiego. Nie ustalono stosowania genotypowania jako metody przesiewowej przy podejmowaniu decyzji o leczeniu allopurynolem. Jeśli wiadomo, że pacjent jest nosicielem HLA-B*580, stosowanie allopurynolu może być brane pod uwagę, jeśli korzyści przewyższają zagrożenia. Wymagane jest wzmożone nadzorowanie objawów zespołu nadwrażliwości oraz SJS/TEN, zaś pacjent powinien zostać poinformowany o konieczności natychmiastowego zaprzestania leczenia po wystąpieniu pierwszych objawów. Zaburzenia czynności wątroby i nerek: U pacjentów z zaburzeniami czynności nerek lub wątroby należy stosować mniejsze dawki produktu leczniczego. U pacjentów z nadciśnieniem tętniczym lub niewydolnością serca, leczonych np. diuretykami czy inhibitorami konwertazy angiotensyny, mogą wystąpić jednocześnie zaburzenia czynności nerek. Dlatego należy zachować ostrożność stosując produkt leczniczy Milurit w tej grupie pacjentów. Ogólnie uważa się, że bezobjawowa hiperurykemia nie jest wskazaniem do stosowania produktu leczniczego Milurit i może być wyrównana przez podawanie płynów, zastosowanie odpowiedniej diety oraz leczenie jej przyczyny. Stosowanie w ostrym napadzie dny: Nie należy rozpoczynać leczenia allopurynolem podczas ostrego napadu dny. Rozpoczęcie stosowania allopurynolu przed całkowitym ustąpieniem ostrego napadu dny może wywołać kolejne napady. W początkowym okresie leczenia produktem leczniczym Milurit, podobnie jak w przypadku środków urykozurycznych, może wystąpić ostre dnawe zapalenie stawów. Dlatego też zaleca się profilaktyczne stosowanie odpowiedniego leku przeciwzapalnego lub kolchicyny przez kilka miesięcy. Należy zasięgnąć odpowiednich informacji z literatury fachowej, dotyczących szczegółowych zaleceń dawkowania i środków ostrożności. Jeśli u pacjenta przyjmującego allopurynol wystąpi ostry napad dny, należy kontynuować leczenie allopurynolem nie zmieniając dawki leku i jednocześnie podawać odpowiedni lek przeciwzapalny. Odkładanie się złogów ksantynowych: W stanach, w których występuje znaczne zwiększenie wytwarzania moczanów (np. w chorobach nowotworowych i podczas ich leczenia, w zespole Lescha-Nyhana) całkowite stężenie ksantyny w moczu może, w rzadkich przypadkach, zwiększyć się na tyle, by spowodować odkładanie się złogów ksantynowych w drogach moczowych. Ryzyko to można zminimalizować zapewniając właściwe nawodnienie pacjenta w celu uzyskania optymalnego rozcieńczenia moczu. Zaklinowanie moczanowych kamieni nerkowych: Ponieważ prawidłowe leczenie produktem leczniczym Milurit doprowadza do rozpuszczenia dużych kamieni moczanowych znajdujących się w miedniczkach nerkowych, istnieje niewielka możliwość ich zaklinowania się w moczowodzie. Hemochromatoza: Główne działanie allopurynolu w leczeniu dny polega na hamowaniu enzymu oksydazy ksantynowej. Oksydaza ksantynowa może uczestniczyć w redukcji i usuwaniu zmagazynowanego w wątrobie żelaza. Niektóre badania na gryzoniach wykazały zwiększone magazynowanie żelaza u zwierząt leczonych allopurynolem, choć są badania, które tego nie potwierdzają. Badanie obejmujące 8 zdrowych ochotników nie wykazało zmian w wątrobowym magazynowaniu żelaza podczas leczenia allopurynolem. Nie ma badań oceniających bezpieczeństwo stosowania allopurynolu u pacjentów z hemochromatozą. Podawanie allopurynolu chorym lub ich bliskim krewnym powinno odbywać się z dużą ostrożnością. Każda tabletka leku Milurit 00 mg zawiera 50 mg laktozy. Pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy nie powinni przyjmować tego leku. Działania niepożądane: Brak współczesnej dokumentacji klinicznej tego produktu leczniczego, która mogłaby być wykorzystana dla oceny częstości występowania działań niepożądanych. Częstość działań niepożądanych może być różna w zależności od stosowanej dawki oraz w przypadku leczenia skojarzonego z innymi lekami. Częstości występowania przypisane do wymienionych poniżej działań niepożądanych zostały określone w przybliżeniu, dla większości z tych działań nie są dostępne odpowiednie dane pozwalające określić częstość występowania. Działania niepożądane stwierdzone po wprowadzeniu leku do obrotu określono jako występujące rzadko lub bardzo rzadko. Kategorie częstości występowania określono w następujący sposób: Poniższe działania niepożądane zostały podzielone na następujące kategorie: Bardzo często /0; Często /00 do </0; Niezbyt często / 000 do </00; Rzadko /0 000 do </ 000; Bardzo rzadko </0 000; Nieznane (nie można określić częstości na podstawie dostępnych danych). Działania niepożądane, związane ze stosowaniem allopurynolu, występują rzadko w populacji leczonych pacjentów i w większości przypadków mają niewielkie nasilenie. Częstość występowania działań niepożądanych zwiększa się w przypadkach współistniejącej choroby nerek i (lub) wątroby. Zakażenia i zarażenia pasożytnicze: Bardzo rzadko: Czyraczność. Zaburzenia krwi i układu chłonnego: Bardzo rzadko: agranulocytoza, niedokrwistość aplastyczna, trombocytopenia, leukopenia, leukocytoza, eozynofilia i wybiórcza aplazja czerwonokrwinkowa; Bardzo rzadko zgłaszano przypadki wystąpienia małopłytkowości, agranulocytozy i niedokrwistości aplastycznej, szczególnie u pacjentów z zaburzeniami czynności nerek i (lub) wątroby, co potwierdza konieczność zachowania szczególnej ostrożności u tych pacjentów. Zaburzenia układu immunologicznego: Niezbyt często: reakcje nadwrażliwości. Ciężkie reakcje nadwrażliwości, w tym reakcje skórne ze złuszczaniem naskórka, gorączką, powiększeniem węzłów chłonnych, bólami stawów i (lub) eozynofilią, w tym zespół Stevensa-Johnsona i toksyczna nekroliza naskórka, występują rzadko. Związane z tym zapalenie naczyń i odczyny tkankowe mogą przejawiać się w różnoraki sposób, w tym zapaleniem wątroby, zaburzeniami czynności nerek i bardzo rzadko drgawkami. Bardzo rzadko opisywano wstrząs anafilaktyczny. Tego rodzaju objawy mogą wystąpić w każdym momencie leczenia. Jeżeli wystąpią, produkt leczniczy Milurit należy odstawić natychmiast i na stałe. Opóźniona reakcja nadwrażliwości wielonarządowej (znana jako zespół nadwrażliwości lub DRESS) z gorączką, wysypkami skórnymi, zapaleniem naczyń krwionośnych, uogólnionym powiększeniem węzłów chłonnych (limfadenopatia), chłoniakiem rzekomym, bólami stawów, leukopenią, eozynofilią, powiększeniem wątroby i śledziony, nieprawidłowymi wynikami badań czynności wątroby oraz zespołem zaniku dróg żółciowych (zniszczenie i zanik wewnątrzwątrobowych dróg żółciowych) występującymi w różnych kombinacjach. Zmiany mogą dotyczyć także innych narządów (np. wątroby, płuc, nerek, trzustki, mięśnia sercowego i jelita grubego). W razie wystąpienia takich reakcji, co może nastąpić w każdym momencie trwania leczenia, należy natychmiast i na stałe przerwać stosowanie leku Milurit. W momencie wystąpienia uogólnionych reakcji nadwrażliwości zazwyczaj występują zaburzenia czynności wątroby i (lub) nerek, zwłaszcza w przypadkach kończących się zgonem; Bardzo rzadko: limfadenopatia angioimmunoblastyczna. Bardzo rzadko opisywano przypadki limfadenopatii angioimmunoblastycznej po dokonaniu biopsji z powodu uogólnionego powiększenia węzłów chłonnych. Zmiany z reguły przemijają po odstawieniu produktu leczniczego Milurit. Zaburzenia metabolizmu i odżywiania: Bardzo rzadko: cukrzyca, hiperlipidemia. Zaburzenia psychiczne: Bardzo rzadko: depresja. Zaburzenia układu nerwowego: Bardzo rzadko: śpiączka, porażenia, ataksja, neuropatia, parestezje, senność, bóle głowy, zaburzenia smaku. Zaburzenia oka: Bardzo rzadko: zaćma, zaburzenia widzenia, zmiany w obszarze plamki żółtej. Zaburzenia ucha i błędnika: Bardzo rzadko: zawroty głowy. Zaburzenia serca: Bardzo rzadko: dławica piersiowa, bradykardia. Zaburzenia naczyniowe: Bardzo rzadko: nadciśnienie tętnicze. Zaburzenia żołądka i jelit: Niezbyt często: wymioty, nudności, biegunka; Bardzo rzadko: nawracające krwawe wymioty, biegunki tłuszczowe, zapalenie błony śluzowej jamy ustnej, zmiana częstości wypróżnień; Częstość nieznana: bóle brzucha. We wczesnych badaniach klinicznych odnotowywano występowanie nudności i wymiotów. Późniejsze doniesienia wskazują, że objawy te nie stanowią poważnego problemu i można im zapobiec przyjmując produkt leczniczy Milurit po posiłkach. Zaburzenia wątroby i dróg żółciowych: Niezbyt często: bezobjawowe zwiększenie aktywności enzymów wątrobowych (zwiększona aktywność fosfatazy zasadowej i amninotransferaz w surowicy); Rzadko: zapalenie wątroby (w tym martwica i ziarniniakowe zapalenie wątroby). Opisywano zaburzenia czynności wątroby bez wyraźnych innych objawów uogólnionej nadwrażliwości. Zaburzenia skóry i tkanki podskórnej: Często: wysypka; Rzadko: zgłaszano występowanie ciężkich skórnych reakcji niepożądanych (SCARs): zespołu Stevensa-Johnsona (SJS) i toksycznego martwiczego oddzielania się naskórka (TEN); Bardzo rzadko: obrzęk naczynioruchowy, rumień trwały, łysienie, odbarwienie włosów. Reakcje skórne są najczęściej występującymi działaniami niepożądanymi i mogą wystąpić w każdym momencie leczenia. Mogą to być zmiany powodujące świąd, grudkowo-plamiste, niekiedy łuskowate, czasem plamicze i rzadko złuszczające takie jak zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka (SJS/TEN). W przypadku wystąpienia takich zmian, produkt leczniczy Milurit należy natychmiast odstawić. W przypadku wystąpienia zmian o niewielkim nasileniu, po ich ustąpieniu można, jeżeli jest to konieczne, ponownie podać produkt leczniczy Milurit, stosując początkowo małą dawkę (np. 50 mg na dobę) i stopniowo ją zwiększać. Jeżeli zmiany skórne wystąpią ponownie, produkt leczniczy Milurit należy odstawić na stałe, ponieważ mogą wystąpić ciężkie reakcje nadwrażliwości. Zgłaszano występowanie obrzęku naczynioruchowego z objawami bardziej uogólnionej reakcji nadwrażliwości, jak i bez takich objawów. Zaburzenia mięśniowoszkieletowe i tkanki łącznej: Bardzo rzadko: bóle mięśniowe. Zaburzenia nerek i dróg moczowych: Bardzo rzadko: krwiomocz, mocznica; Częstość nieznana: kamica nerkowa. Zaburzenia układu rozrodczego i piersi: Bardzo rzadko: niepłodność u mężczyzn, zaburzenia erekcji, ginekomastia. Zaburzenia ogólne i stany w miejscu podania: Bardzo rzadko: obrzęki, ogólne złe samopoczucie, osłabienie, gorączka. Zgłaszano występowanie gorączki z objawami bardziej uogólnionej reakcji nadwrażliwości, jak i bez takich objawów. Zgłaszanie podejrzewanych działań niepożądanych: Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, ul. Al. Jerozolimskie 8C, 0- Warszawa, tel.: , faks: ; ndl@urpl.gov.pl. Pozwolenie na dopuszczenie do obrotu: Milurit 00 mg i Milurit 300 mg odpowiednio nr R/63 i 448 wydane przez MZ. Kategoria dostępności leku: Rp. Cena urzędowa detaliczna: Milurit 00 mg x 50 tabl. i Milurit 300 mg x 30 tabl. wynosi odpowiednio: 8,53 zł i 5,0 zł. Wysokość dopłaty dla pacjenta wynosi odpowiednio: 3,0 zł i 3,0 zł. Podmiot odpowiedzialny: Proterapia Sp. z o.o., Polska. Dodatkowych informacji o leku udziela: EGIS Polska Sp. z o.o., ul. 7 Stycznia 45D, 0-46 Warszawa, tel.: , faks: [07.05] 8
7 Obniżam poziom kwasu moczowego i zrywam z dną MIL/LINIAM/REP/6/0/00
Dna moczanowa. choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? Punkt widzenia reumatologa
 Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? Punkt widzenia reumatologa dr n. med. Maria Rell-Bakalarska, dr n. med. Robert Rupiński dr n. med. Maria Rell-Bakalarska, dr n. med.
Dna moczanowa choroba cywilizacyjna? Tak, ale czy można ją wyleczyć? Punkt widzenia reumatologa dr n. med. Maria Rell-Bakalarska, dr n. med. Robert Rupiński dr n. med. Maria Rell-Bakalarska, dr n. med.
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zyloric 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 300 mg allopurynolu (Allopurinolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zyloric 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 300 mg allopurynolu (Allopurinolum). Pełny wykaz substancji
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej wiadomości.
 VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
VI.2 Plan Zarządzania Ryzykiem dla produktów kwalifikowanych jako "Well established use" zawierających Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Dobenox przeznaczone do publicznej
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
Ulotka dołączona do opakowania: informacja dla pacjenta Zyloric 100 mg, tabletki Zyloric 300 mg, tabletki Allopurinolum
 Ulotka dołączona do opakowania: informacja dla pacjenta Zyloric 100 mg, tabletki Zyloric 300 mg, tabletki Allopurinolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta Zyloric 100 mg, tabletki Zyloric 300 mg, tabletki Allopurinolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Dieta może być stosowana również przez osoby chorujące na nadciśnienie tętnicze, zmagające się z hiperlipidemią, nadwagą oraz otyłością.
 Dieta może być stosowana również przez osoby chorujące na nadciśnienie tętnicze, zmagające się z hiperlipidemią, nadwagą oraz otyłością. Jadłospis 14-dniowy Anna Piekarczyk Dieta nie jest dietą indywidualną
Dieta może być stosowana również przez osoby chorujące na nadciśnienie tętnicze, zmagające się z hiperlipidemią, nadwagą oraz otyłością. Jadłospis 14-dniowy Anna Piekarczyk Dieta nie jest dietą indywidualną
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
SKRÓCONA INFORMACJA O LEKU
 Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Aneks III. Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta.
 Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
Aneks III Zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego i ulotce dla pacjenta. Uwaga: Niniejsze zmiany w odpowiednich punktach skróconej charakterystyki produktu leczniczego
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
Aneks III. Zmiany w odnośnych punktach druków informacyjnych do produktów
 Aneks III Zmiany w odnośnych punktach druków informacyjnych do produktów Uwaga: Zmiany wprowadzone w odnośnych punktach druków informacyjnych do produktów są efektem przeprowadzenia procedury przekazania
Aneks III Zmiany w odnośnych punktach druków informacyjnych do produktów Uwaga: Zmiany wprowadzone w odnośnych punktach druków informacyjnych do produktów są efektem przeprowadzenia procedury przekazania
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Cewkowo-śródmiąższowe zapalenie nerek
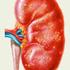 Cewkowo-śródmiąższowe zapalenie nerek Krzysztof Letachowicz Katedra i Klinika Nefrologii i Medycyny Transplantacyjnej, Uniwersytet Medyczny we Wrocławiu Kierownik: Prof. dr hab. Marian Klinger Cewkowo-śródmiąższowe
Cewkowo-śródmiąższowe zapalenie nerek Krzysztof Letachowicz Katedra i Klinika Nefrologii i Medycyny Transplantacyjnej, Uniwersytet Medyczny we Wrocławiu Kierownik: Prof. dr hab. Marian Klinger Cewkowo-śródmiąższowe
Ulotka dołączona do opakowania: informacja dla użytkownika Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki Allopurinolum
 Ulotka dołączona do opakowania: informacja dla użytkownika Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki Allopurinolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki Allopurinolum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Czy mogą być niebezpieczne?
 Diety wysokobiałkowe w odchudzaniu Czy mogą być niebezpieczne? Lucyna Kozłowska Katedra Dietetyki SGGW Diety wysokobiałkowe a ryzyko zgonu Badane osoby: Szwecja, 49 261 kobiet w wieku 30 49 lat (1992 i
Diety wysokobiałkowe w odchudzaniu Czy mogą być niebezpieczne? Lucyna Kozłowska Katedra Dietetyki SGGW Diety wysokobiałkowe a ryzyko zgonu Badane osoby: Szwecja, 49 261 kobiet w wieku 30 49 lat (1992 i
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Rodzinna gorączka śródziemnomorska
 www.printo.it/pediatric-rheumatology/pl/intro Rodzinna gorączka śródziemnomorska Wersja 2016 2. DIAGNOZA I LECZENIE 2.1 Jak diagnozuje się tę chorobę? Zasadniczo stosuje się następujące podejście: Podejrzenie
www.printo.it/pediatric-rheumatology/pl/intro Rodzinna gorączka śródziemnomorska Wersja 2016 2. DIAGNOZA I LECZENIE 2.1 Jak diagnozuje się tę chorobę? Zasadniczo stosuje się następujące podejście: Podejrzenie
Jedna tabletka zawiera 100 mg allopurynolu (Allopurinolum). Substancja pomocnicza o znanym działaniu: laktoza jednowodna 68,1 mg.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALLUPOL, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg allopurynolu (Allopurinolum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALLUPOL, 100 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg allopurynolu (Allopurinolum). Substancja pomocnicza
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 25 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 25 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Allopurinol Medreg, 100 mg, tabletki Allopurinol Medreg, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Tabletka 100 mg: Jedna tabletka
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Allopurinol Medreg, 100 mg, tabletki Allopurinol Medreg, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Tabletka 100 mg: Jedna tabletka
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL, 5 mg, tabletki. Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL, 5 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL, 5 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby móc
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Ulotka dołączona do opakowania: informacja dla pacjenta. Neosine forte, 1000 mg, tabletki Inosinum pranobexum
 Ulotka dołączona do opakowania: informacja dla pacjenta Neosine forte, 1000 mg, tabletki Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Neosine forte, 1000 mg, tabletki Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300 mg allopurynolu (Allopurinolum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
ETYKIETO-ULOTKA OZNAKOWANIE OPAKOWANIA BEZPOŚREDNIEGO PRODUKTU LECZNICZEGO
 ETYKIETO-ULOTKA OZNAKOWANIE OPAKOWANIA BEZPOŚREDNIEGO PRODUKTU LECZNICZEGO RUTINOSAL C Salicis cortex + Rutosidum + Vitaminum C tabletka, 300 mg + 20 mg + 40 mg Skład tabletki: kora wierzby - 300 mg rutozyd
ETYKIETO-ULOTKA OZNAKOWANIE OPAKOWANIA BEZPOŚREDNIEGO PRODUKTU LECZNICZEGO RUTINOSAL C Salicis cortex + Rutosidum + Vitaminum C tabletka, 300 mg + 20 mg + 40 mg Skład tabletki: kora wierzby - 300 mg rutozyd
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej
 6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
Symago (agomelatyna)
 Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Przedstawiona ulotka nie zastępuje informacji zawartej w Charakterystyce Produktu Leczniczego Leflunomide Sandoz.
 Aneks 8: Ulotka dla lekarza Informacja dotycząca bezpieczeństwa Leflunomide Sandoz 20 mg, tabletki powlekane leflunomid Leflunomide Sandoz, jako lek przeciwreumatyczny modyfikujący przebieg choroby (ang.
Aneks 8: Ulotka dla lekarza Informacja dotycząca bezpieczeństwa Leflunomide Sandoz 20 mg, tabletki powlekane leflunomid Leflunomide Sandoz, jako lek przeciwreumatyczny modyfikujący przebieg choroby (ang.
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
 Skrócona informacja o leku Vigantoletten 500 i Vigantoletten 1000 Skład i postać farmaceutyczna: Vigantoletten 500, tabletki 1 tabletka zawiera 12,5 mikrogramów cholekalcyferolu równoważnego 500 j.m. witaminy
Skrócona informacja o leku Vigantoletten 500 i Vigantoletten 1000 Skład i postać farmaceutyczna: Vigantoletten 500, tabletki 1 tabletka zawiera 12,5 mikrogramów cholekalcyferolu równoważnego 500 j.m. witaminy
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
ANEKS III ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA
 ANEKS III ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
ANEKS III ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
ANEKS III POPRAWKA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA
 ANEKS III POPRAWKA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA 1 POPRAWKI DO WSTAWIENIA W ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ZAWIERAJĄCEGO MOKSYFLOKSACYNĘ poprawki
ANEKS III POPRAWKA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA 1 POPRAWKI DO WSTAWIENIA W ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ZAWIERAJĄCEGO MOKSYFLOKSACYNĘ poprawki
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum)
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Glimbax, 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła (Diclofenacum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona ważne informacje
FARMAKOTERAPIA NADCIŚNIENIA TĘTNICZEGO. Prof. dr hab. Jan J. Braszko Zakład Farmakologii Klinicznej UMB
 FARMAKOTERAPIA NADCIŚNIENIA TĘTNICZEGO Prof. dr hab. Jan J. Braszko Zakład Farmakologii Klinicznej UMB Oparte na dowodach zalecenia w leczeniu nadciśnienia tętniczego wg. Joint National Committee (JNC
FARMAKOTERAPIA NADCIŚNIENIA TĘTNICZEGO Prof. dr hab. Jan J. Braszko Zakład Farmakologii Klinicznej UMB Oparte na dowodach zalecenia w leczeniu nadciśnienia tętniczego wg. Joint National Committee (JNC
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel
 VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
VOLTAREN MAX Diklofenak dietyloamoniowy 23,2 mg/g Żel Wskazania do stosowania Voltaren MAX jest wskazany do stosowania u dorosłych i młodzieży w wieku powyżej 14 lat. Produkt działa przeciwbólowo, przeciwzapalnie
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości
 VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
VI.2 Podsumowanie planu zarządzania ryzykiem dla produktu Zanacodar Combi przeznaczone do publicznej wiadomości VI.2.1 Omówienie rozpowszechnienia choroby Szacuje się, że wysokie ciśnienie krwi jest przyczyną
Wpisany przez Lekarz Dyżurny poniedziałek, 02 stycznia :53 - Poprawiony piątek, 01 czerwca :14
 {ramka}co to jest dna moczanowa?{/ramka} Dna moczanowa, inaczej zwana podagra, artretyzm, skaza moczanowa jest przewlekłym schorzeniem reum atycznym, która zazwyczaj atakuje w jednym miejscu na raz. Choroba
{ramka}co to jest dna moczanowa?{/ramka} Dna moczanowa, inaczej zwana podagra, artretyzm, skaza moczanowa jest przewlekłym schorzeniem reum atycznym, która zazwyczaj atakuje w jednym miejscu na raz. Choroba
Częstotliwość występowania tej choroby to 1: żywych urodzeń w Polsce ok. 5-6 przypadków rocznie.
 GALAKTOZEMIA Częstotliwość występowania tej choroby to 1:60 000 żywych urodzeń w Polsce ok. 5-6 przypadków rocznie. galaktoza - cukier prosty (razem z glukozą i fruktozą wchłaniany w przewodzie pokarmowym),
GALAKTOZEMIA Częstotliwość występowania tej choroby to 1:60 000 żywych urodzeń w Polsce ok. 5-6 przypadków rocznie. galaktoza - cukier prosty (razem z glukozą i fruktozą wchłaniany w przewodzie pokarmowym),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
INFORMACJA O LEKU 1. NAZWA PRODUKTU LECZNICZEGO Donepex, 10 mg, tabletki powlekane
 INFORMACJA O LEKU 1. NAZWA PRODUKTU LECZNICZEGO Donepex, 5 mg, tabletki powlekane Donepex, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Donepezili hydrochloridum Każda tabletka powlekana 5
INFORMACJA O LEKU 1. NAZWA PRODUKTU LECZNICZEGO Donepex, 5 mg, tabletki powlekane Donepex, 10 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Donepezili hydrochloridum Każda tabletka powlekana 5
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N
 Załącznik nr 42 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N 25.8 Inne zaburzenia
Załącznik nr 42 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE WTÓRNEJ NADCZYNNOŚCI PRZYTARCZYC U PACJENTÓW HEMODIALIZOWANYCH ICD-10 N 25.8 Inne zaburzenia
UNIWERSYTET MEDYCZNY W LUBLINIE KATEDRA I KLINIKA REUMATOLOGII I UKŁADOWYCH CHORÓB TKANKI ŁĄCZNEJ PRACA DOKTORSKA.
 UNIWERSYTET MEDYCZNY W LUBLINIE KATEDRA I KLINIKA REUMATOLOGII I UKŁADOWYCH CHORÓB TKANKI ŁĄCZNEJ PRACA DOKTORSKA Małgorzata Biskup Czynniki ryzyka sercowo-naczyniowego u chorych na reumatoidalne zapalenie
UNIWERSYTET MEDYCZNY W LUBLINIE KATEDRA I KLINIKA REUMATOLOGII I UKŁADOWYCH CHORÓB TKANKI ŁĄCZNEJ PRACA DOKTORSKA Małgorzata Biskup Czynniki ryzyka sercowo-naczyniowego u chorych na reumatoidalne zapalenie
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. FILOMAG B 6 40 mg jonów magnezu + 5 mg, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA FILOMAG B 6 40 mg jonów magnezu + 5 mg, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA FILOMAG B 6 40 mg jonów magnezu + 5 mg, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. ALLUPOL, 100 mg, tabletki ALLUPOL, 300 mg, tabletki
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALLUPOL, 100 mg, tabletki ALLUPOL, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg allopurynolu (Allopurinolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ALLUPOL, 100 mg, tabletki ALLUPOL, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 100 mg allopurynolu (Allopurinolum).
Ulotka dołączona do opakowania: informacja dla pacjenta. Neosine forte, 500 mg/5 ml, syrop Inosinum pranobexum
 Ulotka dołączona do opakowania: informacja dla pacjenta Neosine forte, 500 mg/5 ml, syrop Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Neosine forte, 500 mg/5 ml, syrop Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO FORTRANS, 74 g, proszek do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Makrogol 4000 * Sodu siarczan bezwodny. Sodu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta VICEBROL FORTE 10 mg, tabletki
 Ulotka dołączona do opakowania: informacja dla pacjenta VICEBROL FORTE 10 mg, tabletki Vinpocetinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta VICEBROL FORTE 10 mg, tabletki Vinpocetinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CIBA-GEIGY Sintrom 4
 CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0)
 Dziennik Urzędowy Ministra Zdrowia 719 Poz. 27 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem
Dziennik Urzędowy Ministra Zdrowia 719 Poz. 27 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
NADCIŚNIENIE ZESPÓŁ METABOLICZNY
 NADCIŚNIENIE ZESPÓŁ METABOLICZNY Poradnik dla pacjenta i jego rodziny Konsultacja: prof. dr hab. med. Zbigniew Gaciong CO TO JEST ZESPÓŁ METABOLICZNY Nadciśnienie tętnicze (inaczej podwyższone ciśnienie
NADCIŚNIENIE ZESPÓŁ METABOLICZNY Poradnik dla pacjenta i jego rodziny Konsultacja: prof. dr hab. med. Zbigniew Gaciong CO TO JEST ZESPÓŁ METABOLICZNY Nadciśnienie tętnicze (inaczej podwyższone ciśnienie
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300 mg allopurynolu (Allopurinolum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300
Aneks I. Wnioski naukowe oraz podstawy zmian warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu.
 Aneks I Wnioski naukowe oraz podstawy zmian warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu. 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe oraz podstawy zmian warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu. 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości
 VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości VI.2.1.Omówienie rozpowszechnienia choroby 1. Ostra biegunka: Biegunka to zwiększona
VI.2. Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego LoperamideDr.Max przeznaczone do publicznej wiadomości VI.2.1.Omówienie rozpowszechnienia choroby 1. Ostra biegunka: Biegunka to zwiększona
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
 Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cinnarizinum Aflofarm, 25 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 25 mg cynaryzyny (Cinnarizinum). Substancja
Ulotka dołączona do opakowania: informacja dla pacjenta. Neosine, 500 mg, tabletki Inosinum pranobexum
 Ulotka dołączona do opakowania: informacja dla pacjenta Neosine, 500 mg, tabletki Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne
Ulotka dołączona do opakowania: informacja dla pacjenta Neosine, 500 mg, tabletki Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Milurit, 100 mg, tabletki Milurit, 300 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera odpowiednio 100 mg lub 300
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. VICEBROL FORTE; 10 mg, tabletki Vinpocetinum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA VICEBROL FORTE; 10 mg, tabletki Vinpocetinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. - Należy zachować tę ulotkę, aby w razie potrzeby
Spis treści. śelazo... 46 Wapń i witamina D... 47 Cynk... 47
 Spis treści Przedmowa... 9 1. Ustalanie zapotrzebowania energetycznego w róŝnych stanach chorobowych (Danuta Gajewska)... 11 Wiadomości ogólne... 11 Całkowita przemiana materii... 12 Wprowadzenie... 12
Spis treści Przedmowa... 9 1. Ustalanie zapotrzebowania energetycznego w róŝnych stanach chorobowych (Danuta Gajewska)... 11 Wiadomości ogólne... 11 Całkowita przemiana materii... 12 Wprowadzenie... 12
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
Ulotka dołączona do opakowania: informacja dla użytkownika. ELOPRINE FORTE, 500 mg/5 ml, syrop Inosinum pranobexum
 Ulotka dołączona do opakowania: informacja dla użytkownika ELOPRINE FORTE, 500 mg/5 ml, syrop Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika ELOPRINE FORTE, 500 mg/5 ml, syrop Inosinum pranobexum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon
 VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
VI.2 VI.2.1 Podsumowanie danych o bezpieczeństwie stosowania produktu leczniczego Demezon Omówienie rozpowszechnienia choroby Deksametazonu sodu fosforan w postaci roztworu do wstrzykiwań stosowany jest
1. Co to jest lek Sal Vichy factitium i w jakim celu się go stosuje
 Ulotka dołączona do opakowania: informacja dla pacjenta Sal Vichy factitium, 600 mg, tabletki musujące (Natrii hydrogenocarbonas + Natrii chloridum + Natrii hydrophosphas anhydricus + Natrii sulfas anhydricus
Ulotka dołączona do opakowania: informacja dla pacjenta Sal Vichy factitium, 600 mg, tabletki musujące (Natrii hydrogenocarbonas + Natrii chloridum + Natrii hydrophosphas anhydricus + Natrii sulfas anhydricus
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Rimantin, 50 mg, tabletki. Rymantadyny chlorowodorek
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Rimantin, 50 mg, tabletki Rymantadyny chlorowodorek Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Rimantin, 50 mg, tabletki Rymantadyny chlorowodorek Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Należy zachować
