Charakterystyka Produktu Leczniczego
|
|
|
- Jerzy Tomczyk
- 8 lat temu
- Przeglądów:
Transkrypt
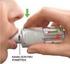
1 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE, 288,2 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 288,2 mg Natrii valproas (sodu walproinianu). Substancje pomocnicze: metylu p-hydroksybenzoesan, propylu p-hydroksybenzoesan, sacharoza, sorbitol (roztwór 70 %), glicerol. Pełny wykaz substancji pomocniczych patrz punkt POSTAĆ FARMACEUTYCZNA Syrop. 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1. Wskazania do stosowania Dorośli i dzieci: W monoterapii lub w skojarzeniu z innymi lekami przeciwpadaczkowymi: - w leczeniu napadów padaczkowych uogólnionych: napady kloniczne, toniczne, napady tonicznokloniczne, napady nieświadomości, napady miokloniczne i atoniczne; - w leczeniu napadów częściowych: napady częściowe, które są lub nie są wtórnie uogólnione Dawkowanie i sposób podawania Zwykle zalecane dawki wynoszą: - niemowlęta i dzieci: 30 mg/kg mc. na dobę, - młodzież i dorośli: 20 do 30 mg/kg mc. na dobę. Lek zaleca się podawać podczas posiłków: - u dzieci poniżej 1 roku życia w 2 dawkach podzielonych; - u pacjentów powyżej 1 roku życia w 3 dawkach podzielonych. Rozpoczynanie leczenia walproinianem sodu Leczenie walproinianem sodu u pacjentów otrzymujących inne leki przeciwpadaczkowe należy wprowadzać stopniowo, osiągając optymalną dawkę leku w ciągu 2 tygodni, a następnie stopniowo zmniejszać dawki innych leków przeciwpadaczkowych, jednocześnie kontrolując objawy choroby. U pacjentów nie przyjmujących innych leków przeciwpadaczkowych dawkę walproinianu sodu należy zwiększać co 2-3 dni w celu osiągnięcia optymalnej dawki leku w ciągu około tygodnia. Sposób podawania Lek jest podawany za pomocą strzykawki z zaznaczoną podziałką, którą umieszcza się w nasadce. Butelka pakowana jest łącznie ze strzykawką z zaznaczoną podziałką oraz nasadką.
2 Strzykawki nie należy stosować do podawania innych leków, ponieważ zaznaczona podziałka na strzykawce jest ściśle określona dla leku Depakine syrop. Postępowanie podczas pierwszego otwarcia butelki: - należy otworzyć butelkę; - umieścić końcówkę nasadki w otworze butelki i nacisnąć w celu całkowitego wprowadzenia nasadki do butelki. Nasadka powinna pozostawać w butelce przez cały czas stosowania leku. Po każdym użyciu butelkę należy zamknąć zatyczką. W celu pobrania leku do strzykawki należy wykonać następujące czynności: - umieścić strzykawkę w nasadce; - odwrócić butelkę i zablokować strzykawkę; - pociągnąć tłok w dół i nabrać do strzykawki przepisaną dawkę. Pobraną dawkę leku należy odczytać na miarce tłoku. - ponownie należy odwrócić butelkę i zablokować strzykawkę; - zdjąć strzykawkę z nasadki; - zamknąć butelkę zatyczką; - po podaniu syropu strzykawkę należy przepłukać 2 lub 3 razy wodą. Po pierwszym otwarciu butelki lek może być przechowywany przez okres 1 miesiąca Przeciwwskazania - Nadwrażliwość na walproinian sodu lub którąkolwiek substancję pomocniczą produktu leczniczego. - Ostre i przewlekłe zapalenie wątroby. - Stosowanie u pacjenta z przebytym ciężkim zapaleniem wątroby, zwłaszcza polekowym lub u pacjenta z wywiadem rodzinnym świadczącym o ciężkim zapaleniu wątroby. - Porfiria. - Jednoczesne stosowanie z meflochiną Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania W rzadkich przypadkach rozpoczęcie leczenia lekiem przeciwpadaczkowym może powodować u pacjenta zwiększenie częstości napadów padaczkowych lub wystąpienie nowego typu napadów. W przypadku walproinianu, dotyczy to głównie zmiany jednocześnie stosowanego innego leku przeciwpadaczkowego lub interakcji farmakokinetycznej (patrz punkt 4.5.), toksyczności (schorzenia wątroby lub encefalopatia - patrz punkt 4.8.) lub przedawkowania. Specjalne ostrzeżenia Zaburzenia czynności wątroby W rzadkich przypadkach zgłaszano występowanie znacznego uszkodzenia wątroby, kończącego się niekiedy zgonem. Najbardziej narażone na ryzyko wystąpienia tych zaburzeń są niemowlęta i dzieci poniżej 3 lat życia z ciężką padaczką, otrzymujące kilka leków przeciwpadaczkowych, a szczególnie z padaczką i z uszkodzeniem mózgu, z opóźnionym rozwojem psychomotorycznym i (lub) metaboliczną lub genetyczną chorobą zwyrodnieniową. U dzieci powyżej 3 lat częstość wystąpienia takich zaburzeń zmniejsza się znacząco i progresywnie do wieku. W większości przypadków zaburzenia czynności wątroby obserwowano podczas pierwszych 6 miesięcy leczenia, najczęściej między 2 a 12 tygodniem leczenia i zwłaszcza podczas stosowania kilku leków przeciwpadaczkowych. Objawy 2
3 Wczesna diagnoza jest głównie oparta na stwierdzonych objawach klinicznych. Lekarz szczególnie powinien wziąć pod uwagę dwa typy objawów, które mogą wystąpić przed żółtaczką, zwłaszcza u pacjentów w grupie ryzyka: - niespecyficzne ogólne objawy, zwykle o nagłym początku, takie jak: osłabienie, brak apetytu, senność, czasami z powtarzającymi się wymiotami i bólami brzucha; - nawrót napadów padaczkowych, chociaż leczenie jest właściwie prowadzone. Pacjent lub jego rodzina (w przypadku dziecka) powinien być poinformowany, że w razie wystąpienia takich objawów należy niezwłocznie skonsultować się z lekarzem. Oprócz przeprowadzenia badania lekarskiego należy sprawdzić laboratoryjne parametry czynności wątroby. Rozpoznanie Przed leczeniem i podczas pierwszych 6 miesięcy leczenia należy okresowo monitorować czynność wątroby. Wśród rutynowych testów laboratoryjnych największe znaczenie mają testy, które odnoszą się do syntezy białek, a zwłaszcza PT (czasu protrombinowego). W przypadku stwierdzenia nieprawidłowego czasu protrombinowego, zwłaszcza jeżeli nieprawidłowe są także wyniki innych testów (znaczące zmniejszenie stężenia fibrynogenu i czynników krzepnięcia, zwiększenie stężenia bilirubiny i zwiększenie aktywności aminotransferaz - patrz Specjalne środki ostrożności dotyczące stosowania), lekarz powinien przerwać leczenie walproinianem sodu (również produktami zawierającymi salicylany, jeżeli są jednocześnie przyjmowane przez pacjenta, ponieważ salicylany mają tę samą drogę przemian metabolicznych). Zapalenie trzustki Bardzo rzadko zgłaszano przypadki ciężkiego zapalenia trzustki, czasami kończące się zgonem. Najbardziej narażone są małe dzieci; ryzyko zmniejsza się wraz z wiekiem. Czynnikami ryzyka mogą być: ciężka padaczka, uszkodzenia neurologiczne i stosowanie leków przeciwpadaczkowych. Niewydolność wątroby współistniejąca z zapaleniem trzustki zwiększa ryzyko zejścia śmiertelnego. Kobiety w wieku rozrodczym Walproinian nie powinien być stosowany u kobiet z padaczką planujących ciążę, poza przypadkami w których inne leczenie jest nieskuteczne lub nie jest tolerowane. Należy rozważyć korzyści z zastosowania leku w stosunku do ryzyka przed pierwszym przepisaniem leku lub kiedy kobieta leczona walproinianem planuje ciążę. Kobiety w wieku rozrodczym muszą stosować skuteczną antykoncepcję w trakcie leczenia. Myśli i zachowania samobójcze U pacjentów, u których stosowano leki przeciwpadaczkowe w różnych wskazaniach, odnotowano przypadki myśli i zachowań samobójczych. Metaanaliza randomizowanych, kontrolowanych placebo badań leków przeciwpadaczkowych również wskazuje na niewielkie zwiększenie ryzyka myśli i zachowań samobójczych. Nie jest znany mechanizm powstawania tego ryzyka, a dostępne dane nie wykluczają możliwości, że zwiększone ryzyko występuje także podczas stosowania walproinianu sodu. W związku z tym należy uważnie obserwować, czy u pacjenta nie występują oznaki myśli i zachowań samobójczych i w razie konieczności rozważyć zastosowanie odpowiedniego leczenia. Pacjentów (oraz ich opiekunów) należy poinformować, że w razie wystąpienia oznak myśli lub zachowań samobójczych należy poradzić się lekarza. Karbapenemy Nie zaleca się jednoczesnego stosowania walproinianu i karbapenemów. Lek zawiera parahydroksybenzoesany i może powodować reakcje alergiczne (możliwe reakcje typu późnego). Lek zawiera sacharozę. Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy - galaktozy lub niedoborem sacharozy-izomaltazy, nie powinni przyjmować produktu Depakine. 3
4 Lek zawiera sorbitol. Nie należy stosować leku Depakine u pacjentów z rzadko występującą dziedziczną nietolerancją fruktozy. Specjalne środki ostrożności dotyczące stosowania Przed rozpoczęciem leczenia i okresowo podczas pierwszych 6 miesięcy leczenia należy wykonywać laboratoryjne testy czynności wątroby, zwłaszcza u pacjentów z grupy ryzyka (patrz Specjalne ostrzeżenia). Podobnie jak w przypadku innych leków przeciwpadaczkowych może wystąpić izolowane i przemijające zwiększenie aktywności aminotransferaz we krwi, zwłaszcza na początku leczenia, bez wystąpienia innych objawów klinicznych. W takim przypadku zaleca się wykonanie bardziej dokładnych testów laboratoryjnych (zwłaszcza czasu protrombinowego) w celu ewentualnego dostosowania dawkowania leku i powtórzenie badań laboratoryjnych. U dzieci poniżej 3 lat zaleca się stosowanie walproinianu sodu w monoterapii poprzedzonej oceną jego terapeutycznej korzyści w porównaniu do ryzyka uszkodzenia wątroby lub zapalenia trzustki (patrz: Specjalne ostrzeżenia). Należy unikać jednoczesnego stosowania salicylanów u dzieci poniżej 3 lat z powodu ryzyka toksycznego działania na wątrobę. Badania laboratoryjne (badanie morfologii krwi z rozmazem, w tym liczba płytek krwi, czas krwawienia i ocena testów krzepnięcia) są zalecane przed rozpoczęciem leczenia, również przed zabiegiem operacyjnym i w przypadku samoistnych krwiaków lub krwawień (patrz punkt 4.8). U dzieci przed jednoczesnym podaniem salicylanów należy rozważyć ryzyko toksycznego działania na wątrobę (patrz: Specjalne ostrzeżenia) i ryzyko wystąpienia krwawienia. U pacjentów z niewydolnością nerek może dojść do zwiększenia stężenia frakcji wolnej kwasu walproinowego w surowicy krwi i do konieczności zmniejszenia dawki leku. Rzadko zgłaszano występowanie zapalenia trzustki, dlatego w przypadku ostrych bólów brzucha, również przed zabiegiem chirurgicznym, zaleca się oznaczenie aktywności enzymów trzustkowych. W przypadku wystąpienia zapalenia trzustki leczenie walproinianem sodu należy przerwać. Walproinianu sodu nie zaleca się stosować u pacjentów z niedoborem enzymów w cyklu przemian mocznika. Opisywano u tych pacjentów rzadkie przypadki zwiększonego stężenia amoniaku we krwi i wystąpienie śpiączki. U dzieci z wywiadem świadczącym o niewyjaśnionych objawach dotyczących przewodu pokarmowego (brak apetytu, wymioty), o epizodach śpiączki, opóźnieniu rozwoju umysłowego lub o przypadkach występowania w rodzinie śmierci noworodków lub dzieci, należy przed rozpoczęciem leczenia walproinianem sodu wykonać metaboliczne badania, zwłaszcza stężenie amoniaku we krwi na czczo i po posiłku. Walproinian sodu w bardzo rzadkich przypadkach może powodować ujawnienie się chorób immunologicznych, dlatego u pacjentów z układowym toczniem rumieniowatym należy rozważyć korzyści z zastosowania leku w stosunku do potencjalnego ryzyka jego szkodliwego działania. U pacjentów leczonych walproinianem sodu może dojść do zwiększenia masy ciała. Przed rozpoczęciem leczenia należy poinformować pacjenta o możliwości wystąpienia takiego ryzyka i przedsięwziąć odpowiednie środki w celu jego minimalizowania. Kobiety w wieku rozrodczym (patrz punkt 4.6) 4
5 Należy przygotować odpowiednie poradnictwo, dostępne dla wszystkich kobiet w wieku rozrodczym chorujących na padaczkę odnośnie ryzyka związanego z ciążą. Nie zaleca się picia alkoholu podczas leczenia walproinianem Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Wpływ walproinianu na inne leki Neuroleptyki, inhibitory MAO, leki przeciwdepresyjne i benzodiazepiny Walproinian może wzmagać działanie neuroleptyków, inhibitorów MAO, leków przeciwdepresyjnych oraz benzodiazepin. W takiej sytuacji dawki leków powinny być modyfikowane w zależności od obrazu klinicznego. Lit Walproinian nie ma wpływu na stężenie litu w surowicy krwi. Fenobarbital Walproinian zwiększa stężenie fenobarbitalu w osoczu krwi z powodu hamowania metabolizmu w wątrobie, co powoduje sedację, zwłaszcza u dzieci. W związku z tym konieczne jest dokładne monitorowanie kliniczne pacjentów stosujących jednocześnie walproinian i fenobarbital przez pierwsze 15 dni leczenia. Jeśli wystąpią objawy sedacji, należy natychmiast zmniejszyć dawkę fenobarbitalu, a w razie konieczności oznaczyć jego stężenie w osoczu krwi. Prymidon Walproinian stosowany jednocześnie z prymidonem powoduje zwiększenie jego stężenia w osoczu krwi oraz nasilenie działań niepożądanych (sedacja). Zjawisko to ma tendencję do zanikania w czasie długotrwałego stosowania obydwu leków jednocześnie. Konieczna jest obserwacja objawów klinicznych i ewentualna korekta dawkowania prymidonu, zwłaszcza w początkowej fazie leczenia skojarzonego. Fenytoina Pochodne kwasu walproinowego powodują zmniejszenie stężenia całkowitego fenytoiny w osoczu krwi. Ponadto walproinian zwiększa stężenie wolnej fenytoiny, jest możliwe wystąpienie objawów przedawkowania (kwas walproinowy wypiera fenytoinę z wiązań z białkami i zmniejsza jej metabolizm w wątrobie). Zalecana jest obserwacja kliniczna. W przypadku oznaczania stężenia fenytoiny w osoczu krwi, należy szczególną uwagę zwrócić na poziom frakcji wolnej. Karbamazepina Zgłaszano toksyczne działanie podczas jednoczesnego stosowania walproinianu sodu i karbamazepiny, ponieważ walproinian może nasilać toksyczne działanie karbamazepiny. Zaleca się kliniczną obserwację pacjenta, zwłaszcza na początku skojarzonego leczenia i dostosowanie dawek leku, jeżeli konieczne. Lamotrygina Walproinian sodu zmniejsza metabolizm lamotryginy i wydłuża jej okres półtrwania niemal dwukrotnie. To działanie walproinianu sodu prowadzi do zwiększenia toksyczności lamotryginy. W związku z tym istnieje ryzyko wystąpienia ciężkiej wysypki. Podczas jednoczesnego stosowania lamotryginy i kwasu walproinowego zaleca się obserwację kliniczną pacjenta oraz dostosowanie dawki leków (zmniejszenie dawki lamotryginy). Zydowudyna 5
6 Walproinian może powodować zwiększenie stężenia zydowudyny w osoczu krwi, co może prowadzić do nasilenia jej toksyczności. Felbamat Kwas walproinowy może zmniejszać średni czas eliminacji felbamatu do 16%. Wpływ innych leków na walproinian Leki przeciwpadaczkowe Leki przeciwpadaczkowe indukujące enzymy (w tym: fenytoina, fenobarbital, karbamazepina) mogą powodować zmniejszenie stężenia kwasu walproinowego w osoczu krwi. W przypadku terapii skojarzonej, dawki powinny być dostosowane do stężenia leków w osoczu krwi. Felbamat Jednoczesne stosowanie felbamatu i walproinianu zmniejsza średni czas eliminacji kwasu walproinowego od 22% do 50% i w konsekwencji zwiększa stężenie kwasu walproinowego we krwi. Zaleca się monitorowanie dawki walproinianu. Meflochina Lek ten przyspiesza metabolizm kwasu walproinowego i obniża próg drgawkowy. W czasie jednoczesnej terapii walproinianem i meflochiną może dojść do zwiększenia częstości napadów padaczkowych. Jednoczesne stosowanie walproinianu z meflochiną jest przeciwwskazane. Leki silnie wiążące się z białkami krwi W przypadku jednoczesnego stosowania walproinianu i leków silnie wiążących się z białkami krwi (np. kwas acetylosalicylowy), może dochodzić do zwiększenia stężenia wolnego walproinianu w osoczu krwi. Środki przeciwzakrzepowe zależne od witaminy K Należy dokładne monitorować czas protrombinowy w przypadku jednoczesnego stosowania walproinianu i środków przeciwzakrzepowych zależnych od witaminy K. Cymetydyna, erytromycyna W przypadku jednoczesnego stosowania z cymetydyną lub erytromycyną, stężenie kwasu walproinowego w osoczu krwi może być zwiększone w wyniku hamowania metabolizmu w wątrobie. Antybiotyki typu karbapenemu (panipenem, meropenem, imipenem) Leki te mogą powodować zmniejszenie stężenia kwasu walproinowego we krwi poniżej stężenia terapeutycznego (od 60% do 100% w ciągu dwóch dni), czasami związane z występowaniem drgawek. W przypadku konieczności podania tych antybiotyków należy monitorować stężenie kwasu walproinowego we krwi. Ryfampicyna może zmniejszać stężenie kwasu walproinowego we krwi i prowadzić do braku skuteczności klinicznej walproinianu. W przypadku jednoczesnego stosowania walproinianu z ryfampicyną może być konieczne dostosowanie dawki walproinianu. Inne interakcje Występowanie encefalopatii i (lub) hyperamonemii było związane z jednoczesnym stosowaniem walproinianu i topiramatu. Pacjenci leczeni jednocześnie tymi dwoma lekami powinni być uważnie obserwowani pod kątem wystąpienia objawów encefalopatii spowodowanej hyperamonemią. 6
7 Walproinian nie pobudza układu enzymów wątrobowych, a w związku z tym nie wpływa na skuteczność doustnych leków antykoncepcyjnych Wpływ na płodność, ciążę i laktację Produktu nie należy stosować w okresie ciąży oraz u kobiet w wieku rozrodczym, jeśli nie jest to bezwzględnie konieczne (tj. w przypadku, gdy inne sposoby leczenia są nieskuteczne lub nie są tolerowane). Kobiety w wieku rozrodczym muszą stosować skuteczną antykoncepcję w trakcie leczenia. Kobiety w wieku rozrodczym Kobiety z padaczką, przed zastosowaniem kwasu walproinowego (niezależnie od postaci farmaceutycznej), które mogą zajść w ciążę podczas stosowania leku, powinny otrzymać specjalistyczną poradę. Z powodu potencjalnego ryzyka dla płodu, należy rozważyć korzyści z zastosowania leku w stosunku do ryzyka. W przypadku, gdy leczenie kwasem walproinowym jest konieczne, należy przedsięwziąć środki ostrożności w celu minimalizowania potencjalnego teratogennego ryzyka (patrz poniżej W świetle powyższych danych). Ciąża Na podstawie doświadczeń u ciężarnych kobiet z padaczką, ryzyko związane ze stosowaniem walproinianu sodu podczas ciąży opisano poniżej: Ryzyko związane z padaczką i lekami przeciwpadaczkowymi Wykazano, że u kobiet z padaczką i stosujących leki przeciwpadaczkowe w czasie ciąży, wady rozwojowe u potomstwa występują 2-3 razy częściej niż w populacji ogólnej (około 3%). Zwiększenie liczby dzieci z wadami rozwojowymi obserwowano podczas leczenia kilkoma lekami. Najczęściej obserwowanymi wadami rozwojowymi są rozszczep wargi i wady sercowo-naczyniowe. Bardzo rzadko zgłaszano opóźnienie rozwoju u dzieci matek chorych na padaczkę. Nie jest możliwe do odróżnienia, czy jest to spowodowane czynnikami genetycznymi, socjalnymi, środowiskowymi, chorobą matki czy leczeniem przeciwpadaczkowym. Pomimo tego potencjalnego ryzyka nie należy nagle przerywać leczenia przeciwpadaczkowego. Nagłe przerwanie leczenia może powodować nasilenie napadów padaczkowych u matki, które mogą mieć poważne konsekwencje zarówno dla matki i dla płodu. Ryzyko związane z walproinianem sodu Badania doświadczalne na zwierzętach wykazały działanie teratogenne u myszy, szczurów i królików. U ludzi: U potomstwa matek z padaczką leczonych walproinianem zgłaszano zwiększenie częstości występowania mniejszych i większych wad rozwojowych, w tym wad cewy nerwowej, wad twarzoczaszki, kończyn, wad wrodzonych układu sercowo-naczyniowego i wad mnogich dotyczących różnych układów ciała. Są dane sugerujące związek między ekspozycją na kwas walproinowy in utero i ryzykiem wystąpienia opóźnienia rozwoju (często skojarzonego z nieprawidłowościami budowy twarzoczaszki), zwłaszcza werbalnego IQ. Zgłaszano przypadki występowania autyzmu u dzieci, których matki leczone były walproinianem sodu w czasie ciąży. W świetle powyższych danych 7
8 Jeśli kobieta planuje zajście w ciążę, stanowi to sposobność do ponownego rozważenia wskazań do leczenia przeciwpadaczkowego. Należy również rozważyć podanie kobiecie przed zajściem w ciążę kwasu foliowego w odpowiedniej dawce (5 mg na dobę), ponieważ kwas foliowy może minimalizować ryzyko wad cewy nerwowej. Stosowanie walproinianu sodu zarówno w monoterapii jak i politerapii jest związane z występowaniem wad rozwojowych u płodu. Dostępne dane wykazują, że politerapia z zastosowaniem walproinianu sodu jest związana z większym ryzykiem występowania wad niż monoterapia. Zalecana jest monoterapia, właściwe jest podawanie minimalnej skutecznej dawki dobowej. Podawanie leku w kilku podzielonych dawkach w ciągu doby i stosowanie postaci o przedłużonym uwalnianiu jest bardziej korzystne. Nie należy przerywać u ciężarnej kobiety skutecznego leczenia przeciwpadaczkowego walproinianem sodu. Powinno rozpocząć się prenatalne monitorowanie płodu w specjalistycznym ośrodku w celu ewentualnego wczesnego rozpoznania wad cewy nerwowej lub innych wad rozwojowych. Ryzyko dla noworodka Bardzo rzadko zgłaszano wystąpienie zespołu krwotocznego u noworodków matek, które stosowały walproinian sodu podczas ciąży. Zespół krwotoczny był związany z hipofibrynogenemią; zgłaszano również występowanie afibrynogenemii, która może spowodować zejście śmiertelne. Hipofibrynogenemia jest spowodowana zmniejszeniem aktywności czynników krzepnięcia. Jednakże, zespół krwotoczny musi być różnicowany ze zmniejszeniem aktywności czynników witaminy K indukowanym przez fenobarbital i leki indukujące enzymy wątrobowe. Zaraz po urodzeniu należy oznaczyć u noworodka liczbę płytek krwi, stężenie fibrynogenu, testy krzepnięcia i czynniki krzepnięcia. Zgłaszano przypadki hipoglikemii u noworodków, których matki przyjmowały walproinian w czasie trzeciego trymestru ciąży. Karmienie piersią Walproinian przenika w niewielkim stopniu do mleka, osiągając stężenia rzędu 1-10% stężenia w surowicy matki. Dotychczas, u dzieci karmionych piersią przez matki stosujące pochodne kwasu walproinowego, nie zaobserwowano działań niepożądanych. Należy rozważyć, czy kobieta może karmić piersią, wziąwszy pod uwagę wszystkie znane fakty Wpływ leku na zdolność prowadzenia pojazdów i obsługiwania maszyn Kierowcy i operatorzy maszyn powinni być ostrzeżeni o możliwości wystąpienia senności, zwłaszcza w przypadku stosowania kilku leków przeciwdrgawkowych lub w przypadku jednoczesnego stosowania innych leków (np. benzodiazepin), które również mogą powodować senność Działania niepożądane Działania niepożądane wymienione poniżej uszeregowane są według częstości występowania przy zastosowaniu następującej konwencji: bardzo często ( 1/10), często ( 1/100 do <1/10), niezbyt często ( 1/1000 do <1/100), rzadko ( 1/ do <1/1000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). Zaburzenia wrodzone i choroby rodzinne/genetyczne (patrz punkt 4.6). Zaburzenia wątroby i dróg żółciowych Rzadko: uszkodzenie wątroby (patrz punkt 4.4). Zaburzenia żołądka i jelit 8
9 Nudności, bóle żołądka, biegunka często występują u niektórych pacjentów na początku leczenia; przemijają zwykle po kilku dniach bez konieczności przerywania leczenia. Bardzo rzadko: zapalenie trzustki, czasami kończące się zgonem (patrz punkt 4.4). Zaburzenia metabolizmu Bardzo rzadko: hiponatremia. Zespół niedostosowanego wydzielania hormonu antydiuretycznego (SIADH ang. Syndrome of Inappropriate Secretion of ADH). Zaburzenia układu nerwowego Niezbyt często: ataksja. Uspokojenie, zaburzenia pozapiramidowe, które mogą być nieprzemijające, włączając przemijające objawy parkinsonizmu. Bardzo rzadko: przemijające otępienie, związane z przemijającą atrofią (zanikiem) mózgu. Opisywano kilka przypadków osłupienia (stupor) lub letargu, czasami powodującego przejściową śpiączkę (encefalopatia), zarówno izolowane, jak i skojarzone z nawrotem napadów podczas leczenia walproinianem sodu, które zmniejszały się po odstawieniu leku lub zmniejszeniu dawki leku. Takie stany najczęściej występują u pacjentów otrzymujących kilka leków przeciwpadaczkowych (zwłaszcza fenobarbital lub topiramat) lub po nagłym zwiększeniu dawkowania walproinianu sodu. Przemijające i (lub) zależne od dawki leku posturalne drżenia mięśniowe i senność. Mogą często wystąpić przypadki izolowanego i umiarkowanego zwiększenia stężenia amoniaku we krwi bez zmian w laboratoryjnych testach czynności wątroby, co nie wymaga przerwania leczenia. Zgłaszano również przypadki zwiększonego stężenia amoniaku we krwi i wystąpienia objawów neurologicznych, które wymagają dodatkowych badań (patrz punkt 4.4). Zaburzenia krwi i układu chłonnego Rzadko: przypadki niedokrwistości, leukopenii lub pancytopenii. Częste występowanie trombocytopenii. Niewydolność szpiku kostnego, w tym aplazja dotycząca krwinek czerwonych. Agranulocytoza. Zgłaszano przypadki izolowanego zmniejszenia stężenia fibrynogenu i wydłużeniu czasu krwawienia, na ogół bez objawów klinicznych i podczas stosowania dużej dawki leku (walproinian sodu wykazuje hamujący wpływ na drugą fazę agregacji płytek krwi) (patrz punkt 4.6). Zaburzenia skóry i tkanki podskórnej Bardzo rzadko: martwica toksyczno-rozpływna naskórka, zespół Stevensa-Johnsona, rumień wielopostaciowy. Podczas stosowania walproinianu mogą wystąpić reakcje skórne, takie jak wysypka. Często zgłaszano przemijające i (lub) zależne od dawki leku wypadanie włosów. Zaburzenia układu rozrodczego Brak miesiączki i nieregularne cykle miesiączkowe. Niepłodność męska Zaburzenia naczyniowe Zapalenie naczyń. Zaburzenia ucha i błędnika Rzadko: osłabienie słuchu, zarówno przemijające i nieprzemijające; jakkolwiek związek przyczynowo-skutkowy nie został ustalony. 9
10 Zaburzenia nerek i dróg moczowych Bardzo rzadko: mimowolne oddawanie moczu. Istnieją pojedyncze doniesienia o przemijającym zespole Fanconiego podczas leczenia walproinianem sodu; mechanizm powstania tego zaburzenia nie jest znany. Zaburzenia układu immunologicznego Obrzęk naczynioruchowy, zespół ciężkiej nadwrażliwości obejmujący w szczególności wysypkę polekową z eozynofilią oraz objawami ogólnymi (DRESS ang. Drug Rash with Eosinophilia and Systemic Symptoms), reakcje alergiczne. Zaburzenia ogólne i stany w miejscu podania Bardzo rzadko: obwodowe obrzęki o umiarkowanym nasileniu. Zwiększenie masy ciała. Pacjentki z zespołem policystycznych jajników są w grupie ryzyka i należy je dokładnie obserwować (patrz punkt 4.4). Zaburzenia psychiczne Splątanie. Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Istnieją doniesienia o zmniejszeniu gęstości mineralnej kości, osteopenii, osteoporozie oraz o złamaniach u pacjentów stosujących Depakine w długoterminowej terapii. Mechanizm działania Depakine wpływający na metabolizm kostny nie został ustalony Przedawkowanie Kliniczne objawy ciężkiego przedawkowania to: śpiączka, zmniejszenie napięcia mięśniowego, hiporefleksja, zwężenie źrenic i zaburzenia oddychania; może również wystąpić kwasica metaboliczna. Rokowanie w zatruciu pochodnymi kwasu walproinowego jest z reguły korzystne, choć po szczególnie ciężkich zatruciach opisywano zgon. Pojawiać się mogą również inne objawy, opisywano m.in. napady drgawkowe w przypadku bardzo dużych stężeń leku w osoczu krwi. Opisywano przypadki zwiększenia ciśnienia wewnątrzczaszkowego związanego z obrzękiem mózgu. Leczenie szpitalne w przypadku zatrucia powinno obejmować: stałe nadzorowanie czynności układu krążenia i oddychania. W najcięższych przypadkach konieczna może się okazać hemodializa lub hemoperfuzja. W pojedynczych przypadkach skuteczne było zastosowanie naloksonu. 5. WŁAŚCIWOŚCI FARMAKOLOGICZNE Grupa farmakoterapeutyczna: leki przeciwdrgawkowe Kod ATC: N 03 AG Właściwości farmakodynamiczne Walproinian sodu wywiera działanie na ośrodkowy układ nerwowy. Wykazuje działanie przeciwdrgawkowe w różnych typach napadów drgawkowych u zwierząt i w różnych typach padaczki u ludzi. Doświadczalne i kliniczne badania z walproinianem wskazują na dwa typy działania przeciwdrgawkowego leku. Pierwszy jest bezpośrednim efektem farmakologicznym, związanym ze stężeniem walproinianu w surowicy i w płynie mózgowo-rdzeniowym. Drugi polega na niebezpośrednim działaniu, prawdopodobnie związanym z metabolitami walproinianu, które utrzymują się w ośrodkowym układzie nerwowym lub ze zmianami stężenia 10
11 neuroprzekaźników albo bezpośrednim działaniem na błonę neuronu. Najbardziej uznana hipoteza dotyczy kwasu gamma-aminomasłowego (GABA), którego stężenie zwiększa się po podaniu walproinianu. Walproinian skraca czas trwania pośredniej fazy snu i jednocześnie wydłuża fazę wolną snu Właściwości farmakokinetyczne Liczne badania farmakokinetyczne przeprowadzone z walproinianem wykazały następujące dane: - biodostępność walproinianu po doustnym podaniu wynosi prawie 100 %; - objętość dystrybucji jest głównie ograniczona do krwi i do ulegającego szybkiej wymianie płynu zewnątrzkomórkowego. Walproinian przenika do płynu mózgowo-rdzeniowego i do mózgu. - okres półtrwania wynosi godzin; - minimalne stężenia leku w surowicy, niezbędne do uzyskania skuteczności terapeutycznej, wynosi mg/l, w szerokim zakresie między 40 a 100 mg/l. W przypadku utrzymywania się stężenia leku powyżej 200 mg/l należy zredukować dawkę leku. - stężenia leku w stanie stacjonarnym w surowicy krwi osiągane są w ciągu 2 do 4 dni, - walproinian w bardzo wysokim stopniu wiąże się z białkami krwi, jest to zależne od dawki leku; - lek jest wydalany głównie z moczem po przemianie metabolicznej polegającej na sprzęganiu z kwasem glukuronowym i beta-utlenieniu; - walproinian jest usuwany z organizmu za pomocą dializy, jednak hemodializa usuwa tylko niezwiązaną z białkami osocza frakcję walproinianu (około 10 %); - walproinian nie indukuje enzymów wchodzących w skład cytochromu P-450, w przeciwieństwie do większości innych leków przeciwdrgawkowych nie przyspiesza swojego własnego metabolizmu, ani innych leków, takich jak preparaty estrogenowo-progesteronowe i doustne leki przeciwzakrzepowe. 5.3 Przedkliniczne dane o bezpieczeństwie Brak dodatkowych danych. 6. DANE FARMACEUTYCZNE 6.1. Wykaz substancji pomocniczych metylu p-hydroksybenzoesan 0,10 g propylu p-hydroksybenzoesan 0,02 g sacharoza 60,0 g sorbitol (roztwór 70 %) 15,0 g glicerol 15,0 g zapach wiśniowy 0,03 g kwas solny stężony lub sodu wodorotlenek do ph 7,3-7,7 woda oczyszczona do 100 ml 6.2. Niezgodności farmaceutyczne Nie stwierdzono Okres ważności 3 lata Po otwarciu butelki: 1 miesiąc 6.4. Specjalne środki ostrożności podczas przechowywania 11
12 Przechowywać w suchym miejscu, chronić od światła Rodzaj i zawartość opakowania Butelka z oranżowego szkła o pojemności 150 ml z nakrętką z polipropylenu (zamknięcie zabezpieczające przed otwarciem butelki przez dziecko) oraz dołączoną miarko-strzykawką i nasadką w tekturowym pudełku Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania Brak specjalnych zaleceń oprócz podanych w punkcie PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Sanofi-Aventis France 1-13 boulevard Romain Rolland Paryż Francja 8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU Pozwolenie MZ Nr: R/ DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA JEGO PRZEDŁUŻENIA 12 kwietnia 1994; 15 listopada 1999; 5 stycznia 2005; 10 stycznia 2006, DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 11/
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu DEPAKINE CHRONO 500, 333 mg + 145 mg, tabletki powlekane
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu DEPAKINE CHRONO 500, 333 mg + 145 mg, tabletki powlekane
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu DEPAKINE CHRONO 500, 333 mg + 145 mg, tabletki powlekane
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu DEPAKINE CHRONO 500, 333 mg + 145 mg, tabletki powlekane
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO Convival Chrono, 500 mg, tabletki o przedłużonym uwalnianiu. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka o przedłużonym uwalnianiu Convival
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO Convival Chrono, 500 mg, tabletki o przedłużonym uwalnianiu. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka o przedłużonym uwalnianiu Convival
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAMIDE, 300 mg, tabletki powlekane dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana dojelitowa zawiera 300 mg walpromidu
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAMIDE, 300 mg, tabletki powlekane dojelitowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana dojelitowa zawiera 300 mg walpromidu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu. 1 tabletka zawiera 200 mg walproinianu sodu i 87 mg kwasu
 DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu. 1 tabletka zawiera 200 mg walproinianu sodu i 87 mg kwasu walproinowego, co odpowiada łącznie 300 mg walproinianu sodu.
DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu. 1 tabletka zawiera 200 mg walproinianu sodu i 87 mg kwasu walproinowego, co odpowiada łącznie 300 mg walproinianu sodu.
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA
 ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
ANEKS III ZMIANY W CHARAKTERYSTYKACH PRODUKTÓW LECZNICZYCH I ULOTCE DLA PACJENTA Poprawki do CHPL oraz ulotki dla pacjenta są ważne od momentu zatwierdzenia Decyzji Komisji. Po zatwierdzeniu Decyzji Komisji,
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
Charakterystyka Produktu Leczniczego Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Oviderm, 250 mg, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 gram kremu zawiera 250 mg glikolu propylenowego Substancja pomocnicza o znanym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ESPUMISAN, 40 mg, kapsułki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 40 mg symetykonu. Substancje pomocnicze o znanym działaniu:
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE CHRONO 300 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu DEPAKINE CHRONO 500 333 mg + 145 mg, tabletki powlekane o przedłużonym uwalnianiu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE CHRONO 300 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu DEPAKINE CHRONO 500 333 mg + 145 mg, tabletki powlekane o przedłużonym uwalnianiu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Syrop tymiankowy Labima, 110 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Płynny wyciąg z ziela tymianku (Thymi extractum fluidum).
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE 288,2 mg/5 ml, syrop (Natrii valproas) Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE 288,2 mg/5 ml, syrop (Natrii valproas) Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Cholestil Max, 200 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 200 mg hymekromonu (Hymecromonum) Pełny wykaz substancji
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONVULEX, 50 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 50 mg walproinianu sodu (Natrii valproas), otrzymanego z
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONVULEX, 50 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 50 mg walproinianu sodu (Natrii valproas), otrzymanego z
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon o smaku mięty Saszetki, (500 mg + 267 mg + 160 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Gaviscon o smaku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Toselix, 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu (Butamirati citras). 5 ml syropu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ATUSSAN MITE 0,8 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 0,8 mg butamiratu cytrynianu. 5 ml syropu zawiera 4,0
Pełny wykaz substancji pomocniczych, patrz punkt 6.1 Charakterystyki Produktu Leczniczego (ChPL).
 Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
Nazwa produktu leczniczego i nazwa powszechnie stosowana: Aerius 0,5 mg/ml, roztwór doustny, desloratadyna Skład jakościowy i ilościowy w odniesieniu do substancji czynnych oraz tych substancji pomocniczych,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONVULEX, 50 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 ml syropu zawiera 50 mg walproinianu sodu (Natrii valproas),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONVULEX, 50 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 ml syropu zawiera 50 mg walproinianu sodu (Natrii valproas),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NYSTATYNA TEVA, 2 400 000 j.m./5 g, granulat do sporządzenia zawiesiny doustnej i stosowania w jamie ustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
Charakterystyka Produktu Leczniczego Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE CHRONOSPHERE 100 DEPAKINE CHRONOSPHERE 250 DEPAKINE CHRONOSPHERE 500 DEPAKINE CHRONOSPHERE 750 DEPAKINE CHRONOSPHERE 1000 66,66 mg + 29,03 mg, granulat
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE CHRONOSPHERE 100 DEPAKINE CHRONOSPHERE 250 DEPAKINE CHRONOSPHERE 500 DEPAKINE CHRONOSPHERE 750 DEPAKINE CHRONOSPHERE 1000 66,66 mg + 29,03 mg, granulat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum) - witaminy K 1.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VITACON, 10 mg/ml, roztwór do wstrzykiwań 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu do wstrzykiwań zawiera 10 mg fitomenadionu (Phytomenadionum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Cholinex Intense, 2,5 mg + 1,2 mg, tabletki do ssania 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka do ssania zawiera 2,5 mg heksylorezorcynolu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hepa Merz 3000, 3 g/5 g, granulat do sporządzania roztworu doustnego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: L-ornityny L-asparaginian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONVULEX 150, 150 mg, kapsułki miękkie CONVULEX 300, 300 mg, kapsułki miękkie CONVULEX, 500 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONVULEX 150, 150 mg, kapsułki miękkie CONVULEX 300, 300 mg, kapsułki miękkie CONVULEX, 500 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Substancje pomocnicze o znanym działaniu: czerwień koszenilowa (E 124), metylu parahydroksybenzoesan, sód.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Flegamax, 50 mg/ml, roztwór doustny 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu doustnego zawiera 50 mg karbocysteiny (Carbocisteinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 kapsułka twarda VENOTREX 300 mg kapsułki twarde zawiera 300 mg trokserutyny (o-βhydroksyetylorutozydy).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO VENOTREX 200 mg kapsułki twarde VENOTREX 300 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda VENOTREX 200 mg kapsułki
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM 2%, 20 mg/ml (2,8 mg/dawkę donosową), aerozol do nosa, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml roztworu zawiera 20 mg
DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu. 1 tabletka zawiera 200 mg walproinianu sodu i 87 mg kwasu
 DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu. 1 tabletka zawiera 200 mg walproinianu sodu i 87 mg kwasu walproinowego, co odpowiada łącznie 300 mg sodu walproinianu.
DEPAKINE CHRONO 300, 200 mg + 87 mg, tabletki powlekane o przedłużonym uwalnianiu. 1 tabletka zawiera 200 mg walproinianu sodu i 87 mg kwasu walproinowego, co odpowiada łącznie 300 mg sodu walproinianu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Neurolipon-MIP 600, 600 mg, kapsułki miękkie 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka miękka zawiera 600 mg kwasu tioktynowego (Acidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynian
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 250 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 250 mg etamsylatu (Etamsylatum). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO CROTAMITON FARMAPOL płyn do stosowania na skórę, 100 mg/g 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 g płynu do stosowania
100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix L., folium) (4-8:1). Ekstrahent: etanol 30% (m/m).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Hedussin, 33 mg/4 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml syropu zawiera 825 mg suchego wyciągu z liści bluszczu (Hedera helix
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONOSPHERE 100, 66,66 mg + 29,03 mg, granulat o przedłużonym uwalnianiu DEPAKINE CHRONOSPHERE 250, 166,76 mg + 72,61 mg, granulat
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONOSPHERE 100, 66,66 mg + 29,03 mg, granulat o przedłużonym uwalnianiu DEPAKINE CHRONOSPHERE 250, 166,76 mg + 72,61 mg, granulat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO PARACETAMOL HASCO, 80 mg, czopki PARACETAMOL HASCO, 125 mg, czopki PARACETAMOL HASCO, 250 mg, czopki PARACETAMOL HASCO, 500 mg,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Patentex Oval N, 75 mg, globulki dopochwowe 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 globulka (3,15 g) zawiera: Nonoksynol-9 (INN) 75 mg Pełny
Charakterystyka Produktu Leczniczego
 Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONOSPHERE 100, 66,66 mg + 29,03 mg, granulat o przedłużonym uwalnianiu DEPAKINE CHRONOSPHERE 250, 166,76 mg + 72,61 mg, granulat
Charakterystyka Produktu Leczniczego 1. NAZWA PRODUKTU LECZNICZEGO DEPAKINE CHRONOSPHERE 100, 66,66 mg + 29,03 mg, granulat o przedłużonym uwalnianiu DEPAKINE CHRONOSPHERE 250, 166,76 mg + 72,61 mg, granulat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Uro-Vaxom 6 mg, kapsułki, twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka twarda zawiera: liofilizat OM-89 w tym: liofilizowany lizat
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE 400 mg (400 mg/4 ml), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Natrii valproas) Niniejszy produkt leczniczy będzie dodatkowo
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA DEPAKINE 400 mg (400 mg/4 ml), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (Natrii valproas) Niniejszy produkt leczniczy będzie dodatkowo
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Codipar 250, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg paracetamolu (Paracetamolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Codipar 250, 250 mg, czopki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 czopek zawiera 250 mg paracetamolu (Paracetamolum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Claritine, 1 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1 mg Loratadinum (loratadyny). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Laboratoria PolfaŁódź Paracetamol, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg paracetamolu (Paracetamolum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Laboratoria PolfaŁódź Paracetamol, 500 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg paracetamolu (Paracetamolum).
Dorośli 2 do 4 g na dobę w 2 lub 3 podzielonych dawkach (tj. od 4 do 8 tabletek na dobę).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EXACYL, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 500 mg kwasu traneksamowego (Acidum tranexamicum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EXACYL, 500 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka powlekana zawiera 500 mg kwasu traneksamowego (Acidum tranexamicum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1. NAZWA PRODUKTU LECZNICZEGO 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO GLIMBAX 0,74 mg/ml (0,074%), roztwór do płukania jamy ustnej i gardła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 0,74 mg Diclofenacum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PRIMENE 10% roztwór do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 100 ml roztworu do infuzji zawiera: L-Izoleucyna... L-Leucyna... L-Walina...
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lactulosum Aflofarm, 7,5 g/15 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 15 ml syropu zawiera 7,5 g laktulozy ciekłej (Lactulosum liquidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Lactulosum Aflofarm, 7,5 g/15 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 15 ml syropu zawiera 7,5 g laktulozy ciekłej (Lactulosum liquidum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 100 mg, tabletki powlekane 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 100 mg trimebutyny maleinianu (Trimebutini maleas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO LORATADYNA GALENA, 10 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 10 mg loratadyny (Loratadinum). Pełny wykaz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLCROM, 20 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 20 mg sodu kromoglikanu (Natrii cromoglicas).
BIONORICA Polska Sp z o.o. CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Cyclodynon 1
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Cyclodynon 1 1. NAZWA PRODUKTU LECZNICZEGO Cyclodynon 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ 1 tabletka powlekana zawiera 40 mg suchego wyciągu etanolowego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Artelac, 3,2 mg/ml, krople do oczu, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu zawiera 3,2 mg hypromelozy (Hypromellosum).
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Convival Chrono, 500 mg (Natrii valproas) Tabletki o przedłużonym uwalnianiu
 Ulotka dołączona do opakowania: informacja dla pacjenta Convival Chrono, 500 mg (Natrii valproas) Tabletki o przedłużonym uwalnianiu Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi
Ulotka dołączona do opakowania: informacja dla pacjenta Convival Chrono, 500 mg (Natrii valproas) Tabletki o przedłużonym uwalnianiu Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CONDYLINE, 5 mg/ml, roztwór na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml roztworu na skórę zawiera 5 mg podofilotoksyny (Podophyllotoxinum).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Diohespan forte, 600 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna tabletka zawiera 600 mg diosminy (Diosminum). Pełny wykaz substancji
Ulotka dołączona do opakowania: informacja dla pacjenta. LORATADYNA GALENA, 10 mg, tabletki Loratadinum
 Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta LORATADYNA GALENA, 10 mg, tabletki Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. 1 ml syropu zawiera 2 mg fenspirydu chlorowodorku (Fenspiridi hydrochloridum).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fosidal o smaku malinowym, 2 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 2 mg fenspirydu chlorowodorku (Fenspiridi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Fosidal o smaku malinowym, 2 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml syropu zawiera 2 mg fenspirydu chlorowodorku (Fenspiridi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924 mg butamiratu.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Omnitussin, 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każdy ml syropu zawiera 1,5 mg butamiratu cytrynianu, co odpowiada 0,924
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Folacid, 5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 5 mg kwasu foliowego (Acidum folicum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Folacid, 5 mg, tabletki 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 tabletka zawiera 5 mg kwasu foliowego (Acidum folicum). Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 7,87 mg/g, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera: 4,8 mg trimebutyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Debridat, 7,87 mg/g, granulat do sporządzania zawiesiny doustnej 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml zawiesiny zawiera: 4,8 mg trimebutyny
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ambrotaxer, 15 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 15 mg ambroksolu chlorowodorku. Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Ambrotaxer, 15 mg/5 ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 5 ml syropu zawiera 15 mg ambroksolu chlorowodorku. Substancje pomocnicze:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Espumisan 100 mg/ml, krople doustne, emulsja 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: symetykon 1 ml zawiera 100 mg symetykonu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Espumisan 100 mg/ml, krople doustne, emulsja 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna: symetykon 1 ml zawiera 100 mg symetykonu.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego personelu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO SOLUVIT N, proszek do sporządzania roztworu do infuzji 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH 1 fiolka zawiera: Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu (Butamirati citras).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod, 5 mg/ml, krople doustne, roztwór 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml roztworu (22 krople) zawiera 5 mg butamiratu cytrynianu
Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego
 C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
C H A R A K T E R Y S T Y K A P R O D U K T U L E C Z N I C Z E G O 1. NAZWA PRODUKTU LECZNICZEGO Parafina ciekła Avena, 1g/ 1g, płyn doustny i do użytku zewnętrznego 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Sinecod; 1,5 mg/ml, syrop 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jeden ml syropu zawiera 1,5 mg butamiratu cytrynian (Butamirati citras). Substancje
B. ULOTKA DLA PACJENTA
 B. ULOTKA DLA PACJENTA 13 Ulotka dołączona do opakowania: informacja dla pacjenta CLARITINE ALLERGY, 1 mg/ml, syrop Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
B. ULOTKA DLA PACJENTA 13 Ulotka dołączona do opakowania: informacja dla pacjenta CLARITINE ALLERGY, 1 mg/ml, syrop Loratadinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Gaviscon Advance, (1000 mg mg)/10 ml, zawiesina doustna
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Gaviscon Advance, (1000 mg + 200 mg)/10 ml, zawiesina doustna 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu leczniczego zawiera 100 mg
Ulotka dołączona do opakowania: informacja dla pacjenta. Duphalac, 667 mg/ml, roztwór doustny. Lactulosum
 Ulotka dołączona do opakowania: informacja dla pacjenta Duphalac, 667 mg/ml, roztwór doustny Lactulosum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Duphalac, 667 mg/ml, roztwór doustny Lactulosum Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje
Tradycyjny produkt leczniczy roślinny przeznaczony do stosowania w określonych wskazaniach wynikających wyłącznie z jego długotrwałego stosowania.
 1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
1. NAZWA PRODUKTU LECZNICZEGO Avioplant 250 mg kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera 250 mg sproszkowanego kłącza imbiru (Zingiber officinale Roscoe, rhizoma). Substancja pomocnicza
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Produkt leczniczy zawiera barwniki: tytanu dwutlenek (E 171), erytrozynę (E 127) i żółcień chinolinową (E 104).
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg etamsylatu (Etamsylatum). Produkt
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CYCLONAMINE, 500 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka twarda zawiera 500 mg etamsylatu (Etamsylatum). Produkt
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NERVOMIX Forte, kapsułka twarda 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kapsułka zawiera: Substancje czynne: Valerianae radix 210 mg, Lupuli
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Syrop z bluszczu Labima 5,4 mg/ml, syrup 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Suchy wyciąg z liści bluszczu (Hedera helix L., folium). 1 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Syrop z bluszczu Labima 5,4 mg/ml, syrup 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Suchy wyciąg z liści bluszczu (Hedera helix L., folium). 1 ml
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZNEGO HIRUDOID 0,3 g/100 g maść 2. SKŁAD JAKOŚCIOWY l ILOŚCIOWY 100 g maści zawiera: 0,3 g/ 100g mukopolisacharydowego polisiarczanu (Mucopolisaccharidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZNEGO HIRUDOID 0,3 g/100 g maść 2. SKŁAD JAKOŚCIOWY l ILOŚCIOWY 100 g maści zawiera: 0,3 g/ 100g mukopolisacharydowego polisiarczanu (Mucopolisaccharidum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Catosal 10%, roztwór do wstrzykiwań dla psów, kotów i koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Catosal 10%, roztwór do wstrzykiwań dla psów, kotów i koni 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alermed, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy zapoznać się z treścią ulotki przed zażyciem leku. - Należy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Paracetamol APTEO MED, 500 mg, tabletki. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg paracetamolu (Paracetamolum). Substancja
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Paracetamol APTEO MED, 500 mg, tabletki. 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda tabletka zawiera 500 mg paracetamolu (Paracetamolum). Substancja
Ulotka dołączona do opakowania: informacja dla pacjenta. Pulneo, 2 mg/ml, syrop Fenspiridi hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta Pulneo, 2 mg/ml, syrop Fenspiridi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Pulneo, 2 mg/ml, syrop Fenspiridi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ASMAG B 20 mg jonów magnezu + 0,25 mg pirydoksyny chlorowodorku, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG B 20 mg jonów magnezu + 0,25 mg pirydoksyny chlorowodorku, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG B 20 mg jonów magnezu + 0,25 mg pirydoksyny chlorowodorku, tabletki Magnesii hydroaspartas + Pyridoxini hydrochloridum Należy uważnie zapoznać
ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas
 Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla użytkownika ASMAG FORTE 34 mg jonów magnezu, tabletki Magnesii hydroaspartas Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Zineryt 40 mg/ml + 12 mg/ml, proszek i rozpuszczalnik do sporządzania roztworu do stosowania na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CIBA-GEIGY Sintrom 4
 CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
CIBA-GEIGY Sintrom 4 Sintrom 4 Substancja czynna: 3-[a-(4-nitrofenylo-)-0- -acetyloetylo]-4-hydroksykumaryna /=acenocoumarol/. Tabletki 4 mg. Sintrom działa szybko i jest wydalany w krótkim okresie czasu.
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika DEPAKINE 288,2 mg/5 ml, syrop (Natrii valproas) Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie
Ulotka dołączona do opakowania: informacja dla użytkownika DEPAKINE 288,2 mg/5 ml, syrop (Natrii valproas) Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO NAPROXEN EMO, 100 mg/g, żel 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g żelu zawiera 100 mg naproksenu (Naproxenum) Zawiera również etylu parahydroksybenzoesan.
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA 1 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Alerzina, 10 mg, tabletki powlekane (Cetirizini dihydrochloridum) Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA WŁASNA PRODUKTU LECZNICZEGO Feminon PMS, 4 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH Każda kapsułka twarda Feminon PMS zawiera
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Nootropil 20%, 200 mg/ml, roztwór doustny Nootropil 33%, 333 mg/ml, roztwór doustny Piracetamum Należy uważnie zapoznać się z treścią ulotki przed
Ulotka dołączona do opakowania: informacja dla pacjenta Nootropil 20%, 200 mg/ml, roztwór doustny Nootropil 33%, 333 mg/ml, roztwór doustny Piracetamum Należy uważnie zapoznać się z treścią ulotki przed
