Ćwiczenie 1. Pomiar ilości drobnoustrojów
|
|
|
- Janusz Król
- 8 lat temu
- Przeglądów:
Transkrypt
1 Ćwiczenie 1. Pomiar ilości drobnoustrojów Metody bezpośredniego liczenia drobnoustrojów A. Liczenie drobnoustrojów przy użyciu komór BÜRKERA i THOMA Komory do liczenia drobnoustrojów pod mikroskopem to najczęściej szklane płytki z wyciętym wgłębieniem, podzielonym na kwadraty lub prostokąty o znanej powierzchni. Po naniesieniu rozcieńczenia do komory dokonuje się liczenia komórek widocznych w obrazie mikroskopowym, a następnie przelicza się ich liczbę na 1 cm³ badanego materiału. Najczęściej stosuje się komory BÜRKERA i THOMA Liczbę komórek przelicza się według wzorów: Komora Thoma: 4x 10 6 an a-średnia liczba komórek w małym kwadracie n- rozcieńczenie badanej próby Komora Bürkera: 2,5 x 10 5 an a - średnia liczba komórek w małym kwadracie n- rozcieńczenie badanej próbki B. Mikroskopia fluorescencyjna (DEFT) Wykonanie oznaczenia obejmuje filtrowanie odpowiednio przygotowanej próby a następnie barwienie osiadłych na filtrze drobnoustrojów fluorescencyjnym barwnikiem (oranżem akrydyny) i policzenie liczby bakterii przy użyciu mikroskopu fluorescencyjnego. W metodzie tej komórki żywe barwią się na kolor ZIELONY, natomiast martwe na kolor POMARANCZOWY. Metody hodowlane stosowane do oznaczania liczby drobnoustrojów A. Oznaczanie najbardziej prawdopodobnej liczby drobnoustrojów(npl) Oznaczanie liczby drobnoustrojów metodą płytkową Metoda oznaczania liczby drobnoustrojów na podłożu stałym zakłada, że liczba powstających kolonii odpowiada liczbie żywych komórek w badanej próbie. Wynik podaje się w jednostkach tworzących kolonie jtk (ang.cfu- colony forming units)w 1g lub 1 cm³ produktu. a. posiewy wgłębne Na płytki Petriego nanosi się po 1cm³ wybranych kolejnych rozcieńczeń w dwóch powtórzeniach, a następnie wylewa się określone podłoże ogrzane do temp C w łaźni wodnej. W przypadku badania w kierunku bakterii mezofilnych płytki inkubuje się w 30 C przez 72 godziny lub w temperaturach optymalnych dla wybranych grup drobnoustrojów. Do odczytu wybiera się płytki z 2 kolejnych rozcieńczeń, na których wyrosło od 30 do 300 kolonii. Liczbę drobnoustrojów (L) w 1 cm³ lub 1 g próbki oblicza się wg wzoru: C d / (N1+ 0,1N2) C-suma kolonii na wszystkich płytkach wybranych do liczenia N1-liczba płytek z pierwszego liczonego rozcieńczenia N2-liczba płytek z drugiego liczonego rozcieńczenia d - wskaźnik rozcieńczenia odpowiadający pierwszemu (najniższemu) liczonemu rozcieńczeniu Do odczytu wyników, można wybrać jedno rozcieńczenie, zliczyć kolonie na płytkach z równoległych powtórzeń, wyliczyć średnią liczbę kolonii w rozcieńczeniu i przeliczyć na 1 cm³ lub 1 g próby, mnożąc przez odwrotność rozcieńczenia. b. posiewy powierzchniowe Na płytki Petriego z zestalonym podłożem nanosi się po 0,1 cm³ wybranych, kolejnych rozcieńczeń próby w dwóch powtórzeniach. Materiał rozprowadza się jałową głaszczką na powierzchni całego podłoża, aż do wyschnięcia. Przy oznaczaniu liczby bakterii mezofilnych płytki inkubuje się w temp.30 C przez 72 h, przy oznaczaniu innych grup drobnoustrojów należy stworzyć optymalne warunki temperaturowe i czasowe potrzebne do wzrostu drobnoustrojów. Do odczytu wybiera się płytki z 2 kolejnych rozcieńczeń, na których wyrosło od 15 do 150 kolonii. Liczbę drobnoustrojów (L) w 1 cm³ lub 1g próbki oblicza się wg wzoru: C d a/ (N1+0.1N2) C - suma kolonii na wszystkich płytkach wybranych do liczenia N1 - liczba płytek z pierwszego liczonego rozcieńczenia N2 - liczba płytek z drugiego liczonego rozcieńczenia D - wskaźnik rozcieńczenia odpowiadający pierwszemu (najniższemu) liczonemu rozcieńczeniu A - współczynnik posianej ilości materiału przy posiewie 0,1 cm³,a=10
2 SCHEMAT WYKONANIA ROZCIEŃCZEŃ I POSIEWÓW METODĄ WGŁĘDNĄ I POWIERZCHNIOWĄ Produkt badany 10 ml lub 10 mg produktu badanego +90 ml płynu fizjologicznego (rozcieńczenie 10¹) 1 ml rozcieńczenia 10¹ +9 ml płynu fizjologicznego (rozcieńczenie 10²) 1 ml rozcieńczenia 10²+9 ml płynu fizjologicznego (rozcieńczenie 10³) Posiew wgłębny (po 1 ml rozcieńczeń) Posiew powierzchniowy (po 0,1 ml rozcieńczeń) B. Oznaczanie liczby drobnoustrojów metodą sączenia przez filtry membranowe Dla prób o niewielkiej liczbie drobnoustrojów można zastosować metodę polegającą na przesączeniu badanej próbki (np. określona objętość) przez sączek membranowy, a następnie położeniu sączka na podłożu stałym i po okresie inkubacji policzeniu kolonii wyrosłych na powierzchni sączka. C. Określenie ilości bakterii na podstawie zmętnienia zawiesiny według skali McFarlanda Oryginalne standardy zawierają określone ilości chlorku baru i kwasu siarkowego razem. Mieszanie tych dwóch związków powoduje zmętnienie roztworu wskutek powstawania osadu siarczanu baru. Zmętnienie odpowiadające 0.5 w skali McFarland powstaje poprzez zmieszanie 0,05 ml -1,175% dwuwodnego chlorku baru (BaCl 2 2H 2 O), z 9,95 (H 2 SO 4) ml 1% kwasu siarkowego. Standard McFarlanda ,0% chlorekbaru (ml) ,0% Kwassiarkowy (ml) Gęstość komórek (1x10 8 cfu/ml) % Transmitancji Absorbancja * Ćwiczenie 2. Określenie cech metabolicznych drobnoustrojów wykorzystywanych w celach przemysłowych. A.Określenie zdolności proteolitycznych Posiew szczepów na bulion z żelatyną w celu wykrycia drobnoustrojów rozkładających żelatynę B.Określenie zdolności do rozkładu cukrów Posiew na podłoże Hugh- Leifsona- zdolność rozkładu glukozy Posiew na podłoże trójcukrowe z cytrynianem żelaza- określenie zdolności do rozkładu glukozy, laktozy, sacharozy i siarkowodoru. C.Określenie innych cech metabolicznych drobnoustrojów Posiew na wodę peptonową określenie zdolności do reakcji Voges- Proskaurea służącą do różnicowanie bakterii ze względu na zdolność do wytwarzania acetylometylokarbinolu (acetoiny) Posiew na podłoże z mocznikiem- Christensena- zdolność do rozkładu mocznika do dwutlenku węgla i amoniaku. Posiew na podłoże Simonsa- zdolność do wykorzystywania cytrynianu jako źródła węgla. D.Oznaczanie kwasowości miareczkową w ᵒSH 24-godzinnych hodowli szczepów fermentacji mlekowej. W tym celu 20 cm³ hodowli przenieść do suchej kolbki stożkowej i wobec fenoloftaleiny zobojętniać 0,25M roztworem NaOH. Kolejno podać kwasowość hodowli w ᵒSH ( ilość zużytej do zobojętnienia 100cm³ roztworu/ produktu zasady). Następnie obliczyć ilość produkowanego przez szczepy kwasu mlekowego, korzystając z przelicznika: 1ᵒSH= 0,0225% kwasu mlekowego
3 Ćwiczenie 1 i 2 karta zaliczeniowa Test Wzory Candida Bacillus E. coli komorabürkera komorathoma DEFT Filtr membranowy Metoda rozcieńczeniowa Posiew wgłębny Metoda rozcieńczeniowa Posiew powierzchniowy Oznaczenie liczby drobnoustrojów metodą filtracji membranowej Określenie zdolności proteolitycznych szczepów Określenie zdolności do rozkładu cukrów Określenie zdolności do wytwarzania acetoiny Określenie zdolności do rozkładu mocznika Określenie zdolności wytwarzania cytrynianu Nazwisko i imię: Zaliczenie:
4 Ćwiczenie 3. Izolacja szczepów Bacillus z gleby 1. Izolacja szczepów Bacillus z gleby. Sprawdzanie cech użytkowych wyizolowanych szczepów z rodzaju Bacillus. Izolacja szczepów Bacillus z gleby: Procedura wykonania: W celu izolacji szczepów Bacillus z gleby należy napełnić łaźnię wodną do połowy objętości i podgrzać do osiągnięcia temperatury 80 o C. Próbkę gleby w warunkach sterylnych dodać do kolbki z 90 ml jałowej soli fizjologicznej, wytrząsać intensywnie przez 10 minut (otrzymane w ten sposób rozcieńczenie to 10-1 ). Próbę pozostawić na 10 min w celu sedymentacji makrocząstek glebowych, a po zsedymentowaniu próbki wykonać kolejne rozcieńczenia (od 10-2 do10-4 ) w probówkach z 9 ml soli fizjologicznej.przygotowane rozcieńczenia roztworu glebowego umieścić w gorącej łaźni wodnej (<80 0 C) na 10 minut. Upewnić się, że poziom wody w łaźni jest wyższy od poziomu roztworu w probówkach. Jest to ważne ze względu na konieczność równomiernego ogrzania próbki. Podgrzane próbki schłodzić do temperatury pokojowej. Z przygotowanych, schłodzonych roztworów wykonać posiew metodą płytek mazanych (na płytki Petriego z zestalonym podłożem stałym bulion agarowy nanieść po 0,1 ml z rozcieńczeń ). Inkubować płytki przez 7 dni. Sprawdzanie cech użytkowych wyizolowanych szczepów z rodzaju Bacillus. Procedura wykonania: A. Określenie zdolności wyizolowanych szczepów Bacillus do produkcji enzymów amylolitycznych. Szybki test określający zdolność szczepów do degradacji skrobi: Z wybranych kolonii bakterii wyrosłych na podłożu bulion-agar sporządzić zawiesinę w soli fizjologicznej poprzez przeniesienie ezą mikrobiologiczną materiału do kropli soli fizjologicznej na szkiełku podstawowym.przygotować następujące próby na szkiełku podstawowym: - roztwór skrobi + zawiesina bakteryjna, - woda destylowana + zawiesina bakteryjna, - roztwór skrobi + woda destylowana. Należy pamiętać o dokładnych oznaczeniu poszczególnych prób! Do każdej próby delikatnie wprowadzić po kropli płynu Lugola odczekać 30 min. Zmiana barwy na czerwoną, żółtą lub odbarwienie próby wskazuje na zdolność bakterii do rozkładu skrobi. Barwa niebieska świadczy o braku rozkładu skrobi. B. Określenie zdolności wyizolowanych szczepów Bacillus do produkcji enzymów lipolitycznych: Pojedyncze kolonie szczepu Bacillus wyrosłe na podłożu z dodatkiem tłuszczu zalać 20% roztworem siarczanu miedzi (II). Pojawienie się zielonego zabarwienia kolonii świadczy o zdolności hydrolizy tłuszczu C. Określenie zdolności wyizolowanych szczepów Bacillus do produkcji enzymów proteolitycznych: Powierzchnię płytki przesianej redukcyjnie z podłożem żelatynowym Fraziera zalać nasyconym roztworem siarczanu amonowego lub odczynnikiem Fraziera, zamknąć płytkę i pozostawić na 5 minut. Nadmiar płynu ostrożnie odpipetować. Obecność kolonii wokół których powstały strefy przejaśnienia świadczy o hydrolizie białka. Wzrost bakterii w probówce z 1% wodą peptonową w postaci zmętnienia, kożucha czy osadu świadczy o aktywności proteolitycznej. Po dodaniu kilku kropel odczynnika Nesslera pojawienie się pomarańczowej zabarwienia wskazuje na aktywność amonifikacyjną wyizolowanych szczepów. D. Identyfikacja wyizolowanych szczepów metodą Grama, wykrywanie przetrwalników.
5 ĆWICZENIA 3 - Karta zaliczeniowa Rodzaj testu Szczep badany Barwienie metodą GRAMA(obecność przetrwalników) Zdolność do produkcji enzymów amylolitycznych Zdolność do produkcji enzymów lipolitycznych Zdolność do produkcji enzymów proteolitycznych (podłoże stałe) Zdolność do produkcji enzymów proteolitycznych (podłoże płynne) Imię i Nazwisko Zaliczenia
6 Ćwiczenie 4. Mikroflora wybranych produktów żywnościowych 4. Mikroflora wybranych produktów żywnościowych - wykonanie posiewów wybranych produktów spożywczych: kefir, ser pleśniowy, sok owocowy, mięso drobiowe, mleko odtłuszczone w proszku - określenie bakterii kwaszących typu mlekowego - oznaczanie liczby bakterii z grupy coli metodą płytkową - wykrywanie obecności bakterii Campylobacterspp. - oznaczanie liczby drożdży i pleśni metodą płytkową - oznaczanie liczby drobnoustrojów tlenowych, mezofilnych metodą płytkową - oznaczanie liczby gronkowców koagulazododatnich - oznaczanie liczby Bacillus cereus metodą płytkową Kontynuacja ćwiczenia Odczyt wykonanych poprzedniego dnia posiewów oraz wykonanie testów diagnostycznych służących identyfikacji drobnoustrojów Określenie liczby bakterii kwaszących typu mlekowego wg. Normy PN-90-A-75052/07:1990 Materiał badany: kefir, mleko odtłuszczone w proszku Roztwór fizjologiczny z peptonem (10 g +90 ml rozcieńczenia) Zmodyfikowane podłoże Blickfeldta- posiew metodą zalewową, inkubacja h Testy potwierdzające Test katalazy barwienie metodą Grama Oznaczanie liczby bakterii z grupy coli metodą płytkową wg normy PN-ISO 4832:3007 Materiał badany: kefir, sok owocowy, mięso drobiowe, mleko odtłuszczone w proszku Roztwór fizjologiczny z peptonem (10 g/ml + 90 ml rozcieńczenia) - zawiesina wyjściowa Agar z fioletem krystalicznym, czerwienią obojętną, żółcią i laktozą (VRBL) - posiew metodą zalewową 2 etapową: -1 ml próbki produktu płynnego lub 1 ml zawiesiny wyjściowej przenieść na 2 płytki, zalać 15 ml pożywki VRBL o temp.45 C. Po zestaleniu płytki zalać 4 ml pożywki VRBL o temp.45 C (inkubacja odwróconych płytek -37 C -24 h) -płytka kontrolna z pożywką (w przypadku mleka i produktów mlecznych ) -inkubacja -30 C- 24 h W przypadku obecności nietypowych kolonii pobrać 5 kolonii i posiać do probówek z bulionem z zielenią brylantynową, laktozą i żółcią inkubacja 37 C- 24 h Wynik: Podłoże VRBL- ciemno- purpurowo-czerwone kolonie otoczone czerwoną strefą wytrącanej żółci(wynik+) Bulion z zielenią brylantynową, laktozą i żółcią wynik += gaz + Wykrywanie obecności bakterii Campylobacterspp. Materiał badany: mięso drobiowe Naważka x g/ml + 9 ml bulionu TSB- inkubacja w atmosferze mikroareofilnej - 37 C- 48 h Posiew zawiesiny na podłoże mccda- inkubacja 41,5 C- 44 C Testy potwierdzające na 5 typowych lub podejrzanych koloniach Przesiew na agar z dodatkiem krwi metodą powierzchniową inkubacja 41,5 C- 24h Barwienie metodą Grama - test oksydazy - test katalazy - wrażliwość na kwas nalidyksowy i cefalotynę - test z hipuranem - test z krążkiem zawierającym octan indoksylu
7 Oznaczanie liczby drożdży i pleśni metodą płytkową wg normy PN-ISO :2009 Materiał badany: ser pleśniowy, jogurt, sok owocowy Metoda liczenia kolonii w produktach o aktywności wody niż 0,95 0,1% wody peptonowej (x g/ml próby + 9 ml rozcieńczalnika) Płytka agarowa z dichloranem, różem bengalskim i chloramfenikolem (DRBC) lub podłoże Sabouradou - posiew 0,1 ml próbki produktu płynnego oraz wykonanie kolejnych rozcieńczeń dziesiętnych - posiew na 1 płytkę Petriego po 0,1 ml zawiesiny wyjściowej. Inkubacja wieczkiem do góry 25 C- 5dni W celu ułatwienia oznaczenia niskiej liczby drożdży i pleśni można zwiększyć objętość posiewanego inokulum do 0,3 ml i posiewać na 3 równoległe płytki Oznaczanie liczby drobnoustrojów tlenowych mezofilnych metodą płytkową w 30 C wg normy PN- EN ISO 4833: Ap 1:2005 Materiał badany: mięso drobiowe, mleko odtłuszczone w proszku Roztwór fizjologiczny z peptonem Podłoże do oznaczania ogólnej liczby drobnoustrojów posiew metodą zalewową na 2 płytki 1 ml zawiesiny wyjściowej ml pożywki o temp.44 C-47 C (przetwory mleczne- pożywka z dodatkiem 1 g mleka w proszku na 1 litr pożywki) - inkubacja 30 C- 72 h Oznaczanie liczby gronkowców koagulazododatnich wg normy PN- EN ISO 6888:1:2001+A 1:2004 Materiał badany: mleko odłtłuszczone w proszku, ser pleśniowy, kefir Roztwór fizjologiczny z peptonem Podłoże agar Baird-Parkera- posiew metodą powierzchniową po 0,1 ml zawiesiny na 2 płytki lub 1 ml zawiesiny na jedną dużą płytkę agarową Inkubacja 37 C 24 h- 48h Z każdej płytki przenieść 5 kolonii typowych lub 5 kolonii nietypowych do bulionu mózgowo-sercowego inkubacja 37 C- 24h Test koagulazy Oznaczanie liczby Bacillus cereus metodą płytkową wg normy PN-EN ISO 7932:2005 Materiał badany: sok owocowy, mleko w proszku, kefir, ser pleśniowy Roztwór fizjologiczny z peptonem Podłoże agarowe MYP rozprowadzić po 0,1 ml zawiesiny wyjściowej na 2 płytki z pożywką Inkubacja 30 C h 5 podejrzanych kolonii przesiewamy na agar z dodatkiem krwi baraniej Preparat barwiony metodą Grama Wynik: Podłoże MYP- duże, różowe kolonie (zdolność do fermentacji mannitolu)otoczone strefą zmętnienia (wytwarzanie lecytynazy) Podłoże agar z dodatkiem krwi baraniej- zdolność do wytwarzania hemolizy
8 ĆWICZENIE 4- Karta zaliczeniowa Test Określenie liczby bakterii kwaszących Obserwacje i wnioski Określenie liczby bakterii z grupy coli Wykrywanie obecności bakterii Campylobacter spp. Określenie liczby drożdży i pleśni Określenie liczby bakterii mezofilnych Określenie liczby gronkowców koagulazododatnich Określenie liczby bakterii Bacillus cereus Imię i nazwisko Zaliczenie
9 Kontrola stanu sanitarno-higienicznego zakładu przemysłowego Ćwiczenie Analiza mikrobiologiczna wody - określenie liczby bakterii tlenowych rosnących w temp.22 ⁰C - określenie liczby bakterii tlenowych rosnących w temp.37⁰c - określenie liczby pałeczek grupy coli metodą filtrów membranowych - określenie liczby paciorkowców kałowych z rodzaju Enterococcus 2. Analiza mikrobiologiczna powietrza i powierzchni - ocena czystości powietrza metodą sedymentacyjna - badanie czystości powierzchni metodą szablonową - badanie czystości powierzchni z zastosowaniem płytek kontaktowych (Count-tact) 3. Analiza czystości mikrobiologicznej rąk pracowników - określenie liczby bakterii tlenowych mezofilnych - wykrywanie obecności gronkowców koagulazo-dodatnich 4. Analiza czystości opakowań - określenie liczby bakterii tlenowych mezofilnych - wykrywanie obecności pałeczek grupy coli 4b. Kontynuacja ćwiczenia 2.a. Odczyt wykonanych poprzedniego dnia posiewów oraz wykonanie testów diagnostycznych służących identyfikacji drobnoustrojów 1. Analiza mikrobiologiczna wody Określenie liczba bakterii tlenowych rosnących w temp. 22⁰C 1ml wody wodociągowej posiać metodą posiewu wgłębnego na szalkę Petriego,a następnie zalać upłynnionym agarem odżywczym. Płytki inkubować w temp. 22⁰C przez 24h. Po inkubacji zliczyć wyrosłe kolonie. Określenie liczby bakterii tlenowych rosnących w temp.37 ⁰C 1ml wody wodociągowej posiać metodą posiewu wgłębnego na szalkę Petriego,a następnie zalać upłynnionym agarem odżywczym. Płytki inkubować w temp. 37⁰C przez 24h. Po inkubacji zliczyć wyrosłe kolonie. Określenie liczby pałeczek grupy coli metodą filtrów membranowych. Przefiltrować 2 porcje po 100 cm³ prez filtry membranowe o średnicy porów 0,45µm. Filtry umieścić na płytkach z podłożem MacConkey a i inkubować w temp. 37⁰C przez 24 godziny. Po inkubacji sprawdzić wyrosłe kolonie i wykonać szybkie testy identyfikacyjne (indol, malonian, KOH) Określenie liczby paciorkowców kałowych z rodzaju Enterococcus Przefiltrować 100 cm³ wody przez filtr membranowy. Filtr umieścić na płytce z podłożem Enterococcosel agar. Płytki inkubować w temp.37⁰c przez 24 godziny. Po inkubacji zliczyć charakterystyczne czarne kolonie wyrosłe na podłożu. 2. Analiza mikrobiologiczna powietrza i powierzchni Ocena czystości powietrza metodą sedymentacyjną Płytki z podłożem agar odżywczy oraz podłoże Sabourauda ustawić w miejscu gdzie chcemy przeprowadzić badanie powietrza. Płytki otworzyć i pozostawić na 5, 10 lub 15 minut podczas których następuje sedymentacja komórek na powierzchnię płytki. Po tym czasie zamknąć płytki i wstawić do inkubacji. Po inkubacji zliczyć wyrosłe kolonie,a liczbę bakterii i grzybów w 10 litrach powietrza (X) obliczyć ze wzoru: X= ( a x 100) / ( b x c ), a- Liczbakoloniiwyrosłychnapłytce b- Powierzchniapłytki c- C-współczynnik czasu ekspozycji wynoszący 1 dla 5 min, 2-10 min, 3-15 min. Wynik: Pomieszczenie produkcyjne przemysłu spożywczego Sale wykładowe i sale ćwiczeń Liczba bakterii tlenowych jtk/m³ Nie więcej niż 2000 jtk/m³ Liczba grzybów 0-50 jtk/m³ Nie więcej niż 2000 jtk/m³ Badanie czystości powierzchni z zastosowaniem płytek kontaktowych (Count-Tact) Zdjąć pokrywkę płytki i przyłożyć podłoże bezpośrednio do badanej powierzchni, po czym nałożyć pokrywkę i inkubować. Po inkubacji zliczyć kolonie wyrosłe na powierzchni podłoża.
10 3. Analiza czystości mikrobiologicznej rąk pracowników Określenie liczby bakterii tlenowych mezofilnych Wykonać wymaz z wewnętrznej strony dłoni, a następnie wymazówkę umieścić w kolbie z solą fizjologiczną i wytrząsać 5 minut. Pobrać po 1 cm³ popłuczyn i metodą umieścić na sterylnej płytce Petriego. Płytkę zalać upłynnionym agarem odżywczym i inkubować w temp. 30⁰C przez 72 godziny. Po inkubacji policzyć wyrosłe kolonie i przeliczyć na 40 cm³ płynu. Wykrywanie obecności gronkowców koagulazo-dodatnich Wykonać wymaz z wewnętrznej strony dłoni, a następnie wymazówkę umieścić w kolbie z solą fizjologiczną i wytrząsać 5 minut. Pobrać po 1 cm³ popłuczyn i posiać metodą powierzchniową na płytkę z podłożem Chapmana. Inkubować 37 ⁰C przez 24 h. Po inkubacji określić obecności żółtych kolonii, a następnie wykonać test koagulazy. Wymagania: Liczba bakteriit lenowych mezofilnych Obecność gronkowców koagulazododatnich Stopień czystości rąk Poniżej 100 Nb. Ręce czyste Nb. Ręce dostatecznie czyste Powyżej 1000 Nb. Ręce brudne 4. Analiza czystości opakowań Określenie liczby bakterii mezofilnych Do badanego naczynia np. butelki wlać 20 cm³ NaCl z dodatkiem 0,05 % tiosiarczanu sodu, który jest inaktywatorem pozostałości detergentów i środków dezynfekujących. Naczynie zamknąć korkiem a następnie ustawić w pozycji poziomej obracając ją płukać 20- krotnie całą jej powierzchnię. Po 1 cm³ popłuczyn przenieś na sterylną płytkę Petriego, po czym zalać upłynnionym agarem odżywczym. Inkubować w temp.30 ⁰C przez 72 h. Po inkubacji policzyć wyrosłe kolonie i przeliczyć na 20 cm³ płynu płuczącego. Wykrywanie obecności pałeczek grupy coli Do badanego naczynia np. butelki wlać 20 cm³ NaCl z dodatkiem 0,05 % tiosiarczanu sodu, który jest inaktywatorem pozostałości detergentów i środków dezynfekujących. Naczynie zamknąć korkiem a następnie ustawić w pozycji poziomej obracając ją płukać 20- krotnie całą jej powierzchnię. Po 1 cm³ popłuczyn przenieść na podłoże McConkey a. Inkubować w temp.30⁰c przez 48 h. Wymagania: Pojemność opakowania Liczba bakterii tlenowych Obecność pałeczek grupy coli Stopień czystości 1 litr Poniżej 1000 Nb. Dobry 1 litr Poniżej 1500 Nb. Dostateczny 0,5 litra Powyżej 500 Nb. Dobry 0,5 litra Poniżej 750 Nb. Dostateczny 0,25 litra Poniżej 200 Nb. Dobry 0,25 litra Poniżej 500 Nb. dostateczny
11 Ćwiczenie 6 - karta zaliczeniowa Test Określenie liczby bakterii tlenowych rosnących w temp.22 C Obserwacje i wnioski Określenie liczby bakterii tlenowych rosnących w temp.37 C Określenie pałeczek grupy coli metodą filtrów membranowych Określenie liczby paciorkowców kałowych z rodzaju Enterococcus Ocena czystości powietrza metodą sedymentacyjna Ocena czystości powierzchni z zastosowaniem płytek kontaktowych (Counttact) Określenie liczby bakterii tlenowych mezofilnych na rękach Wykrywanie obecności gronkowców koagulazododatnich na rękach Określenie liczby bakterii tlenowych mezofilnych na opakowaniu Wykrywanie obecności pałeczek grupy coli na opakowaniu Imię i nazwisko Zaliczenie
12 Ćwiczenie 7. Immobilizacja (unieruchomienie) enzymu i komórek drożdży. 1. W zlewce o objętości 100 cm³ przygotować 80 ml 1,5% roztwór CaCl2 w wodzie destylowanej 2. W próbówce sporządzić 2% roztwór alginianu sodu, w 5 ml wody destylowanej. Alginian sodu niezbyt dobrze rozpuszcza się w wodzie, wymaga ciepłej wody, wytrząsania i cierpliwości w czasie rozpuszczania ( roztwór alginianu ogrzewamy umieszczając w ciepłej wodzie- ogrzanej w małej zlewce na kuchence elektrycznej, lub w łaźni wodnej w temperaturze ok ᵒC). 3. Odważyć/ odmierzyć 2g/ml drożdży piekarniczych/winiarskich. 4. Rozpuścić i wymieszać ( vortex) odważone drożdże w probówce zawierającej 5 ml wody destylowanej. Zakryć probówkę folią aluminiową i pozostawić do wyrośnięcia przez 10 minut w temperaturze pokowej. 5. Do probówki z rozpuszczonym alginianem wlać zawiesinę drożdży i wsypać całą zawartość kapsułki zawierającej bakterie z rodzaju Lactobacillus. Całość dokładnie wymieszać ( wytrząsanie, vortex). 6. Nabrać ok. 10 ml mieszaniny drożdży, bakterii i alginianu sodu do strzykawki- użyć wężyka gumowego, następnie zdjąć wężyk i dodawać powoli, po kropli roztwór do zlewki z 1,5% CaCl2. Nie wolno dopuścić aby końcówka strzykawki zetknęła się z roztworem CaCl2. Po wkropleniu całości należy dokładnie umyć strzykawkę, wężyk i używane probówki z pozostałości alginianu!!! 7. Pozostawić kulki immobilizowanych komórek drożdży i bakterii do utwardzenia w roztworze CaCl2 przez 10 minut. 8. Odcedzić powstałe kuleczki z roztworu CaCl2 za pomocą sitka ( przelewając zawartość przez sitko do drugiej zlewki) i pozostawić aż odciekną. 9. Kuleczki przechowywać w zlewce z jałową wodą destylowaną. 7. Przygotowanie fermentowanego mleka 1. Wlać ok. 300 ml mleka do zlewki ml, przykryć folią aluminiową i wstawić do łaźni wodnej o temperaturze ok ᵒC na 10 minut (do kontroli temperatury wody użyc termometru) 2. Ogrzane mleko poddać procesowi homogenizacji- ok. 5 minut. 3. Po homogenizacji mleko spasteryzować zagotowując je na kuchence- w trakcie gotowania mleko należy od czasu do czasu zamieszać!!! 4. Po pasteryzacji mleko schłodzić do temperatury ok. 40ᵒC w zimniej wodzie. 5. Rozlać po ok. 150ml mleka do 2 jałowych kolb o pojemności cm³, do pierwszej dodać 3-4 łyżeczki jogurtu naturalnego, do drugiej kuleczki immobilizowanych komórek drożdży i bakterii ( po uprzednim odcedzeniu, kuleczki pobrać łyżeczką plastikową). Całość delikatnie zamieszać. 6. Dokonać pomiaru ph mleka. Należy pamiętać, aby dokładnie płukać elektrodę wodą destylowaną i delikatnie ją osuszyć bibułą przed każdym pomiarem. 7. Szczelnie zakryć kolby folią aluminiową, opisać i inkubować w temperaturze ok. 30ᵒC przez ok. 1-2 godziny. 8. Po tym czasie wyciągnąć kolby z termostatu i przechowywać w chłodnym miejscu do kolejnych zajęć.
13 Ćwiczenie 7. - kontynuacja Wytwarzanie i analiza produktów mlecznych 1. Analiza wyników fermentacji mlekowej. Dokonać pomiaru ph otrzymanych produktów i opisać zaobserwowane zmiany ( konsystencja, barwa itd.) 2. Immobilizacja laktazy UWAGA!!! Wszystkie roztwory używane w doświadczeniu muszą być przygotowane na bazie wody destylowanej ( jony wapnia w wodzie kranowej mogą wchodzić w reakcje z alginianem sodu). 1. W zlewce o objętości 100 cm³ przygotować 80 ml 1,5 % roztwór CaCl2 w wodzie destylowanej. 2. W probówce sporządzić 2% roztwór alginianu sodu, w 5 ml wody destylowanej. Alginian sodu niezbyt dobrze rozpuszcza się w wodzie, wymaga ciepłej wody, wytrząsania i cierpliwości w czasie rozpuszczania ( roztwór alginianu ogrzewamy umieszczając w ciepłej wodzie- ogrzanej w małej zlewce na kuchence elektrycznej, lub w łaźni wodnej w temperaturze ok ᵒC). 3. Za pomocą glukometru oznaczyć w mleku ( nie UHT), które będzie używane w doświadczeniu poziom glukozy 4. Wprowadzić do probówki z roztworem alginianu sodu zawartość kapsułki z enzymem laktazą. Całość dokładnie wymieszać (vortex) 5. Mieszaninę enzymu i alginianu pobrać do strzykawki- użyć wężyka gumowego i delikatnie wkraplać do zlewki z CaCl2. Nie wolno dopuścić aby końcówka strzykawki zetknęła się z roztworem CaCl2. Po wkropleniu całości należy dokładnie umyć strzykawkę, wężyk i używane probówki z pozostałości alginianu!!! 6. Pozostawić kulki immobilizowanego enzymu do utwardzenia w roztworze CaCl2 przez 10 minut. 7. Odcedzić powstałe kuleczki z roztworu Ca Cl2 za pomocą sitka ( przelewając zawartość przez sitko do drugiej zlewki) i pozostawić aż odciekną. 8. Jako kolumny wypełnionej immobilizowaną laktazą użyć cylindra strzykawki ( 10 ml). W tym celu należy wyjąć tłoczek ze strzykawki, umieścić w środku kawałeczek waty i ubić go delikatnie tłoczkiem tak aby grubość warstwy nie przekraczała 1 cm. Wata lub gaza zapobiegną blokowaniu wylotu cylindra strzykawki przez kuleczki enzymu. 9. Do strzykawki wprowadzić kuleczki unieruchomionego w alginianie enzymu (użyć plastikowej łyżeczki). 10. Przez tak przygotowaną kolumnę przelać powoli ok. 50 ml mleka. Otrzymaną frakcję zebrać do czystej zlewki o pojemności ml i po kilku minutach oznaczyć w niej poziom glukozy za pomocą glukometru. OPRACOWANIE WYNIKÓW: - pomiary ph, opis otrzymanego produktu i na tej podstawie wyciągnięte wnioski o przebiegu i skutkach fermentacji, - pomiary poziomu glukozy w mleku i na tej podstawie wyciągnięte wnioski dotyczące aktywności laktazy.
14 Ćwiczenie 7 - karta zaliczeniowa Ćwiczenie Obserwacje Wnioski Immobilizacja (unieruchomienie) enzymu i komórek drożdży Fermentacja mleka Analiza fermentacji mlekowej Immobilizacja laktazy Pomiar glukozy za pomocą glukometru Imię i nazwisko Zaliczenie
II. OZNACZANIE LICZBY BAKTERII Z GRUPY COLI I BAKTERII Z GRUPY COLI TYP FEKALNY METODĄ PŁYTKOWĄ W ŻYWNOŚCI I INNYCH PRODUKTACH wg PN-ISO 4832: 2007
 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
Ćwiczenie 9. Temat: Metody ilościowe w mikrobiologicznych badaniach żywności Cz.1
 Ćwiczenie 9 Temat: Metody ilościowe w mikrobiologicznych badaniach żywności Cz.1 Pobieranie prób do badań Próbka pobrana do badań mikrobiologicznych powinna być reprezentatywna tzn. powinna odzwierciedlać
Ćwiczenie 9 Temat: Metody ilościowe w mikrobiologicznych badaniach żywności Cz.1 Pobieranie prób do badań Próbka pobrana do badań mikrobiologicznych powinna być reprezentatywna tzn. powinna odzwierciedlać
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody
 ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
Ćwiczenie 7, 8. Temat: Metody ilościowe w mikrobiologicznych badaniach żywności.
 Ćwiczenie 7, 8 Temat: Metody ilościowe w mikrobiologicznych badaniach żywności. Pobieranie prób do badań Próbka pobrana do badań mikrobiologicznych powinna być reprezentatywna tzn. powinna odzwierciedlać
Ćwiczenie 7, 8 Temat: Metody ilościowe w mikrobiologicznych badaniach żywności. Pobieranie prób do badań Próbka pobrana do badań mikrobiologicznych powinna być reprezentatywna tzn. powinna odzwierciedlać
Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz?
 Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 3. Cukry mono i disacharydy
 ĆWICZENIE 3 Cukry mono i disacharydy Reakcja ogólna na węglowodany (Reakcja Molischa) 1 ml 1% roztworu glukozy 1 ml 1% roztworu fruktozy 1 ml 1% roztworu sacharozy 1 ml 1% roztworu skrobi 1 ml wody destylowanej
ĆWICZENIE 3 Cukry mono i disacharydy Reakcja ogólna na węglowodany (Reakcja Molischa) 1 ml 1% roztworu glukozy 1 ml 1% roztworu fruktozy 1 ml 1% roztworu sacharozy 1 ml 1% roztworu skrobi 1 ml wody destylowanej
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne. Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową
 II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
Ćwiczenie 11. Temat: Wskaźniki higieniczne żywności.
 Ćwiczenie 11 Temat: Wskaźniki higieniczne żywności. Wskaźniki higieniczne żywności są to grupy bakterii dostające się do żywności w wyniku niewłaściwej higieny produkcji i braku higieny osobistej pracowników.
Ćwiczenie 11 Temat: Wskaźniki higieniczne żywności. Wskaźniki higieniczne żywności są to grupy bakterii dostające się do żywności w wyniku niewłaściwej higieny produkcji i braku higieny osobistej pracowników.
liczba godzin 2 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA półpłynne stałe
 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie.
 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
WYTWARZANIE I ANALIZA PRODUKTÓW MLECZNYCH
 WYTWARZANIE I ANALIZA PRODUKTÓW MLECZNYCH Fermentacja różno-kulturowa, otrzymywanie kefiru. Kefir jest popularnym napojem mlecznym fermentowanym, wywodzącym się z Bałkanów. Sporządzany jest z mleka krowiego
WYTWARZANIE I ANALIZA PRODUKTÓW MLECZNYCH Fermentacja różno-kulturowa, otrzymywanie kefiru. Kefir jest popularnym napojem mlecznym fermentowanym, wywodzącym się z Bałkanów. Sporządzany jest z mleka krowiego
woda do 1000 ml ph=6,9-7,1. Po sterylizacji dodać nystatynę (końcowe stężenie ok. 50 μg/ml). Agar z wyciągiem glebowym i ekstraktem drożdżowym (YS)
 Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej
 III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej
III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej
XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne
 XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
VII. Fizjologia bakterii - ćwiczenia praktyczne
 VII. Fizjologia bakterii - ćwiczenia praktyczne Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej krwi baraniej
VII. Fizjologia bakterii - ćwiczenia praktyczne Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej krwi baraniej
Laboratorium 3 Toksykologia żywności
 Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
PRACOWNIA ANALIZY ILOŚCIOWEJ. Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy
 PRACOWNIA ANALIZY ILOŚCIOWEJ Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy Ćwiczenie obejmuje: 1. Oznaczenie jakościowe kwasu acetylosalicylowego 2. Przygotowanie
PRACOWNIA ANALIZY ILOŚCIOWEJ Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy Ćwiczenie obejmuje: 1. Oznaczenie jakościowe kwasu acetylosalicylowego 2. Przygotowanie
FORMULARZ CENOWY. Data:... Nazwa wykonawcy:... Siedziba wykonawcy:... Przedstawia zestawienie cenowe dla oferowanego przedmiotu zamówienia:
 1/PN/2013 Załącznik nr 2 B FORMULARZ CENOWY Data:... Nazwa wykonawcy:...... Siedziba wykonawcy:...... Przedstawia zestawienie cenowe dla oferowanego przedmiotu zamówienia: Lp. Rodzaj Norma Ilość Cena jednostkowa
1/PN/2013 Załącznik nr 2 B FORMULARZ CENOWY Data:... Nazwa wykonawcy:...... Siedziba wykonawcy:...... Przedstawia zestawienie cenowe dla oferowanego przedmiotu zamówienia: Lp. Rodzaj Norma Ilość Cena jednostkowa
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne
 XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
OSTRACODTOXKIT F Procedura testu
 OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
RAPORT Z BADAŃ 01369/2015/D/AGST. Blirt S.A Gdańsk, ul. Trzy Lipy 3/1.38. Dział DNA-Gdańsk. Nr zlecenia
 Strona1/7 Blirt S.A. 80-172 Gdańsk, ul. Trzy Lipy 3/1.38 RAPORT Z BADAŃ Dział DNA-Gdańsk Nr zlecenia 01369/2015/D/AGST NAZWA I ADRES KLIENTA Zenon Koszorz Ground-Therm Sp z o.o. Ul. Stepowa 30 44-105 Gliwice
Strona1/7 Blirt S.A. 80-172 Gdańsk, ul. Trzy Lipy 3/1.38 RAPORT Z BADAŃ Dział DNA-Gdańsk Nr zlecenia 01369/2015/D/AGST NAZWA I ADRES KLIENTA Zenon Koszorz Ground-Therm Sp z o.o. Ul. Stepowa 30 44-105 Gliwice
Ćwiczenie 8, 9, 10 Kontrola mikrobiologiczna środowiska pracy
 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 8, 9, 10 Kontrola mikrobiologiczna środowiska pracy liczba godzin 8 Badanie mikrobiologicznej czystości
MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 8, 9, 10 Kontrola mikrobiologiczna środowiska pracy liczba godzin 8 Badanie mikrobiologicznej czystości
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne
 VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
Ćwiczenie 1. Technika ważenia oraz wyznaczanie błędów pomiarowych. Ćwiczenie 2. Sprawdzanie pojemności pipety
 II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
IV. Streptococcus, Enterococcus ćwiczenia praktyczne
 IV. Streptococcus, Enterococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów paciorkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii... gatunek
IV. Streptococcus, Enterococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów paciorkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii... gatunek
1. Demonstracja preparatów bakteryjnych barwionych metodą negatywną ukazujących kształty komórek bakteryjnych.
 Ćwiczenie 1. Mikrobiologia ogólna - Budowa komórki bakteryjnej. Metody barwienia preparatów bakteryjnych. Wzrost drobnoustrojów w warunkach laboratoryjnych. Uzyskiwanie czystej hodowli. Identyfikowanie
Ćwiczenie 1. Mikrobiologia ogólna - Budowa komórki bakteryjnej. Metody barwienia preparatów bakteryjnych. Wzrost drobnoustrojów w warunkach laboratoryjnych. Uzyskiwanie czystej hodowli. Identyfikowanie
Ćwiczenie 14. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej
 Ćwiczenie 14. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej Cel ćwiczenia: Analiza mikrobiologiczno-biochemiczna fermentowanych produktów spożywczych.
Ćwiczenie 14. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej Cel ćwiczenia: Analiza mikrobiologiczno-biochemiczna fermentowanych produktów spożywczych.
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych. a. Candida albicans preparat z hodowli barwiony metoda Grama
 XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI
 Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
1. Oznaczanie aktywności lipazy trzustkowej i jej zależności od stężenia enzymu oraz żółci jako modulatora reakcji enzymatycznej.
 ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
ĆWICZENIE 4. Oczyszczanie ścieków ze związków fosforu
 ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
Instrukcja do ćwiczeń
 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Instrukcja do ćwiczeń Temat: Woda jako
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Instrukcja do ćwiczeń Temat: Woda jako
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1)
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
VIII. Pałeczki Gram-ujemne z rodziny Enterobacteriaceae
 VIII. Pałeczki Gram-ujemne z rodziny Enterobacteriaceae Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
VIII. Pałeczki Gram-ujemne z rodziny Enterobacteriaceae Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 15, Data wydania: 13 czerwca 2016 r. AB 510 Nazwa i adres GRUPA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 15, Data wydania: 13 czerwca 2016 r. AB 510 Nazwa i adres GRUPA
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 404
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 404 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 30 czerwca 2015 r. Nazwa i adres AB 404 J.S.
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 404 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 30 czerwca 2015 r. Nazwa i adres AB 404 J.S.
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1537
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1537 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 20 lipca 2016 r. Nazwa i adres UO TECHNOLOGIA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1537 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 20 lipca 2016 r. Nazwa i adres UO TECHNOLOGIA
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ
 mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ 1) Analiza sanitarna wody 2) Analiza mikrobiologiczna gleby 3) Analiza sanitarna powietrza 4) Charakterystyka szczepów bakterii opornych na antybiotyki, wyizolowanych
mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ 1) Analiza sanitarna wody 2) Analiza mikrobiologiczna gleby 3) Analiza sanitarna powietrza 4) Charakterystyka szczepów bakterii opornych na antybiotyki, wyizolowanych
Ocena czystości mikrobiologicznej cystern przewożących cukier luzem. dr Dagmara Wojtków Teresa Basińska Jesior
 Ocena czystości mikrobiologicznej cystern przewożących cukier luzem dr Dagmara Wojtków Teresa Basińska Jesior 2 2012-06-26 Plan prezentacji Mycie i dezynfekcja Kontrola mikrobiologiczna Luminometria Proces
Ocena czystości mikrobiologicznej cystern przewożących cukier luzem dr Dagmara Wojtków Teresa Basińska Jesior 2 2012-06-26 Plan prezentacji Mycie i dezynfekcja Kontrola mikrobiologiczna Luminometria Proces
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
Zjazd 5 Temat: Elementy kontroli stanu sanitarno-higienicznego zakładu przetwórstwa spożywczego i zakładu żywienia zbiorowego
 Zjazd 5 Temat: Elementy kontroli stanu sanitarno-higienicznego zakładu przetwórstwa spożywczego i zakładu żywienia zbiorowego W procesach przetwórstwa surowców rolno-spożywczych nadrzędnym zadaniem jest
Zjazd 5 Temat: Elementy kontroli stanu sanitarno-higienicznego zakładu przetwórstwa spożywczego i zakładu żywienia zbiorowego W procesach przetwórstwa surowców rolno-spożywczych nadrzędnym zadaniem jest
X. Pałeczki Gram-dodatnie. Rodzaje: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus
 X. Pałeczki Gram-dodatnie. Rodzaje: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus Gramujemne pałeczki auksotroficzne. Rodzaj: Haemophilus, Brucella, Legionella Ćwiczenie 1. Wykonanie preparatu
X. Pałeczki Gram-dodatnie. Rodzaje: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus Gramujemne pałeczki auksotroficzne. Rodzaj: Haemophilus, Brucella, Legionella Ćwiczenie 1. Wykonanie preparatu
Laboratorium. Technologia i Analiza Aromatów Spożywczych
 Laboratorium Technologia i Analiza Aromatów Spożywczych Regulamin pracowni Technologii i Analizy Aromatów Spożywczych...3 Ćw. 1. Mikrokapsułkowanie olejków eterycznych z wykorzystaniem drożdży piwnych...4
Laboratorium Technologia i Analiza Aromatów Spożywczych Regulamin pracowni Technologii i Analizy Aromatów Spożywczych...3 Ćw. 1. Mikrokapsułkowanie olejków eterycznych z wykorzystaniem drożdży piwnych...4
Temat: Analiza sanitarna wody
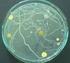 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Diagnostyka mikrobiologiczna Analityka medyczna III rok Instrukcja do ćwiczeń Temat: Analiza sanitarna
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Diagnostyka mikrobiologiczna Analityka medyczna III rok Instrukcja do ćwiczeń Temat: Analiza sanitarna
SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20006/11859/09
 SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20006/11859/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20006/11859/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
1.1 Reakcja trójchlorkiem antymonu
 ĆWICZENIE IV - WYKRYWANIE WITAMIN Odczynniki: - chloroform bezwodny, - bezwodnik kwasu octowego, - trójchlorek antymonu roztwór nasycony w chloroformie, - 1,3-dichlorohydryna gliceryny - żelazicyjanek
ĆWICZENIE IV - WYKRYWANIE WITAMIN Odczynniki: - chloroform bezwodny, - bezwodnik kwasu octowego, - trójchlorek antymonu roztwór nasycony w chloroformie, - 1,3-dichlorohydryna gliceryny - żelazicyjanek
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana. Argentometryczne oznaczanie chlorków w mydłach
 Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Argentometryczne oznaczanie chlorków w mydłach Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Argentometryczne oznaczanie chlorków w mydłach Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu AgNO
Ćwiczenie 1 Morfologia I fizjologia bakterii
 Ćwiczenie 1 Morfologia I fizjologia bakterii 1. Barwienie złożone - metoda Grama Przygotowanie preparatu: odtłuszczone szkiełko podstawowe, nałożenie bakterii ( z hodowli płynnej 1-2 oczka ezy lub ze stałej
Ćwiczenie 1 Morfologia I fizjologia bakterii 1. Barwienie złożone - metoda Grama Przygotowanie preparatu: odtłuszczone szkiełko podstawowe, nałożenie bakterii ( z hodowli płynnej 1-2 oczka ezy lub ze stałej
(54)Pożywka do wykrywania i oznaczania liczby komórek Lactobacillus acidophilus
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 187937 (21) Numer zgłoszenia: 332135 (22) Data zgłoszenia: 22.03.1999 (13) B1 (51) IntCl7 C12Q 1/06 C12N
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 187937 (21) Numer zgłoszenia: 332135 (22) Data zgłoszenia: 22.03.1999 (13) B1 (51) IntCl7 C12Q 1/06 C12N
Oznaczanie SO 2 w powietrzu atmosferycznym
 Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 16 Data wydania: 23 czerwca 2017 r. AB 510 Kod identyfikacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 16 Data wydania: 23 czerwca 2017 r. AB 510 Kod identyfikacji
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 30 lipca 2014 r. Nazwa i adres organizacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 13 Data wydania: 30 lipca 2014 r. Nazwa i adres organizacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1537
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1537 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 6 Data wydania: 12 lipca 2017 r. Nazwa i adres UO TECHNOLOGIA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1537 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 6 Data wydania: 12 lipca 2017 r. Nazwa i adres UO TECHNOLOGIA
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20005/11858/09
 SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20005/11858/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20005/11858/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
TWARDOŚĆ WODY. Ca(HCO 3 ) HCl = CaCl 2 + 2H 2 O + 2CO 2. Mg(HCO 3 ) 2 + 2HCl = MgCl 2 + 2H 2 O + 2CO 2
 TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
TWARDOŚĆ WODY Ćwiczenie 1. Oznaczanie twardości przemijającej wody wodociągowej Oznaczenie twardości przemijającej wody polega na miareczkowaniu określonej ilości badanej wody roztworem kwasu solnego o
OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI
 OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI Odczynniki: wosk pszczeli (4 g) olej parafinowy (9 cm 3 i 6 cm 3 ) oliwa z oliwek (5,5 cm 3 ) boraks (Na 2 B 4 O 7 10H 2 O) (0,2 g) olejek zapachowy (lawendowy
OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI Odczynniki: wosk pszczeli (4 g) olej parafinowy (9 cm 3 i 6 cm 3 ) oliwa z oliwek (5,5 cm 3 ) boraks (Na 2 B 4 O 7 10H 2 O) (0,2 g) olejek zapachowy (lawendowy
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 17 Data wydania: 8 maja 2018 r. AB 510 Kod identyfikacji dziedziny/przedmiotu
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 17 Data wydania: 8 maja 2018 r. AB 510 Kod identyfikacji dziedziny/przedmiotu
KATALIZA I KINETYKA CHEMICZNA
 9 KATALIZA I KINETYKA CHEMICZNA CEL ĆWICZENIA Zapoznanie studenta z procesami katalitycznymi oraz wpływem stężenia, temperatury i obecności katalizatora na szybkość reakcji chemicznej. Zakres obowiązującego
9 KATALIZA I KINETYKA CHEMICZNA CEL ĆWICZENIA Zapoznanie studenta z procesami katalitycznymi oraz wpływem stężenia, temperatury i obecności katalizatora na szybkość reakcji chemicznej. Zakres obowiązującego
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1319
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1319 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 28 stycznia 2015 r. AB 1319 Kod identyfikacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1319 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 5 Data wydania: 28 stycznia 2015 r. AB 1319 Kod identyfikacji
X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria
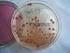 X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria Maczugowce (rodzaj Corynebacterium) Ćwiczenie 1. Wykonanie preparatu
X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria Maczugowce (rodzaj Corynebacterium) Ćwiczenie 1. Wykonanie preparatu
UWAGA NA WRZĄCY OLEJ!!!!
 ĆWICZENIE 4 Lipidy Wykazanie obecności glicerolu próba akroleinowa 0,5 ml oleju 0,5ml glicerolu kilka kryształów bezwodnego CuSO 4 2x pipetka plastikowa kuchenka elektryczna 1x chwytak do probówek Przygotuj
ĆWICZENIE 4 Lipidy Wykazanie obecności glicerolu próba akroleinowa 0,5 ml oleju 0,5ml glicerolu kilka kryształów bezwodnego CuSO 4 2x pipetka plastikowa kuchenka elektryczna 1x chwytak do probówek Przygotuj
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.0 Numer zadania: 01 Wypełnia
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.0 Numer zadania: 01 Wypełnia
Zakład Biologii Sanitarnej i Ekotechniki ĆWICZENIE 2 BUDOWA I FUNKCJE ENZYMÓW. ZASTOSOWANIE BADAŃ ENZYMATYCZNYCH W INŻYNIERII ŚRODOWISKA.
 ĆWICZENIE 2 BUDOWA I FUNKCJE ENZYMÓW. ZASTOSOWANIE BADAŃ ENZYMATYCZNYCH W INŻYNIERII ŚRODOWISKA. /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw. PWr modyfikacja: dr inż. Agnieszka Trusz-Zdybek
ĆWICZENIE 2 BUDOWA I FUNKCJE ENZYMÓW. ZASTOSOWANIE BADAŃ ENZYMATYCZNYCH W INŻYNIERII ŚRODOWISKA. /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw. PWr modyfikacja: dr inż. Agnieszka Trusz-Zdybek
GRUPA I Lp Nazwa Jm Ilość Cena jedn netto 1. Columbia agar z 5 %krwią baranią
 GRUPA I Lp Nazwa Jm Ilość Cena jedn netto 1. Columbia agar z 5 %krwią baranią 2. Agar Colubmia CNA 3. Podłoże chromogenne do posiewu moczu ze wstępną identyfikacją i oceną bakteriurii 4. Podłoże MaConkey
GRUPA I Lp Nazwa Jm Ilość Cena jedn netto 1. Columbia agar z 5 %krwią baranią 2. Agar Colubmia CNA 3. Podłoże chromogenne do posiewu moczu ze wstępną identyfikacją i oceną bakteriurii 4. Podłoże MaConkey
Ćwiczenie 1. Sporządzanie roztworów, rozcieńczanie i określanie stężeń
 Ćwiczenie 1 Sporządzanie roztworów, rozcieńczanie i określanie stężeń Stężenie roztworu określa ilość substancji (wyrażoną w jednostkach masy lub objętości) zawartą w określonej jednostce objętości lub
Ćwiczenie 1 Sporządzanie roztworów, rozcieńczanie i określanie stężeń Stężenie roztworu określa ilość substancji (wyrażoną w jednostkach masy lub objętości) zawartą w określonej jednostce objętości lub
THAMNOTOXKIT F Procedura testu
 THAMNOTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 LITR) - 5 FIOLEK ZE SKONCENTROWANYMI ROZTWORAMI SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 WLAĆ ZAWARTOŚĆ 5 FIOLEK
THAMNOTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 LITR) - 5 FIOLEK ZE SKONCENTROWANYMI ROZTWORAMI SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 WLAĆ ZAWARTOŚĆ 5 FIOLEK
Protokoły do zajęć praktycznych z mikrobiologii ogólnej i żywności dla studentów kierunku: Dietetyka
 Protokoły do zajęć praktycznych z mikrobiologii ogólnej i żywności dla studentów kierunku: Dietetyka Protokół I, zajęcia praktyczne 1. Demonstracja wykonania preparatu barwionego metodą Grama (wykonuje
Protokoły do zajęć praktycznych z mikrobiologii ogólnej i żywności dla studentów kierunku: Dietetyka Protokół I, zajęcia praktyczne 1. Demonstracja wykonania preparatu barwionego metodą Grama (wykonuje
Ćwiczenie 4. Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne
 Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1319
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1319 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 7 Data wydania: 23 czerwca 2016 r. AB 1319 Kod identyfikacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 1319 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 7 Data wydania: 23 czerwca 2016 r. AB 1319 Kod identyfikacji
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 12 Data wydania: 23 września 2013 r. Nazwa i adres organizacji
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 12 Data wydania: 23 września 2013 r. Nazwa i adres organizacji
Załącznik Nr 7 do SIWZ
 Załącznik Nr 7 do SIWZ Formularz asortymentowo - cenowy Nr 6 Pakiet Nr 6 Testy lateksowe, krążki antybiotykowe, testy MIC, szczepy wzorcowe, podłoża, odczynniki i testy diagnostyczne. Ilość Wartość Wielkość
Załącznik Nr 7 do SIWZ Formularz asortymentowo - cenowy Nr 6 Pakiet Nr 6 Testy lateksowe, krążki antybiotykowe, testy MIC, szczepy wzorcowe, podłoża, odczynniki i testy diagnostyczne. Ilość Wartość Wielkość
CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego
 16 SOLE KWASU WĘGLOWEGO CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego Zakres obowiązującego materiału Węgiel i pierwiastki 14 grupy układu okresowego, ich związki
16 SOLE KWASU WĘGLOWEGO CEL ĆWICZENIA Zapoznanie studentów z chemią 14 grupy pierwiastków układu okresowego Zakres obowiązującego materiału Węgiel i pierwiastki 14 grupy układu okresowego, ich związki
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 9
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 9 Zastosowanie metod miareczkowania strąceniowego do oznaczania chlorków w mydłach metodą Volharda. Ćwiczenie obejmuje:
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 9 Zastosowanie metod miareczkowania strąceniowego do oznaczania chlorków w mydłach metodą Volharda. Ćwiczenie obejmuje:
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Zakład Biologii Sanitarnej i Ekotechniki ĆWICZENIE 3
 ĆWICZENIE 3 ROLA ORGANIZMÓW AUTOTROFICZNYCH W ŚRODOWISKU. DROBNOUSTROJE FOTO- I CHEMOSYNTETYZUJĄCE I ICH ROLA W INŻYNIERII ŚRODOWISKA /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw.
ĆWICZENIE 3 ROLA ORGANIZMÓW AUTOTROFICZNYCH W ŚRODOWISKU. DROBNOUSTROJE FOTO- I CHEMOSYNTETYZUJĄCE I ICH ROLA W INŻYNIERII ŚRODOWISKA /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw.
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510
 ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 18 Data wydania: 17 maja 2019 r. AB 510 Nazwa i adres GRUPA
ZAKRES AKREDYTACJI LABORATORIUM BADAWCZEGO Nr AB 510 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa ul. Szczotkarska 42 Wydanie nr 18 Data wydania: 17 maja 2019 r. AB 510 Nazwa i adres GRUPA
Kontrola pożywek mikrobiologicznych. Sekcja Badań Epidemiologicznych
 Kontrola pożywek mikrobiologicznych Sekcja Badań Epidemiologicznych 27.04.2015 Zgodnie z ISO 17025 oraz ISO 15189 jednym z czynników istotnie wpływających na jakość wyników badań w przypadku badań mikrobiologicznych,
Kontrola pożywek mikrobiologicznych Sekcja Badań Epidemiologicznych 27.04.2015 Zgodnie z ISO 17025 oraz ISO 15189 jednym z czynników istotnie wpływających na jakość wyników badań w przypadku badań mikrobiologicznych,
Metody otrzymywania kwasów, zasad i soli. Reakcje chemiczne wybranych kwasów, zasad i soli. Ćwiczenie 1. Reakcja otrzymywania wodorotlenku sodu
 V. Metody otrzymywania kwasów, zasad i soli. Reakcje chemiczne wybranych kwasów, zasad i soli Zagadnienia Kwasy i metody ich otrzymywania Wodorotlenki i metody ich otrzymywania Sole i metody ich otrzymywania
V. Metody otrzymywania kwasów, zasad i soli. Reakcje chemiczne wybranych kwasów, zasad i soli Zagadnienia Kwasy i metody ich otrzymywania Wodorotlenki i metody ich otrzymywania Sole i metody ich otrzymywania
Imię i nazwisko studenta:...
 Imię i nazwisko studenta:..... Grupa:.. SPOSÓB WYKONANIA ANALIZY WYNIKI POMIARÓW ph - przygotować ph-metr i elektrodę do pomiaru - przelać do małej zlewki badaną próbę wody - zlewkę z próbą umieścić na
Imię i nazwisko studenta:..... Grupa:.. SPOSÓB WYKONANIA ANALIZY WYNIKI POMIARÓW ph - przygotować ph-metr i elektrodę do pomiaru - przelać do małej zlewki badaną próbę wody - zlewkę z próbą umieścić na
KINETYKA HYDROLIZY SACHAROZY
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Staphylococcus ćwiczenia praktyczne. a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK)
 VII. Diagnostyka mikrobiologiczna głównych drobnoustrojów odpowiedzialnych za zakażenia skóry i tkanek miękkich. Drobnoustroje z rodzajów Staphylococcus, Streptococcus, Enterococcus Staphylococcus ćwiczenia
VII. Diagnostyka mikrobiologiczna głównych drobnoustrojów odpowiedzialnych za zakażenia skóry i tkanek miękkich. Drobnoustroje z rodzajów Staphylococcus, Streptococcus, Enterococcus Staphylococcus ćwiczenia
Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona
 Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona Wymagane zagadnienia teoretyczne 1. Enzymy proteolityczne, klasyfikacja, rola biologiczna. 2. Enzymy proteolityczne krwi. 3. Wewnątrzkomórkowa
Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona Wymagane zagadnienia teoretyczne 1. Enzymy proteolityczne, klasyfikacja, rola biologiczna. 2. Enzymy proteolityczne krwi. 3. Wewnątrzkomórkowa
Otrzymywanie siarczanu(vi) amonu i żelaza(ii) soli Mohra (NH 4 ) 2 Fe(SO 4 ) 2 6H 2 O
 Otrzymywanie siarczanu(vi) amonu i żelaza(ii) soli Mohra (NH 4 ) 2 Fe(SO 4 ) 2 6H 2 O Odczynniki: stały Fe(SO) 4 7H 2 O, stały (NH 4 ) 2 SO 4, H 2 O dest. Sprzęt laboratoryjny: elektryczna płyta grzewcza,
Otrzymywanie siarczanu(vi) amonu i żelaza(ii) soli Mohra (NH 4 ) 2 Fe(SO 4 ) 2 6H 2 O Odczynniki: stały Fe(SO) 4 7H 2 O, stały (NH 4 ) 2 SO 4, H 2 O dest. Sprzęt laboratoryjny: elektryczna płyta grzewcza,
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
Ćwiczenie 1. Zależność szybkości reakcji chemicznych od stężenia reagujących substancji.
 VIII. Kinetyka i statyka reakcji chemicznych Zagadnienia Czynniki wpływające na szybkość reakcji Rzędowość i cząsteczkowość reakcji Stała szybkości reakcji Teoria zderzeń Teoria stanu przejściowego Reakcje
VIII. Kinetyka i statyka reakcji chemicznych Zagadnienia Czynniki wpływające na szybkość reakcji Rzędowość i cząsteczkowość reakcji Stała szybkości reakcji Teoria zderzeń Teoria stanu przejściowego Reakcje
